So können Forschende dem Tumor beim Wachsen zusehen
In Österreichs erstem 3D-Bioprinting-Labor nutzen die Forschenden ein neu entwickeltes Tool, um die Entwicklung von Tumoren, aber auch die Wirksamkeit von Krebsmedikamenten quasi im Livemodus zu untersuchen – nachgebautes menschliches Gewebe aus dem 3D-Biodrucker macht's möglich.
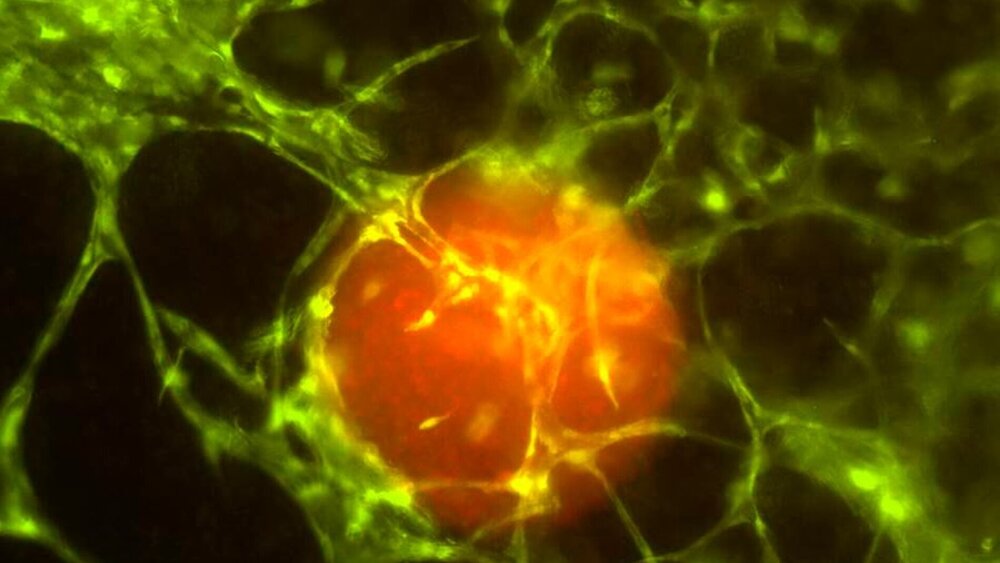
Auch wenn das 3D-Tumormikroumgebungs-Modell – ein „fluidic chip” mit einem drei Millimeter dicken Gewebestück darauf – nachgebaut ist, hat es die Beschreibung „künstlich” nicht verdient. Denn das Modell, das von den ForscherInnen Daniel Nothdurfter, Judith Hagenbuchner und Michael Außerlechner an der Medizinischen Universität Innsbruck entwickelt und bereits zum Patent angemeldet wurde, wächst von selbst und ganz natürlich. Diese nahezu realen Bedingungen sind ein großer Vorteil, wenn im Detail erforscht werden soll, wie der Tumor seine Umgebung manipuliert und für sich nutzt. Die weiteren Pluspunkte: Das von menschlichem Gewebe abgeleitete Äquivalent kann standardisiert produziert werden und macht Tierversuche ersetzbar.
Biogedrucktes menschliches Gewebemodell erlaubt Forschung ohne Tierversuche
Die Innsbrucker ForscherInnen haben in das neuartige 3D-Tumormikroumgebungs-Modell schon während des Druckprozesses Tumorsphäroide aus einem Neuroblastom – einer der häufigsten soliden Tumoren bei Kleinkindern – zwischen die Zellen des Gewebes gesetzt, welche dort innerhalb von zwei bis drei Wochen zu einem Mikrotumor heranwachsen. „So war es uns möglich, zu beobachten, wie dieser kleine Tumor die Kapillaren aus dem Gewebe anzieht und diese dann in den Tumor hineinwachsen. Der Tumor baut sich also seine eigene Versorgungsstruktur auf. Dieses 3D-Modell wird uns helfen, die Mechanismen der Karzinogenese, also des Tumorwachstums, noch besser zu verstehen und damit die Tumormikroumgebung als therapeutisches Ziel für die Krebsbekämpfung besser nutzbar zu machen – und das ohne Tierversuche”, betont Mikrobiologe und Laborleiter Michael Außerlechner.
Dreidimensional, tierversuchsfrei und reproduzierbar
Das Neue an dieser Entwicklung aus dem 3D-Biodrucklabor der Medizinischen Universität Innsbruck ist die Kombination aus komplexem gefäßbildendem Gewebe auf einem fluidic chip. Diese mikrofluidischen Bauteile sind im Bereich der Kultivierung von Zellen zwar bereits in Anwendung, doch verfügen sie meist nur über eine Zellschicht. „Unser Gewebe wächst bis zu einer Dicke von drei Millimetern zu einem dreidimensionalen Netzwerk heran”, erklärt Mikrobiologe Außerlechner.
In einem ersten Schritt werden dafür feine Kanäle in die Chips gelasert, und mit dem Biodrucker ein dreidimensionales Hydrogel mit Zellen so aufgebaut, dass feine Kanäle im Gewebe direkt an die Kanäle im Chip angeschlossen werden. Weil das Gewebe zwei bis drei Wochen braucht, um zu wachsen und zu reifen, haben die darin liegenden Zellen Zeit, sich zu organisieren. Dadurch verändert sich auch das Volumen des Gewebes und es kann sich vom Plastik ablösen. „Zum Verzahnen von Gewebe und Chip haben wir deshalb ein spezielles Design entwickelt, sodass das lebende Gewebe auch über Wochen stabil und verankert bleibt”, beschreibt Außerlechner die Überlegenheit des innovativen Werkzeugs.
Den Innsbrucker ForscherInnen gelang es zudem, feine, Blutgefäß-ähnliche Kapillaren zu züchten, sodass alle Zellen in diesem Gewebemodell ausreichend versorgt werden können. „Die Gefäße, die wir direkt mit dem Biodrucker generieren, bilden in unserem Gewebemodell die Hauptversorgungsrouten und haben einen Durchmesser von etwa 0,3 Millimetern. Damit aber auch Zellen im Gewebe versorgt werden, die weiter von diesen Kanälen entfernt sind, müssen feine Kapillaren entstehen. Dafür haben wir eine spezielle Biotinte entwickelt, in der sich die Endothelzellen – sie kleiden die Innenseiten der Blutgefäße aus – zusammen mit Stammzellen innerhalb von sechs bis sieben Tagen spontan in ein feines Kapillar-Netzwerk selbst organisieren und das gesamte Gewebe durchziehen”, so die Biotechnologin Judith Hagenbuchner, die das 3D-Biodrucklabor gemeinsam mit Außerlechner leitet und auch gegründet hat. Der so in Gang gesetzte Prozess läuft ähnlich ab wie die natürliche Wundheilung.
Modell bietet breites Einsatzgebiet
Die Nutzbarkeit des neuen Modells steht laut den Forschenden vielen Fragestellungen offen. Möglich wird damit etwa die Testung von sogenannten Angiogenesehemmern, eine Gruppe von Arzneistoffen, die auf die Unterdrückung der Blutgefäßneubildung und damit des Tumorwachstums abzielt. Auch PatientInnen-orientierte und damit personalisierte Fragestellungen lassen sich untersuchen, etwa die Wahl der geeigneten Therapie. Damit leistet das biogedruckte Gewebemodell auch einen wichtigen Schritt in Richtung Präzisionsmedizin. Selbst für die Erforschung der Metastasierung könnte sich die Innsbrucker Entwicklung als geeignete Plattform erweisen.
Daniel Nothdurfter et al., „ 3D bioprinted, vascularized neuroblastoma tumor environment in fluidic chip devices for precision medicine drug testing”. Biofabrication , Volume 14 , Number 3, https://doi.org/10.1088/1758-5090/ac5fb7

 169
169

