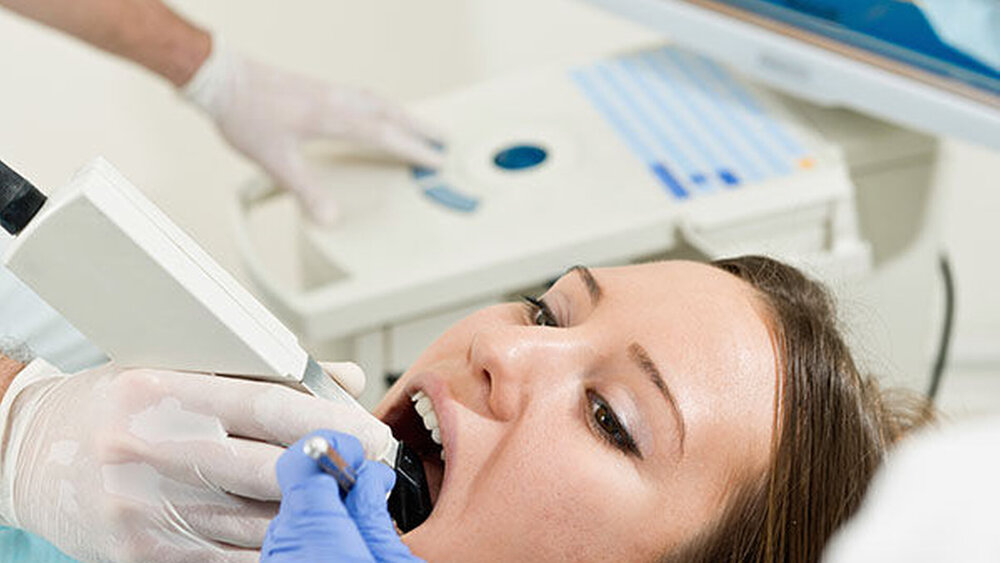
Wie gefährlich ist Titandioxid in Cerec-Mattierungspulvern?
Als sie die Diagnose bekommt, ist für Zahnärztin Julia Hasel klar, dass ihre Krankheit durch das Mattierungspulver Vita Cerec Powder ausgelöst wurde, das sie jahrelang bei jeder optischen Abformung eingeatmet hat. So berichtete die Wochenzeitung "Die Zeit" Ende Dezember über das laufende Verfahren am Landgericht München. Heute praktiziert Hasel – die eigentlich anders heißt – nicht mehr. Sie hat ihre Praxis im Herbst vergangenen Jahres aus gesundheitlichen Gründen verkaufen müssen.
Stattdessen versucht die Anfang 40-Jährige vor dem Landgericht nun das nahezu Unmögliche: Sie will beweisen, dass der Inhaltsstoff eines zugelassenen Medizinprodukts bei ihr Morbus Waldenström, eine seltene Krebserkrankung des Lymphgewebes, ausgelöst hat.
Sollte ihr das gelingen, hätte das weitreichende Folgen für Zahnärzte weltweit. Schätzungsweise sind allein in Deutschland tausende Cerec-Geräte jener Generation auf dem Markt, die den Einsatz von Mattierungspulver oder -Spray nötig machen, um bei der optischen Abformung Artefakte zu reduzieren.
In ihrem kurzem Berufsleben verbrauchte sie 66 dieser Flaschen
Behandler, die diese Produkte einsetzen, haben wahrscheinlich jahrelang ein Titandioxid-haltiges Mattierungspulver oder -Spray verwendet. Oder tun es noch immer. Das Vita Cerec Powder, das Gegenstand des aktuellen Verfahrens ist, kam 2006 auf den Markt. Laut Hersteller sind insgesamt 307.602 Flaschen zu jeweils 12 Gramm verkauft worden. Wahrscheinlich sind Hunderttausende Patienten und Tausende Zahnärzte mit dem Puder mehrfach in Kontakt gekommen. Allein Hasel hat in ihrem kurzem Berufsleben 66 dieser Flaschen verbraucht.
Am 16. März 2018 – fünf Monate nachdem Hasel das Produkt beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) gemeldet hatte – startete der Hersteller Vita Zahnfabrik eine freiwillige Rückrufaktion, "um jede, auch noch so geringe Gefährdung von Patienten und Anwendern auszuschließen", wie es dazu hieß.
Vergleichbare Produkte anderer Hersteller wie etwa Sirona Cerec Optispray enthalten ebenfalls Titandioxid, wurden jedoch nicht zurückgerufen. Auch das 3M High-Resolution Scanning Spray oder Restbestände von weiterhin erhältlichen extraoralen Mattierungsprays sind Titandioxid-haltig.
Wie gefährlich ist die Exposition bei Absaugung mit Mundschutz?
Dass eingeatmete Nanopartikel bis in die kleinsten Lungengefäße eindringen, sich dort ablagern und über die Blutbahn im gesamten Körper verteilen können, ist seit einiger Zeit unstrittig.
Wie gefährlich in diesem Zusammenhang Titandioxid jedoch für den Menschen ist und wie groß die tatsächliche Exposition gegenüber Nanopartikelstaub bei der Verwendung von Mattierungssprays oder anderen zahnärztlichen Tätigkeiten bei gleichzeitiger Absaugung und Tragen eines Mundschutzes ist, bleibt offen.
Selbst wenn Unternehmen wie Sirona gegenüber der Zeit angeben, ihnen sei neben dem aktuellen Verfahren keine weitere Meldung von einer unerwünschten Nebenwirkung bekannt, haben viele Akteure der Branche bereits reagiert. So präsentierten einige Hersteller auf der IDS 2019 Titandioxid-freie Scansprays. Auch mit dem werbewirksamen Hinweis, dass das Einatmen von eben jenen Partikeln nach Ansicht der Europäischen Chemikalienagentur ECHA möglicherweise krebserregend ist.
Die EU ändert Risikoklasse für Medizinprodukte mit Nanopartikeln
Und auch die Politik hat reagiert: So gelten ab dem 26. Mai 2020 die Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates über Medizinprodukte sowie Änderungen verschiedener damit verbundener Richtlinien, die am 25. Mai 2017 in Kraft getreten sind. Eine maßgebliche Änderung betrifft die Risikoklassifizierung von Produkten, die Nanopartikel enthalten.
Bei Medizinprodukten gibt es vier Klassen, 1, 2a, 2b und 3. Je höher die Klasse, desto höher das vom Hersteller veranschlagte Risiko. Und je höher das Risiko, desto intensiver muss eine externe Prüfstelle zur Zertifizierung involviert sein. Bei diesen Prüfstellen handelt es sich jedoch nicht um Behörden, sondern um privatwirtschaftliche Prüfunternehmen wie den TÜV oder die Dekra.
Die Risiko bleibt schwammig formuliert
Allerdings ist bei Produkten der Klasse 1 keine externe Prüfung nötig. Es genügt, wenn der Hersteller in eigener Verantwortung das sogenannte Konformitätsbewertungsverfahren durchführt, für sein Produkt eine technische Dokumentation inklusive Risikomanagementakte erstellt und für die Überprüfung durch Behörden bereithält. Alle Titandioxid-haltigen Pulver und Sprays sind momentan der Risikoklasse 1 zugeordnet – das gilt aktuell für etwa 70 Prozent aller Medizinprodukte.
Ab Mai 2020 müssen jedoch alle neuen Medizinprodukte, die Nanomaterial enthalten oder daraus bestehen, automatisch mindestens der Klasse 2a zugeordnet werden. Und dies auch nur dann, wenn sie nur ein "unbedeutendes Potenzial für interne Exposition" haben. Daraus wird Klasse 2b, wenn "sie ein niedriges Potenzial" beziehungsweise Klasse 3, "wenn sie ein hohes oder mittleres Potenzial für interne Exposition haben". Die Begriffe "unbedeutend", "niedrig", "mittel" und "hoch" sind jedoch nicht mit Zahlen unterlegt.
Das Hintertürchen für Hersteller ist Paragraf 99
Das Hintertürchen für Hersteller ist der § 99, nach dem für alle bis zum 26. Mai 2020 in Verkehr gebrachten Medizinprodukte noch einmal eine Übergangsfrist bis zum 27. Mai 2025 gelten soll. So lange richtet sich das Inverkehrbringen und Inbetriebnahme von Medizinprodukten nach altem Recht.

 169
169



