Myoepitheliales Karzinom der Glandula parotis
Der Fall
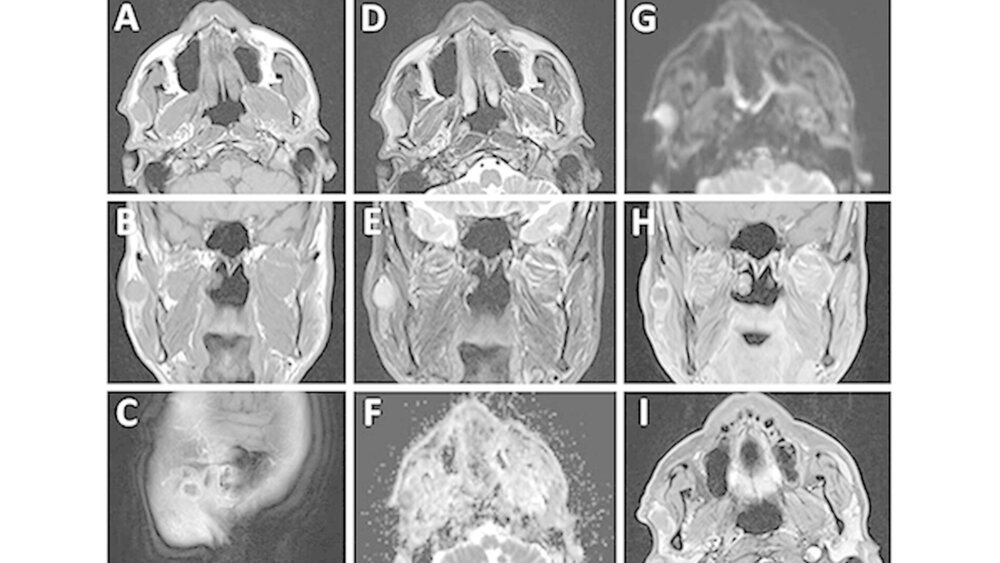
Klinisch wurden keine sensomotorischen Ausfälle im Gesichtsbereich festgestellt. Palpatorisch fand sich eine haselnussgroße, nicht schmerzhafte, bedingt verschiebliche Raumforderung im Bereich der rechten Gl. parotis. Eine B-Symptomatik wurde vom Patienten verneint. Die manuell provozierte Salivation aus dem rechten Stenon-Gang war spontan klar flüssig. Sonografisch zeigte sich ein kreisrunder homogener, im zentralen Drüsengewebe integrierter Tumor mit einem Durchmesser von etwa 18 mm. Zervikal vergrößerte Lymphknoten waren nicht darstellbar. Zur weiteren Abklärung eines möglichen Zystadenoms erfolgte die Anfertigung eines Hals-MRT mit Kontrastmittel. Das angefertigte MRT ergab eine scharf begrenzte zentrale Raumforderung der rechten Gl. parotis mit einer Ausdehnung von 18 mm x 10 mm, die sich zum angrenzenden Muskelgewebe in der T1-Gewichtung hypointens (Abbildung 1A bis 1C) sowie in der T2-Gewichtung leicht hyperintens (Abbildung 1D und 1E) darstellte.
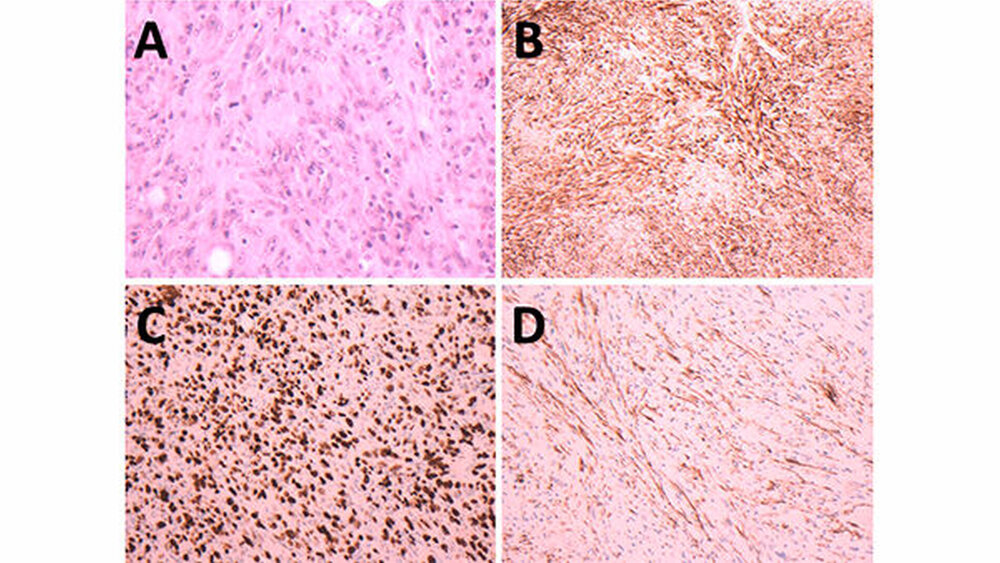
Der ADC-Wert (apparent diffusion coefficient-Wert) war deutlich vermindert (Abbildung 1F und 1G). Die Kontrastmittel gestützten Sequenzen wiesen lediglich eine dezente randständige Anreicherung auf (Abbildung 1h und 1l). Pathologisch veränderte Lymphknoten waren nicht nachweisbar. Im MRT wurde zunächst der Verdacht eines Warthin-Tumors geäußert. Nach Resektion der tumorösen Raumforderung unter Schonung des Plexus parotideus ergab das histologische Ergebnis ein in sano reseziertes, stark proliferierendes, maximal 2,5 cm großes, myoepitheliales Karzinom von insgesamt spindelzellig-mesenchymalem Aspekt (Abbildung 2a) mit einem minimalen Sicherheitsabstand von 0,1 mm (TNM-Klassifikation (8. Auflage): pT2, G3, R0). Immunhistochemisch wurde eine intensive Expression von Zytokeratin 18 (CK18; Abbildung 2b) sowie eine intensive Kernmarkierung mit Ki-67 nachgewiesen (Abbildung 2c). Zusätzlich fand sich eine fokale Expression von glattmuskulärem Aktin (Abbildung 2d) und Desmin.
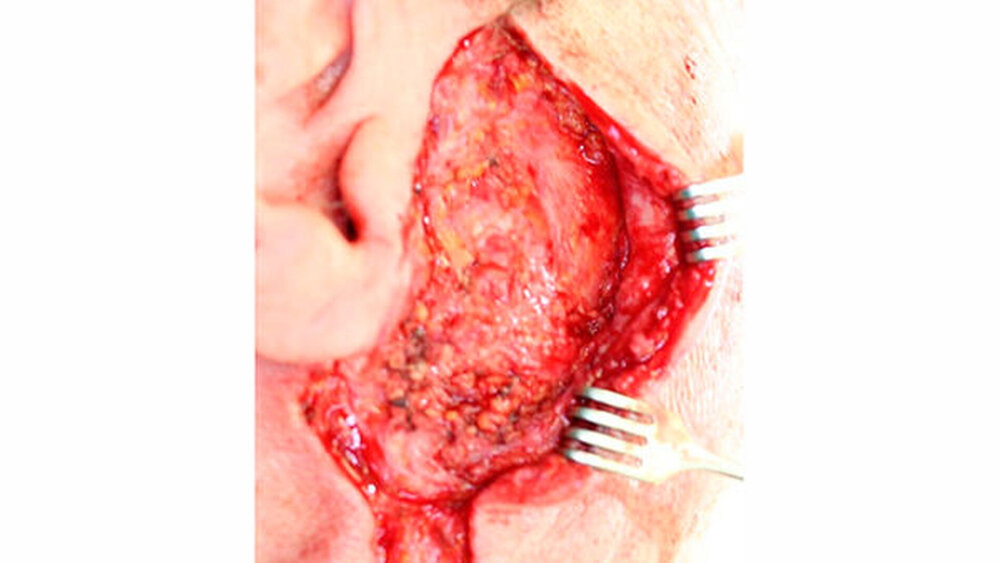
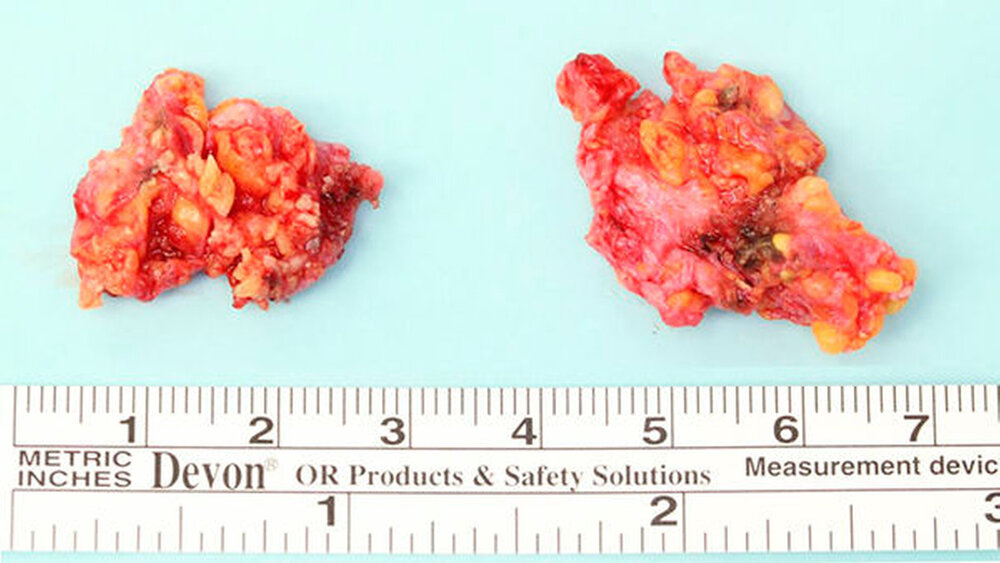
Es wurde die erneute OP-Indikation zur Vergrößerung des Sicherheitsabstandes im Sinne einer partiellen Parotidektomie sowie einer prophylaktischen ipsilateralen Neck dissektion der Level I und II gestellt (Abbildung 3). Abbildung 4 zeigt das Nachresektat. Postoperativ lag kein Hinweis auf eine Schädigung des N. facialis vor. Bei sanatio per primam intentionem entließen wir den Patienten am fünften postoperativen Tag in die ambulante Nachsorge. Die abschließende Histologie ergab weder Residuen des resezierten myoepithelialen Karzinoms noch einen Lymphknotenbefall (TNM-Klassifikation (8. Auflage): pT2, pN0 (0/9), G3, R0).
Diskussion
Bei soliden lokal begrenzten Raumforderungen im Bereich der Glandula (Gl.) parotis sollten differenzialdiagnostisch neben benignen gleichzeitig auch maligne Speicheldrüsentumoren sowie Erkrankungen des lymphatischen Systems ausgeschlossen werden [Driemel et al., 2006]. Das myoepitheliale Karzinom (MECA) tritt mit einer Inzidenz von 0,1 bis 0,45 Prozent aller Speicheldrüsentumoren äußerst selten auf [Vilar-González et al., 2015; Wakasaki et al., 2016]. Dieser Tumor ist meist mittelgradig bis hoch maligne, lokal infiltrativ und destruierend wachsend. Rezidive und Metastasen kommen gehäuft vor [Di Palma and Guzzo, 1993; Haisch et al., 1998]. Als eigene Entität wurde das MECA im Jahr 1991 in die Klassifikation der WHO-Speicheldrüsentumoren aufgenommen [Seifert and Sabin, 1991; Haisch et al., 1998; Bahambra et al., 2016]. Die Primärlokalisation ist zu 75 Prozent die Gl. parotis und mit abnehmender Häufigkeit die Gll. minores sowie die Gl. submandibularis. MECA können sich sowohl aus persistierenden pleomorphen Adenomen oder benignen Myoepitheliomen entwickeln als auch de novo bilden [Bahambra et al., 2016].
Der Erkrankungsgipfel liegt ohne Geschlechterdominanz zwischen der fünften und sechsten Lebensdekade. Differenzialdiagnostisch ist das MECA vom benignen Myoepitheliom, Spindelzellkarzinom, Spindelzellsarkom sowie karzinös entarteten pleomorphen Adenom abzugrenzen [Haisch et al., 1998; Bahambra et al., 2016]. Abgesehen von der Kopf- und Halsregion kann das MECA auch als Primärherd im Brustbereich, in der Lunge und dem Mediastinum auftreten [Wakasaki et al., 2016]. Die Metastasierung erfolgt überwiegend in die lokoregionären Lymphknoten, kann aber auch hämatogen in die Lunge, das Hirn, die Wirbelsäule und die Haut erfolgen [Vilar-González et al., 2015; Wakasaki et al., 2016]. Die klinischen Symptome von MECA ähneln denen anderer Speicheldrüsentumoren. Eine schmerzlose tumoröse Schwellung stellt zumeist das Primärsymptom dar. Folgesymptome können dann Dolor, Hypästhesien, Xerostomie sowie eine ipsilaterale periphere Facialisparese sein [Bahambra et al., 2016; Wakasaki et al., 2016]. Im vorliegenden Fall lag das MECA im zentralen Drüsengewebe der Gl. parotis und machte lediglich durch das Primärsymptom auf sich aufmerksam.
Das primäre bildgebende Verfahren bei Speicheldrüsenerkrankungen ist die Sonografie [Khalife et al., 2016]. In den fortführenden 3-D-bildgebenden Verfahren, wie zum Beispiel Computer- und Kernspintomografie, lassen sich sowohl die Tumorgrenzen als auch die regionale Lymphknotensituation evaluieren [Saliba et al., 2012]. Zur weiteren Diagnostik besteht die Möglichkeit einer Feinnadelaspirationszytologie [Sehgal et al., 2013]. Histologisch zeigt sich bereits bei geringer Vergrößerung ein weitestgehend pathognomonisches läppchenartiges Wachstumsmuster mit zentralen Koagulationsnekrosen und inhomogener Begrenzung. MECA weisen eine breite morphologische sowie zytologische Zellpleomorphie auf, gekennzeichnet durch spindelförmige, teils plasmazytoide myoepitheliale Zellen mit eosinophilem Zytoplasma und einer erhöhten Mitoseaktivität. Immunhistochemisch finden sich in den Zellen stets eine Koexpression von Zytokeratin (einschließlich CAM 5.2, AE1/AE3 und 34βE12), Vimentin und mindestens ein myoepithelialer Marker, wie zum Beispiel glattmuskuläres Aktin. Das Antigen Ki-67 spiegelt dabei die Zellproliferation wieder [Zhu et al., 2015; Bahambra et al., 2016; Wakasaki et al., 2016]. Erst die histopathologische Untersuchung konnte in diesem Fall die Malignität des Speicheldrüsentumors aufdecken.
Zu der allgemein empfohlenen Therapie zählt die großzügige Tumorresektion einschließlich der Mitentnahme eventuell befallener regionaler Lymphknoten. Aufgrund der Seltenheit von MECA gibt es noch keinen Konsens bezüglich einer geeigneten adjunktiven Behandlungsstrategie mit dem Erhalt des motorischen Gesichtsnervs [Haisch et al., 1998; Wakasaki et al., 2016]. Die Überexpression des Antigen Ki-67 könnte zukünftig laut Wakasaki et al. [2016] einen nützlichen Marker für die Prognose von MECA darstellen. Nach Yang et al. [2010] besitzen MECA der Gll. minores eine bessere Prognose als die übriger Lokalisationen. Umstritten bleibt, ob MECA aus benignen Tumoren einen günstigeren Verlauf als de novo entstandene aufweisen [Wakasaki et al., 2016].
Fazit
Die Inzidenz von MECA in Speicheldrüsen liegt zwischen 0,1 und 0,45 Prozent.
MECA sind mittelgradig bis hoch maligne, lokal infiltrativ und destruierend wachsende Tumoren, die oft rezidivieren und metastasieren.
Die Primärlokalisation ist zu 75 Prozent die Gl. parotis und mit abnehmender Häufigkeit die Gll. minores sowie die Gl. submandibularis.
Ihr Erkrankungsgipfel liegt ohne Geschlechterdominanz zwischen der fünften und sechsten Lebensdekade.
Die Metastasierung erfolgt überwiegend in die lokoregionären Lymphknoten, aber auch hämatogen in Lunge, Hirn, Wirbelsäule sowie Haut.
Primär zeichnen sich MECA durch eine zumeist schmerzlose Schwellung aus. Folgesymptome können Dolor, Hypästhesien, Xerostomie sowie eine ipsilaterale periphere Facialisparese sein.
Das primäre bildgebende Verfahren ist die Sonographie, gefolgt von 3-D-bildgebenden Verfahren, wie der Computer- und Kernspintomografie.
Als Therapie gilt die großzügige Tumorresektion unter Mitentnahme evtl. befallener Lymphknoten.
Felix Paulßen von Beck
Nicolai Wunderlich
Dr. Dr. hc. Andreas HammacherDr. Dr. Mehran Masaeili
Klinik für Mund-, Kiefer- und Gesichtschirurgie, plastische und ästhetische OperationenMalteser Krankenhaus St. Josefshospital UerdingenKurfürstenstr. 69, 47829 Krefeld-Uerdingen
Felix.Paulssen@malteser.org
Prof. Dr. med. Claus Dieter GerharzInstitut für PathologieEvangelisches Krankenhaus Bethesta zu Duisburg GmbHHeerstr. 219, 47053 Duisburg
Literatur
:
Bhambra AC, Zhang Y, Huang EC, Bishop J, Matin M, Afify A. Pleural fluid metastases of myoepithelial carcinoma: A case report and review of the literature. Cytojournal. 2016; 13: 13.
Di Palma S, Guzzo M. Malignant myoepithelioma of salivary glands: clinicopathological features of ten cases. Virchows Arch A Pathol Anat Histopathol. 1993; 423(5): 389-396.
Driemel O, Kraft K, Hemmer J. Flow cytometric S-phase fraction contributes to diagnosis of diploid malignant salivary gland tumours. Int J Oral Maxillofac Surg. 2006; 35(10): 947-950.
Haisch·A, Knöbber D, Lobeck H. Das myoepitheliale Karzinom (malignes Myoepitheliom) der Speicheldrüsen. HNO Springer-Verlag 1998; 46(1): 66–6
Khalife A, Bakhshaee M, Davachi B, Mashhadi L, Khazaeni K. The Diagnostic Value of B-Mode Sonography in Differentiation of Malignant and Benign Tumors of the Parotid Gland. Iran J Otorhinolaryngol. 2016; 28(88): 305-312
Saliba I, El Khatib N, Nehme A, Nasser S, Moukarzel N. Metastatic parotid myoepithelial carcinoma in a 7-year-old boy. Case Rep Pediatr. 2012; 2012: 212746.
Sehgal S, Goyal P, Singh S, Kumar A. Fine-needle aspiration cytology of myoepithelial carcinoma of salivary gland: Diagnostic challenge to cytopathologist. J Cytol. 2013; 30(3): 207-210.
Seifert G, Sabin L. Histological Typing of Salivary Gland Tumors (World Health Organization). 2nd ed. Berlin, Heidelberg, New York: Springer-Verlag; 1991. pp. 23-24.
Vilar-González S, Bradley K, Rico-Pérez J, Vogiatzis P, Golka D, Nigam A, Sivaramalingam M, Kazmi S. Salivary gland myoepithelial carcinoma. Clin Transl Oncol. 2015; 17(11): 847-855.
Wakasaki T, Kubota M, Nakashima Y, Tomonobe E, Mihara T, Fukushima J. Invasive myoepithelial carcinoma ex pleomorphic adenoma of the major salivary gland: two case reports. BMC Cancer. 2016; 16(1): 827.
Yang S, Zeng M, Zhang J, Chen X. Clear cell myoepithelial carcinoma of minor salivary gland: a case report. Int J Oral Maxillofac Surg. 2010; 39(3): 297-300
Zhu S, Schuerch C, Hunt J. Review and updates of immunohistochemistry in selected salivary gland and head and neck tumors. Arch Pathol Lab Med. 2015; 139 (1): 55-66.