Zahnärztliche Chirurgie unter oraler Antikoagulation/Thrombozytenaggregationshemmung
1. Priorisierungsgründe
Im Bereich der zahnärztlichen Chirurgie können insbesondere postoperative Nachblutungen ein ernst zunehmendes Problem darstellen. Bei Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung besteht eine weitgehende Unsicherheit bezüglich der Vorbereitung, der Durchführung sowie der Nachsorge im Rahmen zahnärztlich-chirurgischer Eingriffe. Die Einführung neuerer oraler Antikoagulantien und Thrombozytenaggregationshemmer impliziert weitere potenzielle Schwierigkeiten bei der zahnärztlich-chirurgischen Behandlung. Ein Absetzen, eine Veränderung oder eine Reduktion der Antikoagulation erhöht das möglicherweise fatale Risiko thrombembolischer Ereignisse, andererseits sind letale Blutungsereignisse nach zahnärztlich-chirurgischen Eingriffen unter oraler Antikoagulation/Thrombozytenaggregationshemmung ebenso möglich, bisher in der Literatur jedoch nicht dokumentiert. Somit ist der Zahnarzt herausgefordert, die Patienten zum einen vor thrombembolischen Komplikationen zu schützen und zum anderen bedrohliche Blutungen zu vermeiden [1]. Generell gilt es, a priori sowohl bei den oralen Antikoagulantien als auch bei den Thrombozytenaggregationsinhibitoren gemeinsam mit dem Hausarzt oder behandelnden Kardiologen zu hinterfragen, ob diese Therapie noch notwendig ist [2].
Besteht demnach, zum Beispiel bei niedrigem Thromboserisiko, keine Indikation mehr, sollten die Medikamente abgesetzt werden. Falls weiterhin Indikationen für ein Beibehalten der oralen Antikoagulation/Thrombozytenaggregationshemmung bestehen, soll diese Leitlinie Empfehlungen für den Umgang mit Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung, die zahnärztlich-chirurgische Eingriffe benötigen, erarbeiten und darstellen. Bei der Indikationsstellung und Planung von oralchirurgischen Eingriffen an Patienten mit medikationsbedingten Blutungsneigungen sollte neben dem Ausmaß der Antikoagulation beziehungsweise Thrombozytenaggregationshemmung auch die operationsimmanente Blutungsgefährdung beachtet werden. Ferner dürfte das Nachblutungsrisiko einerseits von der Wundversorgung, andererseits von der perioperativen Compliance also der Therapieadhärenz des Patienten bestimmt sein. Nicht zuletzt entscheiden neben den genannten Kriterien die Schwere der Allgemeinerkrankung und schließlich die Lebensumstände des Patienten über die Behandlungsstrategie bis hin zu einem stationären Regime [3]. Diese letzteren, höchst individuellen Aspekte der Patientenbehandlung können in den Empfehlungen dieser Leitlinie allerdings nur angerissen werden.
Weiterhin ist hervorzuheben, dass diese Leitlinie bei Patienten mit kongenitalen und/oder erworbenen hämorrhagischen Diathesen keine Anwendung findet.
2. Hintergrund
2.1 Prävalenz und Indikation oraler Antikoagulation/Thrombozytenaggregationshemmung
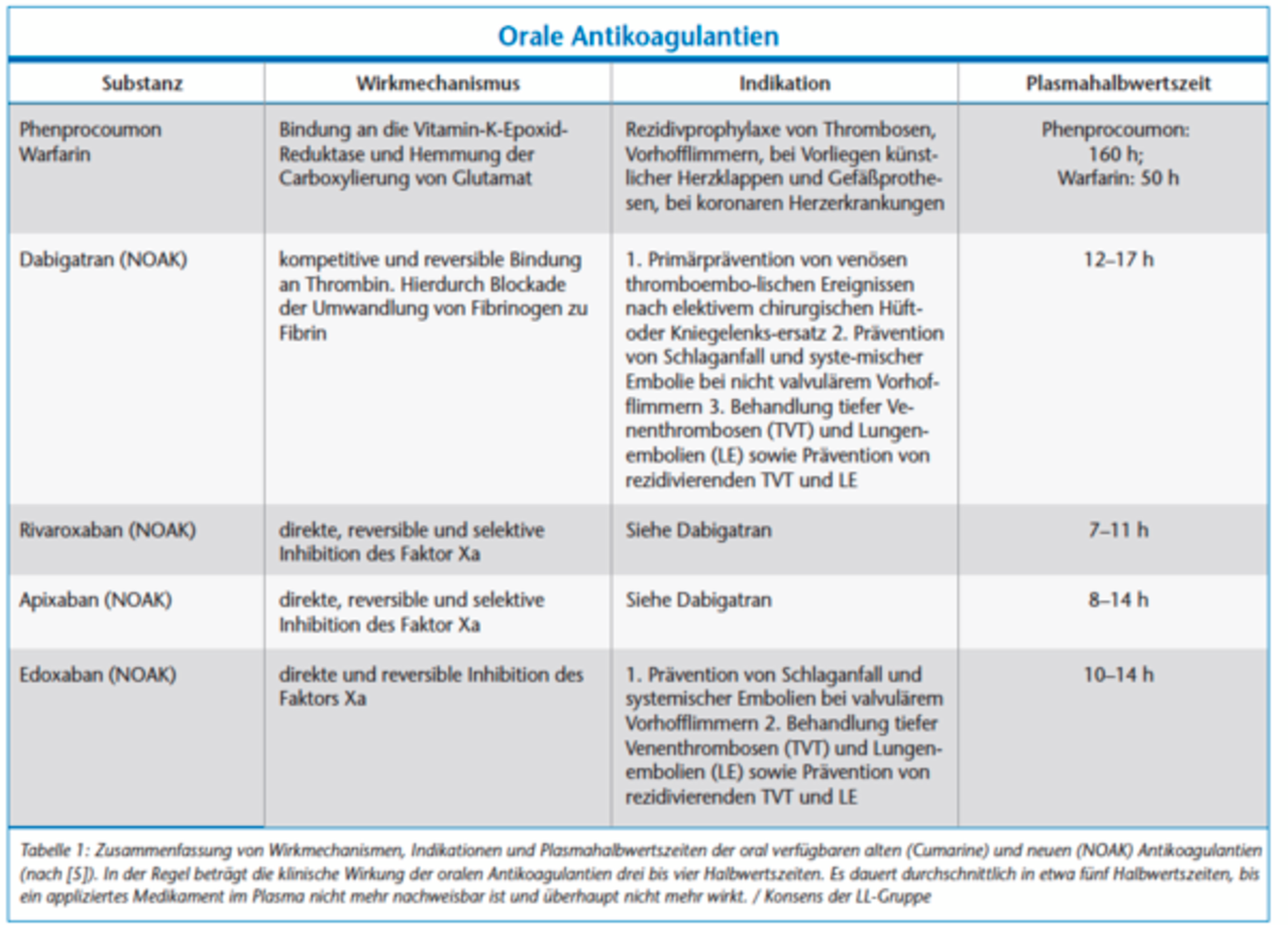
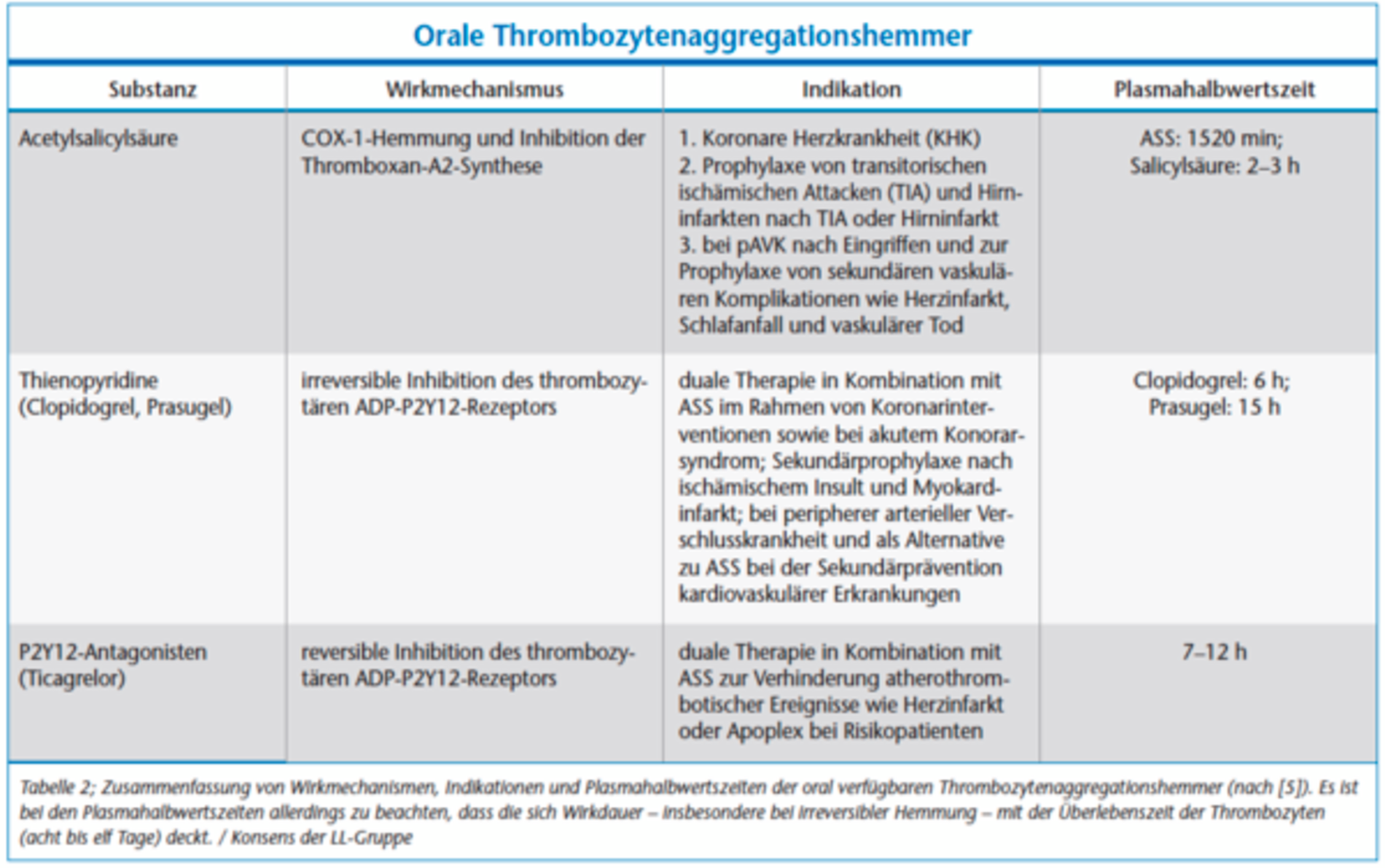
In Deutschland nehmen derzeit geschätzt etwa eine Million Menschen, also mehr als ein Prozent der Bevölkerung, Substanzen zur oralen Antikoagulation/Thrombozytenaggregationshemmung ein [4]. Bei den meisten wird die Medikation langfristig rezeptiert. Indikationen für eine Antikoagulation bestehen prophylaktisch beispielsweise zur Vermeidung von thrombembolischen Ereignissen prä-, intra- und postoperativ, bei Eingriffen am Herzen (Herzkathetereingriffe, Herz-Lungen-Maschine) sowie zur Dialyse. Weitere Indikationen zur Antikoagulation bestehen beim Vorhofflimmern und -flattern, nach Implantation mechanischer künstlicher Herzklappen, bei fortgeschrittener Arteriosklerose, bei peripheren arteriellen Verschlusskrankheiten, koronaren Herzkrankheiten, nach bereits stattgehabter tiefen Beinvenenthrombose, bei Aneurysmen aber auch bei untypischer Hämostase oder angeborenen Gerinnungsstörungen wie der APC-Resistenz (Tabelle 1). Thrombozytenaggregationshemmer werden vor allem zur sekundären Vorbeugung von Herzinfarkten und Schlaganfällen eingesetzt, da sich ihre Wirkung vor allem auf den arteriellen Teil des Gefäßsystems erstreckt. Ihre Indikationen werden in Tabelle 2 dargestellt.
2.2 Pharmakologische Grundlagen
In zunehmendem Maße werden Patienten, teilweise über mehrere Jahre oder sogar lebenslang, zur Verhinderung von thrombotischen und thrombembolischen Ereignissen ambulant mit die Blutgerinnung hemmenden Medikamenten behandelt. Diese können in Antikoagulantien und in Thrombozytenaggregationshemmer unterteilt werden.
Antikoagulantien:
Unter Antikoagulantien werden indirekte und direkte Hemmer der plasmatischen Gerinnung subsummiert. Typische Vertreter der indirekten Antikoagulantien, also solcher, die einen Kofaktor zur Entfaltung der antikoagulatorischen Wirkung benötigen oder die Synthese der Gerinnungsfaktoren hemmen, sind zum einen die Heparine und zum anderen die oral einzunehmenden Vitamin-K-Antagonisten wie das Phenprocoumon und das Warfarin. Bei den Vitamin-K-Antagonisten handelt es sich um Cumarinderivate, die durch Inhibition der Gerinnungsfaktoren II, VII, IX, X sowie der Proteine C, S und Z wirken. Unfraktionierte Heparine sind Antithrombin-III-abhängige Thrombininhibitoren, die i.v. oder s.c. gegeben werden, während die fraktionierten, niedermolekularen Heparine den Faktor Xa bei s.c.-Gabe hemmen.
Neue Orale Antikoagulantien (NOAK), gelegentlich auch „Direkte Orale Antikoagulantien“ (DOAK) genannt, interagieren mit einzelnen Gerinnungsfaktoren. Hier sind direkte Thrombininhibitoren wie das Dabigatran sowie Faktor-Xa-Inhibitoren wie das Rivaroxaban, Apixaban und das Edoxaban als Wirkstoffe von aktueller klinischer Relevanz (Tabelle 1).
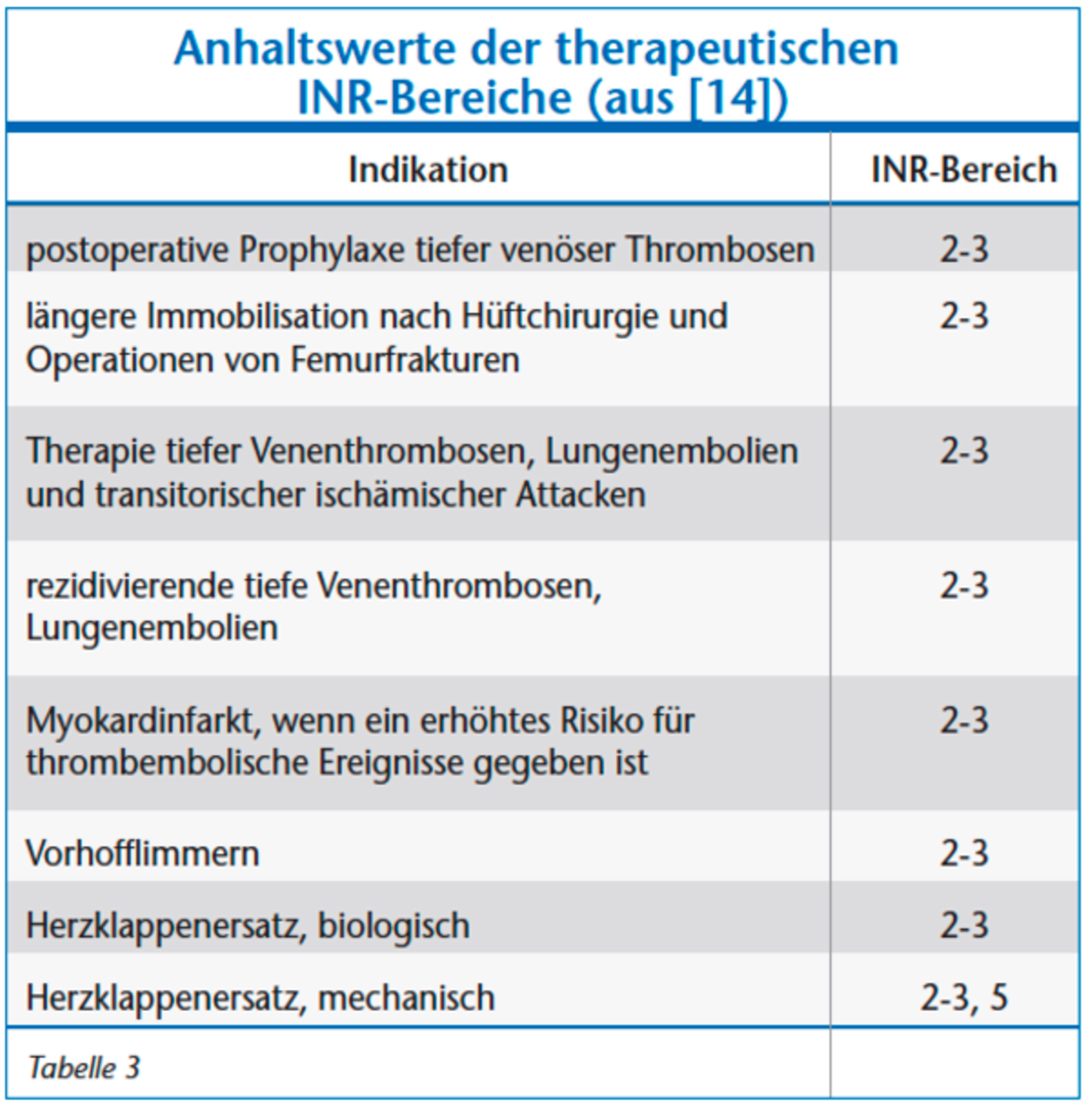
Heparine werden vor allem im stationären Bereich eingesetzt, haben einen schnellen Wirkbeginn und eine Halbwertszeit von fünf bis sieben Stunden. Eine Überprüfung der Wirkung ist über verschiedene Laborparameter (unfraktioniert: partielle Thromboplastinzeit (PTT), niedermolekular: Anti-Xa-Aktivität) möglich; eine Antagonisierung mit Protamin ist verfügbar. Die Wirkung von den peroral applizierten Vitamin-K-Antagonisten im therapeutischen Bereich setzt erst nach Verbrauch der vorhandenen Gerinnungsfaktoren, also nach 48 bis 72 Stunden bei einer langen Halbwertszeit von ungefähr 160 Stunden ein. Aufgrund der hohen inter- und intraindividuellen Variabilität wird mittels des International Normalisierten Ratio (INR) – einer internationalen Normierung des Quickwertes – bei den Cumarinen der individuelle Zustand des Patienten anschließend überwacht, wobei der jeweilige therapeutische INR je nach Indikation zwischen 2 und 3,5 liegen sollte (Tabelle 3). Im Notfall stehen zur Antagonisierung bevorzugt Prothrombinkonzentrate (PPSB) und alternativ gefrorenes Frischplasma (FFP) zur Verfügung. Eine Antagonisierung mit Vitamin K ist für den Notfall ungeeignet.
Bei oral aufgenommenem Dabigatran ist der maximale Plasmaspiegel nach 0,5 bis 2 Stunden erreicht, wobei die Halbwertszeit mit 12 bis 17 Stunden beziffert wird. Genauso wie bei den anderen NOAKs ist eine Messung der gerinnungshemmenden Wirkung nur durch spezialisierte Labortests, die nicht zu der klinischen Routine gehören, erfassbar. Daher ist das Monitoring schwierig; die verlängerte Blutungszeit kann nicht allein durch die Laborwerte vollständig dargestellt werden. Daher ist vor dem geplanten zahnärztlich-chirurgischen Eingriff vor allem die klinische Einschätzung der individuellen Blutungsneigung des Patienten („Blutungsanamnese“) wichtig.
Rivaroxaban erreicht seine Maximalkonzentration nach 2 bis 4 Stunden und hat eine Halbwertszeit von 7 bis 11 Stunden.
Bei Apixaban liegt die Halbwertszeit bei 8 bis 14 Stunden, wobei der Spitzenspiegel nach 3 bis 4 Stunden erreicht wird.
Edoxaban hat eine Halbwertszeit von 10 bis 14 Stunden; nach 1 bis 2 Stunden ist die maximale Plasmakonzentration erreicht (Tabelle 1). Sowohl für den Thrombinantagonisten Dabigatran als auch für die Klasse der Faktor-Xa-Antagonisten (Rivaroxaban, Apixaban, Edoxaban) wurden Antidots zur schnellen Antagonisierung im Notfall entwickelt. Idarucizumab ist ein humanisiertes Antikörperfragment, das Dabigatran spezifisch bindet und die gerinnungshemmende Wirkung von Dabigatran innerhalb von Minuten nahezu vollständig antagonisiert [6, 7]. Andexanet alfa ist ein rekombinantes humanes Faktor-Xa-Analogon. Die Substanz fungiert als Bindungsfalle für Faktor-Xa-Inhibitoren, indem es an diese bindet und einen Komplex bildet, so dass die antikoagulatorische Wirkung von Faktor-Xa-Antagonisten größtenteils innerhalb von Minuten aufgehoben werden kann [7, 8]. Zum jetzigen Zeitpunkt kann aus wissenschaftlicher Sicht bei sehr begrenzter Erfahrung und sehr kleinen Studien noch nicht valide eingeschätzt werden, welchen klinischen Nutzen beziehungsweise welche Risiken die beiden Antidots über die bisher nachgewiesene Normalisierung der Blutgerinnung hinaus haben.
Thrombozytenaggregationshemmer (Tabelle 2) wirken über eine, durch verschiedene Mechanismen induzierte, Funktionshemmung der Thrombozyten und sind daher von den Antikoagulantien abzugrenzen. Der am längsten in Gebrauch befindliche Wirkstoff aus dieser Gruppe ist die Acetylsalicylsäure (ASS). ASS entfaltet seine gerinnungshemmende Wirkung bereits in geringen Dosen über eine irreversible Hemmung der Cyclooxygenase-1 (COX-1), verhindert so die Thromboxan-A2-Bildung und hat eine mit der Überlebenszeit der Thrombozyten (8 bis 11 Tage) analoge Wirkdauer. Zu den neueren oral zu applizierenden Thrombozytenaggregationshemmern gehören die irreversiblen Hemmer der Adenosindiphosphat (ADP)-Rezeptoren wie Clopidogrel und Prasugrel. Bei Clopidogrel werden ungefähr eine Stunde nach Einnahme maximale Plasmaspiegel erreicht, die Halbwertszeit beträgt ungefähr sechs Stunden. Allerdings dauert der gewünschte Wirkeintritt von Clopidogrel in der üblichen Dosis mehrere Tage, kann aber durch die Gabe einer initialen Aufsättigungsdosis auf wenige Stunden verkürzt werden [9, 10]. Ticlopidin kann als Vorläufersubstanz von Clopidogrel verstanden werden, wobei die Plasmahalbwertszeit bei ein bis zwei Stunden liegt. Aufgrund der im Vergleich zu Clopidogrel erhöhten Nebenwirkungen ist die Substanz therapeutisch in den Hintergrund getreten und wird nicht mehr angewandt. Prasugrel hat ein dem Clopidogrel ähnliches Wirkprofil. Mit Ticagrelor liegt ein reversibler ADP-Hemmer vor, der in Kombination mit ASS zur Dualtherapie zugelassen ist. Aufgrund des anderen Mechanismus der Thrombozytenaggregationshemmer ist eine Substitution durch Heparin, wie bei den Cumarinen, nicht möglich.
2.3 Definition Eingriffsgrößen
In dieser Leitlinie werden typische akute und elektive zahnärztlich-chirurgische Eingriffe adressiert. Diese umfassen Zahnextraktionen (einfach und multipel), orale Lappenplastiken, kleine Weichgewebeeingriffe, Osteotomien, Implantationen und Augmentationen [1]. Von diesen werden Eingriffe mit größerem Blutungsrisiko (infizierte Wunden und Abszesse, Eingriffe im Mundbodenbereich, im Sinus maxillaris und im retromaxillären Raum) unterschieden.
3. Blutungsrisiko bei dental-chirurgischen Eingriffen
Generell werden zahnärztlich-chirurgische Eingriffe mit einem nur niedrigen Blutungsrisiko bewertet [11]. Dabei ist allerdings von Bedeutung, ob eine suffiziente Versorgung der Wunde, zum Beispiel durch Nahtversorgung oder Komprimierbarkeit (Verbolzung/Tamponierung im Fall von Knochenblutungen), möglich ist. Im Falle infizierter Wunden oder Abszessen wird kein primärer Wundverschluss angestrebt. Daher ist hier das Blutungsrisiko möglicherweise erhöht. Eine zentrale Frage stellt die Komprimierbarkeit der Wunde dar, die ausgenommen im Bereich des Mundbodens, des Sinus maxillaris und des retromaxillären Raums meist gegeben ist.
4. Präoperativer Umgang in der zahnärztlichen Chirurgie unter Antikoagulation
4.1 Phenprocoumon, Warfarin
Anhand eines aktuellen systematischen Reviews [1] konnte gezeigt werden, dass zahnärztlich-chirurgische Eingriffe unter fortlaufender Therapie mit Phenprocoumon oder Warfarin im therapeutischen Bereich (Tabelle 3) möglich sind. Allerdings ist, selbst unter Beibehaltung strikter Kautelen (INR < 4, Benutzung hämostatischer Maßnahmen [s.u.]) mit vermehrten, stillbaren Nachblutungen zu rechnen [1, 12, 13]. Somit beinhaltet das Gesamtrisiko des perioperativen Management des antikoagulierten Patienten zum einen kardiovaskuläre Risiken und zum anderen das Risiko lokaler Blutungen, die in ihrer Schwere allerdings meistens gut beherrschbar sind.
4.2 Dabigatran
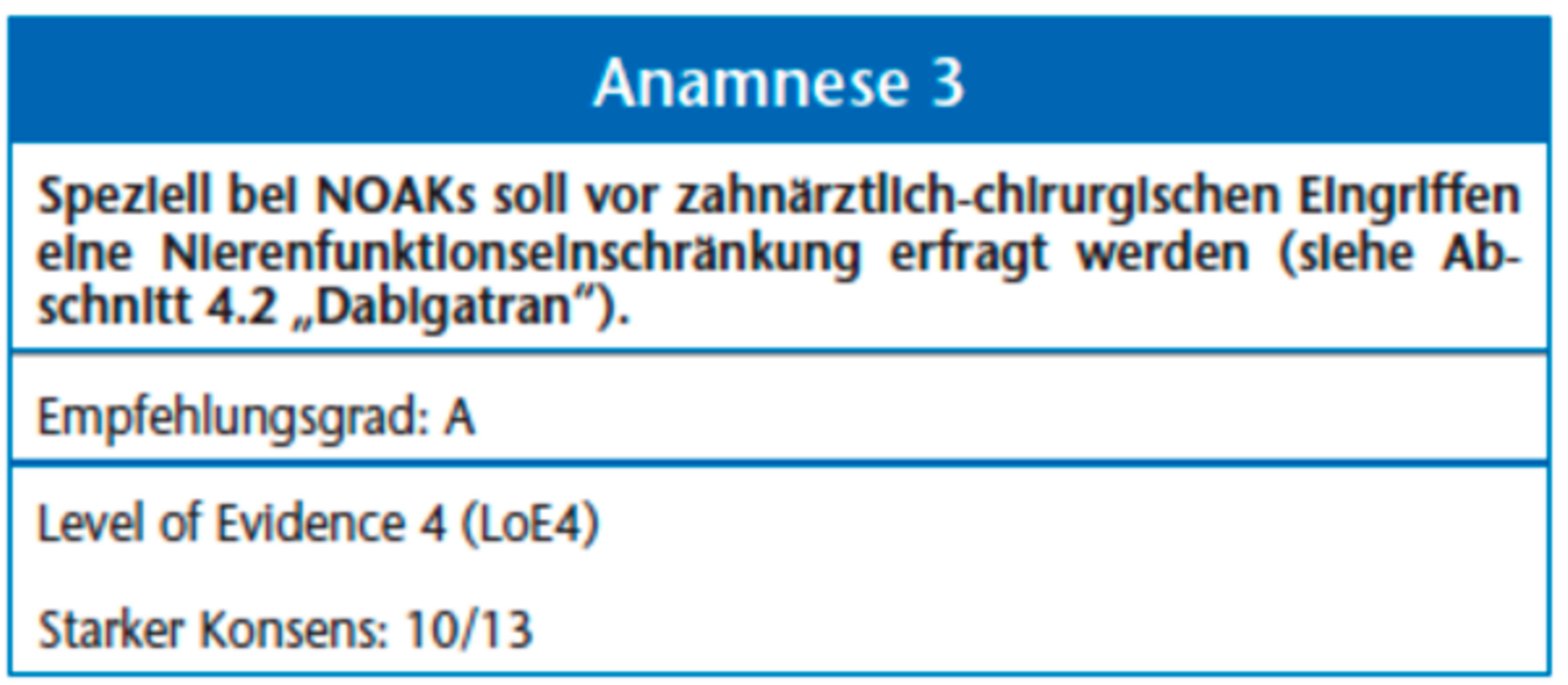
Bei Notfalleingriffen ist das Medikament dialysierbar [9]; schwere Blutungskomplikationen unter NOAKs stellen ein ernstes Problem dar und erfordern eine ausgesprochene Expertise im Bereich der Hämostaseologie. Zur Behandlung kann unter entsprechender Überwachung bei allen drei NOAKs die Gabe von Prothrombinkonzentraten (PPSB) oder rekombinantem Faktor VIIa erfolgen [9, 15 bis 17]. Da bei Patienten mit eingeschränkter Nierenfunktion unter Medikation unter NOAKs letale Blutungen auftreten können, sollte vor allem vor klinischen Situationen, in denen es zu einer Abnahme der Nierenfunktion kommen könnte, die Nierenfunktion durch den Hausarzt überprüft werden. Bei eingeschränkter Nierenfunktion kann ein früheres präoperatives Absetzen sinnvoll sein. Aufgrund der Daten aus der Allgemeinchirurgie wird vor Eingriffen mit Blutungsrisiken ein Absetzen von Dabigatran bei einer Kreatinin-Clearance von > 50 ml/min zwei bis drei Tage präoperativ empfohlen. Bei einer Kreatinin-Clearance von 30 bis 50 ml/min erhöht sich die Karenzzeit auf ≥ 4 Tage. Bei allen NOAKs gilt, dass sie nach Eingriffen bei kompletter Hämostase nach dem Eingriff wieder angesetzt werden sollten; der maximale antikoagulative Effekt tritt zwei Stunden nach Einnahme auf [18]. Die unten beschriebene Evidenz bezieht sich auf die Insertion zahnärztlicher Implantate (siehe Evidenztabellen) und wurde von der Leitliniengruppe auf einfache zahnärztlich-chirurgische Eingriffe im komprimierbaren Bereich ausgeweitet.
4.3 Rivaroxaban, Apixaban, Edoxaban
In einer einfach verblindeten, prospektiven Fall-Kontroll-Studie wurden die Blutungsereignisse von Patienten unter Rivaroxaban-Medikation nach Insertion von dentalen Implantaten mit einer Gruppe ohne hämatologische Besonderheiten, die ebenfalls Implantate erhalten hatten, verglichen. Die diesbezüglichen Unterschiede zwischen den Gruppen waren nicht signifikant. Es handelt sich um eine gut durchgeführte klinische Studie bei einer allerdings nur geringen Patientenzahl und einer fehlenden Standardisierung des implantologischen Eingriffs [19]. Generell wird angeraten, das Medikament ein bis zwei Tage vor invasiven Eingriffen zu pausieren [9, 18, 20], wobei dies umstritten ist. Bei gleichzeitiger Einnahme von Rivaroxaban und Thrombozytenaggregationshemmern erhöht sich das Blutungsrisiko stark, weshalb hier besondere Vorsicht geboten ist. Es existiert Evidenz, die sich in erster Linie auf Daten der Allgemeinchirurgie bezieht, Apixaban ≥ 2 Tage und Edoxaban ein bis zwei Tage präoperativ abzusetzen. Wie auch bei den anderen NOAKs ist immer das Blutungsrisiko gegen die Dringlichkeit und Notwendigkeit des Eingriffs abzuwägen. Die gleichzeitige Anwendung von Edoxaban und anderen Antikoagulantien ist kontraindiziert. Acetylsalicylsäure, P2Y12-Antagonisten wie Clopidogrel und Prasugrel sowie nonsteroidale anti-inflammatorische Medikamente (NSAIDs) führen zu vermehrten Blutungen und einer Verlängerung der Blutungszeit. Insgesamt existiert bei Rivaroxaban, Apixaban und Edoxaban für den zahnärztlich-chirurgischen Bereich nur eine geringe Evidenz, weshalb die Empfehlungen vor allem auf den Expertenmeinungen der Leitlinienkommission beruhen. Wie bei Dabigatran bezieht sich die unten beschriebene Evidenz auf die Insertion zahnärztlicher Implantate (siehe Evidenztabellen) und wurde von der Leitliniengruppe auf einfache zahnärztlich-chirurgische Eingriffe im komprimierbaren Bereich ausgeweitet.
5. Präoperativer Umgang bei dental-chirurgischen Eingriffen bei Thrombozytenaggregationshemmung
Eine Monotherapie mit Thrombozytenaggregationshemmern hat, im Gegensatz zu einer dualen Thrombozytenaggregationshemmung, eine nur gering ausgeprägte Korrelation zu prolongierten Blutungsereignissen nach zahnärztlich-chirurgischen Eingriffen. Bei kleineren Eingriffen (multiple Extraktionen, Lappenplastiken, Alveoloplastiken, Biopsien) konnte ebenfalls kein Zusammenhang zwischen Art des Eingriffs und dem Auftreten von Nachblutungen evaluiert werden [21].
5.1 Acetylsalicylsäure
Das Risiko, unter einer niedrig dosierten Acetylsalicylsäure-Medikation (75 bis 100 mg) während eines allgemeinchirurgischen Eingriffes eine Blutungskomplikation zu erleiden, ist um den Faktor 1,5 erhöht [22], wobei Studien, die sich mit zahnärztlich-chirurgischen Eingriffen befassten, hier nur eine schwache, wenn überhaupt eine, Korrelation nachweisen konnten [21]. Weiterhin waren alle Blutungen nicht lebensbedrohlich und konnten problemlos durch die Anwendung lokaler Maßnahmen gestillt werden [23]. Im Gegensatz dazu erhöht sich das Risiko eines kardiovaskulären Ereignisses beim Absetzen von Acetylsalicylsäure um das Dreifache [23]. Ein Absetzen von Acetylsalicylsäure vor zahnärztlich-chirurgischen Eingriffen ist daher, auch im Rahmen der durch aktuelle Leitlinien nicht empfohlenen Primärprophylaxe, nicht notwendig, kann aber bei niedrigem Thromboserisiko theoretisch erfolgen [24 bis 26].
5.2 Clopidogrel, Prasugrel, Ticagrelor
Patienten unter Clopidogrel haben nach oralchirurgischen Eingriffen ein bis zu zweifach erhöhtes relatives Risiko einer prolongierter Nachblutung [21], wobei keine Einflüsse auf Morbidität und Mortalität berichtet wurden [23]. Prasugrel führt zu einer ausgeprägteren Hemmung der Thrombozyteninhibition als Clopidogrel [27] bei geringeren interindividuellen Schwankungen [28, 29]. Ist nach Absprache mit dem behandelnden Hausarzt oder behandelnden Kardiologen ein kurzfristiges Absetzen der Thienopyridine möglich, so empfiehlt sich bei zahnärztlich-chirurgischen Eingriffen ein Aussetzen der morgendlichen Gabe vor der Operation, wobei durch die irreversible Thrombozytenhemmung durch Clopidogrel und Prasugrel von einer Wirkdauer von acht bis zehn Tagen ausgegangen werden muss (siehe oben). Durch die reversible Wirkung des ADP-Rezeptors P2Y12 durch Ticagrelor klingt die Thrombozytenhemmung hier nach ein bis drei Tagen ab. Ist ein Absetzen nicht möglich, wird unter Belassen der Medikation unter Anwendung hämostyptischer Maßnahmen operiert [21, 30]. Während für Clopidogrel einzelne Vergleichsstudien vorliegen, sind diese für Prasugrel und Ticagrelor nicht vorhanden.
5.3 Duale Thrombozytenaggregationshemmung
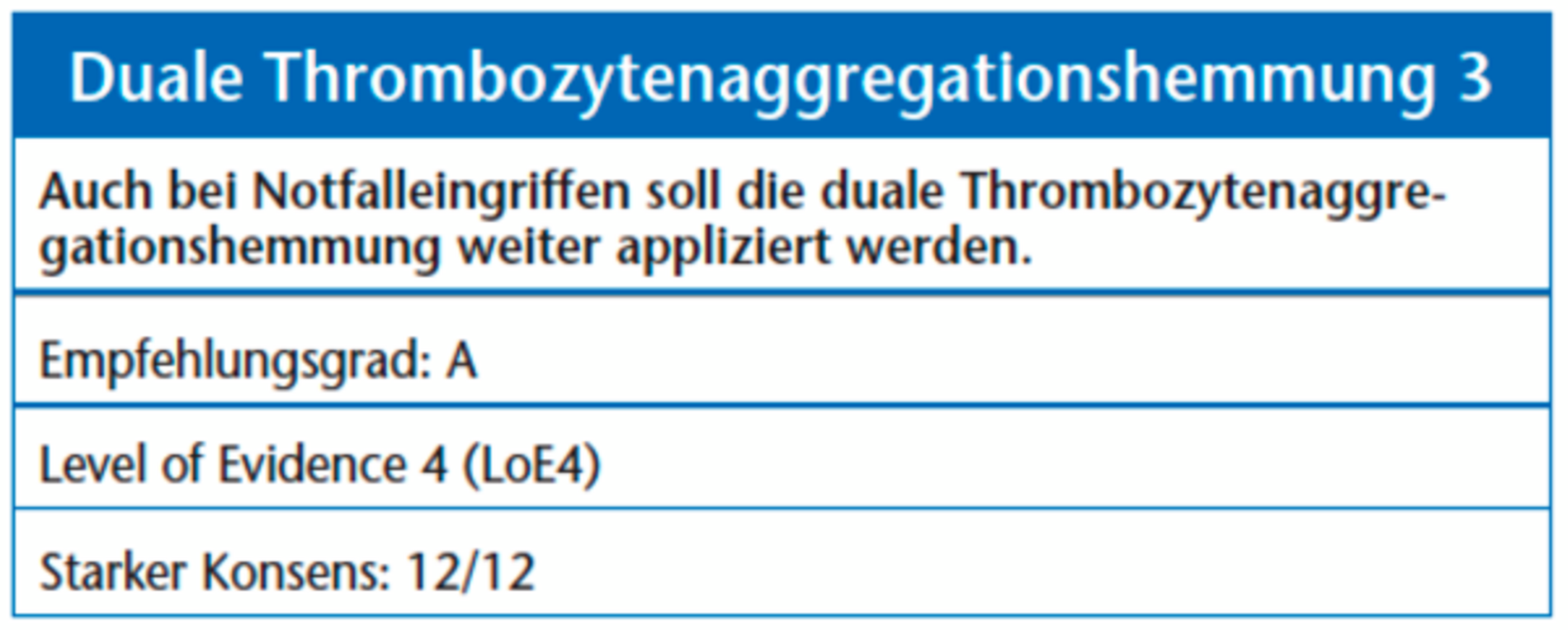
Häufig werden bei Patienten (wie nach Stentimplantation) zwei Thrombozytenaggregationshemmer (vor allem Acetylsalicylsäure und ein Thienopyridin) eingesetzt. Acetylsalicylsäure wird hier lebenslang rezeptiert. Die Thienopyridine werden bei unbeschichteten, „bare metal“-Stents zusätzlich für vier Wochen und bei beschichteten, „drug eluting“-Stents für mindestens sechs Monate empfohlen [31]. Bei Patienten mit einem akuten Koronarsyndrom erfolgt die duale Thrombozytenaggregationshemmung mit Ticagrelor grundsätzlich für zwölf Monate. Generell bleibt eine Verlängerung der Einzelfallentscheidung vorbehalten [28]. Dies kann wiederum auch nach zahnärztlich-chirurgischen Eingriffen zu erheblichen postoperativen Blutungskomplikationen führen [21]. Das wichtigste Risiko für das Eintreten einer Stentthrombose (Hazard Ratio von 89,9), die in bis zu 75 Prozent der Fälle einen letal verlaufenden Myokardinfarkt zur Folge hat, ist das Absetzen der dualen Thrombozytenaggregationshemmung [9, 32]. Bei Patienten mit einem frisch implantierten Stent führte das Absetzen der Thrombozytenaggregation zu einer Mortalitätssteigerung von 20 bis 40 Prozent [33]. Daher sollten elektive zahnärztliche Eingriffe erst nach Beendigung der dualen Thrombozytenaggregation stattfinden [31]. Selbst im Notfall ist die antiaggregatorische Medikation nicht zu verändern. Hier können Thrombozytenkonzentrate, Desmopression und/oder Antifibrinolytika Anwendung finden [9], wobei diese wiederum die Gefahr einer Thrombose erhöhen. Das Verwenden von hämostyptischen Maßnahmen, wie Nähten, der Applikation von Tranexamsäure und lokalem Druck hat bereits gute Ergebnisse in der Vermeidung von Blutungskomplikationen gezeigt [34].
6. Tripletherapie
Ist, beispielsweise bei Vorhofflimmern, eine dauerhafte orale Antikoagulation notwendig und erfordert die begleitende koronare Herzkrankheit (bei 20 bis 30 Prozent der oral antikoagulierten Patienten [35]) eine Stentintervention, wird eine Tripletherapie mit oraler Antikoagulation und dualer Thrombozytenaggregationshemmung benötigt, die das Blutungsrisiko signifikant steigert [28]. Es ist davon auszugehen, dass hier die Handlungsempfehlungen für die zahnärztliche Chirurgie analog zur dualen Thrombozytenaggregationshemmung sind.
7. Bridging – Definition, Sinn und Möglichkeiten
Beim Bridging wird eine schwer steuerbare (Langzeit-)Antikoagulation perioperativ durch ein besser steuerbares Heparin überbrückt. Damit soll eine „ungeschützte Phase“ durch die Unterbrechung der Antikoagulation vermieden werden. Tatsächlich wurde im Abstract einer Arbeit aus dem Jahr 2000 angegeben, dass eine Unterbrechung der oralen Antikoagulation ohne Substitution in einem dreifach erhöhten Embolierisiko mit potenziell letalen Komplikationen resultieren würde [36]. Ein methodisch korrekter Nachweis für diese Risikobewertung wurde nicht erbracht. Allerdings ist nicht zu erwarten, dass insbesondere bei den NOAKs ein solcher Nachweis jetzt, oder überhaupt, zu erbringen ist.
Zum Bridging werden die Vitamin-K-Antagonisten vier bis sieben Tage präoperativ abgesetzt. Bei Unterschreiten der INR des therapeutischen Bereichs (< 2; Tabelle 3) werden, je nach Indikation, subkutan applizierte niedermolekulare Heparine oder intravenös appliziertes unfraktioniertes Heparin angesetzt, wobei bei niedermolekularen Heparinen eine höhere Effizienz nachgewiesen werden konnte [39]. Ist das postoperative Blutungsrisiko vertretbar, in der Regel am ersten Tag nach dem Eingriff, wird mit der oralen Therapie mit Vitamin-K-Antagonisten wieder begonnen, wobei die Heparine erst dann abgesetzt werden, wenn die INR wieder bei > 2 liegt [38]. Zum Thema Bridging verweisen wir auf die aktuelle S1-Leitlinie der DEGAM.
Ein Bridging mit Heparinen ist unter Umständen bei Vitamin-K-Antagonisten und NOAKs aber nicht bei Thrombozytenaggregationshemmern sinnvoll. Allerdings ist auch bei größeren Eingriffen (wie Mundboden, Retromolarraum) die Praxis des Bridging derzeit umstritten. Nach Abschluss der Literaturrecherche dieser Leitlinie erschien eine randomisiere, doppelt-verblindete, Plazebo-kontrollierte klinische Studie, die das Risiko einer Thrombembolie bei 1.884 Patienten mit Vorhofflimmern unter oraler Antikoagulation mit Warfarin verglich, wobei bei 950 Patienten kein Bridging (kompletter Abbruch der Antikoagulation/Plazebogabe) und bei 934 Patienten ein Bridging durchgeführt wurde. Die Autoren kamen zu dem Schluss, dass zwischen den beiden Gruppen kein signifikanter Unterschied bezüglich thrombembolischer Ereignisse (ohne Antikoagulation 0,4 Prozent, Bridging 0,3 Prozent), wohl aber bezüglich der Blutungskomplikationen (ohne Antikoagulation 1,3 Prozent, Bridging 3,2 Prozent) existiert [37]. Diese Ergebnisse sind allerdings nicht unmittelbar auf die für Phenprocoumon notwendigen Unterbrechungs-Zeiten und bislang auch nicht auf andere Indikationen (zum Beispiel zahnärztlich-chirurgische Eingriffe) zu übertragen.
Im Bereich der Zahn-, Mund- und Kieferheilkunde, für kleinere zahnärztlich-chirurgische Eingriffe wie Zahnextraktionen und Osteotomien ergab sich in einer prospektiv randomisierten Studie zwar eine etwas höhere Zahl von Blutungsereignissen für die Fortführung der Antikoagulation, der Unterschied erreichte aber keine Signifikanz [38]. Kritisch anzumerken ist allerdings, dass in dieser Studie keine einheitliche operative Vorgehensweise für die Studiengruppen gewählt wurde. Im Gegensatz zur Antikoagulations-Gruppe wurden beispielsweise in der Bridging-Gruppe keinerlei lokale hämostyptische Maßnahmen durchgeführt, sodass die Studie ein Bias zugunsten der fortgeführten Antikoagulation beinhaltet.
Sollte ein Bridging notwendig sein, erfolgt dies immer in enger Rücksprache mit dem behandelnden Hausarzt oder mit dem behandelnden Kardiologen. Hier wird empfohlen, das Kreatinin im Serum zu bestimmen, um mögliche Indikationseinschränkungen zu bewerten.
8. Präoperative Kautelen
8.1 Anamnese
Wie aus dem oben Erwähnten zu entnehmen, kommt der Anamnese eine besondere Bedeutung zu. Patienten unter Antikoagulation und/oder Thrombozytenaggregationsinhibition haben oftmals einen Pass, in dem die rezeptierten Antikoagulantien und Thrombozytenaggregationshemmer sowie, wenn möglich und vorhanden, die aktuellen Laborwerte vermerkt sind. Die antikoagulatorische pharmakodynamische Wirkung eines NOAK lässt innerhalb von 12 bis 24 Stunden nach der letzten Einnahme zunehmend nach. Zur klinischen Einschätzung der Blutungsneigung eines Patienten unter NOAK-Behandlung ist daher die genaue Erhebung der Arzneimittelanamnese klinisch von hoher Relevanz. Hier ist insbesondere die Klärung der Frage am wichtigsten, wann die letzte Tablette welches genauen Wirkstoffs in welcher Dosierung eingenommen wurde [18].
8.2 Rücksprache mit dem behandelnden Hausarzt oder mit dem behandelnden Kardiologen
Primär obliegt es dem Zahnarzt, die Möglichkeiten, durch lokale Maßnahmen eine suffiziente Blutstillung zu erreichen, zu bewerten. Hausärzte können primär zwar das Risiko für thrombembolische Komplikationen, nicht aber den Umfang des zahnärztlichen Eingriffs einschätzen [36]. Es reicht bei der Rechtfertigung entstandener Komplikationen nicht aus, den Vorgaben des Hausarztes oder des behandelnden Kardiologen gefolgt zu haben; auch der Zahnarzt hat hier einen Teil der professionellen Verantwortung [36, 39]. Wenn das Nachblutungsrisiko hoch eingeschätzt wird, sollte vorab Kontakt zum Hausarzt oder zum behandelnden Kardiologen aufgenommen werden.
8.3 Labor
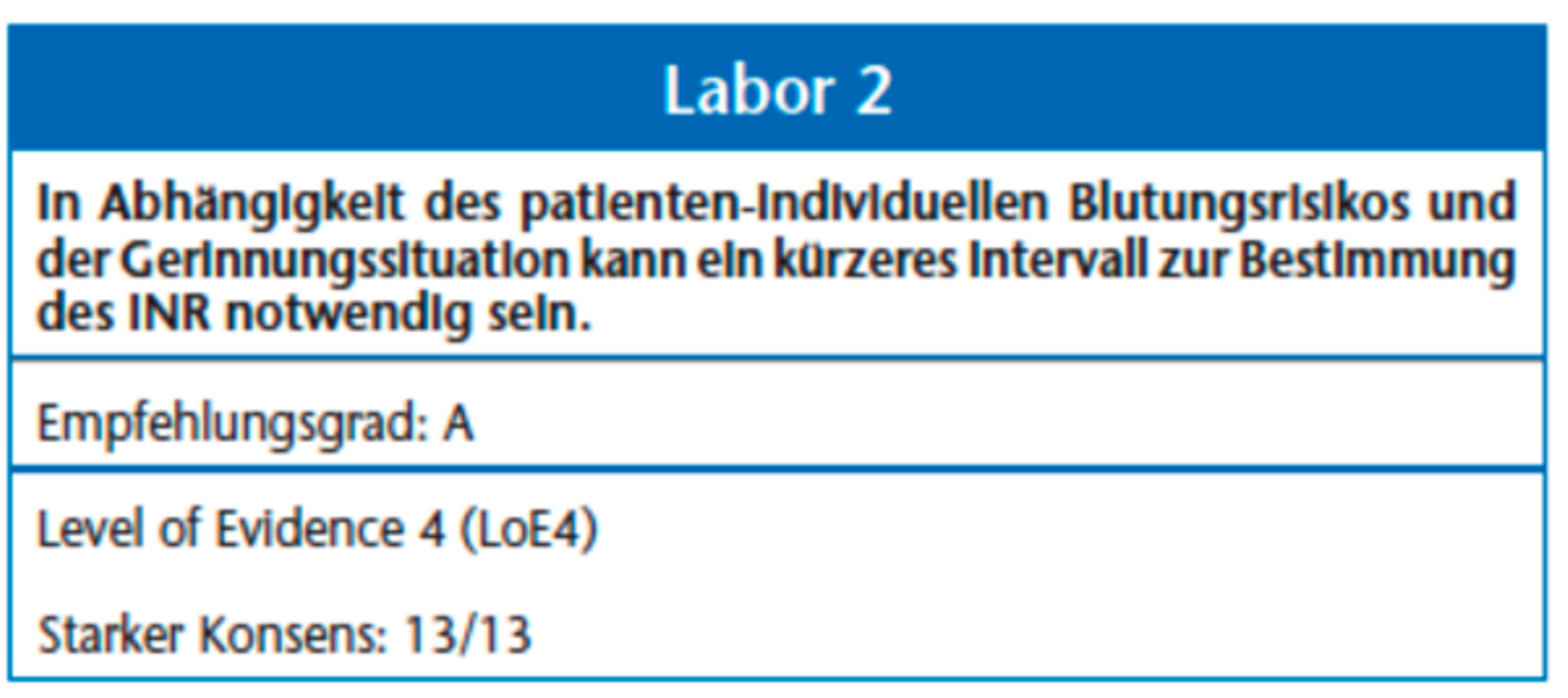
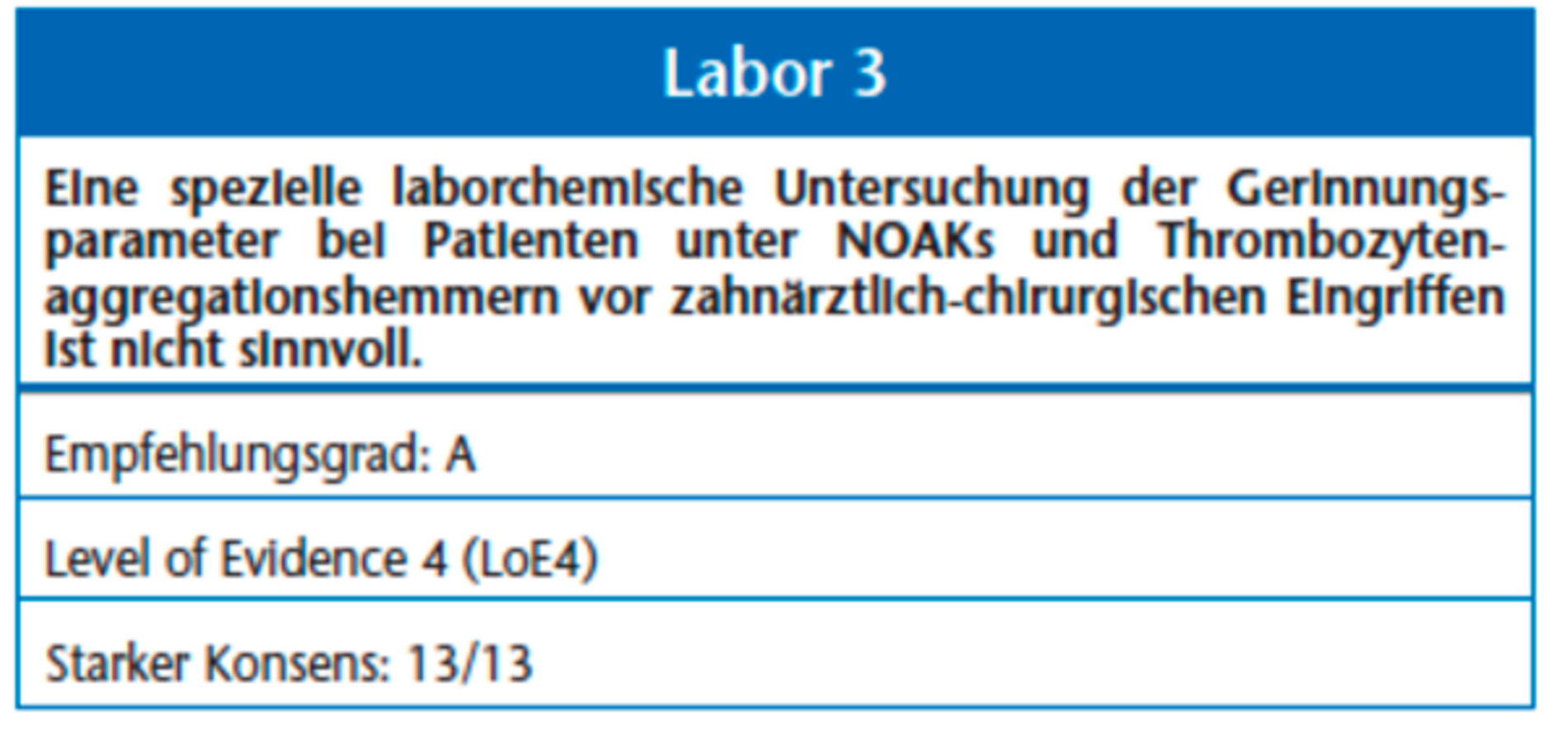
Ein INR > 4 resultiert in einem inakzeptabel hohen Risiko für postoperative Blutungsereignisse [1, 40], das Unterschreiten des therapeutischen INR-Werts (Tabelle 3) ist wiederum mit einem erheblichen Risiko für thrombembolische Ereignisse verbunden. Die Hemmung der Blutgerinnung durch NOAKs und Thrombozytenaggregationshemmer ist nur durch spezielle Laboruntersuchungen zu bestimmen. Zu der individuellen Bestimmung der INR verweisen wir auf die entsprechende Leitlinie der DEGAM.
8.4 Aufklärung
Selbst unter Beibehaltung aller Vorsichtsmaßnahmen ist bei Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung von einer, wenn auch nur gering erhöhten, Nachblutungsrate nach oralchirurgischen Eingriffen auszugehen [1, 30, 34].
8.5 Präoperative Vorbereitung
9. Intraoperative Kautelen
9.1 Art der Lokalanästhesie
Wenn keine anderweitigen Kontraindikationen bestehen, sind Lokalanästhetika wie Articain und Lidocain jeweils mit Vasokonstriktoren einsetzbar. Allerdings ist zu beachten, dass es durch das Nachlassen der Adrenalinwirkung zu einer verstärkten Blutung („Rebound“) kommen kann. Eine Leitungsanästhesie des Nervus alveolaris inferior ist auch ohne Zugabe von Adrenalin möglich [41]. Im Gegensatz hierzu ist bei der Infiltration unter Verwendung von Articain ein Vasokonstriktor notwendig [42], wobei auch in der geringen Konzentration von 1:400.000 eine für kürzere Eingriffe ausreichende Taubheit beobachtet wurde [42 bis 44]. Da Techniken wie die Leitungsanästhesie des Nervus alveolaris inferior theoretisch eine erhöhte Rate an akzidentiellen Verletzungen größerer Gefäße mit sich führen, wird bei Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung ein Ausweichen auf Techniken geraten, durch die es zu signifikant weniger Gefäßverletzungen kommen kann. Bei der Infiltration im Vestibulum können kaum relevante Gefäße verletzt werden. Die intraligamentäre Anästhesie hat hohe Erfolgsraten, wobei bei sachgemäßer Durchführung keine solche Blutungen auftreten können [45, 46]. Allerdings ist die intraligamentäre Anästhesie an das Vorliegen eines Zahnes gebunden und es entsteht nur eine umschriebene Betäubung des Weichgewebes, die beispielsweise für Lappenoperationen oder Osteotomien möglicherweise nicht ausreicht.
9.2 Versorgung der Alveole
Da das Granulationsgewebe in der Alveole einen nicht unerheblichen Grund für postoperative Blutungen darstellt, ist dieses im Rahmen der zahnärztlich-chirurgischen Operation vollständig zu entfernen [21]. Anschließend können lokale Hämostyptika wie zum Beispiel Kollagen und Gelatine eingelegt werden [38, 47]. Die darauffolgende Naht fixiert das eingelegte Material und senkt das Nachblutungsrisiko [21, 48], wobei randomisierte, prospektive Studien teilweise auch keinen Vorteil einer Naht nachweisen konnten [49, 50]. Die Empfehlung einer adaptierenden Naht bezieht sich somit auf die Expertenmeinung.
9.3 Hämostyptische Maßnahmen
Neben der Naht ist die Anwendung von Hämostyptika bei der Behandlung von Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung von großer Relevanz [48].
In einer Studie an 2.400 Patienten unter Antikoagulation waren nur in zwölf Fällen derartige lokale Maßnahmen nicht ausreichend, wobei allerdings in sieben der Fälle der INR über der therapeutischen Grenze lag [36]. Die einfachste und hoch effiziente Maßnahme ist die physikalische Kompression durch Aufbisstupfer [38] oder präoperativ angefertigte Verbandsplatten [51]. Weiterhin finden Fibrin- und Histoacrylkleber [52, 53], lokale antifibrinolytische Lösungen wie die Tranexamsäure [54], Kollageneinlagen [38], Gelatineschwämme [47] und Cyanoacrylate [24] Anwendung. Im Vergleich der einzelnen Maßnahmen untereinander konnten bisher weder Vor- noch Nachteile einzelner Maßnahmen nachgewiesen werden [48, 55 bis 57]. Es scheint entscheidend zu sein, dass die besagten Hämostyptika nach individueller Präferenz überhaupt angewendet werden, da unbehandelte Kontrollgruppen unter oraler Antikoagulation/Thrombozytenaggregationshemmung regelmäßig höhere Nachblutungsraten aufwiesen [26, 58, 59].
9.4 Tranexamsäure
Die Anwendung von Tranexamsäure als antifibrinolytische Mundspülung kann die Frequenz von Blutungen nach oralchirurgischen Eingriffen in signifikantem Ausmaß senken, ohne dass eine antikoagulatorische/anti-aggregatorische Medikation verändert wird [12, 54, 60, 61]. Entsprechend den DAC/NRF-Rezepturhinweisen ist das Medikament als dafür zugelassene Rezeptursubstanz erhältlich und über die Apotheke rezeptierbar. Ein Präparat kann auch individuell aus 5-%iger Tranexamsäure (Cyklokapron®) durch Verdünnung einer 5-ml-Ampulle mit Aqua ad injectabilia auf 10 ml hergestellt werden. Im angloamerikanischen Raum ist die Anwendung erfolgreich und verbreitet (Spülung mit Tranexamsäure nach dem chirurgischen Eingriff sowie für sieben Tage, viermal am Tag für je zwei Minuten [60]), wobei sowohl bei Reduktion auf fünf als auch auf zwei Tage das gleiche positive Ergebnis gezeigt werden konnte [62]). Auch bei Patienten unter Thrombozytenaggregationshemmung konnten gute Ergebnisse gezeigt werden [34].
9.5 Schmerzmedikation mit NSAIDs
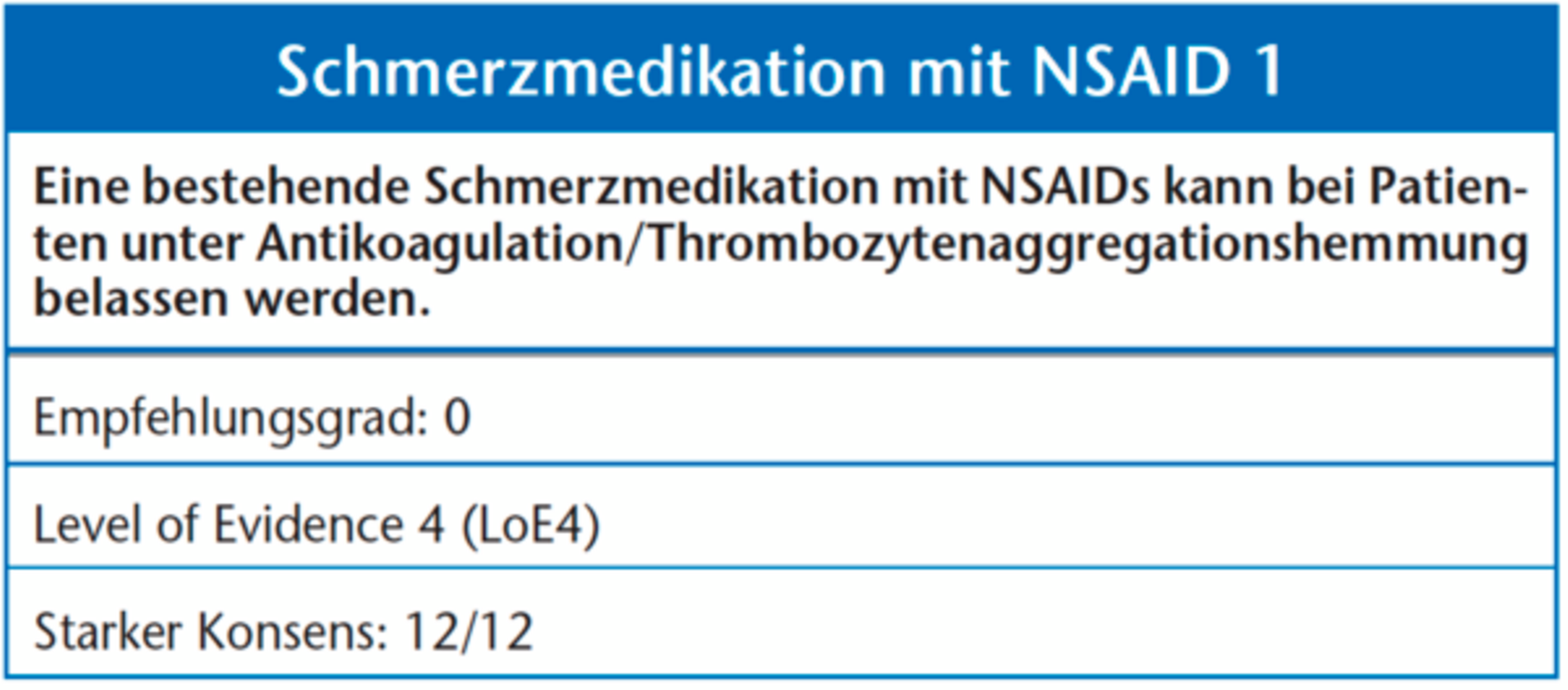
Nonsteroidale anti-inflammatorische Medikamente (NSAIDs) entfalten ihre Wirkung über eine transitorische Hemmung der Cyclooxygenasen. Es besteht Evidenz, dass zum Beispiel Ibuprofen und Naproxen bei Patienten unter Acetylsalicylsäure zu einer Verminderung der Thrombozytenaggregationswirkung führen könnte [63, 64], wobei hier die klinische Relevanz noch nicht geklärt ist. Der Effekt der NSAIDs auf die primäre Hämostase ist von ihrer Plasmahalbwertszeit abhängig [65, 66]. Die Blutungszeit bleibt normalerweise jedoch auch unter Einnahme gängiger NSAIDs im normalen Bereich, daher ist ein Absetzen der Medikamente vor zahnärztlich-chirurgischen Eingriffen nicht notwendig [67]. Cyclooxygenase-2-spezifische Schmerzmedikamente haben keinen Einfluss auf die Gerinnung [68].
10. Postoperative Kautelen
10.1 Überwachung, Nachbehandlung
Postoperativ wird bei Patienten unter oraler Antikoagulation/Thrombozytenaggregationshemmung eine verlängerte Nachbeobachtungszeit empfohlen. Nach der Operation ist ein lokaler Druck, zum Beispiel durch Aufbisstupfer, zu applizieren. Anschließend ist eine Kontrolle der Wunde empfohlen, wobei bei persistierender Blutung entsprechende, oben bereits genannte Maßnahmen zum Einsatz kommen. Die Anwendung von Elekrokoagulation ist bei Weichgewebseingriffen empfehlenswert. Die Anwendung von Tranexamsäure (siehe oben) kann zu einer signifikanten Verminderung von (Nach-)Blutungen führen.
10.2 Abwägung ambulante vs. stationäre Behandlung
Ist die lokale Behandlung nicht möglich und/oder ist ein höheres Blutungsrisiko zu erwarten, wird eine stationäre Einweisung der Patienten empfohlen.
S3-Leitlinie (Langversion)
AWMF-Registernummer: 083–018; Stand: August 2017;
Gültig bis: August 2020
Federführende Fachgesellschaften:
Deutsche Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK)
Deutsche Gesellschaft für Mund-, Kiefer- und Gesichtschirurgie e.V. (DGMKG)
Beteiligung weiterer AWMF-Fachgesellschaften:
Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM)
Deutsche Gesellschaft für Implantologie im Zahn-, Mund- und Kieferbereiche (DGI)
Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e.V. (DGK)
Deutsche Gesellschaft für Parodontologie (DG PARO)
Beteiligung weiterer Fachgesellschaften/Organisationen:
Arbeitsgemeinschaft für Kieferchirurgie (AGKi)
Arzneimittelkommission Zahnärzte (AKZ)
Berufsverband Deutscher Oralchirurgen (BDO)
Bundesverband der implantologisch tätigen Zahnärzte in Europa (BDIZ EDI)
Bundeszahnärztekammer (BZÄK)
Deutsche Gesellschaft für Ästhetische Zahnmedizin (DGÄZ)
Freier Verband Deutscher Zahnärzte (FVDZ)
Interdisziplinärer Arbeitskreis Zahnärztliche Anästhesie (IAZA)
Kassenzahnärztliche Bundesvereinigung (KZBV)
Die LL zum Download:
www.dgzmk.de/uploads/tx_szdgzmkdocuments/antikoaglang.pdf
Diese AWMF-S3-Leitlinie ist gültig bis August 2020.
PD Dr. Dr. Peer W. Kämmerer, M.A., FEBOMFS
Leitender Oberarzt/Stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie der Universitätszahnklinik Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Prof. Dr. Dr. Bilal Al Nawas
Direktor
Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie der Universitätszahnklinik Mainz
Augustusplatz 2, 55131 Mainz
Literatur zu LL Antikoagulantien
1. Kämmerer PW et al.: Oral surgery during therapy with anticoagulants – a systematic review. Clin Oral Investig 2015; 19: 171–180
2. Rechenmacher SJ, Fang JC: Bridging anticoagulation: primum non nocere. J Am Coll Cardiol 2015M; 66: 1392–403
3. Burwinkel M: Eingriffe an Blutungspatienten Teil 1: Systematik zur Risikoeinschätzung. Quintessenz 2013; 64: 339–350
4. Kuramatsu JB et al.: Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage. JAMA 2015; 313: 824–36
5. Kossler J, Steigerwald U, Walter U: [Anticoagulants of primary haemostasis]. Hamostaseologie 2009; 29: 274–78
6. Pollack CV, Jr. et al.: Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511–20
7. Costin J et al.: Reversal agents in development for the new oral anticoagulants. Postgrad Med 2014; 126: 19–24
8. Das A, Liu D: Novel antidotes for target specific oral anticoagulants. Exp Hematol Oncol 2015; 4: 25
9. Schlitt A et al.: Perioperativer Umgang mit Antikoagulanzien und Thrombozytenaggregationshemmern. Dtsch Arztebl 2013; 110: 525–532
10. Angiolillo DJ et al.: High clopidogrel loading dose during coronary stenting: effects on drug response and interindividual variability. Eur Heart J 2004; 25: 1903–10
11. Hoffmeister HM et al.: Unterbrechung antithrombotischer Behandlung (Bridging) bei kardialen Erkrankungen. Kardiologe 2010; 4: 365–74
12. Gaspar R et al.: Use of tranexamic acid mouthwash to prevent postoperative bleeding in oral surgery patients on oral anticoagulant medication. Quintessence Int 1997; 28: 375–79
13. Evans IL et al.: Can warfarin be continued during dental extraction? Results of a randomized controlled trial. Br J Oral Maxillofac Surg 2002; 40: 248–52
14. Marcumar(R) F: 2015
15. Eerenberg ES et al.: Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation 2011; 124: 1573–79
16. Zhou W et al.: Hemostatic therapy in experimental intracerebral hemorrhage associated with the direct thrombin inhibitor dabigatran. Stroke 2011; 42: 3594–99
17. Kaatz S et al.: Guidance on the emergent reversal of oral thrombin and factor Xa inhibitors. Am J Hematol 2012; 87(Suppl 1): S141–45
18. Heidbuchel H et al.: Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015
19. Gomez-Moreno G et al.: Dental implant surgery in patients in treatment with the anticoagulant oral rivaroxaban. Clin Oral Implants Res 2015
20. Schellong SM, Haas S: Neue orale Antikoagulanzien und ihre Anwendung im perioperativen Umfeld. Anasthesiol Intensivmed Notfallmed Schmerzther 2012; 47: 266–72
21. Girotra C et al.: Assessment of the risk of haemorrhage and its control following minor oral surgical procedures in patients on anti-platelet therapy: a prospective study. Int J Oral Maxillofac Surg 2014; 43: 99–106
22. Burger W et al.: Low-dose aspirin for secondary cardiovascular prevention – cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation – review and meta-analysis. J Intern Med 2005; 257: 399–414
23. Vaclavik J, Taborsky M: Antiplatelet therapy in the perioperative period. Eur J Intern Med 2011; 22: 26–31
24. Aldridge E, Cunningham LL, Jr.: Current thoughts on treatment of patients receiving anticoagulation therapy. J Oral Maxillofac Surg 2010; 68: 2879–87
25. Ardekian L et al.: Does low-dose aspirin therapy complicate oral surgical procedures? J Am Dent Assoc 2000; 131: 331–5
26. Aframian DJ, Lalla RV, Peterson DE: Management of dental patients taking common hemostasis-altering medications. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103: S45.e1–11
27. Dezsi BB et al.: Prasugrel xersus Clopidogrel: a comparative examination of local bleeding after dental extraction in patients receiving dual antiplatelet therapy. J Oral Maxillofac Surg 2015; 73: 1894–900
28. Scheller B et al.: Medikamente freisetzende Koronarstents und mit Medikamenten beschichtete Ballonkatheter – Positionspapier der DGK 2011. Der Kardiologe 2011; 5: 411–35
29. Payne CD et al.: Increased active metabolite formation explains the greater platelet inhibition with prasugrel compared to high-dose clopidogrel. J Cardiovasc Pharmacol 2007; 50: 555–62
30. Bajkin BV et al.: Dental extractions and risk of bleeding in patients taking single and dual antiplatelet treatment. Br J Oral Maxillofac Surg 2015; 53: 39–43
31. Grines CL et al.: Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: a science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Coll Cardiol 2007; 49: 734–9
32. Iakovou I et al.: Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293: 2126–30
33. Kaluza GL et al.: Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 2000; 35: 1288–94
34. Sanchez-Palomino P et al.: Dental extraction in patients receiving dual antiplatelet therapy. Med Oral Patol Oral Cir Bucal 2015; 20: e616–20
35. Nabauer M et al.: The Registry of the German Competence NETwork on Atrial Fibrillation: patient characteristics and initial management. Europace 2009; 11: 423–34
36. Wahl MJ: Myths of dental surgery in patients receiving anticoagulant therapy. J Am Dent Assoc 2000; 131: 77–81
37. Douketis JD, Hasselblad V, Ortel TL: Bridging anticoagulation in patients with atrial fibrillation. N Engl J Med 2016; 374: 93–4
38. Bajkin BV, Popovic SL, Selakovic SD: Randomized, prospective trial comparing bridging therapy using low-molecular-weight heparin with maintenance of oral anticoagulation during extraction of teeth. J Oral Maxillofac Surg 2009; 67: 990–5
39. Wahl MJ, Howell J: Altering anticoagulation therapy: a survey of physicians. JADA 1996; 127: 625–38
40. Beirne OR, Koehler JR: Surgical management of patients on warfarin sodium. J Oral Maxillofac Surg 1996; 54: 1115–8
41. Kämmerer PW et al.: Comparison of 4 % articaine with epinephrine (1:100,000) and without epinephrine in inferior alveolar block for tooth extraction: double-blind randomized clinical trial of anesthetic efficacy. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 113: 495–9
42. Kämmerer PW et al.: Comparative clinical evaluation of different epinephrine concentrations in 4 % articaine for dental local infiltration anesthesia. Clin Oral Investig 2014; 18: 415–21
43. Daubländer M et al.: Clinical use of an epinephrine-reduced (1/400,000) articaine solution in short-time dental routine treatments – a multicenter study. Clin Oral Investig 2012; 16: 1289–95
44. Kämmerer PW et al.: Epinephrine-reduced articaine solution (1:400,000) in paediatric dentistry: a multicentre non-interventional clinical trial. Eur Arch Paediatr Dent 2013; 14: 89–95
45. Shabazfar N et al.: Periodontal intraligament injection as alternative to inferior alveolar nerve block – meta-analysis of the literature from 1979 to 2012. Clin Oral Investig 2014; 18: 351–8
46. Kämmerer PW et al.: Clinical efficacy of a computerised device (STA) and a pressure syringe (VarioJect INTRA) for intraligamentary anaesthesia. Eur J Dent Educ 2015; 19: 16–22
47. Cieslik-Bielewska A, Pelc R, Cieslik T: Oral surgery procedures in patients on anticoagulants. Preliminary report. Kardiol Pol 2005; 63: 137–40; discussion 141
48. Blinder D et al.: Dental extractions in patients maintained on continued oral anticoagulant: comparison of local hemostatic modalities. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 88: 137–40
49. Bajkin BV et al.: Comparison of efficacy of local hemostatic modalities in anticoagulated patients undergoing tooth extractions. Vojnosanit Pregl 2014; 71: 1097–101
50. Al-Mubarak S et al.: Evaluation of dental extractions, suturing and INR on postoperative bleeding of patients maintained on oral anticoagulant therapy. Br Dent J 2007; 203: E15; discussion 410–1
51. Eichhorn W et al.: Bleeding incidence after oral surgery with continued oral anticoagulation. Clin Oral Investig 2012; 16: 1371–76
52. Rakocz M et al.: Dental extractions in patients with bleeding disorders. The use of fibrin glue. Oral Surg Oral Med Oral Pathol 1993; 75: 280–2
53. Al-Belasy FA, Amer MZ: Hemostatic effect of n-butyl-2-cyanoacrylate (histo- acryl) glue in warfarin-treated patients undergoing oral surgery. J Oral Maxillofac Surg 2003; 61: 1405–9
54. Ramstrom G et al.: Prevention of postsurgical bleeding in oral surgery using tranexamic acid without dose modification of oral anticoagulants. J Oral Maxillofac Surg 1993; 51: 1211–6
55. Soares EC et al.: Postoperative hemostatic efficacy of gauze soaked in tranexamic acid, fibrin sponge, and dry gauze compression following dental extractions in anticoagulated patients with cardiovascular disease: a prospective, randomized study. Oral Maxillofac Surg 2014
56. Halfpenny W, Fraser JS, Adlam DM: Comparison of 2 haemostatic agents for the prevention of postextractional hemorrhage in patients on anticoagulants. Oral Surg Oral Med Oral Pathol 2001; 92: 257–9
57. Carter G et al.: Tranexamic acid mouthwash versus autologous fibrin glue in patients taking warfarin undergoing dental extractions: a randomized prospective clinical study. J Oral Maxillofac Surg, 2003; 61: p 1432–5
58. Devani P, Lavery KM, Howell CJT: Dental extractions in patients on warfarin: Is alteration of anticoagulant regime necessary? Br Dent J 1998; 36: 107–11
59. Blinder D et al.: Dental extractions in patients maintained on oral anticoagulant therapy: comparison of INR value with occurrence of postoperative bleeding. Int J Oral Maxillofac Surg 2001; 30: 518–21
60. Sindet-Pedersen S et al.: Hemostatic effect of tranexamic acid mouthwash in anticoagulant-treated patients undergoing oral surgery. N Engl J Med 1989; 320: 840–3
61. Carter G et al.: Tranexamic acid mouthwash versus autologous fibrin glue in patients taking warfarin undergoing dental extractions: a randomized prospective clinical study. J Oral Maxillofac Surg 2003; 61: 1432–5
62. Carter G, Goss A: Tranexamic acid mouthwash – a prospective randomized study of a 2-day regimen vs 5-day regimen to prevent postoperative bleeding in anticoagulated patients requiring dental extractions. Int J Oral Maxillofac Surg 2003; 32: 504–7
63. Meek IL et al.: Interference of NSAIDs with the thrombocyte inhibitory effect of aspirin: a placebo-controlled, ex vivo, serial placebo-controlled serial crossover study. Eur J Clin Pharmacol 2013; 69: 365–71
64. Yokoyama H et al.: Influence of non-steroidal anti-inflammatory drugs on antiplatelet effect of aspirin. J Clin Pharm Ther 2013; 38: 12–5
65. Cronberg S, Wallmark E, Soderberg I: Effecton platelet aggregation of oral administration of 10 non-steroidal analgesics to humans. Scand J Haematol 1984; 33: 155–9
66. Daniel NG et al.: Antiplatelet drugs: is there a surgical risk? J Can Dent Assoc 2002; 68: 683–7
67. Schafer AI: Effects of nonsteroidal antiinflammatory drugs on platelet function and systemic hemostasis. J Clin Pharmacol 1995; 35: 209–19
68. Leese PT et al.: Effects of celecoxib, a novel cyclooxygenase-2 inhibitor, on platelet function in healthy adults: a randomized, controlled trial. J Clin Pharmacol 2000; 40: 124–32
69. Clemm R, Neukam FW, Rusche B, Bauersachs A, Musazada S, Schmitt CM: Management of anticoagulated patients in implant therapy: a clinical comparative study. Clin Oral Impl Res 2016; 27: 1274–82
70. Arzneimittelbrief 47, 2013, S. 67
71. Arzneimittelbrief 44, 2013, S. 66–68
Co-Autoren
Christian Berger (BDIZ EDI)
Matthias Burwinkel (DGI)
Harald Darius (DGK)
Monika Daubländer (IAZA)
Michael Frank (BZÄK, KZBV)
Ti-Sun Kim (DG PARO)
Paulus Kirchhof (DGK)
Jonas Lorenz (DGÄZ)
Armin Mainz (DEGAM)
Norbert Mrochen (BDO)
Emeka Nkenke (AGKi)
Robert Sader (DGÄZ)
Christoph Schindler (AKZ)
Martin Ullner (BDO)
Hans-Otto Wagner (DEGAM)
Thomas Wolf (FVDZ)