Häusliches chemisches Biofilmmanagement in der Prävention und Therapie der Gingivitis
Einleitung
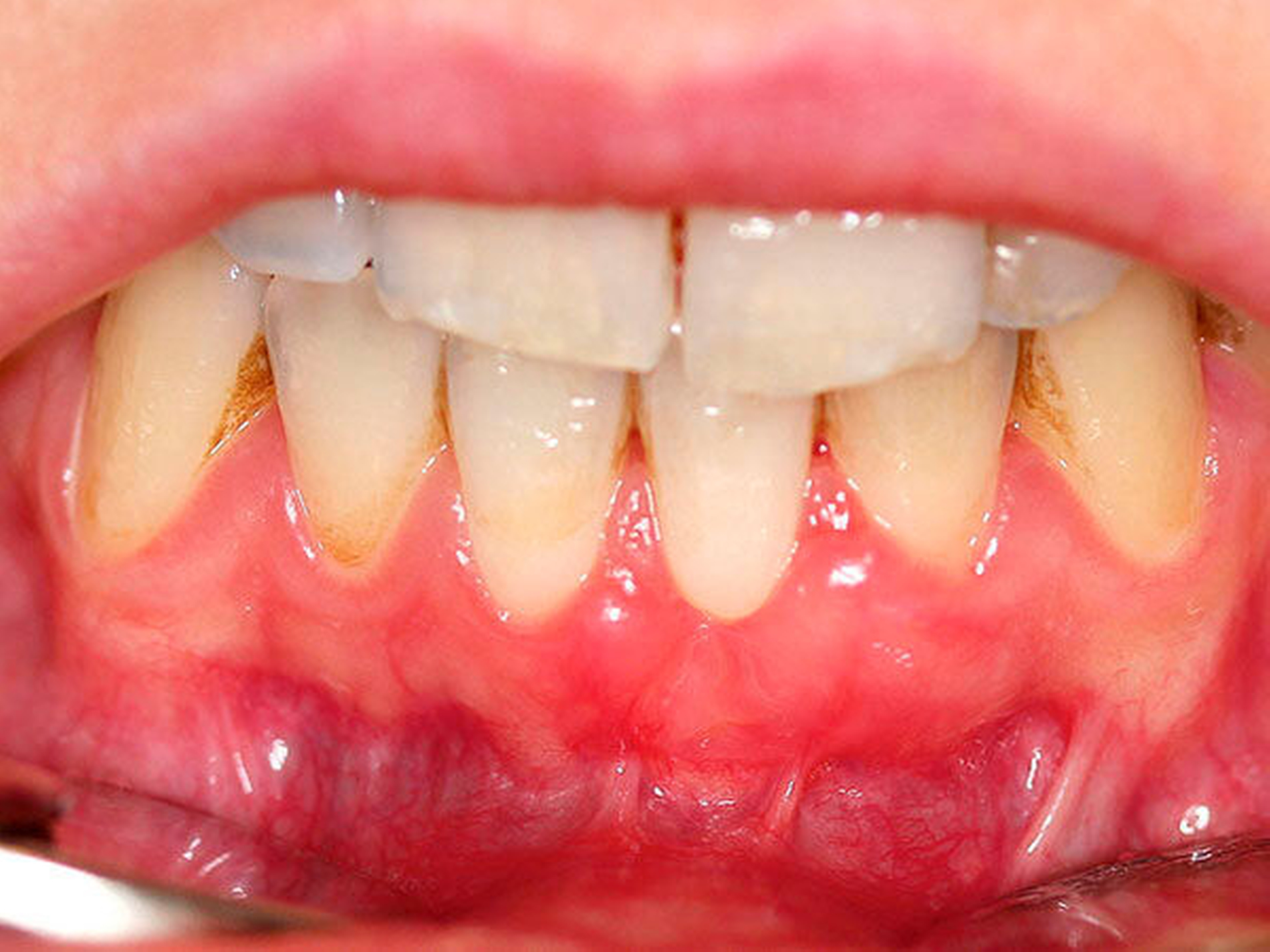
Durch den dentalen Biofilm (dentale Plaque) verursachte parodontale Erkrankungen zeichnen sich durch entzündliche Veränderungen der Gingiva sowie des gesamten Zahnhalteapparats aus. In der ersten, reversiblen Phase kommt es durch den an den Zähnen und am Zahnfleischsaum anhaftenden mikrobiellen Biofilm zu einer Entzündung der Gingiva, die sich klinisch durch Rötung, Schwellung sowie eine erhöhte Blutungsneigung auszeichnet [Löe et al., 1965]. Die Gingivitis stellt eine chronische Entzündung dar, kann bei Nicht-Behandlung zu einer Parodontitis und daraus resultierend zu Zahnverlust führen [Chapple et al., 2015].
Nicht bei allen Patienten schreitet die Gingivitis zu einer Parodontitis fort, ihre Entwicklung ist anteilig durch genetische Prädisposition sowie signifikant von „Lifestyle“-Faktoren wie Rauchen, Typ-2-Diabetes, Ernährung und Stress bestimmt [Chapple et al., 2015], was als „unbalancierte“ Immunantwort zusammengefasst werden kann. Bei der Parodontitis handelt es sich um eine irreversible Entzündung des den Zahn umgebenden Zahnhalteapparats, bestehend aus Zement, parodontalem Ligament und Alveolarknochen, die im weiteren Verlauf zum Verlust des betroffenen Zahnes führen kann [Kinane & Attström, 2005].
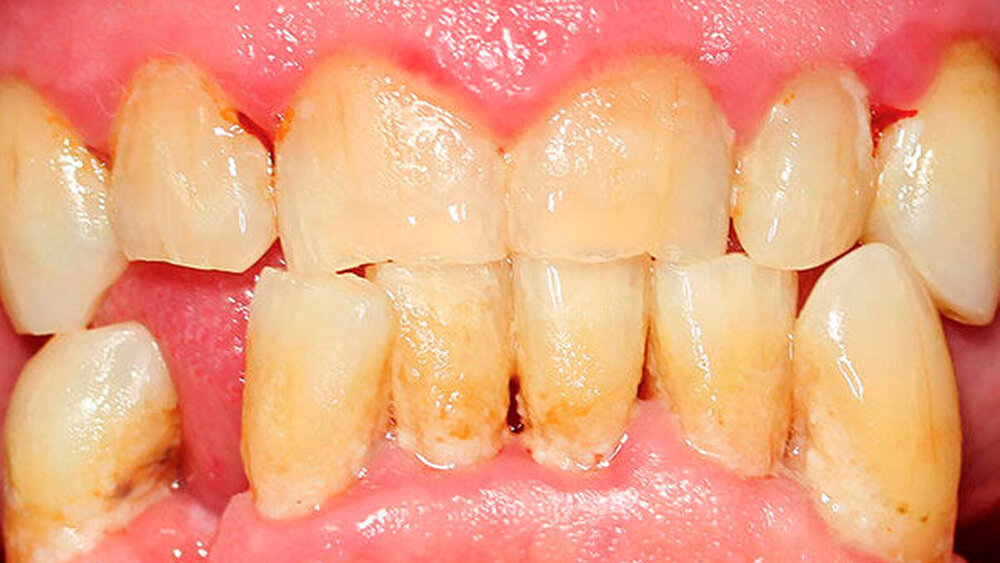
Der dentale Biofilm gilt somit als die Grundvoraussetzung beider Erkrankungen und die gingivale Entzündung (Gingivitis) als der Hauptrisikofaktor für die Parodontitis [Chapple et al., 2015]. Eine mangelhafte Mundhygiene hat einen hohen Einfluss auf die Etablierung der Gingivitis wie auch der Parodontitis [Abdellatif & Burt, 1987] (Abbildung 1).
Sowohl die wissenschaftliche als auch die klinische Evidenz sprechen für die Notwendigkeit einer ausreichenden Mundhygiene zur Vermeidung von parodontalen Erkrankungen und Zahnhartsubstanzdefekten. Dennoch weisen entzündliche parodontale Erkrankungen eine hohe Prävalenz auf [Jordan & Micheelis, 2016]. In Deutschland liegt der Anteil der Menschen mit moderater und schwerer Parodontitis in der Altersgruppe der jüngeren Erwachsenen (35- bis 44-Jährige) bei circa 52 Prozent und in der Altersgruppe der Senioren (65- bis 74-Jährige) bei circa 65 Prozent. Die Autoren der DMS V resümieren, dass die Zahl der Parodontalerkrankten rückläufig ist (Vergleich DMS IV zu DMS V), in Zukunft aber aufgrund der demografischen Entwicklung und der Verlagerung chronischer Munderkrankungen in ein höheres Lebensalter mit einem steigenden Behandlungsbedarf zu rechnen ist [Jordan & Micheelis, 2016].
Zur Vermeidung und/oder zur Therapie beider Krankheitsbilder ist somit die Etablierung einer adäquaten Mundhygiene zwingend notwendig [Axelsson et al., 2004; van der Weijden & Slot, 2011]. Die wichtigste Prophylaxestrategie ist die regelmäßige und möglichst vollständige Entfernung des dentalen Biofilms. Somit ist eine erfolgreiche Behandlung parodontaler Erkrankungen unabhängig von der Immunlage nur im Zusammenhang mit einem weitgehend plaquefrei gehaltenen Gebiss möglich und setzt eine sehr gute Mundhygiene des Patienten voraus [Lindhe & Nyman, 1975].
Dem mechanischen Management des mikrobiellen Biofilms durch die Zahnbürste und interdentale Hilfsmittel kommt hierbei die Hauptrolle der Mundhygiene zu [Berchier et al., 2008; DG-PARO-Leitlinie „Häusliches mechanisches Biofilmmanagement in der Prävention parodontaler Erkrankungen“, 2018]. Allerdings kann aus den epidemiologischen Daten abgelesen werden, dass mit mechanischen Mundhygienemaßnahmen häufig nicht das Niveau erreicht wird, das notwendig ist, um die parodontalen Erkrankungen zu vermeiden und/oder zu therapieren [van der Weijden & Slot, 2011; Marsh, 1992; Arweiler et al., 2018; van der Weijden et al., 2015; Serrano et al., 2015].
Das vornehmliche Ziel des chemischen Biofilmmanagements ist die zusätzliche Anwendung antimikrobieller Wirkstoffe zur Hemmung oder Vorbeugung der dentalen Biofilmbildung – und damit die Prophylaxe oder Bekämpfung der Entzündung der Gingiva. Der Einsatz von chemischen Hilfsmitteln kann beispielsweise in Form von antibakteriellen Mundspüllösungen als Ergänzung zum mechanischen Biofilmmanagement oder auch in bestimmten Fällen als Ersatz für die Hemmung der Plaqueneubildung erfolgen. Definiert werden solche chemischen Plaquehemmer oder Anti-Plaque-Wirkstoffe als Agenzien zur lokalen Anwendung von Wirkstoffen mit dem Ziel der Plaquehemmung und damit der Prophylaxe von Karies und Gingivitis.
Die effektivsten Wirkstoffe zum chemischen Biofilmmanagement sind Wirkstoffe, deren Aktivität in erster Linie gegen die bakterielle Plaque, aber indirekt auch gegen gingivale Entzündungen und Zahnsteinbildung gerichtet ist [Heasman & Seymour, 1994]. Die Effektivität solcher Zusätze wird maßgeblich von dem antibakteriellen Potenzial und der Verweildauer des Wirkstoffs im Mund bestimmt [Goodson, 1989]. Im Rahmen der Applikation ist der direkte Kontakt des Wirkstoffs in Mundspüllösungen am Wirkungsort auf die kurze Zeit der Spülung im Mund beschränkt [Guggenheim, 1990]. Anschließend bewirkt der Speichelfluss einen schnellen Abtransport der Wirkstoffe. Eine hohe Substantivität, das heißt, eine verlängerte aktive Wirkung einer chemischen Substanz über die Spülzeit hinaus, verbessert die Effektivität eines Wirkstoffs in der Mundhöhle und stellt neben der direkten Abtötung der Mikroorganismen die wichtigste Einflussgröße für die unterschiedliche Wirksamkeit der einzelnen Wirkstoffe dar. Manche Wirkstoffe besitzen – zumeist durch ihre Ladung und gute Anlagerung an orale Strukturen – eine eigene Substantivität oder sie werden in ihrer Wirkung durch Zusatzstoffe oder Wirkstoffkombinationen erhöht.
Die Kombination aus klinischer Wirksamkeit und Substantivität in der Mundhöhle ergibt dann Agenzien beziehungsweise Produkte, die nicht nur in vitro einen Effekt haben, sondern dem Management von Plaque und Gingivitis dienen. Neben der Gingivitis-reduzierenden und Plaque-hemmenden Wirkung ist für den Verbraucher zusätzlich ein frischer, guter Geschmack der Mundspüllösung von Bedeutung. Aus medizinischer Sicht sollten nur solche Wirkstoffe angewandt werden, bei denen systemische Nebenwirkungen, Toxizität, Resistenzbildung und allergische Reaktionen ausgeschlossen sind.
Ziel der Leitlinie
Da der Gingivitis-Prävention und -Therapie damit sowohl für den Erhalt der parodontalen Gesundheit als auch des parodontalen Gewebes eine primäre und entscheidende Aufgabe zukommt [Addy & Moran, 1997], ist das Ziel der Leitlinie, den Anwendern eine Entscheidungshilfe zur Prävention und Therapie gingivaler Erkrankungen mittels Mundspüllösungen zu geben. Hierfür wurde die klinische Wirksamkeit der zusätzlichen Anwendung von Mundspüllösungen (chemische Biofilmkontrolle) im Vergleich zur reinen mechanischen Plaquekontrolle oder mechanischer Plaquekontrolle mit zusätzlicher Anwendung einer Placebo- oder Kontroll-Mundspüllösung bewertet.
Methodik
Diese Leitlinie entspricht den Richtlinien von PRISMA [2014] zur Erstellung systematischer Übersichtsarbeiten. Es wurde untersucht, welchen Effekt bei Patienten mit und ohne Gingivitis das chemische Biofilmmanagement durch eine Mundspüllösung in Kombination mit mechanischer Mundhygiene im Vergleich zur reinen mechanischen Mundhygiene oder zur Reinigung in Kombination mit einer Placebo-/Kontrollspüllösung während eines Beobachtungszeitraums von mindestens sechs Monaten in Bezug auf gingivale Parameter und Plaque-Parameter hat (PICO-Frage).
Die wichtigsten Empfehlungen
1. Was stellt die Basis zur Prophylaxe und Therapie parodontaler Erkrankungen dar?
Die Basis der Prophylaxe und Therapie parodontaler Erkrankungen ist die sorgfältige mechanische Mundhygiene, die neben dem Zähneputzen mit einer Form der Interdentalreinigung ergänzt werden muss (siehe Leitlinie „Häusliches mechanisches Biofilmmanagement“). Das primäre Ziel der zusätzlichen Anwendung einer antimikrobiellen Mundspüllösung ist, den Erfolg der mechanischen Mundhygiene zu verbessern, indem zum einen eine Plaquereduktion und damit eine Prophylaxe der Gingivitis erreicht wird und zum anderen die Ausheilung einer bestehenden Gingivitis (Gingivitisreduktion). Dabei sollten lokale Kofaktoren (zum Beispiel Zahnfehlstellungen), aber auch reduzierte motorische und mentale Fähigkeiten (zum Beispiel bei Patienten mit besonderem Unterstützungsbedarf und eingeschränkter Alltagskompetenz) berücksichtigt werden. Die Korrelation kann zwischen Plaque und Entzündung, das heißt, die Neigung, eine Gingivitis zu entwickeln, individuell sehr unterschiedlich sein.
2. Sollten zusätzlich zur mechanischen Mundhygiene Mundspüllösungen zur Prophylaxe der Gingivitis empfohlen werden?
Die zusätzliche Anwendung chemisch antimikrobieller Wirkstoffe in Mundspüllösungen als Ergänzung zur mechanischen Reinigung kann zu einer Reduktion des dentalen Biofilms und damit zur Prophylaxe der Gingivitis empfohlen werden. Die eingeschlossenen Metaanalysen konnten im Vergleich zur alleinigen mechanischen Reinigung einen zusätzlichen Effekt von antimikrobiellen Mundspüllösungen auf die Reduktion von Plaque zeigen. Hervorzuheben ist, dass diese sich ausschließlich auf Patienten mit Gingivitis bezogen. Da eine Plaquereduktion mit der Vorbeugung einer Gingivitis in direktem Zusammenhang steht, wurden diese Daten auf parodontal Gesunde übertragen. Bezüglich der Datenlage gab es lediglich eine indirekte Evidenz und der Evidenzgrad wurde abgestuft.
Beim Vergleich der verschiedenen Wirkstoffe stellten sich die Effekte jedoch in unterschiedlicher Größe dar. Die größten Effekte konnten durch Mundspüllösungen, die ätherische Öle oder Chlorhexidin enthielten, erzielt werden, wobei nicht zwischen spezifischen Formulierungen/Produkten und Konzentrationen unterschieden wurde. [Haas et al., 2016; Haps et al., 2008; James et al., 2017; Serrano et al., 2015; Van Leeuwen et al., 2014]
3. Sollten zusätzlich zur mechanischen Mundhygiene Mundspüllösungen zur Therapie der Gingivitis empfohlen werden?
Die antimikrobiellen Mundspüllösungen mit den Wirkstoffen Aminfluorid/Zinnfluorid, Ätherische Öle, Cetylpyridiniumchlorid, Chlorhexidin sowie Triclosan/Copolymer zeigten in den eingeschlossenen Metaanalysen einen statistisch signifikanten Effekt im Vergleich zur alleinigen mechanischen Reinigung auf die Reduktion von Gingivitis. Beim Vergleich der verschiedenen Wirkstoffe stellten sich die Effekte jedoch in unterschiedlicher Größe dar.
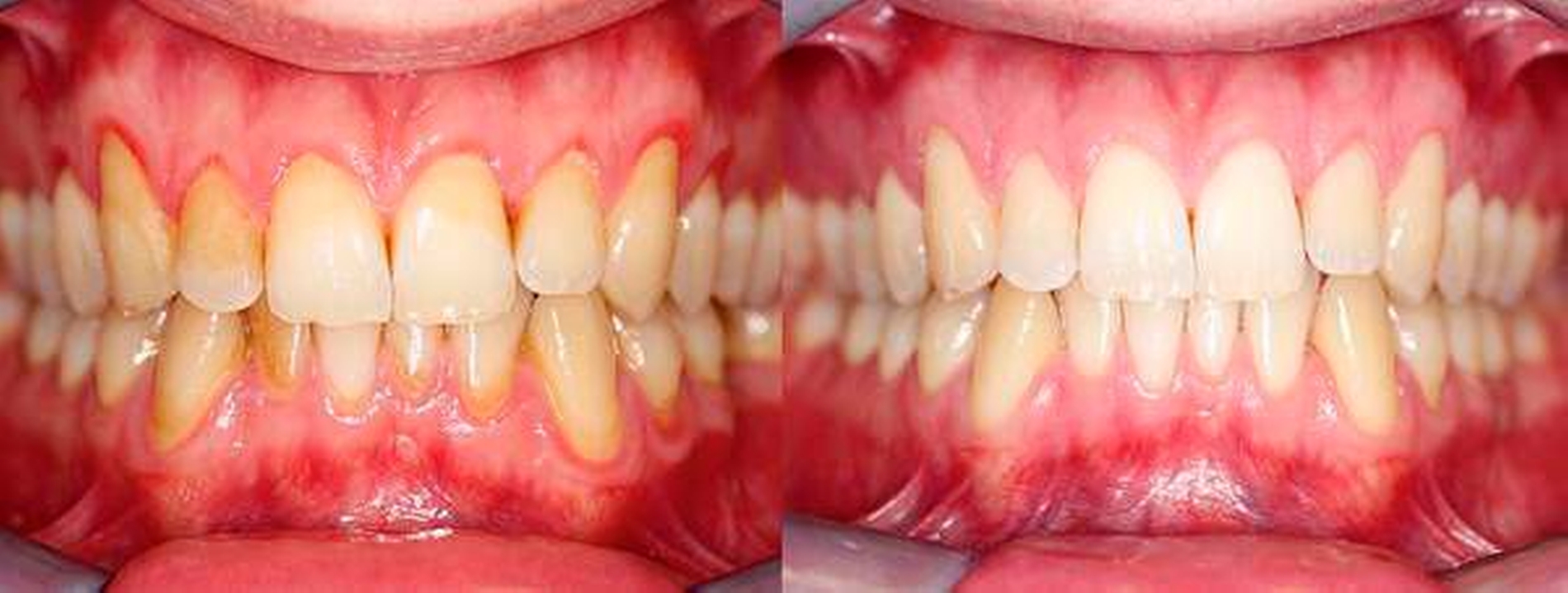
Ein hoher Evidenzgrad und die größten Effekte konnten durch Mundspüllösungen, die ätherische Öle, Chlorhexidin oder Triclosan/Copolymer enthielten, erzielt werden. Die zusätzliche Anwendung dieser antimikrobiellen Wirkstoffe soll als Ergänzung zur mechanischen Reinigung zu einer Reduktion der Gingivitis empfohlen werden (Abbildung 2), wobei nicht zwischen spezifischen Formulierungen/Produkten und Konzentrationen unterschieden wurde und somit eine Aussage hierzu auf Basis der die Einschlusskriterien erfüllenden Studien nicht möglich ist.
Die zusätzliche Anwendung der chemisch antimikrobiellen Wirkstoffe „Aminfluorid/Zinnfluorid“ und „Cetylpyridiniumchlorid“ kann als Ergänzung zur mechanischen Reinigung zu einer Reduktion der Gingivitis ebenfalls empfohlen werden, hier zeigte sich ein moderater Evidenzgrad. Auch hier ist eine Aussage zu spezifischen Formulierungen beziehungsweise Konzentrationen auf Basis der die Einschlusskriterien erfüllenden Studien nicht möglich [Haas et al., 2016; Haps et al., 2008; James et al., 2017; Serrano et al., 2015; Van Leeuwen et al., 2014].
4. Wie sollten Mundspüllösungen im Alltag Anwendung finden?
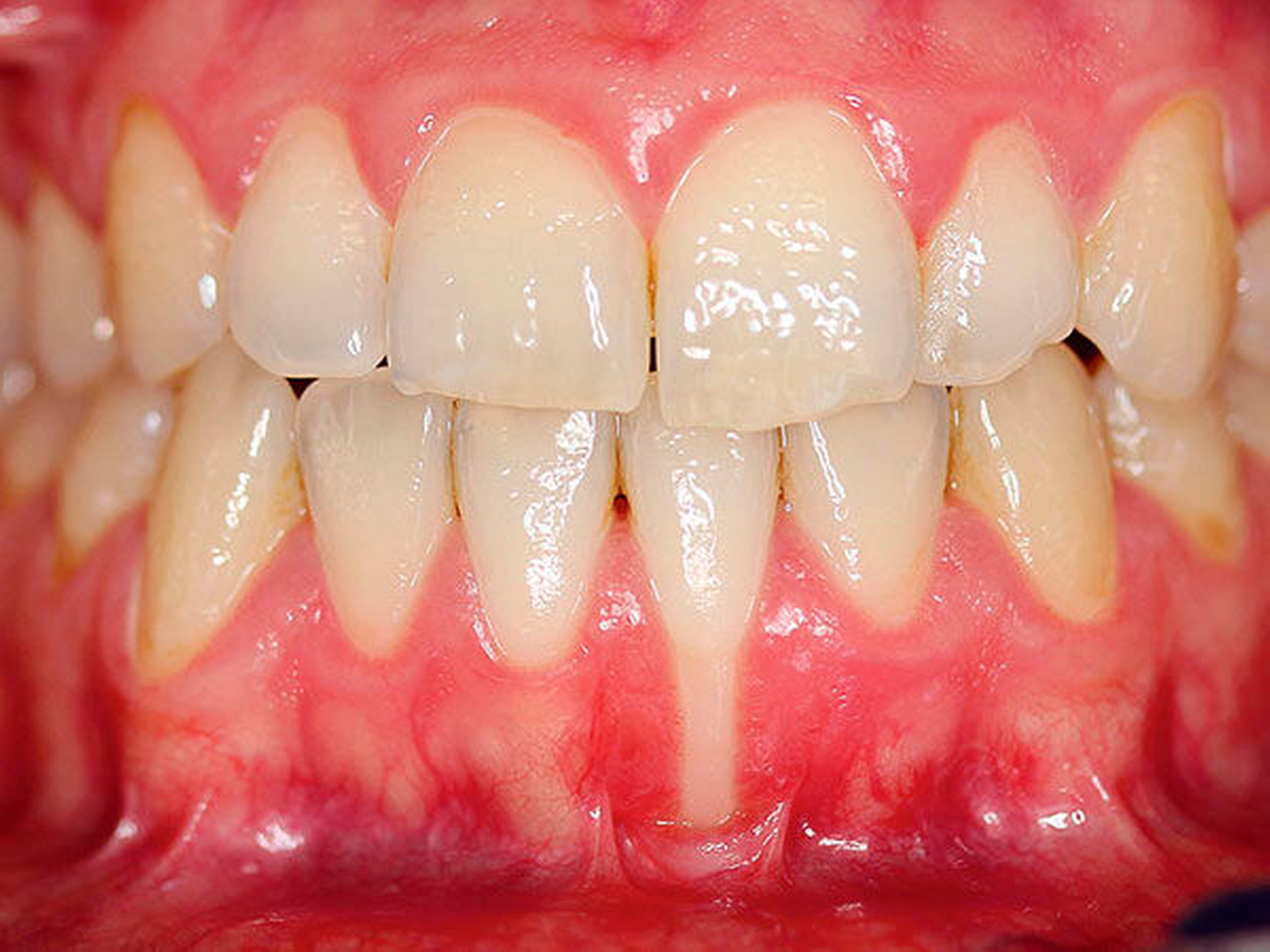
In Situationen, bei denen kurzfristig (etwa zwei bis vier Wochen) eine hohe Keimzahlreduktion als alleinige Maßnahme notwendig ist, wenn ein mechanisches Biofilmmanagement nicht möglich oder indiziert ist, sollten antimikrobielle Mundspüllösungen angewendet werden. Hier sollte auf chlorhexidinhaltige Spüllösungen ≥ 0,1 Prozent zurückgegriffen werden (Abbildung 3) [Arweiler et al., 2018; Haas et al., 2016; Haps et al., 2008; James et al., 2017; Serrano et al., 2015; Van Leeuwen et al., 2014].
Abgesehen von der kurzfristigen Situation kann bei folgenden Risikogruppen die Anwendung antimikrobieller Mundspüllösungen als Ergänzung ihrer täglichen mechanischen Mundhygiene-Maßnahmen zur Prävention der Gingivitis erfolgen:
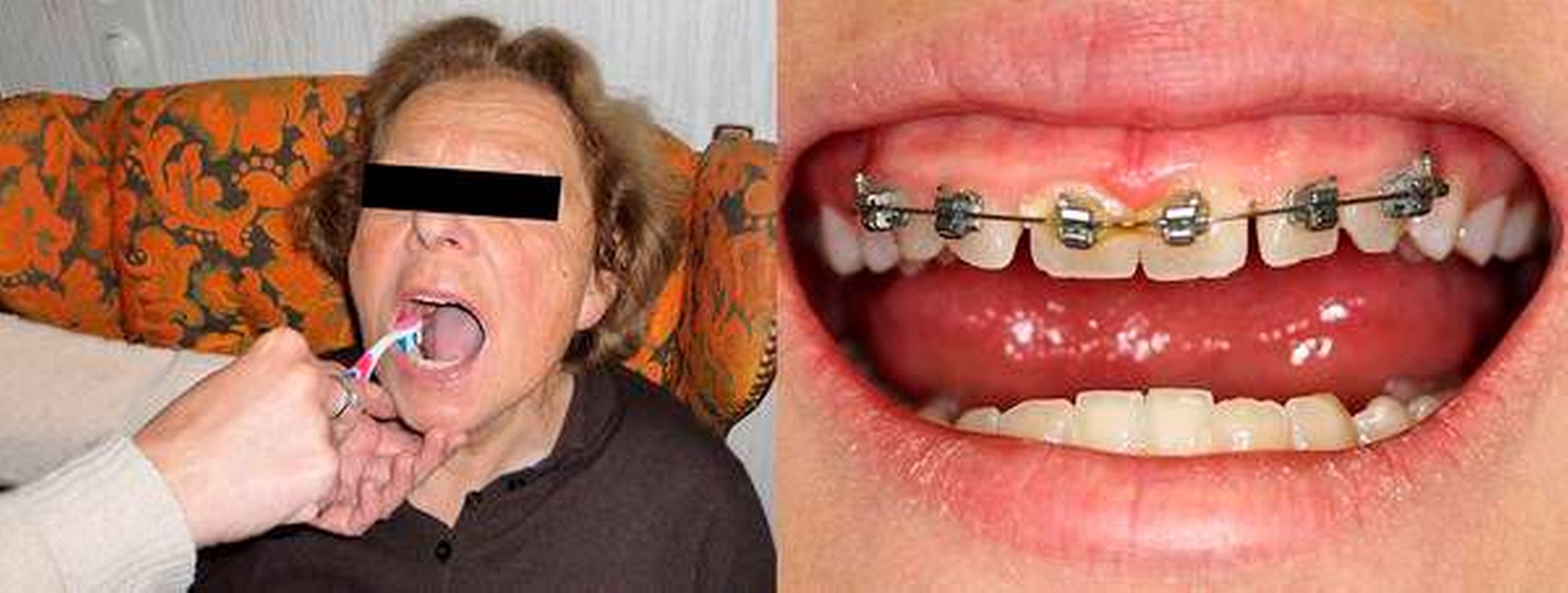
Patienten mit besonderem Unterstützungsbedarf und eingeschränkter Alltagskompetenz (zum Beispiel Pflegebedürftige) (Abbildung 4a)
Patienten mit körperlichen oder mit geistigen Einschränkungen, die kein effektives mechanisches Biofilmmanagement erreichen können
unter besonderer Medikation stehende Patienten (zum Beispiel bei/nach Chemotherapie und/oder Bestrahlung)
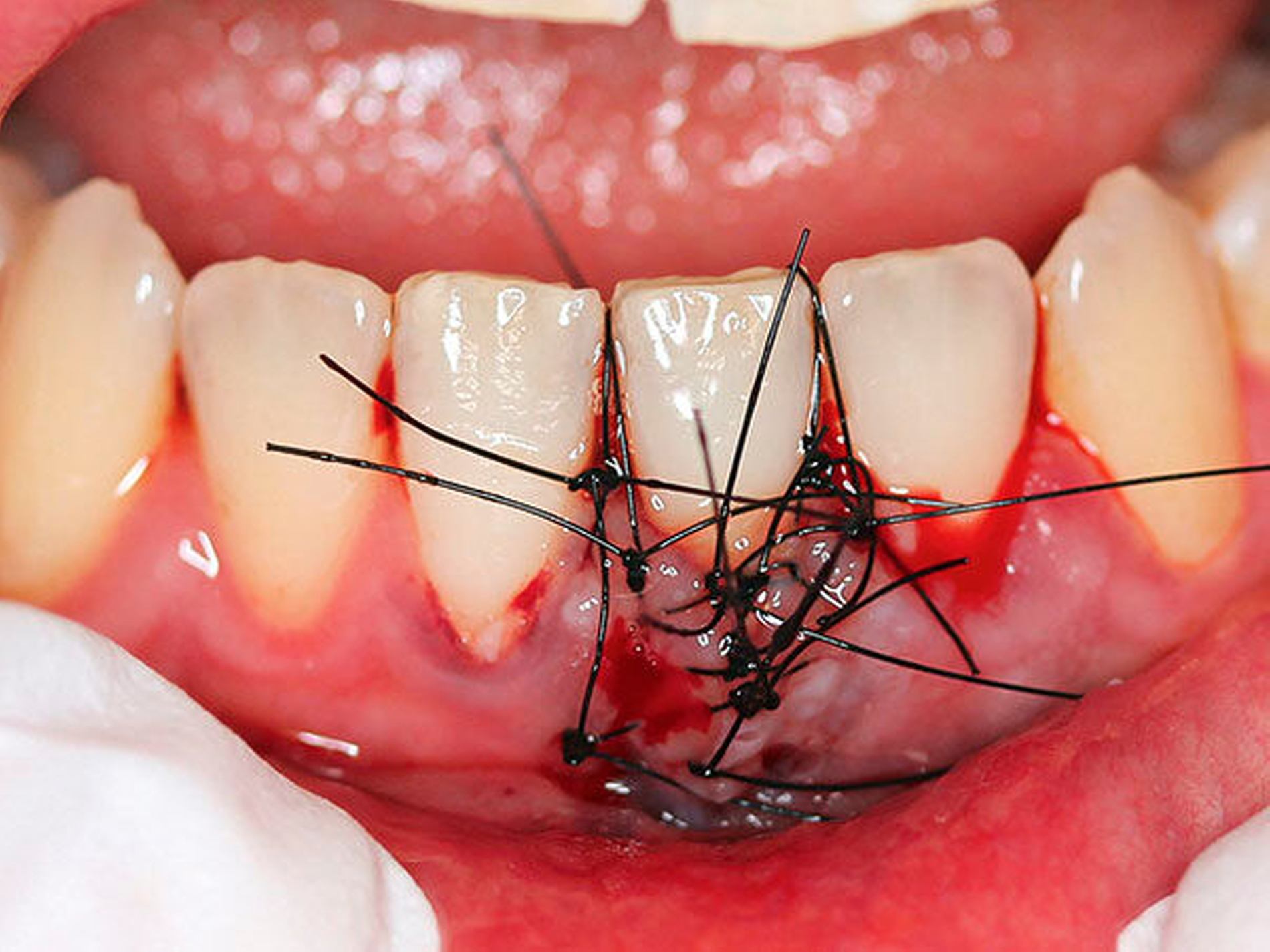
Patienten mit mechanisch so schwer zugänglichen Bereichen, dass kein effektives mechanisches Biofilmmanagement möglich ist (Abbildung 4b).
Hier können Formulierungen mit Aminfluorid/Zinnfluorid, ätherischen Ölen, Cetylpyridiniumchlorid, Chlorhexidin < 0,1 Prozent empfohlen werden. Je nach individueller Situation kann eine lokale Applikation der Mundspüllösung (zum Beispiel mit Interdentalbürste) in Erwägung gezogen werden [Storhaug, 1977; Arweiler et al., 2018].
Fazit
Die Leitlinie verdeutlicht, dass in bestimmten Situationen der Einsatz von häuslichem chemischem Biofilmmanagement zur Prävention und Therapie der Gingivitis sinnvoll und indiziert ist. Nebenwirkungen bei der Anwendung, Kontraindikationen, Kosten sowie Zulassungsbestimmungen und Umweltfaktoren sollen bei der Wahl des Wirkstoffs und des Produkts berücksichtigt werden.
Prof. Dr. Thorsten Auschill, MBA
Universitätsklinikum Gießen und Marburg GmbH,
Standort Marburg, Zentrum für Zahn-, Mund- und Kieferheilkunde,
Abteilung für Parodontologie
Georg-Voigt-Str. 3, 35039 Marburg
auschill@med.uni-marburg.de
Dr. Sonja Sälzer
Klinik für Zahnerhaltungskunde und Parodontologie am Universitätsklinikum Schleswig-Holstein
Arnold-Heller-Str. 3, 24105 Kiel
Prof. Dr. med. dent. Nicole B. Arweiler
Universitätsklinikum Gießen und Marburg GmbH,
Standort Marburg, Zentrum für Zahn-, Mund- und Kieferheilkunde,
Abteilung für Parodontologie
Georg-Voigt-Str. 3, 35039 Marburg
Literaturliste
Löe H, Theilade E, Jensen SB. Experimental Gingivitis in Man. J Periodontol 1965; 36:177-187.
Chapple IL, Van der Weijden F, Dörfer C, Herrera D, Shapira L, Polak D, Madianos P, Louropoulou A, Machtei E, Donos N, Greenwell H, Van Winkelhoff AJ, Eren Kuru B, Arweiler N, Teughels W, Aimetti M, Molina A, Montero E, Graziani F. Primary prevention of periodontitis: managing gingivitis. J Clin Periodontol. 2015; 42 Suppl 16:S71-76.
Kinane DF, Attström R. Advances in the pathogenesis of Periodontology. Group B concensus report of the fifth European Workshop in Periodontology. J Clin Periodontol. 2005;32(Suppl 6):130-131.
Abdellatif HM, Burt BA. An epidemiological investigation into the relative importance of age and oral hygiene status as determinants of periodontitis. J Dent Res 1987;66:13-18.
Jordan AR, Micheelis W (Hrsg) Fünfte Deutsche Mundgesundheitsstudie (DMS V). Deutscher Ärzteverlag (DÄV), Köln 2016.
Axelsson P, Nyström B, Lindhe J. The long-term effect of a plaque control program on tooth mortality, caries and periodontal disease in adults. Results after 30 years of maintenance. J Clin Periodontol 2004;31:749-757.
van der Weijden FA, Slot DE. Oral hygiene in the prevention of periodontal diseases: the evidence. Periodontol 2000. 2011; 55:104-123.
Lindhe J, Nyman S. The effect of plaque control and surgical pocket elimination on the establishment and maintenance of periodontal health. A longitudinal study of periodontal therapy in cases of advanced disease. J Clin Periodontol 1975;2:67-79.
Berchier CE, Slot DE, Haps S, Van der Weijden GA. The efficacy of dental floss in addition to a toothbrush on plaque and parameters of gingival inflammation: a systematic review. Int J Dent Hyg. 2008 Nov; 6:265-279.
Leitlinie 1
Marsh PD. Microbiological aspects of the chemical control of plaque and gingivitis. JDent Res 1992;71:1431–1438.
Slot DE, Wiggelinkhuizen L, Rosema NA, van der Weijden GA. The efficacy of manual toothbrushes following a brushing exercise: a systematic review. International Journal of Dental Hygiene 2012;10(3):187–197.
van der Weijden, F. A. & Slot, D. E. Efficacy of homecare regimens for mechanical plaque removal in managing gingivitis a meta review. J Clin Periodontol 2015;42 Suppl 16, S77-91
Serrano J, Escribano M, Roldán S, Martín C, Herrera D. Efficacy of adjunctive anti-plaque chemical agents in managing gingivitis: a systematic review and meta-analysis. Journal of Clinical Periodontology 2015;42 Suppl 16:S106–138.
Heasman PA, Seymour RA. Pharmacological control of periodontal disease. I. Antiplaque agents. J Dent. 1994;22:323-335.
Goodson JM. Pharmacokinetic principles controlling efficacy of oral therapy. J Dent Res 1989;68:1625–1632.
Guggenheim B. Ist eine chemische Plaquekontrolle überhaupt wünschenswert? Z Stomatol 1990;87:25-38.
Addy M, Moran JM: Evaluation of oral hygiene products: science is true; don't be misled by the facts. Periodontol 2000 1997;15:40-51.
PRISMA-Statement. Available at: www.prisma-statement.org. Access date: Oct 2017.
Haas AN, Wagner TP, Muniz FW, Fiorini T, Cavagni J, Celeste RK. Essential oils-containing mouthwashes for gingivitis and plaque: Meta-analyses and meta-regression. J Dent 2016;55:7-15.
Haps S, Slot DE, Berchier CE, Van der Weijden GA. The effect of cetylpyridinium chloride-containing mouth rinses as adjuncts to toothbrushing on plaque and parameters of gingival inflammation: a systematic review. Int J Dent Hyg 2008;6:290-303.
James P, Worthington HV, Parnell C, Harding M, Lamon T, Cheung A Whelton H, Riley P. Chlorhexidine mouthrinse as an adjunctive treatment for gingival health (Review). Cochrane Database of Systematic Reviews 2017, Issue 3. CD008676.
Van Leeuwen MP, Slot DE, Van der Weijden GA. The effect of an essential-oils mouthrinse as compared to a vehicle solution on plaque and gingival inflammation: a systematic review and meta-analysis. Int J Dent Hyg 2014;12:160-167.
Arweiler NB, Auschill TM, Sculean A. Patient self-care of periodontal pocket infections. Periodontol 2000 2018;76:164-179.
Storhaug K. Hibitane in oral disease in handicapped patients. J Clin Periodontol 1977;4(5):102-107.