Probiotika und Mundgesundheit
Im Jahr 2015 zeigte der weltweite Markt um probiotische Produkte ein Volumen von 35 Milliarden US-Dollar und ein bemerkenswertes globales Wachstum von etwa 7 Prozent. [Global Industry Analysis Report, 2012]. In Deutschland konsumierten im Jahr 2018 Umfragen zufolge 3,21 Millionen Verbraucher im Alter von über 14 Jahren täglich oder mehrmals pro Woche probiotische Milchprodukte wie beispielsweise Joghurt, Trinkjoghurt oder Quark [Statista report, 2018]. Damit haben Probiotika mittlerweile eine erhebliche Bedeutung erlangt und es steht die Frage im Raum, in welcher Weise dieser Wandel in den Ernährungsgewohnheiten die oralen Verhältnisse beeinflusst.
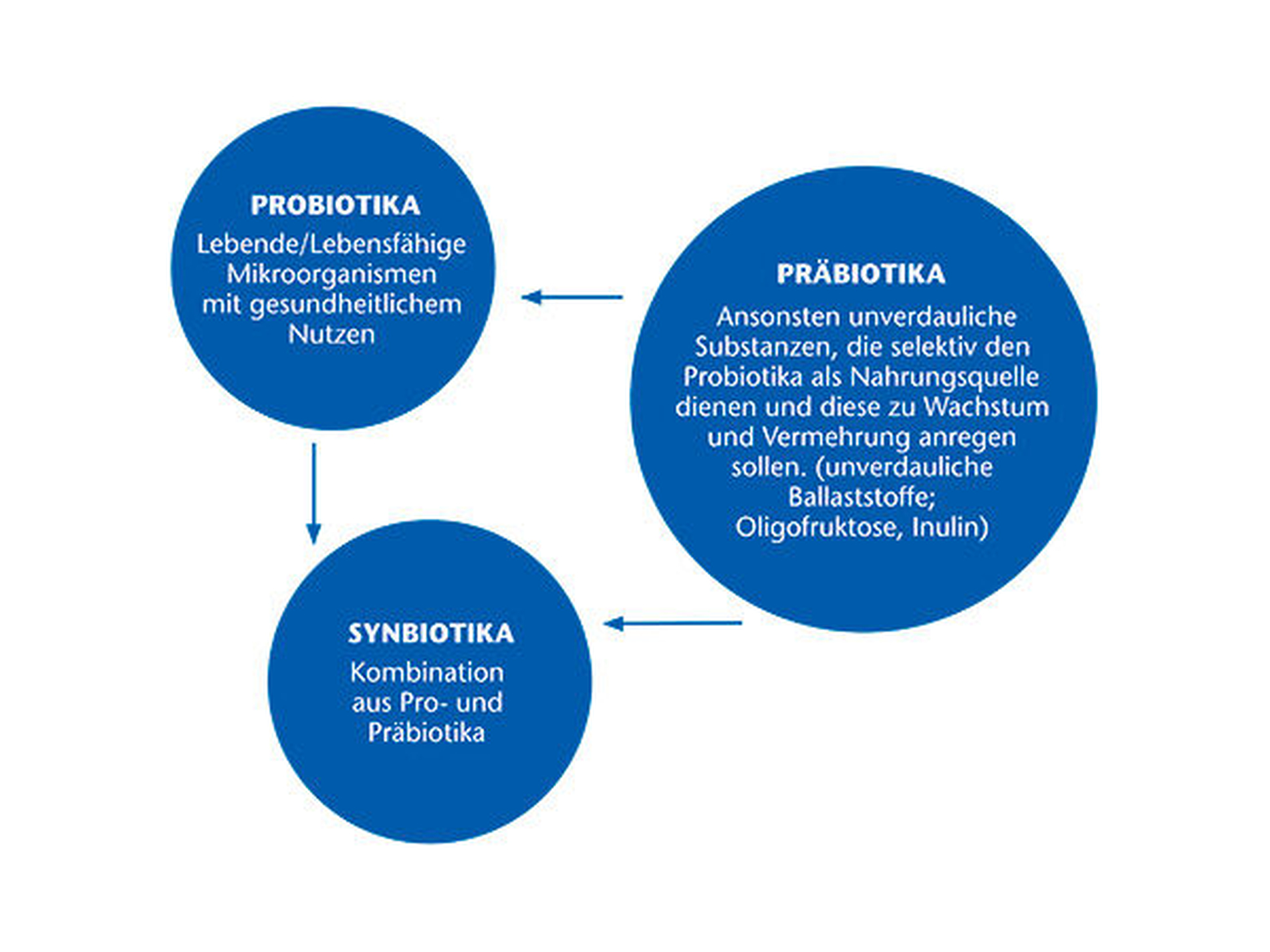
Was sind „Probiotika“?
Der Immunologe und Nobelpreisträger Ilja Iljitsch Metschnikow (1845–1916) gilt als Urvater der Anwendung von Probiotika zur Verbesserung der Gesundheit und zur Verlängerung des Lebens. Er stellte die Hypothese auf, dass der vermehrte Verzehr von mit Milchsäure-produzierenden Bakterien angereicherten Nahrungsmitteln („Probiotika“) den – für ihn nicht notwendigen – Alterungsprozess durch Hemmung von Entzündungsvorgängen herauszögern könnte. Er stützte sich dabei auf die Beobachtung einer überdurchschnittlich hohen Lebenserwartung bei bulgarischen Bergbauern, die sich zu einem großen Anteil von fermentierten Milchprodukten ernährten.
Sehr humorvoll beschreibt der Mikrobiologe G. W. Tannock die Wirkung von Probiotika: „They go in at one end of the digestive tract and come out the other, and hopefully something good happens along the way“ [Tannock, 2005]. Im Rahmen eines Joint Workshops der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO) und der Weltgesundheitsorganisation (WHO) [Food and Agricultural Organization of the United Nations and World Health Organization, 2002] definierten die beteiligten Institutionen Probiotika als „lebende bzw. lebensfähige Mikroorganismen, die für den Wirt einen gesundheitlichen Nutzen haben, wenn sie in ausreichender Menge verabreicht werden beziehungsweise in den Darm gelangen“. Die Bezeichnung „Probiotika“ („für das Leben“) ist eigentlich ein Kunstwort und sollte ursprünglich als Pendant zu den Antibiotika etabliert werden.
Darunter fällt eine große Bandbreite von Bakterien, insbesondere die am längsten als Probiotika angewendeten Milchsäure-produzierenden Bakterien wie Lactobacillus und Bifidobacterium spp., aber auch andere Bakterien wie zum Beispiel Enterococcus faecalis sowie Hefen (Hefepilze). Von den Probiotika abgegrenzt werden sogenannte Präbiotika und Synbiotika. Während Erstgenannten eine positive Wirkung – meist Wachstumsanregung – auf sich bereits im Darm befindliche Mikroorganismen zugesprochen wird, stellen Synbiotika eine Kombination aus beiden dar.
Der postulierte Wirkmechanismus von Probiotika setzt zunächst die Überwindung der Magenpassage einer noch teilungsfähigen Bakterienmenge voraus. Im Darm können diese durch quantitative Verdrängung und Produktion von antibakteriellen Stoffen (Bakteriozine) einer Fehlbesiedlung mit Darmkeimen entgegenwirken. Möglicherweise verdrängen sie aber gleichzeitig Teile der erwünschten Darmflora (Darmmikrobiom), wodurch das dort herrschende Gleichgewicht empfindlich gestört werden kann (siehe auch „Nebenwirkungen und Gefahren“).
Neben Milchprodukten können zahlreiche fermentierte Lebensmittel lebende probiotische Bakterien enthalten, sofern diese nicht durch Pasteurisation oder Erhitzung abgetötet worden sind. Dazu zählen zum Beispiel Sauerkraut oder Sauerkrautsaft sowie der sogenannte „Brottrunk“ und die „Miso“-Paste – eine japanische Paste aus Sojabohnen und anderen Getreidebestandteilen, bei der die Fermentierung durch einen Schimmelpilz erfolgt.
Probiotische Mikroorganismen werden jedoch nicht nur in Lebensmitteln eingesetzt, sondern darüber hinaus in Arzneimitteln, Nahrungsergänzungsmitteln und Kosmetika. Für jeden dieser Verwendungszwecke existiert ein eigener rechtlicher Rahmen, wobei die Vorschriften für den Lebensmittelbereich als moderat gelten können. Hier regelt die sogenannte „Health Claims“-Verordnung der EU (Verordnung-Nr. 1924/2006) lediglich, dass nährwert- und gesundheitsbezogene Angaben „sich auf allgemein akzeptierte wissenschaftliche Erkenntnisse stützen und durch diese abgesichert sein“ müssen [EU, 2006].
Darreichungsformen
Derzeit eröffnet sich neben den klassischen Präparaten aus Supermarkt, Apotheke, Drogerie und Reformhaus, bei denen es sich vornehmlich um Nahrungsergänzungsmittel, diätetische Lebens- oder Arzneimittel handelt, ein riesiges Online-Angebot.
Probiotika finden sich klassischerweise in zahlreichen, speziell mit Milchsäure-produzierenden Bakterien angereicherten (Trink-)Joghurts, Quarkspeisen, Käse, neuerdings auch in Wurst oder Speiseeis. Sie stellen eine sehr heterogene Gruppe von Bakterien dar, die normalerweise ein Prozent oder weniger der Stuhlflora des erwachsenen Menschen ausmachen. Probiotika sind aber auch in Form von Pulver, Suspensionen oder als Lutschtabletten kommerziell erhältlich. Zunehmend weitet sich der Trend auf Körperpflege- und Mundhygieneprodukte aus.
Probiotika – zwischen Anspruch und Realität
Seit der ersten Vorstellung durch Metschnikow (1910) sind Probiotika bezüglich ihrer Allergie-präventiven Eigenschaften, ihrer positiven Wirkung bei der Prävention und Therapie gastrointestinaler Krankheiten sowie ihrer positiven Beeinflussung der Immunabwehr mittlerweile intensiv erforscht. Aktuelle Metaanalysen konnten aber bislang noch kein einheitliches Urteil über eine signifikante Effektivität von Probiotika fällen [Vuotto et al., 2014; Fleming et al., 2015; Sinclair et al., 2016; Forsberg et al., 2016]. Hauptgrund dafür ist die Heterogenität der Produkte bezogen auf die Dosis, das Vehikel und insbesondere die Auswahl des Keimes. Vuotto et al. resümieren, dass keines der Probiotika-Produkte einem anderen gleicht und auch innerhalb der gleichen Spezies verschiedene Bakterien-Stämme unterschiedliche Effekte haben können [Vuotto et al., 2014].
Über die Massenmedien werden Produkte an den Endverbraucher herangetragen, die – auch wenn nicht direkt mit Werbeaussagen verknüpft – doch Gesundheit und Wohlbefinden suggerieren. Des Weiteren werden sie in Zusammenhang mit der Behandlung diverser Allergien (zum Beispiel Neurodermitis, Asthma, Heuschnupfen), mit der Prävention und Behandlung von Depressionen, Lebererkrankungen, Morbus Crohn, Reizdarm-Symptomen und Krebserkrankungen gebracht. Darüber hinaus sollen Probiotika zur Hautgesundheit beitragen und Anti-Aging-Effekte haben. Im Zuge des veganen Ernährungstrends sowie vermehrten Laktoseintoleranzen sind Milchprodukte in den vergangenen Jahren unpopulärer geworden, was tendenziell andere Darreichungsformen fördert.
Therapiealternative in der Zahnmedizin?
Trotz zurückgehender Prävalenzen in Deutschland gehören die dentalen Erkrankungen Karies, Gingivitis und Parodontitis weltweit immer noch zu den am weitesten verbreiteten Infektionserkrankungen [Selwitz et al., 2007; Dye et al., 2012; Jordan & Micheelis, 2016] und können durchaus als „Volkskrankheiten“ bezeichnet werden. Während bei diesen Erkrankungen meist der Zahnverlust im Vordergrund steht, muss bedacht werden, dass es sich insbesondere bei der Parodontitis um eine chronische Erkrankung handelt, die eine andauernde Herausforderung für das Immunsystem und die Allgemeingesundheit darstellt [Pihlstrom et al., 2005]. Klassische antibakterielle Strategien mit entsprechenden antibakteriellen Wirkstoffen, lokalen Antiseptika oder lokalen und systemischen Antibiotika konnten ihre präventiven und therapeutischen Effekte zeigen [Zandbergen et al., 2013; Chapple et al., 2015; Arweiler et al., 2018; Auschill et al., 2018]. Das trifft für Probiotika-Produkte bislang nicht zu.
Dennoch sind Probiotika als Alternative für die Prävention und Therapie in der Zahnmedizin durchaus vorstellbar, denn die Mundhöhle beherbergt wie der Darm ein komplexes Mikrobiom, das prinzipiell durch die Zufuhr von Mikroorganismen beeinflussbar erscheint. Deshalb ist es nicht verwunderlich, wenn Probiotika in den vergangenen Jahren verstärkt in die Zahnmedizin drängten. Aber auch hier müssen Probiotika erst einmal wissenschaftlichen Studien unterzogen werden, damit evidenzbasierte Aussagen getroffen werden können.
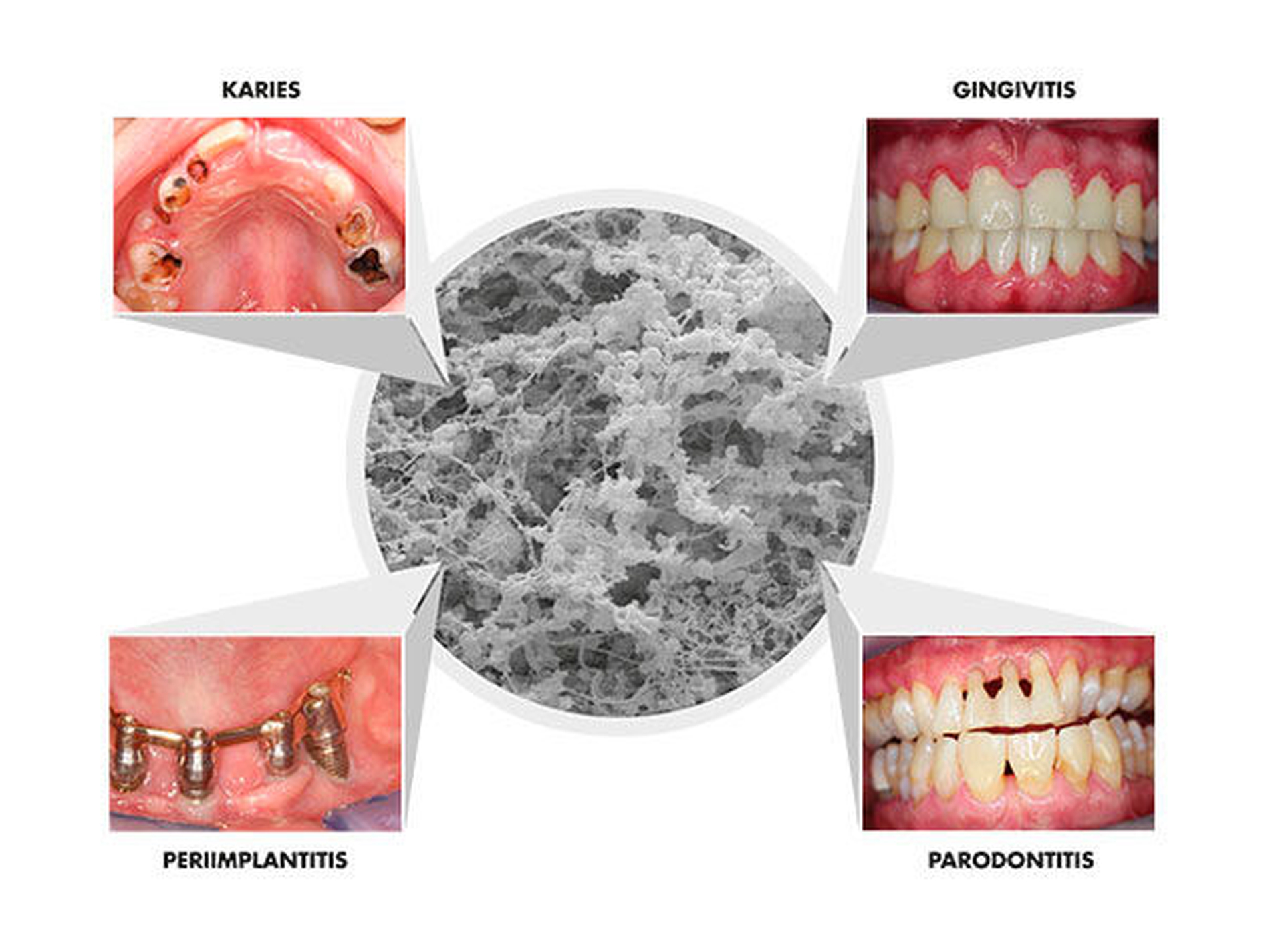
Probiotika zur Prophylaxe oder als parodontale Begleittherapie
Mit der wachsenden Zahl an Studien wird allerdings ein zunehmend inhomogenes Bild von der Wirksamkeit der Probiotika gezeichnet. Man sollte daher immer zunächst unterscheiden, ob die Prävention von Karies, die Prävention und/oder Therapie der Gingivitis oder aber der Therapieausgang einer Parodontitis untersucht wurde. Mittlerweile gibt es verschiedene Übersichtsarbeiten, die die klinischen Effekte von Probiotika in der Kariesprävention sowie in der Prävention und Therapie von Gingivitis- und Parodontitis untersuchten [Teughels et al., 2008; Teughels et al., 2011; Laleman et al., 2014; Gruner et al., 2016]. Einige Reviews resümieren positive und signifikante Wirkungen durch Probiotika. Teughels et al. bezogen in ihren Review drei Tier- und elf In-vivo-Humanstudien ein und schlussfolgerten, dass die Daten einen Effekt der Probiotika auf die orale Mikroflora zeigen, dieser Effekt auf parodontologische Parameter aber sehr begrenzt sei. Sie betonen auch, dass es noch zu früh sei, um aus einigen wenigen statistisch signifikanten Ergebnissen auf eine klinische Signifikanz zu schließen [Teughels et al., 2011].
In der Folge kommen die Autoren zu drei weiteren interessanten Statements:
-Die (häufig) begrenzten klinischen Resultate könnten der Nutzung von Nahrungs-Laktobazillen als Probiotika der Wahl zugeschrieben werden. Im Gegensatz dazu bieten bereits im menschlichen Darm vorhandene Bakterien den Vorteil, dass sie sich der humanen Ökologie angepasst haben. Die äußere Zufuhr von bereits in der Mundhöhle vorhandenen Bakterien sollte daher noch weiter erforscht werden.
-Eine probiotische Therapie sollte nicht als eine Behandlung gesehen werden, die die orale Mikroflora permanent ändern könnte. Es gibt einige Hinweise, dass der probiotische Effekt nur solange anhält, wie die Probiotika appliziert werden. Sobald sie nicht mehr eingenommen werden, verschwindet der Effekt, und es ist unwahrscheinlich, dass sich eine Veränderung hin zu einem stabilen, nicht-pathogenen Mikrobiom ergibt. Eine antibiotische Vorbehandlung, um das körpereigene Bakterienlevel zu reduzieren und dabei mehr Nischen für die Kolonisation von probiotischen Bakterien zu ermöglichen, könnte eine gute Option sein, war aber in den meisten Studiendesigns nicht vorgesehen.
- Probiotika gelten als Nahrungsergänzungsmittel und sind daher nicht den gleichen Standards wie Medizinprodukte unterworfen. Daher könnten Konsumenten Produkte erhalten, die ineffektiv sind oder variierende Bakterienmengen enthalten.
Probiotika zur Prophylaxe von Karies und in der Gingivitis-Therapie
Im Gegensatz zum Statement von Teughels et al. konnten in zahlreichen Studien signifikante Änderungen vor allem in kariologischen Aspekten beziehungsweise Parametern aufgrund der Zufuhr von probiotischen Bakterien beobachtet werden. Die Untersuchungen wurden sowohl im Rahmen von Tierversuchen an Ratten [Michalek et al., 1981] bei Kindern [Näse et al., 2001; Stecksén-Blicks et al., 2009] oder auch in vitro, teilweise an menschlichen Isolaten, durchgeführt [Simark-Mattsson et al., 2007; Twetman et al. 2009; Comelli et al., 2002; Schwendicke et al., 2014a, 2014b, 2017].
Schwendicke et al. verweisen dabei auf eine limitierte Evidenz, da viele Studien Kurzzeit-Charakter oder eine beschränkte Wertigkeit bei analysierten Parametern für den Kariesprozess hätten, so beispielsweise eine Untersuchung von Bakterienzahlen anstelle der Karies-Induktion [Schwendicke et al., 2014a]. Des Weiteren weisen sie auf die prinzipielle Kariogenität von Laktobazillen hin. In ihrer Studie mit einem Biofilmmodell konnten sie vor allem unter Zuckerzufuhr durch Lactobacillus rhamnosus GG einen signifikanten Mineralverlust in Dentinkavitäten bei gleichzeitig fehlender Hemmung von Streptococcus mutans zeigen.
Lodi et al. untersuchten in einer kombinierten In-vitro-/In-situ-Studie den Einfluss von zwei probiotischen, fermentierten Milchprodukten (Batavito und Yakult) auf Biofilme, die orale Mikroflora (Speichel) sowie den Zahnschmelz [Lodi et al., 2015]. Dabei trugen zehn Probanden in einem Cross-over-Design für 14 Tage palatinale Schienen, auf deren Schmelzplättchen achtmal täglich entweder eine 20-prozentige Zuckerlösung oder eines der probiotischen Milchprodukte appliziert wurde, wobei die Probanden die Schiene nach fünf Minuten Einwirkzeit wieder einsetzten. Im entsprechenden In-vivo-Experiment tranken die Probanden über 14 Tage einmal täglich 80 Gramm eines der Milchprodukte, wobei jeweils vor und nach der Einnahme Speichelproben zur mikrobiologischen Analyse genommen wurden. Es zeigte sich, dass die Gesamtbakterienzahl in den Biofilm-Proben nicht signifikant gegenüber der regelmäßigen Zuckerzufuhr reduziert war. Die beiden Milchprodukte zeigten keinerlei signifikante Wirkung auf die Anzahl von Gesamtstreptokokken, Mutans-Streptokokken sowie Laktobazillen und auch die EPS-Konzentration sowie die Menge an extrahierten Kohlehydraten war in allen Gruppen gleich. Lediglich bei der Speichelanalyse ergab sich für das Produkt Batavito eine signifikante Reduktion der Bakterienzahlen gegenüber dem Startwert, während Yakult die Speichelbakterienzahlen nicht reduzieren konnte.
Eine klinische Studie von Arweiler et al. untersuchte die Fähigkeit von probiotischen Bakterien, sich in orale Biofilme von Erwachsenen einzulagern sowie deren Einfluss auf die Zusammensetzung, die Dicke und die Vitalität des Biofilms [Arweiler et al., 2019]. Mittels eines etablierten Schienensystems wurden – zunächst ohne Zuführung probiotischer Bakterienstämme – Informationen über die individuellen, unbeeinflussten Biofilme der Probanden gesammelt. Anschließend nahmen die Probanden in drei parallelen Gruppen von je 13 Personen einen Monat lang täglich Actimel, Infectodiarrstop oder Symbioflor1 ein. Die Schienen wurden zu Beginn, nach 14 Tagen, nach der letzten Einnahme sowie 14 und 28 Tage nach der letzten Einnahme für 24 und 72 Stunden getragen. Primäres Prüfziel war die Detektion der jeweiligen probiotischen Bakterien (pB) und ihr prozentualer Anteil im Biofilm und im Speichel. Sowohl während als auch nach der Intervention konnten die pB nur in äußerst geringen Mengen im Biofilm und in leicht erhöhten Anteilen im Speichel detektiert werden, die sich aber nicht signifikant von der Normalflora unterschieden. Allerdings war der Anteil von Streptokokken-Spezies während der Intervention und nach Zufuhr im Vergleich zur Baseline signifikant reduziert. Die Autoren schlussfolgerten, dass die zugeführten pB sich weder in den Biofilm noch in den Speichel integrieren oder persistieren konnten, aber die Integration der Streptokokken-Spezies im Biofilm sowie deren Konzentration im Speichel reduzierten [Arweiler et al., 2019].
Bakteriozine der pB könnten eine Rolle für dieses „replacement” spielen. Arweiler et al. beobachteten keine Reduktion von Streptococcus mutans, sondern nur eine generelle Reduktion von Streptokokken-Spezies. Laleman et al. fanden in ihrer Metaanalyse eine signifikante Reduktion von Streptococcus-mutans-Zahlen (vor allem im Speichel) durch Probiotika, was aber aufgrund der Testmethoden – die Tests konnten nur Streptokokken-Spezies identifizieren – keinen Widerspruch zu Arweiler et al. darstellt [Laleman et al., 2014].
In einer klinischen Untersuchung an 45 Schwangeren zeigten Schlagenhauf et al., dass nach einer regelmäßigen Einnahme von Lactobacillus reuteri die Plaqueakkumulation und auftretende Entzündungszeichen reduziert werden konnten [Schlagenhauf et al., 2016]. Die Reduktion der Entzündungszeichen im Gingiva-Index war zwar in der Testgruppe signifikant gegenüber der Kontrollgruppe, allerdings mit einer so geringen Differenz (Probiotika-Gruppe: 1,0 auf 0,2, Kontrollgruppe: 0,9 auf 0,7), dass man sich fragt, ob diese Reduktionen nicht auch mit Mundhygieneinstruktionen und einer verbesserten täglichen Mundhygiene hätten erreicht werden können. Beide Gruppen erhielten im Rahmen der Studie keine Mundhygieneinstruktionen. Geisinger et al. zeigten in einer Studie mit 120 schwangeren Probandinnen im zweiten Trimenon, dass (nur) durch eine Intensivierung der Mundhygiene der Plaque-Index von 1,35 auf 0,61 und der Gingiva-Index von 1,45 auf 0,75 – also fast auf die Hälfte – reduziert werden konnte [Geisinger et al., 2014].
Die Studienergebnisse lassen die Schlussfolgerung zu, dass Probiotika sicherlich einen interessanten Ansatz darstellen, um eine aus dem Gleichgewicht geratene orale Mundflora zu normalisieren. Jedoch widersprechen verschiedene Anforderungen, die an Probiotika gestellt werden – zum Beispiel die dauerhafte Veränderung eines ausgeglichenen oralen Mikrobioms nach begrenzter Bakterienzufuhr – jedem mikrobiologischen Grundverständnis. Um dies zu erreichen, müsste die Gesamtökologie der Mundhöhle, zum Beispiel durch regelmäßige mechanische Maßnahmen (Biofilmmanagement), verändert werden. Durch Probiotika erzeugte Effekte – insbesondere anti-entzündliche – könnten in der Mundhöhle auch über positive Wirkungen im Darm oder über das Immunsystem verursacht sein.
Probiotika in der Parodontitis-Therapie
Auch der klinische Effekt von Probiotika als Hilfsmittel bei der nicht-chirurgischen Parodontitistherapie war bereits Gegenstand von Übersichtsarbeiten [Gruner et al., 2016; Martin-Cabezas et al., 2016]. Gruner et al. fanden überwiegend Studien, die Laktobazillen und Bifidobakterien, seltener Streptokokken oder generell Bazillen als probiotische Keime untersuchten, wobei die Dosis der zugeführten Keime insgesamt stark variierte (von 107 bis 1013 CFUs/ml). Typische Vehikel für die Keime waren Milch, Milchprodukte, (Lutsch-)Tabletten, Flüssigkeiten, Pulver, Trinkhalme oder Cerealien. Die Studien wurden über Zeiträume von zwei Tagen bis zu 84 Wochen durchgeführt. Die Zielgrößen waren entweder Laktobazillen- oder Streptokokkus-mutans-Zahlen, parodontale Pathogene, Mundhygiene- und Gingivitis-Indizes, Karies- und Parodontitisparameter sowie mögliche Nebenwirkungen. Bezüglich parodontopathogenen Keimzahlen (A. actinomycetemcomitans, P. gingivalis, P. intermedia) konnten die Laktobazillen zu keinem Unterschied der Keimzahlen gegenüber einer Kontroll-Therapie führen. Bezüglich der Mundhygieneparameter konnte ein signifikanter Vorteil der probiotischen Therapie auf den BOP gezeigt werden, während für den Plaque-Index die Ergebnisse nicht signifikant waren. Auf die Sondierungstiefen konnte ein signifikanter Effekt der probiotischen Therapie gezeigt werden, jedoch wurde auch hier eine hohe Heterogenität gesehen.
Viele Studien untersuchten Nebenwirkungen – während schwere Nebenwirkungen nicht beobachtet werden konnten, berichtete eine Studie von milden gastrointestinalen Irritationen [Gruner et al., 2016].
Martin-Cabezas et al. untersuchten in ihrem Review ganz gezielt den Einfluss von Probiotika als eine Begleittherapie zur subgingivalen Reinigung (scaling and root planing, SRP) auf Sondierungstiefen-Reduktion und einen klinischen Attachment-Gewinn bei chronischen Parodontitis-Patienten [nach Armitage, 1999]. Letztendlich konnten für die Metaanalyse drei klinische Studien eingeschlossen werden [Martin-Cabezas et al., 2016]. Danach wurde bei den Sondierungstiefen generell keine signifikante Reduktion gesehen, lediglich bei moderaten und tiefen Taschen zeigte sich eine Reduktion durch Probiotika.
Auch bei der Betrachtung zweier Studien, deren Daten zur Schlussfolgerung einer signifikanten Wirkung von Probiotika auf die Reduktion der Sondiertiefen (STs) geführt haben [Tekce et al., 2015; Ince et al., 2015], muss jedoch genauer hingeschaut werden. Beide Studien zeigten in ihren Testgruppen (Probiotika-Gabe) bei der Reevaluation eine Reduktion um 1,74 beziehungsweise 1,70 mm, während die Kontrollgruppe (Placebo-Gruppe, die nur mechanisch mit SRP behandelt wurde) eine deutlich geringere Reduktion von nur 0,57 mm beziehungsweise 0,55 mm erreichte. Wenn man aber berücksichtigt, dass ein gutes SRP eine Reduktion der STs um 1 bis 2 mm erreichen kann [Hung & Douglass, 2002], dann relativiert sich die Wirkung einer probiotischen Begleittherapie. Interessanterweise zeigen Laleman et al. in einer ähnlich aufgebauten Studie in ihrer reinen SRP-Gruppe (Placebo-Gruppe) eine Reduktion um 1,62 mm, während die Probiotika-Gruppe mit einer Reduktion um 1,52 mm keinen signifikanten Unterschied erreichen konnte [Laleman et al., 2017].
Probiotika könnten eine vielversprechende Alternative zu anderen Begleittherapien wie Antibiotika, photodynamischer oder Laser-Therapie darstellen. Bisher sind die Ergebnisse der Studien aber noch sehr heterogen, da sie sich stark in den probiotischen Keimen, der Keimzahl und der Applikationsform unterscheiden.
Positive Effekte von Probiotika auf die Mundflora könnten aber durchaus auch ohne Integration probiotischer Bakterien in den Biofilm erreicht werden, nämlich durch orale Bakteriozine und solche, die für die Wirkung von Probiotika im Darm verantwortlich gemacht werden.
Nebenwirkungen und Gefahren
Auch wenn der Begriff „Probiotika“ gegenüber dem häufig negativ belegten Begriff „Antibiotika“ ein positives Bild suggeriert, sollten auch potenzielle Nebenwirkungen dieser künstlich zugeführten und möglichst lebens- und teilungsfähigen Bakterien in Betracht gezogen werden.
Da viele Produkte unterschiedliche Bakterienstämme oder Kombinationen von unterschiedlichen Stämmen enthalten, sind Nebenwirkungen schwierig pauschal zu beurteilen. Zahlreiche Wissenschaftler kritisieren, dass nur ganz wenige Präparate als Arzneimittel, aber die meisten als Nahrungsergänzungsmittel deklariert werden, somit keinen strengen Kontrollen unterliegen und durch den Patienten unlimitiert eingenommen werden können.
Schwendicke und Vuotto et al. weisen dabei auf die prinzipielle Kariogenität von Laktobazillen hin, denn dem Zahnmediziner sind diese Bakterien mit ihrer Milchsäure-Produktion doch eher als schädlich, denn als nützlich bekannt [Schwendicke, 2014a; Vuotto et al., 2014]. In ihrer Studie mit einem Biofilmmodell konnten sie vor allem bei gleichzeitiger Zuckerzufuhr durch Lactobacillus rhamnosus GG einen signifikanten Mineralverlust in Dentinkavitäten zeigen, sowie gleichzeitig eine fehlende Hemmung von Streptococcus mutans. Dies muss sicher bei der Empfehlung für Patienten mit initialen oder manifesten Kariesläsionen sowie einer zuckerreichen Ernährung berücksichtigt werden. In dieser Hinsicht ist vor allem Vorsicht bei den stark kohlenhydrathaltigen Trinkjoghurts geboten, die den Karieskeimen zugleich noch das Substrat liefern.
Sehr viel weitreichender können die Folgen aber auch für den Gesamtorganismus sein. Da Probiotika zunächst Magen und Dünndarm passieren müssen, könnten sie dort auch zu einer „Übersäuerung“, einer sogenannten Laktatazidose, führen. Das Überangebot der D-Milchsäure (linksdrehende) kann zu Orientierungslosigkeit und schlimmstenfalls zum Tod führen [Rao et al., 2018]. Bereits 2008 sorgte die sogenannte ProPaTria-Studie an 89 Pankreatitis-Patienten, publiziert im Lancet, für Schlagzeilen. Probiotika sollten hier zur Prophylaxe einer schweren akuten Pankreatitis eingesetzt werden, führten aber zu einer signifikanten Erhöhung der Sterblichkeit (n = 24) gegenüber der Placebo-Gruppe (n = 9) [Besselink et al., 2008]. Bei acht Patienten konnte eine Darmischämie als Todesursache identifiziert werden, während diese Erkrankung in der Placebo-Gruppe nicht festgestellt wurde.
Als Kontraindikation für die Anwendung von Probiotika werden daher von wissenschaftlicher Seite schwere akute Pankreatitis, Abwehrschwäche, Autoimmunerkrankungen sowie andere chronische Erkrankungen (Herzklappen) angegeben. Die Darmwand von Anwendern sollte weitgehend intakt sein, damit diese Bakterien sie nicht durchdringen und Schaden anrichten könnten.
Fazit und Ausblick
Neben der Fähigkeit von probiotischen Bakterien zur Verdrängung anderer Keime scheint ihre Wirkung im Bereich der parodontalen Erkrankungen eher in der Interaktion mit anderen Pathogenen durch Bakteriozine sowie in der Stimulation der Immunantwort des Wirtes zu liegen. Auch wenn bereits verschiedene Reviews existieren, braucht es weitere, sorgfältig geplante klinische Untersuchungen, um die, vor allem durch die Industrie gerne angenommenen, positiven Wirkungen auch wissenschaftlich fundiert zu verifizieren.
Prof. Dr. med. dent. Nicole Arweiler
Abteilung für Parodontologie und periimplantäre Erkrankungen
Philipps Universität Marburg, UKGM Standort Marburg
Georg-Voigt-Str. 3, 35039 Marburg
arweiler@med.uni-marburg.de
Prof. Dr. Nicole Arweiler
1990–1996: Studium der Zahnheilkunde an der Universität des Saarlands, Deutschland
1997–2000 wissenschaftliche Mitarbeiterin in der Abteilung für Parodontologie und Zahnerhaltung der Universität des Saarlands
1999 Promotion zur Dr. med. dent.
2001–2009: wissenschaftliche Assistentin in der Abteilung für Zahnerhaltungskunde und Parodontologie der Albert-Ludwigs-Universität Freiburg
2002: Ernennung zur Oberärztin in der Abteilung
2003: Ernennung zur Juniorprofessorin sowie Habilitation und Venia legendi an der Albert-Ludwigs-Universität Freiburg
2006: Ernennung zur Apl-Professorin der Albert-Ludwigs-Universität Freiburg
2009: Ruf auf die Professur (W3) für Parodontologie der Philipps-Universität Marburg
seit 02/2010: Ordinaria und Direktorin der Abteilung Parodontologie der Uniklinik der Philipps-Universität Marburg
Literaturliste
1. Arweiler NB, Auschill TM, Sculean A (2018) Patient self-care of periodontal pocket infections. In: Periodontol 2000 76:164-179.
2. Arweiler NB, Auschill TM, Heumann C, Hellwig E, Al Ahmad A. (2019) The Influence of Probiotics on Saliva and Integration into in situ Dental Biofilm – a Randomized Clinical Trial Using FISH/CLSM; Abstract #: 0275; J Dent Res (2019)
3. Auschill TM, Sälzer S, Arweiler NB (2018). S3 Leitlinie: Häusliches chemisches Biofilmmanagement in der Prävention und Therapie der Gingivitis (https://www.dgzmk.de/uploads/tx_szdgzmkdocuments/LL_2__083-016__Final_Langversion_11_2018.pdf
4. Besselink MG, van Santvoort HC, Buskens E, Boermeester MA, van Goor H, Timmerman HM, Nieuwenhuijs VB, Bollen TL, van Ramshorst B, Witteman BJ, Rosman C, Ploeg RJ, Brink MA, Schaapherder AF, Dejong CH, Wahab PJ, van Laarhoven CJ, van der Harst E, van Eijck CH, Cuesta MA, Akkermans LM, Gooszen HG (2008) Dutch Acute Pancreatitis Study Group. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. In: Lancet 23;371(9613):651-659.
5. Food and Agricultural Organization of the United Nations and World Health Organization. Joint FAO/WHO working group report on drafting guidelines for the evaluation of probiotics in food. Food and Agricultural Organization of the United Nations 2002 www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf
6. Global Industry Analysis Report, 2012: www.grandviewresearch.com/industry-analysis/probiotics-market
7. Chapple IL, Van der Weijden F, Doerfer C, Herrera D, Shapira L, Polak D, Madianos P, Louropoulou A, Machtei E, Donos N, Greenwell H, Van Winkelhoff AJ, Eren Kuru B, Arweiler N, Teughels W, Aimetti M, Molina A, Montero E, Graziani F (2015). Primary prevention of periodontitis: managing gingivitis. J Clin Periodontol 42 Suppl 16:p71-76.
8. Dye BA (2012) Global periodontal disease epidemiology. Periodontol 2000 58:10-25.
9. Fleming P, Hall NJ, Eaton S (2015) Probiotics and necrotizing enterocolitis. Pediatr Surg Int, 31:1111-8.
10. Forsberg A, West CE, Prescott SL, Jenmalm MC (2016). Pre- and probiotics for allergy prevention: time to revisit recommendations? Clin Exp Allergy 46:1506-1521.
11. Geisinger ML, Geurs NC, Bain JL, Kaur M, Vassilopoulos PJ, Cliver SP, Hauth JC, Reddy MS (2014) Oral health education and therapy reduces gingivitis during pregnancy. J Clin Periodontol 41:141-8.
12. Gruner D, Paris S, Schwendicke F (2016) Probiotics for managing caries and periodontitis: Systematic review and meta-analysis. J Dent 48:16-25.
13. Hung HC, Douglass CW (2002) Meta-analysis of the effect of scaling and root planing, surgical treatment and antibiotic therapies on periodontal probing depth and attachment loss. J Clin Periodontol 29:975-86.
14. İnce G, Gürsoy H, İpçi ŞD, Cakar G, Emekli-Alturfan E, Yılmaz S (2015) Clinical and Biochemical Evaluation of Lozenges Containing Lactobacillus reuteri as an Adjunct to Non-Surgical Periodontal Therapy in Chronic Periodontitis. J Periodontol 86:746-54.
15. Jordan AR, Micheelis W. (2016) Fünfte Deutsche Mundgesundheitsstudie (DMS V). Materialienreihe Bd. 35, Institut der Deutschen Zahnärzte (Hrsg.), Deutscher Zahnärzte Verlag DÄV, Köln
16. Laleman I, Detailleur V, Slot DE, Slomka V, Quirynen M, Teughels W (2014) Probiotics reduce mutans streptococci counts in humans: a systematic review and meta-analysis. Clin Oral Investig 18:1539-52.
17. Lodi CS, Oliveira LV, Brighenti FL, Delbem AC, Martinhon CC (2015) Effects of probiotic fermented milk on biofilms, oral microbiota, and enamel. Braz Oral Res 29:1-7.
18. Martin-Cabezas R, Davideau JL, Tenenbaum H, Huck O (2016) Clinical efficacy of probiotic as an adjunctive therapy to non-surgical periodontal treatment of chronic periodontitis: A systematic review and meta-analysis. J Clin Periodontol 43:520-30.
19. Michalek SM, Hirasawa M, Kiyono H, Ochiai K, McGhee JR (1981) Oral ecology and virulence of Lactobacillus casei and Streptococcus mutans in gnotobiotic rats. Infect Immun 33:690-6.
20. Näse L, Hatakka K, Savilahti E, Saxelin M, Pönkä A, Poussa T, Korpela R, Meurman JH (2001) Effect of long-term consumption of a probiotic bacterium, Lactobacillus rhamnosus GG, in milk on dental caries and caries risk in children. Caries Res 35:412-20.
21. Pihlstrom BL, Michalowicz BS, Johnson NW (2005) Periodontal diseases. Lancet 366(9499):1809-20.
22. Rao SSC, Rehman A, Yu S, Andino NM (2018) Brain fogginess, gas and bloating: a link between SIBO, probiotics and metabolic acidosis. Clin Transl Gastroenterol 19;9:162.
23. Schlagenhauf U, Jakob L, Eigenthaler M, Segerer S, Jockel-Schneider Y, Rehn M (2016) Regular consumption of Lactobacillus reuteri-containing lozenges reduces pregnancy gingivitis: an RCT. J Clin Periodontol 43:948-954.
24. Schwendicke F, Dörfer C, Kneist S, Meyer-Lueckel H, Paris S (2014a) Cariogenic effects of probiotic Lactobacillus rhamnosus GG in a dental biofilm model. Caries Res 48:186-92.
25. Schwendicke F, Horb K, Kneist S, Dörfer C, Paris S (2014b) Effects of heat-inactivated Bifidobacterium BB12 on cariogenicity of Streptococcus mutans in vitro. Arch Oral Biol 59:1384-90.
26. Schwendicke F, Korte F, Dörfer CE, Kneist S, Fawzy El-Sayed K, Paris S (2017) Inhibition of Streptococcus mutans Growth and Biofilm Formation by Probiotics in vitro. Caries Res 51:87-95.
27. Selwitz RH, Ismail AI, Pitts NB (2007) Dental caries. Lancet 369(9555):51-9.
28. Simark-Mattsson C, Emilson CG, Håkansson EG, Jacobsson C, Roos K, Holm S (2007) Lactobacillus-mediated interference of mutans streptococci in caries-free vs. caries-active subjects. Eur J Oral Sci 115:308-14.
29. Sinclair A, Xie X, Saab L, Dendukuri N (2016) Lactobacillus probiotics in the prevention of diarrhea associated with Clostridium difficile: a systematic review and Bayesian hierarchical meta-analysis. CMAJ Open 24;4(4):E706-E718
30. Statista report 2018: de.statista.com › Konsum & FMCG › Lebensmittel & Ernährung).
31. Stecksén-Blicks C, Sjöström I, Twetman S (2009) Effect of long-term consumption of milk supplemented with probiotic lactobacilli and fluoride on dental caries and general health in preschool children: a cluster-randomized study. Caries Res 43:374-81.
32. Tannock GW (2005): What are Probiotic? in “Probiotics and Prebiotics: Scientific Aspects” (ed. GW Tannock), Caister Academic Press, 2005
33. Tekce M, Ince G, Gursoy H, Dirikan Ipci S, Cakar G, Kadir T, Yılmaz S (2015) Clinical and microbiological effects of probiotic lozenges in the treatment of chronic periodontitis: a 1-year follow-up study. J Clin Periodontol 42:363-72.
34. Teughels W, Loozen G, Quirynen M (2011) Do probiotics offer opportunities to manipulate the periodontal oral microbiota? J Clin Periodontol 38 Suppl 11:159-77.
35. Teughels W, Van Essche M, Sliepen I, Quirynen M (2008) Probiotics and oral healthcare. Periodontol 2000 48:111-47.
36. Vuotto C, Longo F, Donelli G (2014) Probiotics to counteract biofilm-associated infections: promising and conflicting data. Int J Oral Sci 6:189-94.
37. Zandbergen D, Slot DE, Cobb CM, Van der Weijden FA (2013) The clinical effect of scaling and root planing and the concomitant administration of systemic amoxicillin and metronidazole: a systematic review. J Periodontol 84:332-51.