Klarzelliger odontogener Tumor
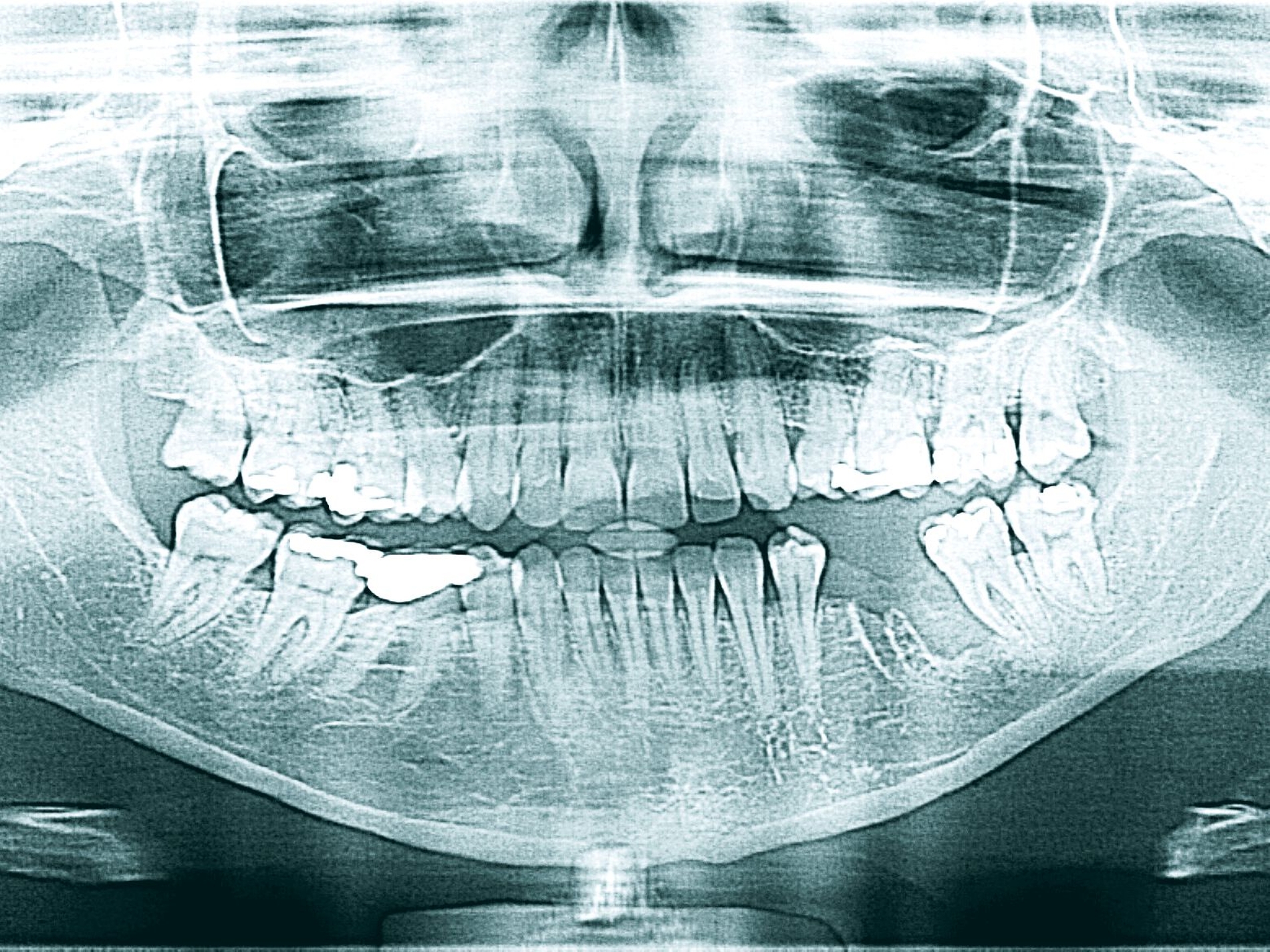
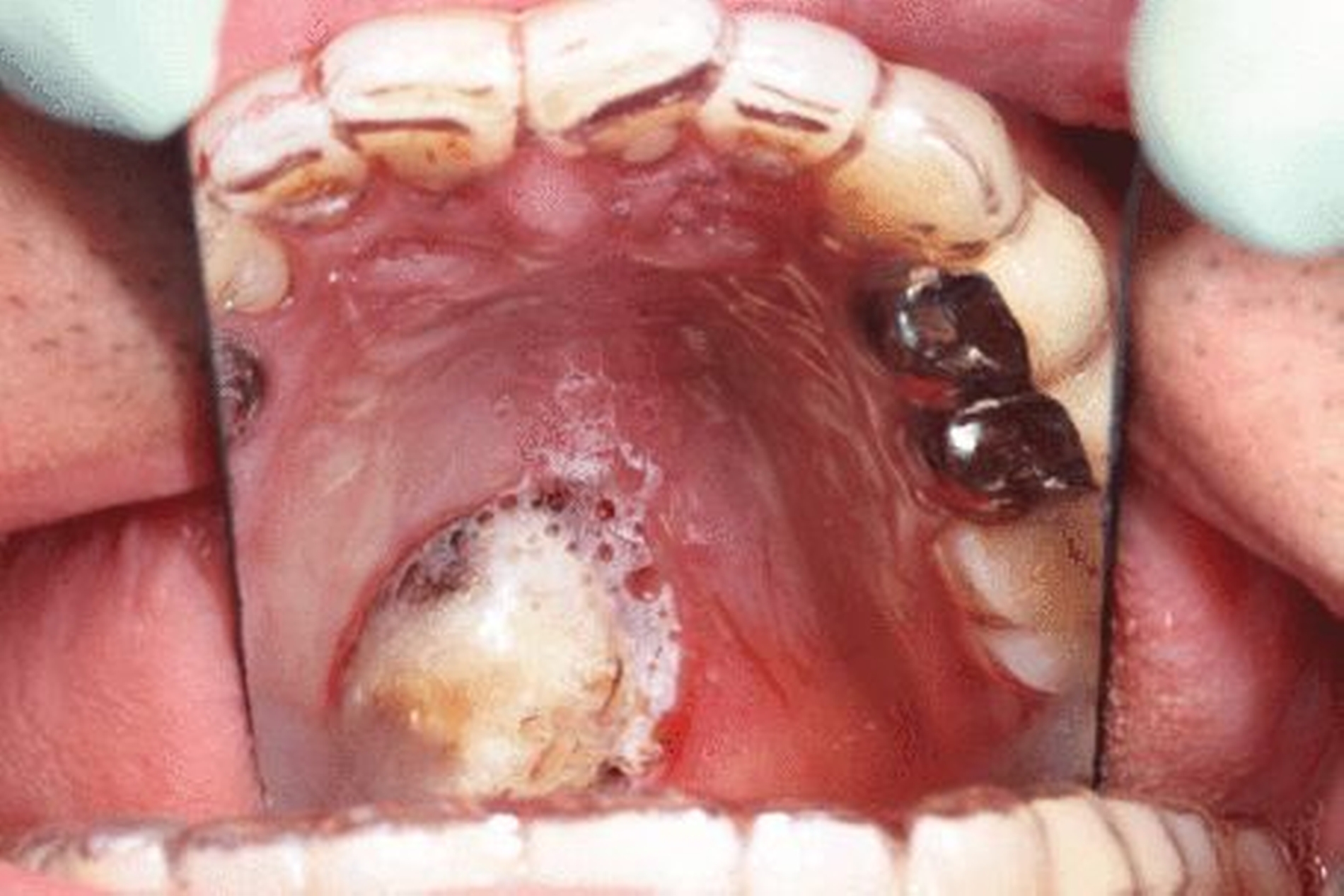
Eine 42-jährige Patientin stellte sich nach Extraktion der Zähne 35 und 36 alio loco mit einer persistierenden Wundinfektion in unserer Klinik vor. Schmerzen, eine An- beziehungsweise Hypästhesie oder Schwellungen lagen zum Zeitpunkt des Erstkontakts nicht vor. Die extra- und die intraorale Untersuchung zeigten keine weiteren pathologischen Befunde. Auf der OPT-Aufnahme (Abbildung 1) stellte sich ein ausgeprägter knöcherner Defekt regio 035–036 mit einer nach apikal fortschreitenden Osteolyse dar.
Im Rahmen der Wundrevision erfolgte eine Probenentnahme. In der histopathologischen Aufbereitung wurde ein niedrig differenziertes, solide wachsendes, das Knochengewebe infiltrierendes, klarzelliges odontogenes Karzinom diagnostiziert. Aufgrund der vorliegenden Diagnose wurde ein Tumorstaging eingeleitet. Computertomografisch zeigte sich eine Osteodestruktion der lingualen Alveolenwand Regio 036 und 37, mit einem unauffälligen Verlauf des Nervus alveolaris inferior. Im Halsbereich stellte sich ein vermehrter Lymphknotenbesatz der Level I und II beidseits bis 12 mm Durchmesser dar. Im weiteren Tumorstaging (Sonografie des Abdomens sowie Oesophago-Gastro-Duodenoskopie) lag kein Anhalt auf eine Fernmetastasierung oder auf ein Zweitkarzinom vor.
Es folgte die radikale Tumorresektion mit Mundbodenteil- und Unterkieferkontinuitätsresektion. Gleichzeitig erfolgte die suprahyoidale selektive Neck dissection beidseits unter Belassen der Glandula submandibularis. Der Unterkiefer wurde mit einer Reko-Platte und mehrschichtiger lokal plastischer Deckung temporär rekonstruiert. Die histopathologische Aufarbeitung ergab das Tumorstadium pT1, G3, R0, pN0 (0/14), Pn0. Nach einhelliger Meinung der hausintern durchgeführten interdisziplinären onkologischen Tumorkonferenz erfolgte anschließend eine Strahlentherapie mit insgesamt 50 Gy.
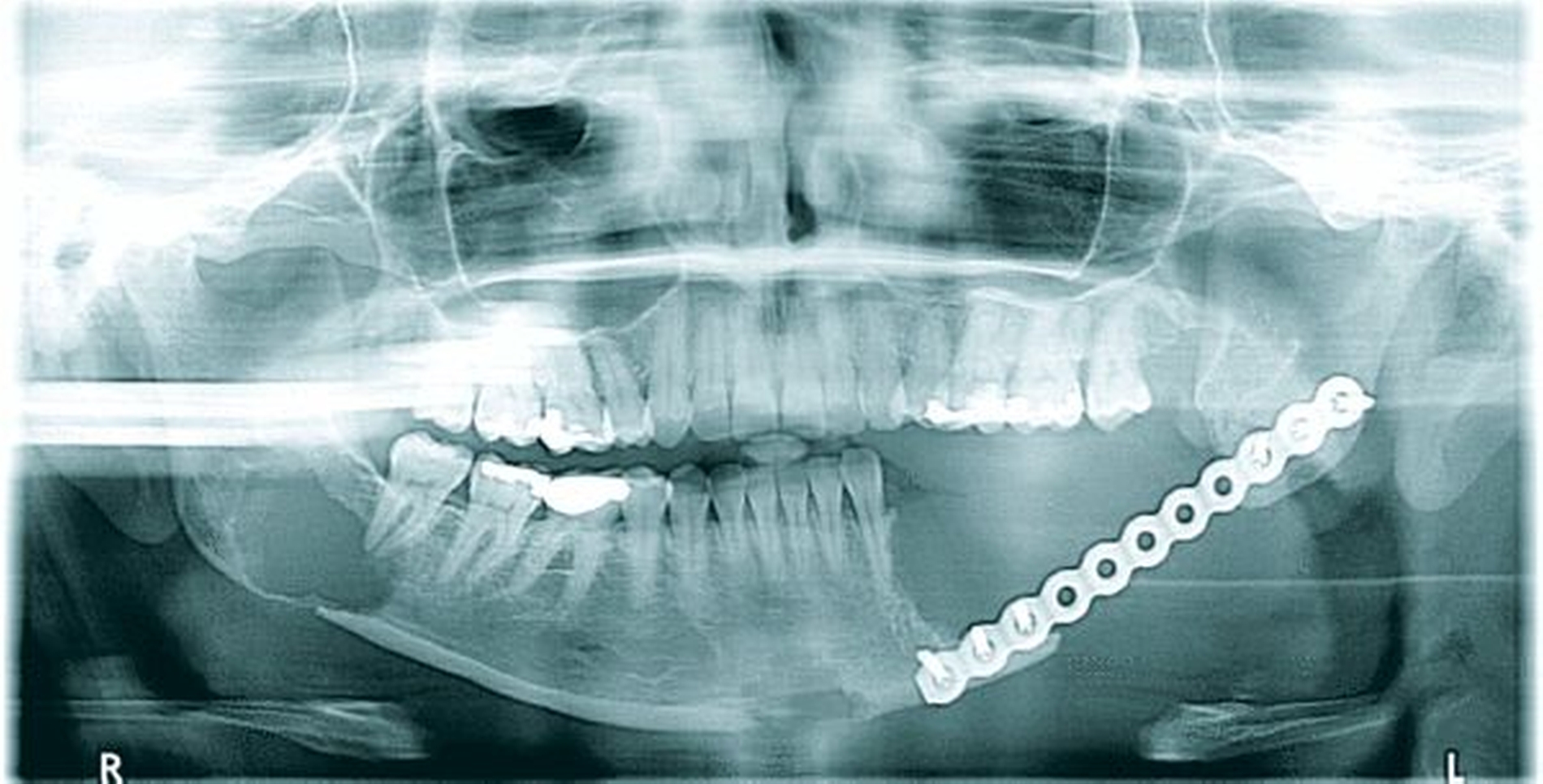
In der regelmäßigen Tumornachsorge beschrieb die Patientin zwei Jahre nach der Erstoperation eine neu aufgetretene persistierende Schwellung am anterioren Kieferstumpf. In der radiologischen Kontrolle mittels OPT stellten sich drei neue pathologische Befunde dar (Abbildung 2). Eine deutlich fortgeschrittene Osteolysezone am mesialen Kieferstumpf links, im Kinnbereich sowie im rechten Kieferwinkel. In der Computertomografie verdeutlichten sich drei Kontrastmittel aufnehmende, rundliche, glatt begrenzte Weichteilläsionen am Unterkiefer (Ausmaße paramedian: 17 mm, am aufsteigenden Ast rechts Regio 48: 18 mm x 17 mm, ehemaliges Operationsgebiet Regio 036: 15 mm x 24 mm). Im erneuten Staging ergab sich wie bei der Erstdiagnose kein Anhalt auf eine Fernmetastasierung.
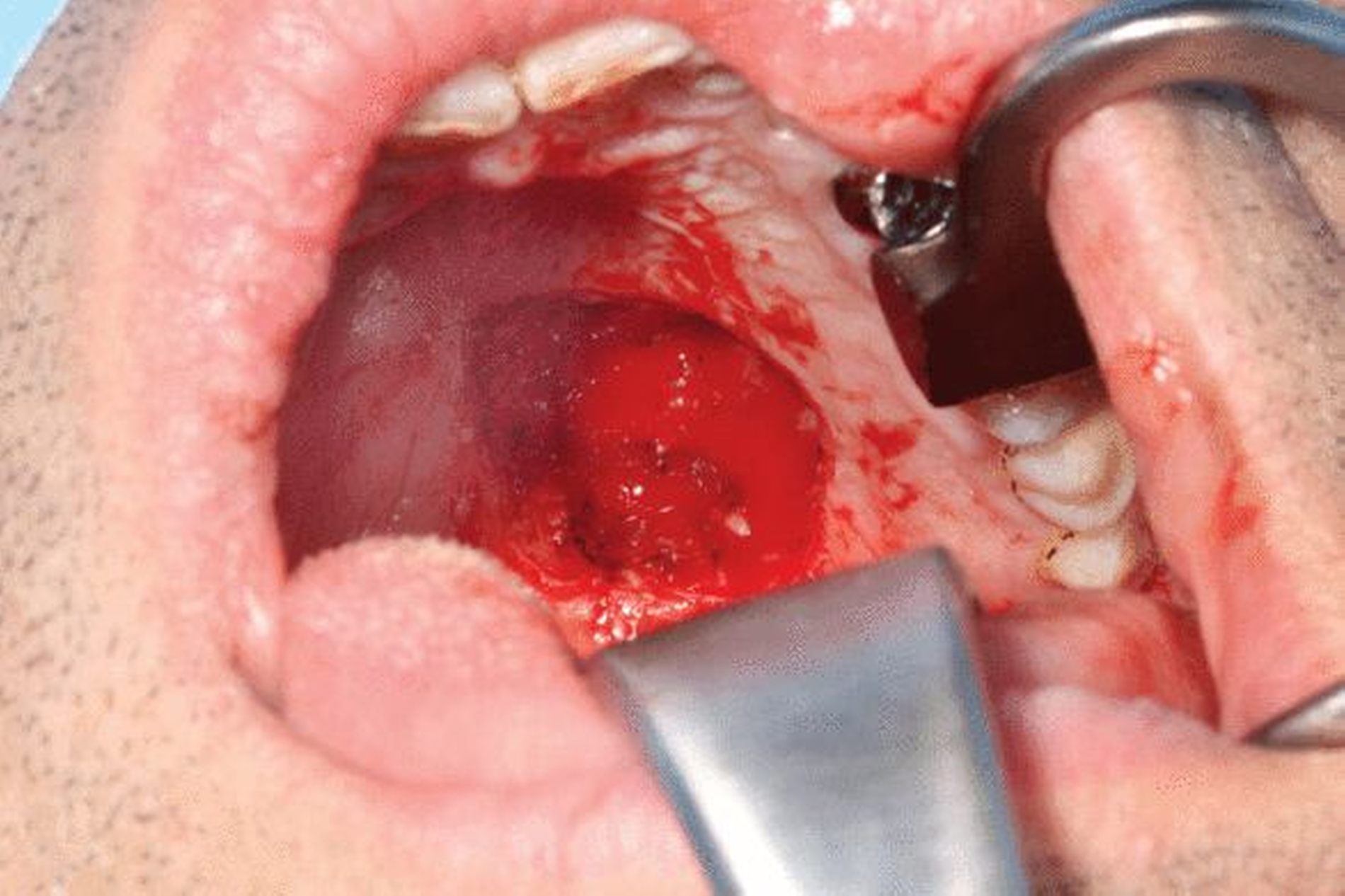
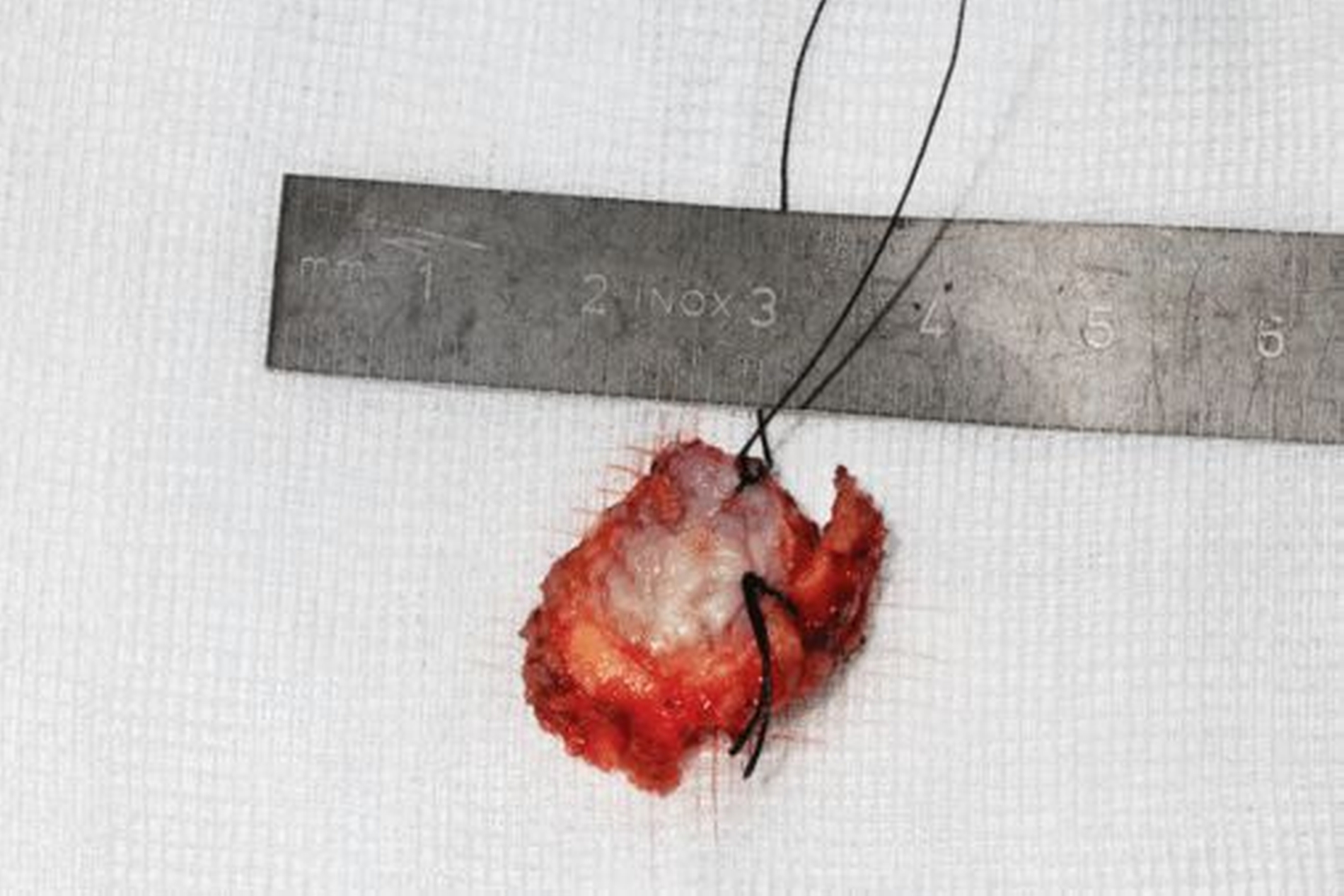
Die geplante Mandibulektomie und sofortige Defektrekonstruktion des Unterkiefers erfolgte mit einem CAD/CAM-geplanten mikrovaskulär anastomosierten Fibulatransplantat aus dem rechten Unterschenkel (Abbildung 3). In der darauf folgenden Operation wurden das Rezidiv unter Einbeziehung des linken Mundbodens sowie der Unterkiefer vom Kieferwinkel links bis zum Kiefergelenk rechts reseziert (Abbildung 4). Histopathologisch wurde eine R0-Resektion bestätigt.
Ergänzend zu der standardmäßigen histologischen Aufarbeitung erfolgte eine immun-histochemische Untersuchung. Für das Gesamt-Cytokeratin zeigte sich bei den Tumorzellen eine ausgeprägte Positivität, während beim Cytokeratin 7 nur 40 Prozent der Zellen eine cytoplasmatische Reaktion zeigten. 60 Prozent der Tumorzellen zeigten eine mäßiggradige cytoplasmatische Positivität für Cytokeratin 5 und 6, während bei S100 keine Reaktion hervorgerufen wurde. Auf den Proliferationsmarker Ki67 reagierten 15 Prozent aller Tumorzellen.
Die Patientin befindet sich seitdem in enger regelmäßiger Tumorkontrolle (Zweimonatsintervall) und ist rezidivfrei. Die Rekonstruktionsplatte wurde mittlerweile entfernt und die Implantation von enossalen Implantaten 3-D-inseriert und prothetisch versorgt (Abbildung 5).
Diskussion
Die ersten Fallberichte über das klarzellige odontogene Karzinom publizierten zwei Arbeitsgruppen – von Waldron et al. sowie Hansen et al. – im Jahr 1985 getrennt voneinander [Ganvir, 2014]. Waldron et al. beschreiben in ihrer Veröffentlichung zwei Fälle eines aggressiv wachsenden, intraossären epithelialen Tumors im Kieferbereich. Morphologisch beschreibt die Arbeitsgruppe ein biphasisches Muster in einem follikulären Ameloblastom mit insertierten Anteilen von klarzelligen Komponenten. Sie kommen zu dem Schluss, dass diese neu aufgetretene Neoplasie weiter durch die WHO klassifiziert werden müsste [Waldron, 1985]. Vier Jahre nach der Erstveröffentlichung wurde ein weiterer Artikel über drei Patienten veröffentlicht [Bang, 1989]. 1992 erfolgte die Klassifikation durch die WHO als gutartiger, klarzelliger odontogener Tumor (englische Literatur – clear cell odontogenic carcinoma – CCOC) oder Klarzell-Ameloblastom mit lokal invasivem Wachstum. 13 Jahre später wurde die Reklassifikation aufgrund des aggressiven Wachstums in eine bösartige Neoplasie mit metastasierendem Potenzial in Lymphknoten und Lunge durchgeführt [Swain, 2013; Yazici, 2011]. Bis zum Jahr 2018 wurden 96 Fallberichte über diese Form der Neoplasie veröffentlicht [Datar, 2017].
Ätiologie
Zur Ätiologie der Erkrankung ist festzuhalten, dass diese weiterhin als unbekannt gilt. In den bis dato vorliegenden Fällen wird nicht über potenzielle Vorläuferläsionen wie zum Beispiel die odontogene Keratozyste, Zahnreste oder andere Prädispositionen berichtet [Yazici, 2011]. Um die Diagnose sowie die Ausschlussdiagnose gegenüber anderen benignen und malignen Neubildungen zu erheben, ist eine histopathologische sowie immunhistochemische Aufarbeitung der Präparate unumgänglich [Krishnamurthy, 2014].
Klinik
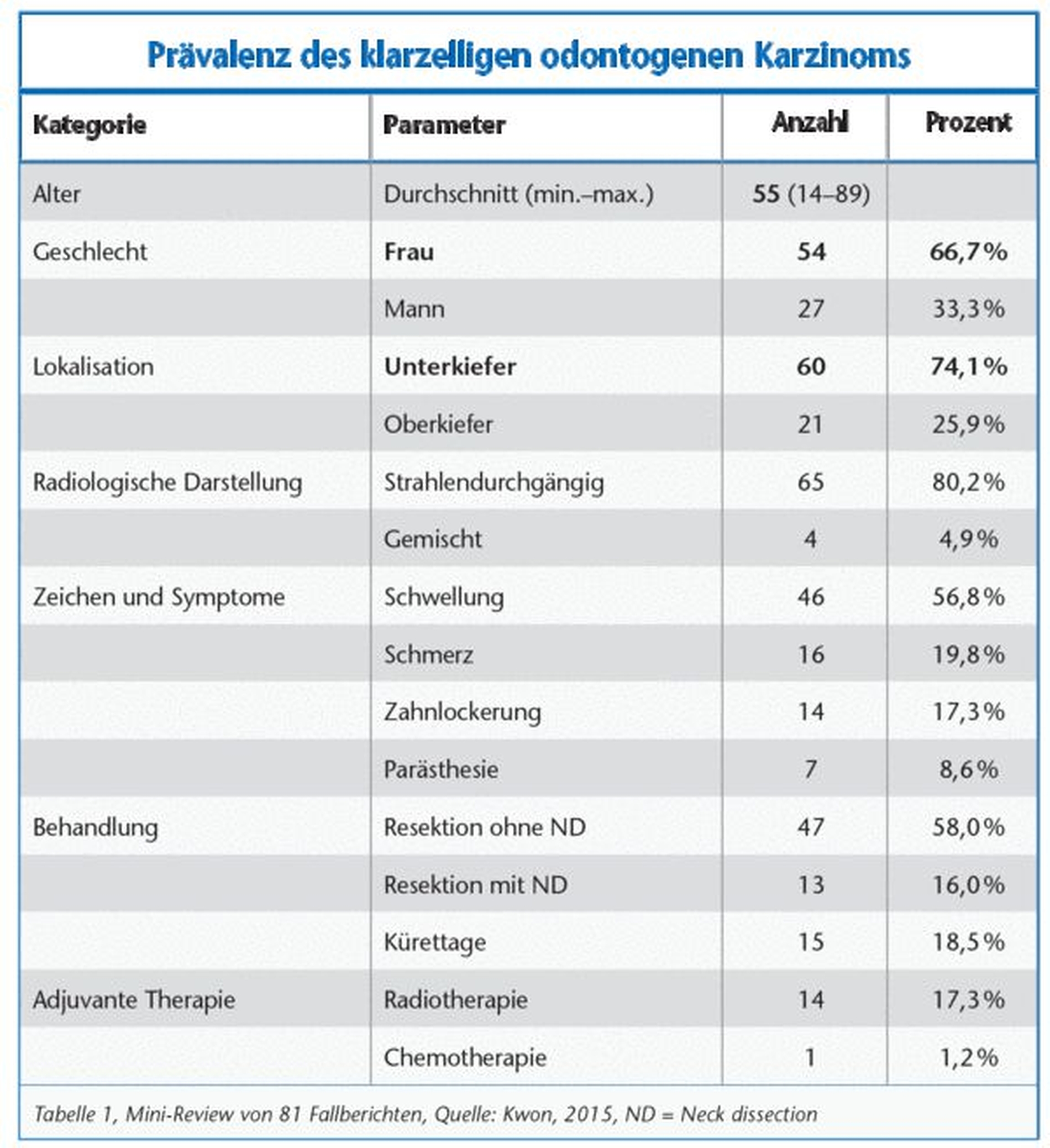
In einer Studie von 2015 werden 81 Fälle auf verschiedene Prävalenzen dieser Neoplasieform untersucht [Tabelle 1]. Die Auswertung zeigt, dass eine deutliche Prädisposition mit 66,7 Prozent beim weiblichen Geschlecht vorliegt. Auffällig ist das Auftreten im Unterkieferbereich mit 74,1 Prozent. Anschaulich verdeutlicht Tabelle 1 die unterschiedlichen Herangehensweisen in Bezug auf die Therapie. Nur in knapp 58 Prozent der 81 Case Reports erfolgte die Tumorresektion mit begleitender Neck dissection. Symptombezogen zeigt sich diese Art der Neoplasie mit Zahnlockerung, Schwellung, Schmerzen in dem Gebiet. Weiterhin kann es zu Hyp- beziehungsweise Parästhesien im Unterlippenbereich kommen [Kwon, 2015].
Radiologisch zeigen sich die Befunde in den meisten Fällen als Radioluzenz mit unilokulären oder multilokulären Läsionen, wobei die Ränder nicht eindeutig scharf oder unscharf begrenzt sind. Des Weiteren zeigen sich auch Fälle, in denen sich eine Mischform ausbildet. In wenigen Fällen wird auch zusätzlich eine Resorption der Wurzelspitzen mit einhergehender Divergenz der Wurzeln beschrieben [Kim, 2014; Walia, 2015].
Das Auffinden von Klarzellen in einem histologischen Präparat ist kein Garant für das Vorliegen dieser Neoplasie. Viele andere Primärtumoren sowie metastasierende Tumore weisen diese Zellart auf [Yazici, 2011]. So zeigen odontogene, Speichel-, Melano-, Nieren-, Schilddrüsen-, Brust-, Kolon- oder Prostatakarzinome das Vorkommen dieses Zelltyps [Ferreira, 2018; Werle, 2009]. Aufgrund der hohen Variabilität kommt die Arbeitsgruppe Datar et al. zu dem Schluss, „die Differenzierung dieser Tumore ist aufgrund der erheblichen Überlappung ihrer histologischen Merkmale verwirrend und stellt somit eine diagnostische Herausforderung dar“ [Datar, 2017].
Zur genauen Abgrenzung gegenüber anderen tumorösen Läsionen erfolgt die histologische und immunhistologische Untersuchung. Durch die Färbung lassen sich histologisch drei Subtypen des klarzelligen odontogenen Karzinoms unterscheiden [Dahiya, 2002]. Zu der häufigsten Darstellung zählt die biphasische Form. Diese zeichnet sich durch klare Zellnester aus, die gepaart mit hyperchromen, polygonalen und eosinophilen Zellen vorliegen. In der monophasischen Form zeichnen sich nur Zellnester von Klarzellen ab. Die am seltensten auftretende Form ist die ameloblastische Form, die sich durch eine Pallisadenanreihung von ameloblastischen Zellen an den Rändern der Klarzellnester auszeichnet [Avninder, 2006; Eversole, 1995].
Zur genaueren Bestimmung können ergänzend immunhistochemische Untersuchungen durchgeführt werden. Hierzu eignen sich Cytokeratine (CK), Vimentine, S100-Proteine und epitheliales Membranantigen (EMA). Die Reaktion auf das EMA und das Cytokeratin 19 sind bei dieser Tumorart positiv, während er negativ auf das Vimentine und das S100-Protein reagiert. Eine Auswertung der immunhistochemischen Untersuchungsergebnisse von 74 Fallberichten von Swain et al. zeigt einen Zusammenhang der oben genannten Marker und dieser Neoplasie [Swain et al., 2013] (Tabelle 2).
Eine weitere Alternative in Bezug auf Diagnose, Staging oder Nachsorge beschreibt die Gruppe um Krishnamoorthy et al. in Form eines FDG-PET/CTs. Auf die metabolischen Eigenschaften und die damit einhergehende Aussagekraft eines PET/CTs wird in diesem Zusammenhang kaum eingegangen. Auch beschreibt die Arbeitsgruppe nur zwei Fälle, wobei diese in ihrer Aussage diametral zueinander stehen [Krishnamoorthy, 2014].
Differenzialdiagnose
Kim et al. beschreiben in ihrer Veröffentlichung eine hohe Rate an Fehltherapien, aufgrund der sich darstellenden Klinik und der damit einhergehenden Fehldiagnosen. Vor allem die Verwechslungsgefahr mit Ameloblastomen und unilokulären Zysten spielt in der Literatur eine Rolle [Kim, 2014].
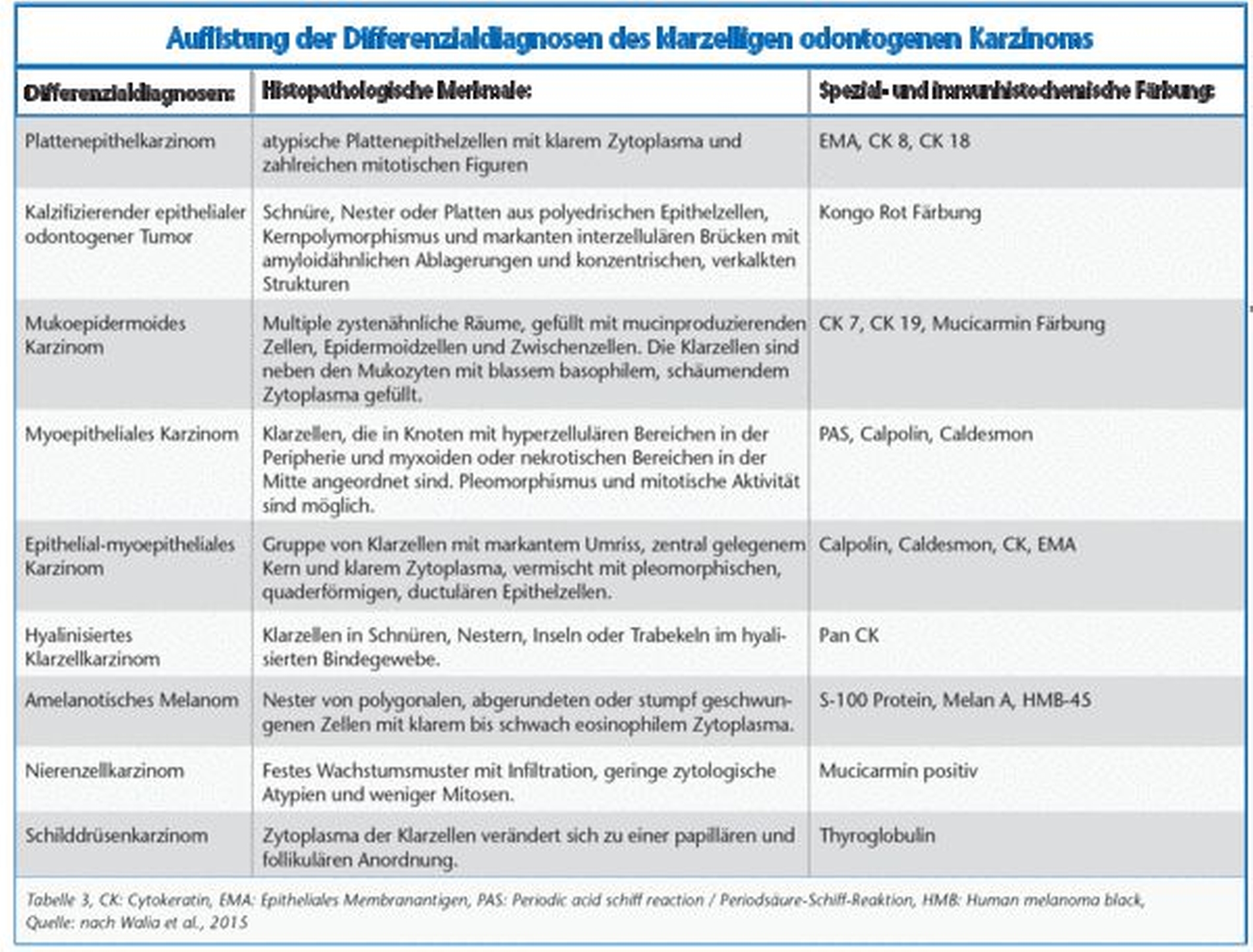
Differenzialdiagnostisch muss das klarzellige odontogene Karzinom gegen eine Vielzahl von anderen Neoplasien – hier vor allem das Mukoepidermoidkarzinom und die Klarzellvariante des kalzifizierenden epithelialen odontogenen Tumors – abgegrenzt werden [Krishnamurthy, 2014]. Ebenso müssen als Differenzialdiagnose auch das amelanotische maligne Melanom, das epithelial myoepitheliale Karzinom, das Azinuszellkarzinom und das hyalinisierte Klarzellkarzinom der Speicheldrüsen ausgeschlossen werden.
Im Hinblick auf Metastasen gilt es, besonders Nieren- , Leber- , Schilddrüsen- und Prostatakarzinome in Betracht zu ziehen. Eine genaue Übersicht der Differenzialdiagnosen samt der histologischen und immunhistochemischen Differenzen listete die Gruppe um Walia et al. in ihrem Fallbericht auf [Walia et al., 2015] (Tabelle 3).
Fazit
Aufgrund der hohen Rezidivrate von über 55 Prozent liegt die Therapie der Wahl in der chirurgischen Resektion des betroffenen Knochens mit ausreichendem Sicherheitsabstand von mindestens 1 cm [Bilodeau, 2011]. Kommt es dabei zur Invasion von Nachbarstrukturen, sollten eine adjuvante neck dissection sowie eine Bestrahlungstherapie im erkrankten Gebiet erfolgen [Ebert, 2005].
Eine Therapiehypothese wird in einer Veröffentlichung von Ginat et al. beschrieben. Die Hypothese beruht auf dem Vorkommen des Proteins BRAFV600 E in einigen odontogenen Tumoren. Dieses Protein könnte als Biomarker für eine molekulare Zieltherapie fungieren [Ginat, 2016]. Dass diese Art von Proteinen als Onkogen identifiziert ist, zeigen Forschungen im Bereich des Hautkrebses [Davies, 2002]. Die molekulare Analyse kann weiter hilfreich sein, um die Diagnose eines klarzelligen odontogenen Karzinoms stellen zu können [Hadj Said, 2017]. Das Gen EWSR 1 ist bei 83 Prozent aller klarzelligen odontogenen Karzinome vorhanden. Zu vermerken ist, dass dieses Gen auch im hyalinisierten, klarzelligen Karzinom der Speicheldrüse auftreten kann [Ginat, 2016; Kujiraoka, 2017].
Aufgrund der Seltenheit dieser Neoplasie kann gut drei Jahrzehnte nach der Erstbeschreibung noch keine einheitliche Therapie beschrieben werden [Ferreira, 2018].
Dr. Bastian Alexander HeidtPraxis MKG-Chirurgie im QuantumhausOsterfelder Str. 13446242 Bottropheidt@mkg-quantumhaus.deDr. Dr. Andreas HammacherSt. Johannes StiftKlinik für Mund-, Kiefer- und Gesichtschirurgie, Implantologie, Plastische und Ästhetische OperationenJohannisstr. 2147198 Duisburg-HombergDr. Cristian Tudor RäderRäder + Räder Praxisklinik am WallWall 18–2042103 Wuppertal
Literaturliste
1. Ganvir SM, Gajbhiye NY. An unusual presentation of clear cell odontogenic carcinoma in mandibular anterior region. J Oral Maxillofac Pathol. 2014;18(3):442-8.
2. Waldron CA, Small IA, Silverman H. Clear cell ameloblastoma--an odontogenic carcinoma. J Oral Maxillofac Surg. 1985;43(9):707-17.
3. Bang G, Koppang HS, Hansen LS, Gilhuus-Moe O, Aksdal E, Persson PG, et al. Clear cell odontogenic carcinoma: report of three cases with pulmonary and lymph node metastases. J Oral Pathol Med. 1989;18(2):113-8.
4. Swain N, Dhariwal R, Ray JG. Clear cell odontogenic carcinoma of maxilla: A case report and mini review. J Oral Maxillofac Pathol. 2013;17(1):89-94.
5. Yazici ZM, Mete O, Elmali Z, Sayin I, Yilmazer R, Kayhan FT. Clear cell odontogenic carcinoma of the maxilla. Acta Medica (Hradec Kralove). 2011;54(3):122-4.
6. Datar UV, Kamat MS, Kanitkar SS, Byakodi SS. Clear cell odontogenic carcinoma: A rare case report with emphasis on differential diagnosis. J Cancer Res Ther. 2017;13(2):374-7.
7. Krishnamurthy A, Ramshankar V, Majhi U. Clear cell odontogenic carcinoma of the mandible and temporomandibuar joint with cervical lymph nodal metastasis. Natl J Maxillofac Surg. 2014;5(2):221-3.
8. Kwon IJ, Kim SM, Amponsah EK, Myoung H, Lee JH, Lee SK. Mandibular clear cell odontogenic carcinoma. World J Surg Oncol. 2015;13:284.
9. Kim M, Cho E, Kim JY, Kim HS, Nam W. Clear cell odontogenic carcinoma mimicking a cystic lesion: a case of misdiagnosis. J Korean Assoc Oral Maxillofac Surg. 2014;40(4):199-203.
10. Walia C, Chatterjee RP, Kundu S, Roy S. Clinical enigma: A rare case of clear cell odontogenic carcinoma. Contemp Clin Dent. 2015;6(4):559-63.
11. Ferreira S, Faverani LP, Santos GMD, Martins EP, Garcia Junior IR. Clear cell odontogenic carcinoma of the mandible: a treatment strategy. J Appl Oral Sci. 2018;26:e20160645.
12. Ebert CS, Jr., Dubin MG, Hart CF, Chalian AA, Shockley WW. Clear cell odontogenic carcinoma: a comprehensive analysis of treatment strategies. Head Neck. 2005;27(6):536-42.
13. Werle H, Blake FA, Reichelt U, Schmelzle R, Heiland M. Clear-cell odontogenic carcinoma: a new case and long-term follow-up of an old case, and review of the literature. J Oral Maxillofac Surg. 2009;67(6):1342-8.
14. Dahiya S, Kumar R, Sarkar C, Ralte M, Sharma MC. Clear cell odontogenic carcinoma: a diagnostic dilemma. Pathol Oncol Res. 2002;8(4):283-5.
15. Avninder S, Rakheja D, Bhatnagar A. Clear cell odontogenic carcinoma: a diagnostic and therapeutic dilemma. World J Surg Oncol. 2006;4:91.
16. Eversole LR, Duffey DC, Powell NB. Clear cell odontogenic carcinoma. A clinicopathologic analysis. Arch Otolaryngol Head Neck Surg. 1995;121(6):685-9.
17. Krishnamoorthy R, Ravi Kumar AS, Batstone M. FDG-PET/CT in staging of clear cell odontogenic carcinoma. Int J Oral Maxillofac Surg. 2014;43(11):1326-9.
18. Bilodeau EA, Hoschar AP, Barnes EL, Hunt JL, Seethala RR. Clear cell carcinoma and clear cell odontogenic carcinoma: a comparative clinicopathologic and immunohistochemical study. Head Neck Pathol. 2011;5(2):101-7.
19. Ginat DT, Villaflor V, Cipriani NA. Oral Cavity Clear Cell Odontogenic Carcinoma. Head Neck Pathol. 2016;10(2):217-20.
20. Davies H, Bignell GR, Cox C, Stephens P, Edkins S, Clegg S, et al. Mutations of the BRAF gene in human cancer. Nature. 2002;417:949.
21. Hadj Said M, Ordioni U, Benat G, Gomez-Brouchet A, Chossegros C, Catherine JH. Clear cell odontogenic carcinoma. A review. J Stomatol Oral Maxillofac Surg. 2017;118(6):363-70.
22. Kujiraoka S, Tsunematsu T, Sato Y, Yoshida M, Ishikawa A, Tohyama R, et al. Establishment and characterization of a clear cell odontogenic carcinoma cell line with EWSR1-ATF1 fusion gene. Oral Oncol. 2017;69:46-55.