Ein Zuckeraustauschstoff macht Karriere in der Zahnmedizin
Seit Längerem warnen Institutionen wie die Deutsche Gesellschaft für Ernährung (DGE) und die Weltgesundheitsorganisation (WHO) vor den gesundheitlichen Gefahren hohen Zuckerkonsums. Die WHO empfiehlt, nicht mehr als 25 Gramm freien Zucker am Tag zu konsumieren. Zucker begünstigt Adipositas, die weitere Krankheiten verursachen kann. Neben der Beeinflussung systemischer Allgemeinerkrankungen spielt der Zuckergenuss auch in der Zahnmedizin eine sehr wichtige Rolle: Schon lange bekannt ist die Bedeutung von Zucker für die Entstehung von Karies [Gustafsson et al.,1954]. Hinzu kommen Zusammenhänge zwischen Zuckerkonsum und Gingivitis beziehungsweise Parodontitis [Janus et al., 2017; Hashino et al., 2013]. So ist es verständlich, dass die medizinische und die zahnmedizinische Forschung nach Möglichkeiten suchen, um Zucker zu ersetzen.
Grundsätzlich kommen Süßstoffe und Zuckeraustauschstoffe als Zuckerersatz infrage. Bei den Süßstoffen wird unterschieden, ob sie synthetisch hergestellt werden oder in der Natur vorkommen. Die bekanntesten synthetischen Süßstoffe sind Cyclamat, Aspartam oder Saccharin. Stevia dagegen kommt in der Natur vor. Diese Süßstoffe sind keine Kohlenhydrate, haben keine oder nahezu keine Kalorien und lassen den Blutzuckerspiegel nicht ansteigen. Sie werden häufig in Low-Carb-Rezepten oder „Light“-Produkten verwendet. Hoch dosierte Süßstoffe stehen in der Kritik, da sie in Tierversuchen teils zu Beschwerden (von Allergien bis hin zu Krebs) führten. Es gibt jedoch keine Belege dafür, dass diese Gefahren auch bei Menschen bestehen.
Zuckeraustauschstoffe sind süß schmeckende Verbindungen, meist Polyole (sogenannte Zuckeralkohole), die einen geringeren Einfluss auf den Blutzuckerspiegel haben. Die wichtigsten Vertreter dieser Gruppe sind Sorbitol, Mannitol, Lactit, Isomalt, Xylitol und Erythritol. Zuckeraustauschstoffe dürfen dem Bundesinstitut für Risikobewertung (BfR) zufolge in Lebensmitteln unbegrenzt eingesetzt werden. Es gibt folglich laut EU keinen Grenzwert für ein verträgliches Maximum der Tageszufuhr („acceptable daily intake“). Zu beachten ist, dass Zuckeraustauschstoffe Blähungen, Durchfall und Bauchschmerzen verursachen können. Von den Zuckeralkoholen gilt Erythritol als am verträglichsten.
Erythritol
Erythritol/Erythrit (Chemical Abstracts Service (CAS)-Nr.: 149–32–6) ist ein weißes kristallines Pulver und hat die chemische Formel C4H10O4. Es kommt in geringen Mengen in der Natur vor, zum Beispiel in Honig, Weintrauben, Melonen und Pilzen. Hergestellt wird Erythritol heute durch die mikrobiologische Umwandlung (Fermentation) natürlicher Zucker. Es ist industriell schwieriger herzustellen als andere Zuckeraustauschstoffe – dementsprechend sind die Produktionskosten wesentlich höher.
Die wichtigsten Eigenschaften von Erythritol sind:
Dichte: 1,45 g/ml
Löslichkeit: 100 g/l
pH-Wert: neutral
60 bis 70 Prozent der Süßkraft von Zucker
stabil in saurer und in basischer Umgebung
hitzestabil
besitzt nahezu keine Kalorien, nur circa 0,2 kcal/g, dies entspricht 5 Prozent des kalorischen Werts von Zucker
Orale Bakterien können Erythritol nicht metabolisieren, das heißt, es ist nicht kariogen, sondern zahnfreundlich [De Cock et al., 2016]. Der glykämische Faktor ist 0. Erythritol ist folglich für Diabetiker geeignet, da es den Glukose-Wert im Blutplasma und den Insulinspiegel nicht anhebt. Im Gegensatz zu anderen Polyolen wird Erythritol fast vollkommen (> 90 Prozent) im Dünndarm aufgenommen, nicht metabolisiert und unverändert über den Urin wieder ausgeschieden. Kleine Mengen können im Stuhl gefunden werden. Deshalb treten Nebenwirkungen wie Blähungen und Durchfall bei Erythritol seltener und in geringerer Intensität auf als bei den anderen Zuckeralkoholen. Erythritol ist ein Antioxidans und wirkt als Radikalfänger.
Erythritol ist sicher. Es ist in mehr als 60 Ländern uneingeschränkt zugelassen (Europa, USA, Japan, Kanada, Australien, Neuseeland, Russland und vielen Ländern im asiatischen Raum).
Erythritol in der präventiven Zahnmedizin
Über viele Jahre galten Sorbitol und vor allem Xylitol als Goldstandard der Zuckeralkohole für die präventive Anwendung in der Zahnheilkunde [Mäkinen, 1972; Mäkinen et al., 2008; Mäkinen et al., 1995 a; Mäkinen et al., 1995 b; Mäkinen et al., 1996 a; Mäkinen et al., 1996 b]. Die bereits beschriebenen Vorteile von Erythritol gegenüber anderen Zuckeralkoholen waren Auslöser für viele wissenschaftliche Arbeiten zum Einsatz von Erythritol in der präventiven Zahnmedizin. Die neueste Literatur zeigt das große Potenzial von Erythritol [Regnat et al., 2018; Falony et al., 2016; Janus et al., 2017; Hashino et al., 2013; Hägi et al.,2013; De Cock et al., 2016].
Erythritol und Biofilm
Der Einfluss von Erythritol auf das Wachstum von Biofilm und Einzelbakterien, vor allem von Streptokokkus mutans im Speichel und im Biofilm, ist bekannt und wurde in der Literatur vielfach beschrieben [Regnat et al., 2018; Falony et al., 2016; Janus et al., 2017; Hashino et al., 2013; De Cock et al., 2016; Mäkinen et al., 2001; Mäkinen et al., 2005; Söderling et al., 2010; Park et al., 2014; Honkala et al., 2014]. Die Auswertung der Literatur beim Vergleich von Xylitol, Erythritol und Sorbitol auf das Biofilmwachstum, den Bakterienlevel im Speichel und im Biofilm lässt sich wie folgt zusammenfassen:
Alle drei Polyole zeigen eine signifikante Reduktion des Biofilmgewichts (Biofilmdicke) wie auch eine Reduktion der S. mutans in der Plaque und im Speichel.
Die besten Ergebnisse wurden in der Erythritol-Gruppe erreicht.
Diese Ergebnisse werden auf die geringste Löslichkeit (längere Retention) und das geringste Molekulargewicht von Erythritol in der Gruppe der Polyole und der damit verbundenen leichteren Durchdringung der Zellmembran zurückgeführt [Munro et al., 1998]. Auch scheint Xylitol eher das Biofilmwachstum unspezifisch zu hemmen, wohingegen das Wachstum von S. mutans durch Erythritol spezifisch gehemmt wird.
Erythritol verringert auch die Adhäsion der Plaque für einige Polysaccharid-bildende Streptokokken (S. mutans, S. sanguinis, S. salivarius, S. sobrinus) [Regnat et al., 2018; Falony et al., 2016; Hashino et al., 2013; Mäkinen et al., 2002].
Hashino et al. versuchten mit ihrer Arbeit von 2013 [Hashino et al., 2013], eine große Lücke im Wissen um Zuckeralkohole und deren Einfluss auf orale Biofilme zu schließen. Ausgehend davon, dass Streptokokkus gordonii ein wichtiger Frühbesiedler von Biofilmen (verantwortlich für die Adhäsion der Biofilme) und dass Porphyromonas gingivalis als Spätbesiedler der Leitkeim für die Entstehung und Unterhaltung der Parodontitis ist, haben Hashino et al. den Einfluss von Zuckeralkoholen auf die Mikrostruktur und den Stoffwechsel eines aus S. gordonii und P. gingalis zusammengesetzten Biofilms untersucht. Die Ergebnisse dieser Arbeit sind:
Die größte Hemmung des Wachstums von S. gordonii und P. gingivalis wurde mit Erythritol, gefolgt von Xylitol und Sorbitol erreicht.
Die metabolischen Profile von Erythritol bezogen auf S. gordonii und P. gingivalis zeigen eine dosisabhängige Reduktion der Keime und der extrazellulären Matrix.
Der direkte Zell-Einfluss von Erythritol und Sorbitol auf P. gingivalis zeigt, dass Erythritol das Wachstum von P. gingivalis hemmt und Sorbitol das Wachstum fördert.
Zusammengefasst zeigt die Arbeit, dass Erythritol über verschiedene biologische Wege (Unterdrückung von Wachstum infolge von DNA- und RNA-Depletion, abgeschwächter extrazellulärer Matrixproduktion und Veränderungen der Dipeptid-Beschaffung und des Aminosäurestoffwechsels) einen hemmenden Effekt sowohl auf S. gordonii und P. gingivalis im Biofilmwachstum hat.
Erythritol und Karies
Xylitol hat sich seit Langem als kariesvorbeugend erwiesen, insbesondere zeigten sich die Vorteile beim Kauen von Xylitol-Kaugummis [Mäkinen et al., 2008; Mäkinen et al., 1995a; Mäkinen et al., 1995b; Mäkinen et al., 1996a; Mäkinen et al., 1996b]. Obwohl der nichtkariogene Effekt von Erythritol seit 1992 bekannt war [Kawanabe et al.,1992], dauerte es 13 Jahre, bis die erste Arbeit zu Erythritol und Karies veröffentlicht wurde [Mäkinen et al., 2005]. Jugendliche, die im Durchschnitt 17 Jahre alt waren, verwendeten für sechs Monate Lutsch-Bonbons und Zahnpasten, die Xylitol, Erythritol oder Sorbitol enthielten (Tagesdosis 7 g, einschließlich 0,5 g aus der Zahnpasta). Ergebnis: Sowohl das Gewicht der Plaque als auch die Anzahl der S. mutans in der Plaque und im Speichel wurden in der Xylitol- und in der Erythritol-Gruppe signifikant reduziert. Die Werte für das Plaque-Gewicht waren in der Erythritol-Gruppe signifikant geringer als in der Sorbitol- und in der Xylitol-Gruppe.
2014 wurde eine weitere Studie zum Effekt von Erythritol im Vergleich zu Xylitol und Sorbitol veröffentlicht [Honkala et al., 2014]. Diese doppelverblindete, randomisierte, kontrollierte, prospektive klinische Studie wurde über drei Jahre bei Kindern einer Grundschule (Wechselgebiss) durchgeführt. Die Tagesdosis der Zuckeralkohole betrug 7,5 g pro Tag. Ergebnis:
Die Anzahl an Dentin- und Schmelz-Karies war in der Erythritol-Gruppe signifikant geringer.
Die Zeitspanne, bis sich Dentin- oder Schmelzkaries entwickelte, war in der Erythritol-Gruppe signifikant größer.
Der Karies-Score (altersmodifizierter DMF-T-, dmf-t-, DMF-S-, dmf-s-Wert) war in der Erythritol-Gruppe am geringsten.
Falony et al. publizierten im Jahr 2016 eine Nachfolgestudie zu Honkala et al. [2014]. Diese Studie bestätigte die Ergebnisse in allen Punkten [Falony et al., 2016].
Weitere Studien wie die von Runnel [Runnel et al., 2013], Mäkinen [Mäkinen, 2010], Söderling [Söderling et al., 2010], Ghezelbash [Ghezelbash, 2012], White [White et al., 2015], Saran [Saran et al., 2015] und Park [Park et al., 2014] zeigten ähnliche Ergebnisse. Es kann festgestellt werden, dass Erythritol aktuell Xylitol als Goldstandard in der Kariesprävention abgelöst hat.
Erythritol und Gingivitis/Parodontitis
Zuckeralkohole haben direkte kariespräventive Effekte und sie beeinträchtigen die oralen Biofilme. Naheliegend ist, dass sie auch Auswirkungen auf die Entwicklung von Gingivitis und Parodontitis haben. Der Frage nach dem Einfluss von Erythritol auf die Mikrobiologie des Biofilms bei Gingivitis ist die Forscher-Gruppe Janus et al. nachgegangen [Janus et al., 2017]. Das Ziel der Studie war es, die Wirkung von Erythritol auf die Gingivitisentstehung und -progression zu eruieren. Die Ergebnisse zeigen, dass Biofilme in Anwesenheit von Erythritol in Richtung einer weniger pathogenen Zusammensetzung reifen und das Biofilmwachstum insgesamt reduziert wird. Daher wird in der Arbeit der Schluss gezogen, dass Erythritol zu einem gesunden oralen Ökosystem beitragen kann. Dies ist wichtig, da eine unbehandelte Gingivitis zu einer Parodontitis führen kann. Wie oben gezeigt, kann Erythritol die Entwicklung von P. gingivalis, einer der wichtigsten Keime bei der Entstehung und Progression der Parodontitis, auf verschiedenen biochemischen Wegen hemmen [Hashino et al., 2013].
Erythritol in der professionellen Prophylaxe
Neben dem Einsatz als Zuckeraustauschstoff in Nahrungsmitteln und zur häuslichen Kariesprävention hat Erythritol auch in der professionellen Prophylaxe Anwendung gefunden. Im Jahr 2011 führte die Firma EMS ein Airpolishing-Pulver auf Erythritol-Basis ein. Neben Pulvern auf Glycin- und Trehalose-Basis gehört Erythritol zu den niedrig abrasiven Airpolishing-Pulvern, die sowohl supra- als auch subgingival angewendet werden können. Die Literatur zur Airpolishing-Technologie mit gering abrasiven Pulvern beim Biofilmmanagement gegenüber Hand- und Ultraschallinstrumenten zeigt die Vorteile dieser neuen Technologie eindrücklich [Hägi et al., 2013; Steinmann et al., 2003; Tunkel et al., 2003; Hetzel et al., 2007; Arushanov et al., 2012; Décaillet et al., 2010; Hofmänner et al., 2015].
So konnte gezeigt werden, dass Airpolishing mit niedrig abrasiven Pulvern mehr Bakterien reduziert als dies mit Hand- und Ultraschallinstrumenten möglich ist [Steinmann et al., 2003; Tunkel et al., 2003; Hetzel et al., 2007; Arushanov et al., 2012; Décaillet et al., 2010; Hofmänner et al., 2015; Wennström et al., 2011; Trtic et al., 2016; Hägi et al., 2015; Bühler et al., 2015]. Auch supragingivale Beläge und Verfärbungen können besser und schneller entfernt werden als durch klassische Politur mit rotierenden Instrumenten, Polierbürsten, Gummikelchen und Polierpasten [Bühler et al., 2015; Camboni et al., 2016; Haas et al., 2019; Bastendorf-Strafela et al., 2016].
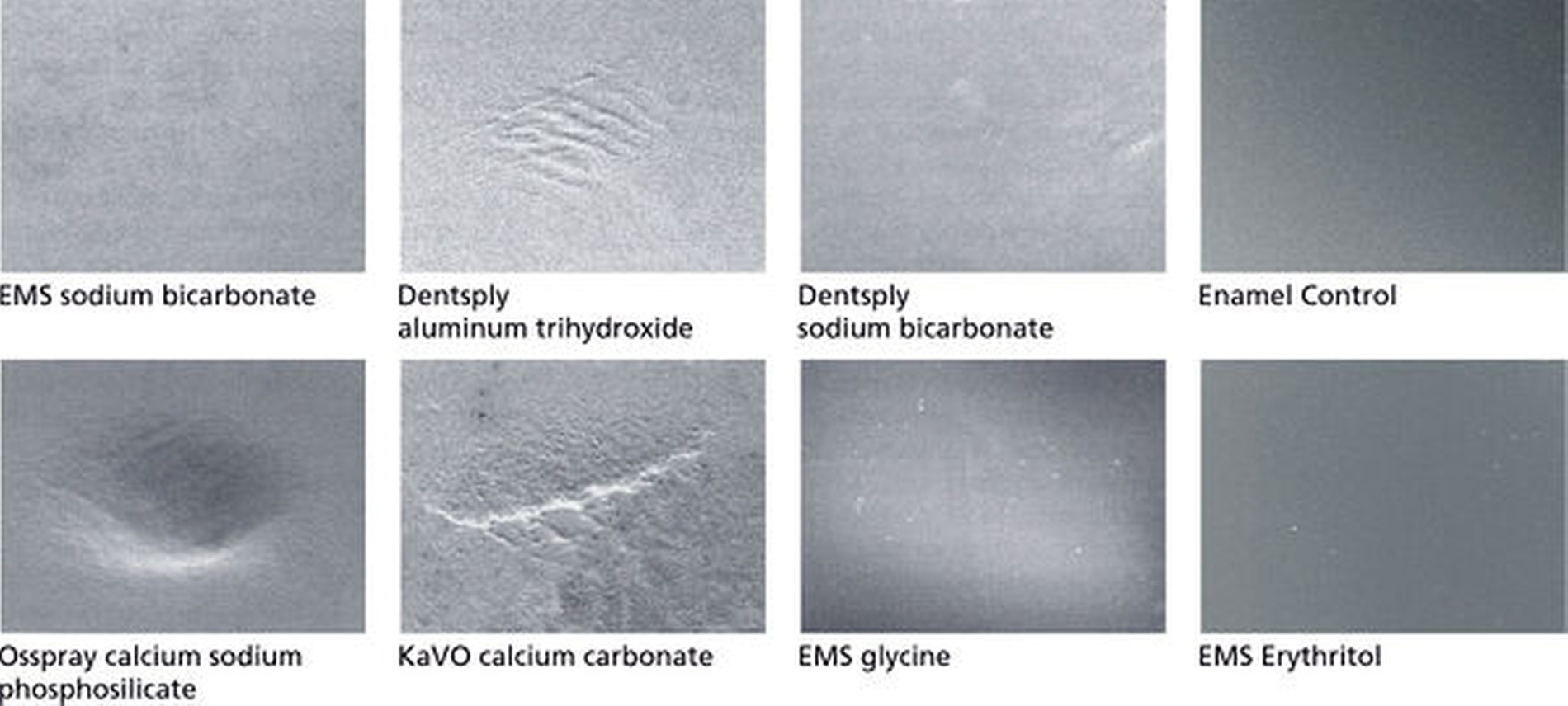
Neben der Reinigungsleistung (Effektivität) steht heute auch die Substanzschonung im Vordergrund. Dabei führt Airpolishing mit Erythritol nicht zu Irritationen der Gingiva [Petersilka et al., 2018]. Die Arbeiten von Barnes und die von ihr auf internationalen Vorträgen gezeigten Bilder [Barnes et al., 2014; Barnes, 2016] zeigen eindrücklich, dass nur gering-abrasive Pulver auf Schmelzoberflächen und Kompositfüllungen ohne Veränderung der Oberflächenstruktur angewendet werden können (Abbildung 2). Auf Glasionomeroberflächen führte nur die Anwendung von Erythritol-Pulver zu keinen Oberflächenveränderungen. Auch auf Milchzahnschmelz kam es beim Einsatz von Erythritol-basiertem Pulver ebenfalls zu fast keinen Oberflächenveränderungen [Reimann et al, 2015]. Subgingivales und supragingivales Biofilmmanagement zeigen nicht nur auf Schmelz und Dentin, sondern auch auf Wurzelzement und Implantaten den geringsten Substanzverlust bei gleichzeitig niedrigsten Oberflächenrauigkeiten [Hofmänner et al., 2015; Hägi et al., 2015; Bühler et al., 2015; Camboni et al., 2016; Haas et al., 2019; Bozbay et al., 2016; Hägi et al., 2015]. Die Arbeit von Petersilka et al. zeigte im Vergleich zu Handinstrumenten und Ultraschallscalern die geringsten Veränderungen an der Gingiva [Petersilka et al., 2018].
Vergleicht man Glycin-Pulver mit Erythritol-Pulver, so liegen die Vorteile beim Erythritol. Es ist ein leichtes Pulver (Korngröße circa 14 µm, geringe Abrasivität), mit ausreichender Härte für eine gute Reinigungsleistung supra- und subgingival, das sicher in der Anwendung auf Zahnhartsubstanzen und an Schleimhäuten ist und neben den mechanischen Effekten sowohl den Biofilm wie auch einzelne Keime (S. mutans, S. gordonii) auf biochemischem Weg hemmt. [Janus et al., 2017; Drago et al., 2014].
Fazit
Der Zuckeraustauschstoff Erythritol bietet zahlreiche Vorteile für die Allgemein- und die Mundgesundheit. Als Alternative zum Zucker ermöglicht Erythritol eine Reduzierung der Kalorienaufnahme, was wichtig ist, um die Adipositas und deren Folgeerkrankungen zu kontrollieren. Für die häusliche Kariesprophylaxe wird Erythritol unter anderem in Lutschtabletten, Kaugummis, Zahnpasten, Mundspüllösungen angewendet – hier bietet das süße Pulver gleich zwei Vorteile: Es ist nicht kariogen und hemmt darüber hinaus die Entwicklung kariogener und parodontalpathologischer Keime in den oralen Biofilmen. Bei routinemäßiger häuslicher, präventiver Anwendung von Erythritol kann die Karieslast und damit auch der entsprechende zahnärztliche Behandlungsbedarf verringert werden. Die Literatur zeigt, dass Erythritol den anderen Zuckeralkoholen überlegen ist.
Auch als unterstützende Maßnahme zur Eindämmung der Erkrankungsprogression sowohl bei Gingivitis wie auch bei Parodontitis zeigt Erythritol bessere Ergebnisse als andere Zuckeralkohole. Das Potenzial von Erythritol in der häuslichen Prophylaxe – beispielsweise in Zahnpasten, Kaugummis, Schokolade oder Bonbons – dürfte bei Weitem noch nicht ausgeschöpft sein.
Schlussendlich ermöglicht Erythritol beim Einsatz in der Airpolishing-Technologie einen breiten klinischen Anwendungsbereich und bietet Vorteile gegenüber allen anderen Pulvern – es gibt gute Gründe dafür, es dort bereits heute als Goldstandard zu betrachten.
Literaturliste
1. Regnat K, Mach RL., Mach-Aigner AR: Erythritol as sweetener-wherefrom and where to? Aplied Microbiology and Biotechnology 2018; 102:587-595
2. Falony G, Honkala S, Runnel R, Olak J, Nõmmela R, Russak S, Saag M, Mäkinen PL, Mäkinen K, Vahlberg T, Honkala E:
Long-Term Effect of ErythritolL on DentalL Caries Development During Childhood: A Post Treatment Survival Analysis. Caries Res 2016; 50:579–588
3. Janus MM, Volgenant CMC, Brandt BM, BuijsBJF, Keijser, Crielaard W, Zaura E, Krom BP: Effect of erythritol on microbial ecology of in vitro gingivitis biofilms. Journal of Oral Microbiology 2017;9 (1),1337477,
DOI: 10.1080/20002297.2017.1337477
4. Hashino E, Kuboniwa M, Alghamdi SA, Yamaguchi M, Yamamato R, Cho H, Amano A: Erytrhritol alters microstructure and metabolomic profiles of biofilm composed of Streptococcus gordonii and Porphyromonas gingivalis. Molecular oral microbiology 2013; 28: 435-451
5. Hägi TT, Hofmänner P, Salvi GE, Ramseier CA, Sculean A: Clinical outcomes following subgingival application of a novel erythritol powder by means of air polishing in supportive periodontal therapy: a randomized, controlled clinical study. Quintessence International 2013; 44 (10):753–761
6. Gustafsson BE, Quensel CE, Lanke LS, Lundqvist C, Grahnen H, Bonow BE, Krasse B: The Vipeholm dental caries study; the effect of different levels of carbohydrate intake on caries activity in 436 individuals observed for five years. Acta Odontologica Scandinavica 1954; 11 (3–4), 232–264.
7. De Cock P, Mäkinen K, Honkala E, Saag M, Kennepohl E, Eapen A: Erythritol is more effective than Xylitol and Sorbitol in managing oral health endpoints. International Journal of Dentistry 2016; article ID 9868421
8. Mäkinen K K (1972): Enzyme dynamics of a cariogenic streptococcus: the effect of xylitol and sorbitol. J Dent Res 51: 403 – 408
9. Mäkinen KK, Alanen P, Isokangas P, Isotupa K, Söderling E, Mäkinen PL, Wenhui W, Weijian W, Xiaochi C, Yi W, Boxue Z (2008): Thirty-nine-month xylitol chewing-gum programme in initially 8-year-old school children: a feasibility study focusing on mutans streptococci and lactobacilli. Int Dent J 58: 41
10. Mäkinen KK, Bennett C A, Hujoel P P, Isokangas P J, Isotupa K P, Pape H R Jr, Mäkinen P L: Xylitol chewing gums and caries rates: a 40-month cohort study. J Dent Res 1995a; 74: 1904 – 1913
11. Mäkinen KK, Mäkinen PL, Pape HR Jr, Allen P, Bennett CA, Isokangas PJ, Isotupa KP Stabilisation of rampant caries: polyol gums and arrest of dentine caries in two long-term cohort studies in young subjects. Int Dent J 1995b; 45: 93 – 107
12. Mäkinen KK, Hujoel P P, Bennett C A, isotupa K P, Mäkinen PL, Allen P (1996a): Polyol chewing gums and caries rates in primary dentition: a 24-month cohort study. Caries Res 1996a; 30: 408 – 417
13. Mäkinen KK, Mäkinen PL, Pape HR Jr., Peldyak J, Hujoel P, Isotupa KP, Söderling EM, Isokangas P J, Allen P, Bennett C (1996b): Conclusion and review of the Michigan Xylitol Programme (1986 - 1995) for the prevention of dental caries. Int Dent J 1996b; 46: 22 – 34
14. Mäkinen KK, Isotupa KP, Kivilompolo T, Mäkinen P L, Toivanen J, Söderling EM: Comparison of erythritol and xylitol saliva stimulants in the control of dental plaque and mutans streptococci. Caries Research 2001; 35 (2):129–135,
15. Mäkinen KK, Saag M, Isotupa KP: Similarity of the effects of erythritol and xylitol on some risk factors of dental caries. Caries Research 2005; 39 (3): 207–215
16. Söderling EM, Hietala-Lenkkeri AM: Xylitol and erythritol decrease adherence of polysaccharide-producing oral streptococci. Current Microbiology 2010; 60 (1): 25–29
17. Park YN, Jeong SS, ZengJ: Anti-cariogenic effects of erythritol on growth and adhesion of Streptococcus mutans. Food Science and Biotechnology 2014; 23 (5): 1587–1591
18. Honkala S, Runnel R, Saag M, Olak J, Nömmela R, Russak S, Mäkinnen PL, Vahlberg T, Falony G, Mkinen K, Honkala E: Effect of Erythritol and Xylitol on Dental Caries Prevention in children. Caries Res 2014; 48:482-490
19. Munro IC, Berndt WO, Borzelleca JF, Flamm G, Lynch BS, Kennepohl E, Bär EA, Modderman J: Erythritol: an interpretive summary of biochemical, metabolic, toxicological and clinical data. Food Chem Toxicol1998; 36: 1139-1174
20. Mäkinen KK, Isotupa KP, Kivilompolo T: The effect of polyol-combinant saliva stimulants on S. mutans levels in plaque and saliva of patients with mental retardation. Special Care in Dentistry 2002; 22 (5): 187–193
21. Kawanabe J, Hirasawa M, Takeuchi T, Oda T, Ikeda T: Noncariogenicity of erythritol as a substrate. Caries Res 1992; 26 (5): 358-362
22. Runnel R, Mäkinen KK, Honkala S: Effect of three years consumption of erythritol, xylitol and sorbitol candies on various plaque and salivary caries-related variables. Journal of Dentistry 2013; 41 (12): 1236–1244
23. Mäkinen KK: Sugar alcohols, caries incidence, and remineralization of caries lesions: a literature review. International Journal of Dentistry 2010; Article ID981072
24. Söderling EM, Hietala-Lenkkeri AM: Xylitol and erythritol decrease adherence of polysaccharide-producing oral streptococci. Current Microbiology 2010; 60 (1): 25–29
25. Ghezelbash GR, Nahvi I, Rabbani M: Comparative inhibitory effect of xylitol and erythritol on the growth and biofilm formation of oral Streptococci. African Journal of Microbiology Research 2012; 6 (20): 4404–4408
26. White K, Le C, Cannon M: Inhibition of Streptococcus mutans and sobrinus by xylitol and erythritol (poster),” in Proceedings of the 93rd General Session of the International Association for Dental Research, Boston,Mass, USA, 2015.
27. Saran S, Mukherjee S, Dalal J, Saxena RK: High production of erythritol from Candida sorbosivorans SSE-24 and its inhibitory effect on biofilm formation of Streptococcus mutans. Bioresource Technology 2015;198: 31–38
28. Sculean A, Bastendorf K-D, Becker C, Bush B, Einwag J, Lanoway C, Platzer U, Schmage P, Schoeneich B, Walter C, Wennström JL, Flemmig TF: A paradigm shift in mechanical biofilm management? Subgingival air polishing: a new way to improve mechanical biofilm management in the dental practice. Quintessence International 2013; 44: 475-477
29. Schwarz F, Becker K, Bastendorf K-D, Cardaropoli D, Chatfield C, Dunn I, Fletcher P, Einwag J, Louropoulou A, Mombelli A, Ower P, Pavlovic P, Sahrmann P, Salvi G, Schmage P, Takeuchi Y, Van Der Weijden F, Renvert S: Recommendations on the clinical application of air polishing for the management of peri-implant mucositis and peri-implantitis. Quintessenz International, Peridontology 2015; doi: 10.3290/j.qi.a35132
30. Steinmann D, Häberlein I, Heinecke A, Flemmig TF (2003b): Subgingival plaque removal in buccal and lingual sites using a novel low abrasive air-polishing powder. Journal of Clinical Periodontology 2003; 30: 328-333.
31. Tunkel J, Barakos K, Heinecke A, Häberlin I, Flemmig TF (2003a): Subgingival plaque removal at interdental sites using a low abrasive air polishing powder. Journal of Periodontology 2003; 74: 307-311.
32. Hetzel M, Topoll H, Gerss J, Häberlein I, Petersilka GF: Subgingival debridement efficacy of glycine powder air-polishing. Journal of Periodontology 2007; 78: 1002-1010.
33. Arushanov D, Daubert D, Rothen M, Mueller G, Leroux BG: Randomized controlled trial assessing efficacy and safety of glycine powder air-polishing in moderate to deep periodontal pockets. Journal of Periodontology 2012; 83: 444-452.
34. Décaillet F, Andersen E, Mombelli A: Subgingival plaque removal using a new air-polishing device. Journal of Periodontology 2010, 81:79-88.
35. Hofmänner P, Eick S, Donnet M, Salvi G, Sculean A, Ramseier C: The effects of erythritol air-polishing powder on microbiological and clinical outcomes during supportive periodontal therapy. Six months results of a randomized controlled clinical trial. Quintessence Int 2015 ; 46 : 31-41
36. Wennström JL, Dahlen G, Ramberg P: Subgingival debridement of periodontal pockets by air polishing in comparison with ultrasonic instrumentation during maintenance therapy. J Clin Peridontol 2011; 38: 820-827
37. Trtic N, Bosnjak A, Arbutina R, Balk J: Efficacy of subgingival Air Polishing in patients with aggressive periodontitis. J Dent Med 2016; 20:149-154
38. Hägi TT, Klemensberger S, Bereiter R, Cosgarea R, Flury S, Lussi A, Sculean A, Eick S: The relative effects of Root-Debridement on Biofilm-Removal and Hard-Substance-Alterations using new in-vitro pocket model. Journal phone 2015; PLOS ONE/DOI:10.1371/0131056
39. Bühler J, Amato M, Weiger R, Walter C.: A systematic review on the effects of airpolishing devices on oral tissues. Int J Dent Hygiene 2015; DOI:10.111/idh.12120
40. Camboni S, Donnet M: Tooth surface comparison after Air Polishing and Rubber Cup: A Scanning Electron Microscopy Study. JClin Dent 2016; 27:13-18
41. Haas M, Koller M, Arefnia B: Rauheit und Substanzverlust von Zahnoberflächen nach Biofilmentfernung mit unterschiedlichen Bearbeitunggsverfahren. Die Assistentin 2018; 03: 22-27. Vortag CED-IADR 09. 2019 Madrid
42. Bastendorf-Strafela N, Bastendorf K.-D, Mann P.:
Kann die Qualität der Professionellen Zahnreinigung durch ein strenges Ablaufprotokoll (Guided Biofilm Therapy) mit Sichtbarmachen (Anfärben) des Biofilms verbessert werden? PlaqueNcare 2/2016
43. Petersilka G, Heckel R, Koch R, Ehmke B, Arweiler N: Evaluation of an ex vivo porcine model to investigate the effect of low abrasive airpolishing. Clinical Oral Investigations: doi.org/10.1007/s00784-018-2536-5 June 2018
44. Barnes,MC., Covey,D., Watanabe,H., Simetich,B., Schulte,J., Chen,H.: An in Vitro Comparison of the Effects of Various Air Polshing Powders on Enamel and Selected Esthetic Restorative Material. JClin Dent 2014; 25:76-87
45. Barnes MC: The Effects of Glycine and Erythritol Airpolishing Powders on enamel and select restorative materials. Vortrag Internationale DH-Tagung in Basel, Juni 2016
46. Bozbay E, Dominici F, Gokbuget AY, Cintan S, Guida L, Aydi MS, Mariotti A, Pilloni A: Preservation of root cementum: a comparative evaluation of power-driven versus hand instruments. Int J Dent Hygiene September 2016 DOI: 10.111/idh.12249
47. Hägi TT, Klemensberger S, Bereiter R, Nietzsche S, Cosgarea R, Flury S, Lussi A, Sculean A and Eick S: A Biofilm Pocket Model to evaluate different non-surgical periodontal treatment modalities in terms of Biofilm Removal and Reformation, Surface Alterations and Attachment of Periodontal Ligaments Fibroblasts. Journal.pone. 2015; June29, PLOS ONE/DOI:10.1371/0131056
48. Drago L, Del Fabbro M, Bortolin M Vassena C, De Vecchi E Taschieri S : Biofilm Removal and Antimicrobial Activity of Two Different Air-Polishing Powders. An in Vitro Study. Journal of Periodontology November 2014; 85/11: 363-369 (doi: 10.1902/jop.2014.140134)
49. Reimann S, Bourauel C.: Tests of effectivity (abrasion) of Air-Flow® powder applications used on dental hard tissue surfaces Air-Flow® powder Plus on milk teeth, 2015 Report to Dr. Wittmann GmbH & Co. KG