Fakultative Myiasis – der bewegte Wundgrund
Eine 93-jährige Frau stellte sich über die Notaufnahme in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Asklepios Klinik Nord-Heidberg in Hamburg vor. 2016 war bei ihr ein okzipitales Plattenepithelkarzinom mittels Tumorresektion sowie Defektdeckung durch ein Spalthautransplantat des rechten Oberschenkels behandelt worden. Weitere Nachsorgetermine in der ambulanten Tumorsprechstunde der Abteilung wurden von ihr nicht in Anspruch genommen.
Die Patientin litt unter einer demenziellen Erkrankung und lebte in einem Seniorenheim. Zu den weiteren Grunderkrankungen zählten koronare Herzkrankheit, LWS-Syndrom, Gonarthrose rechts, Angstattacken, Unterschenkelödeme beidseits sowie eine MRSA-Besiedlung des Nasenrachenbereichs. Die Hausmedikation umfasste Torasemid 10 mg sowie Tilidin 100/8 mg retard.
Wie uns die begleitende Betreuerin informierte, habe die Patientin seit einem halben Jahr einen Hauttumor im Bereich der rechten Schläfe, verweigere jedoch jegliche ärztliche Behandlung. Einmal pro Woche werde ein Verbandswechsel durchgeführt. Aktuell würde die Patientin über Schmerzen klagen und am Kopf manipulieren. Zusätzlich sei eine zunehmende Rötung und Schwellung der rechten Gesichtshälfte sowie eine Vigilanzminderung aufgetreten, woraufhin nun die Vorstellung in der Klinik erfolgt sei.
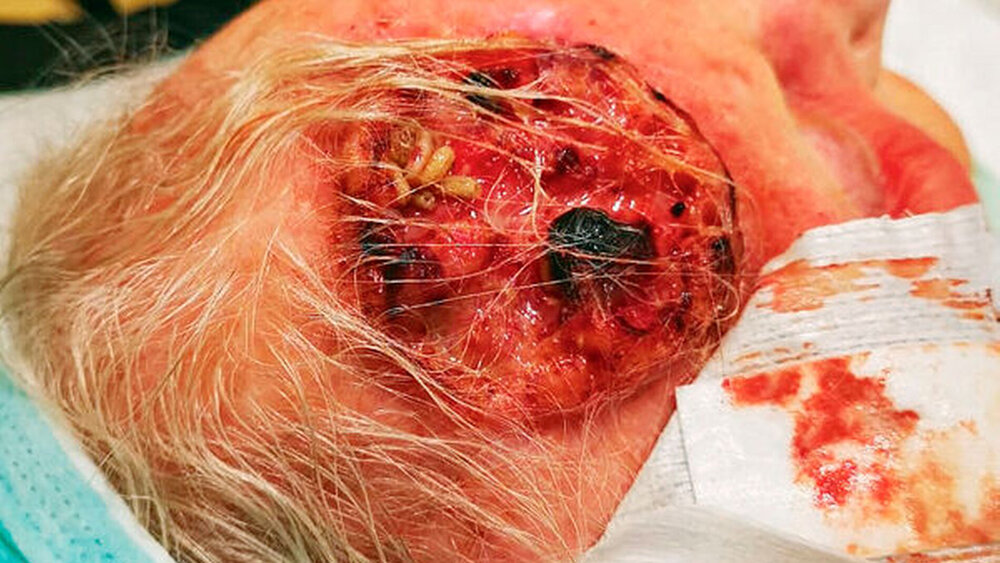
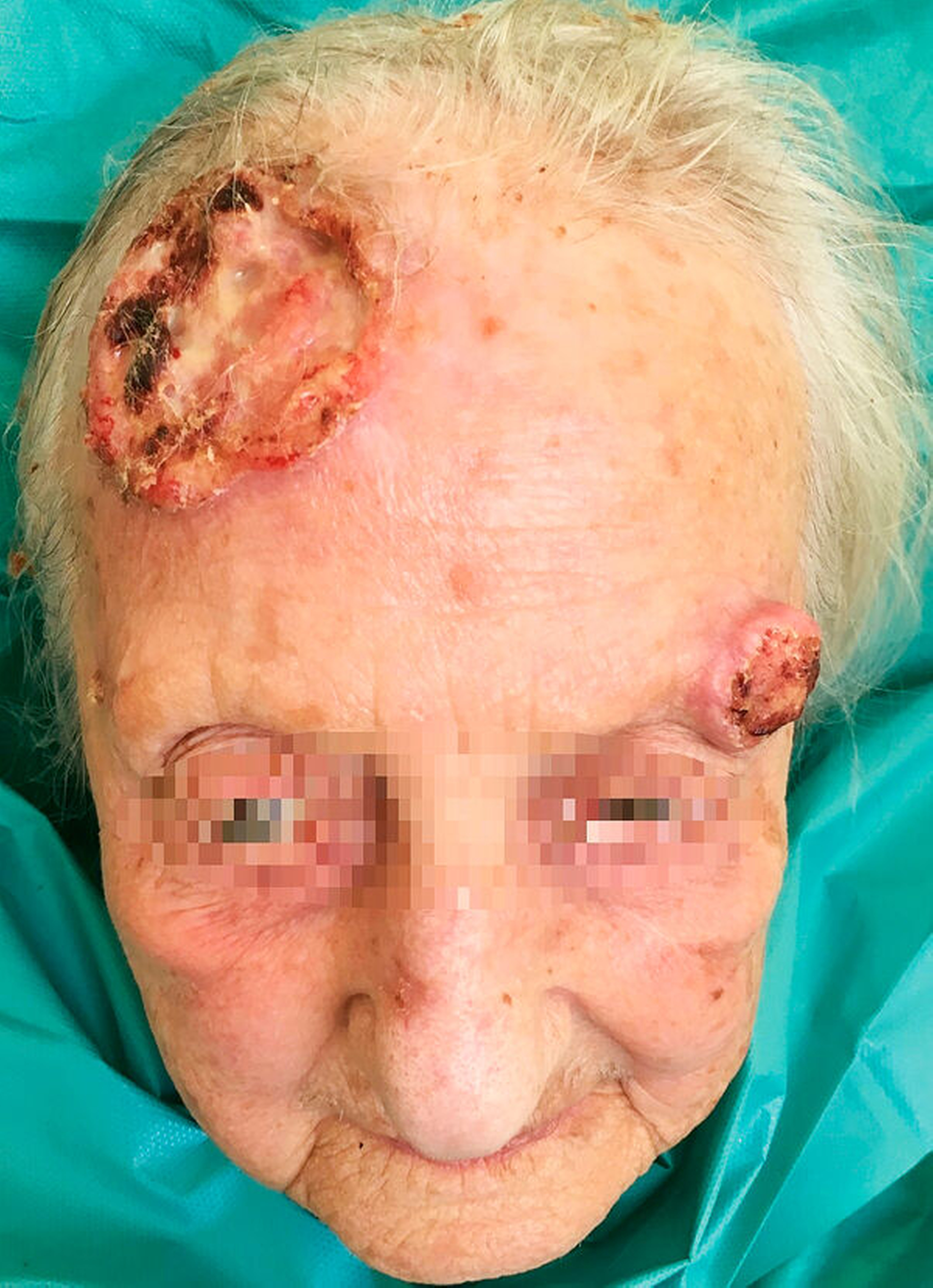
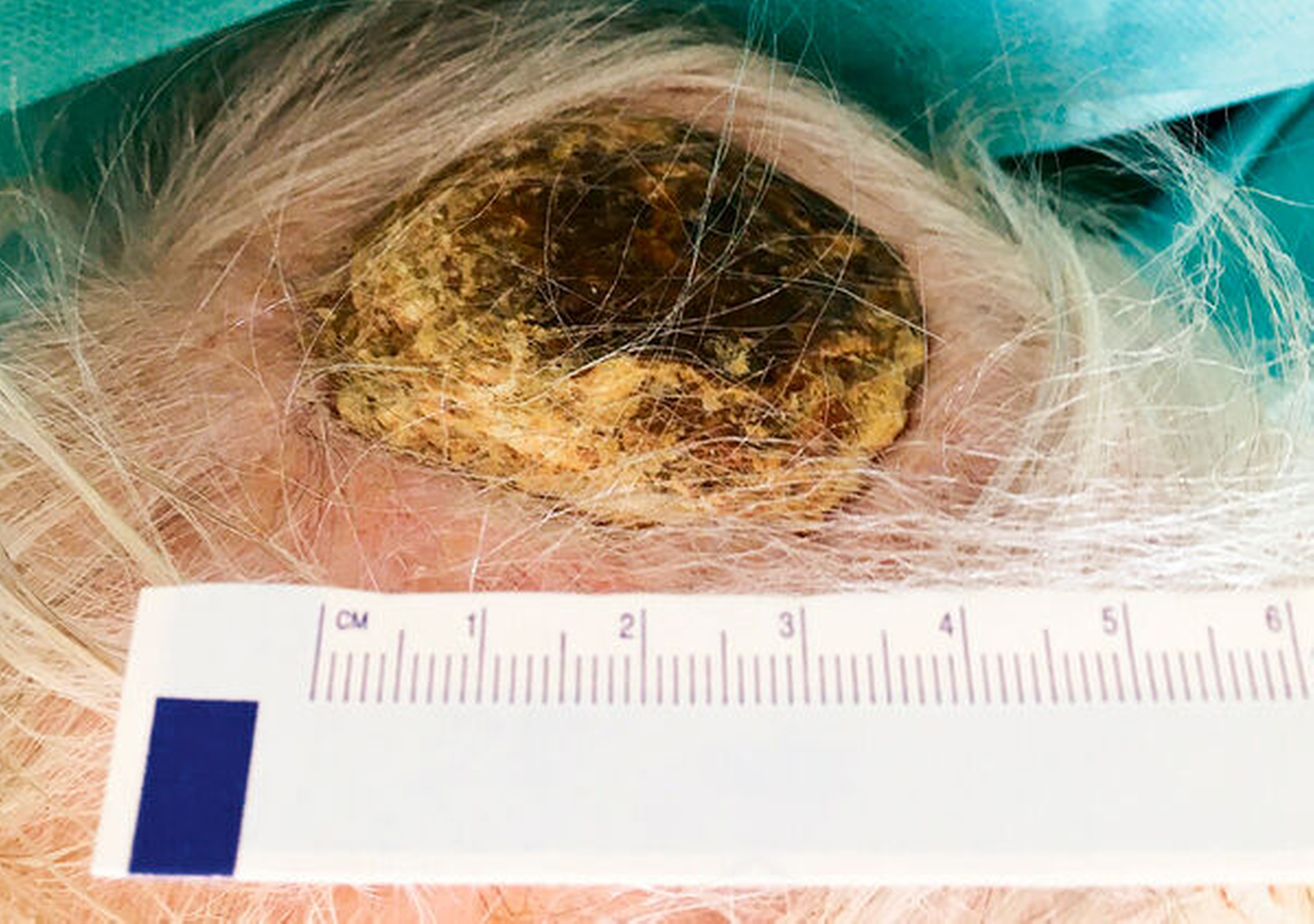
Bei der klinischen Untersuchung zeigte sich eine mobile Dame in reduziertem Ernährungs- und Allgemeinzustand. Die klinischen und laborchemischen Parameter wiesen auf eine Infektion hin (erhöhte Temperatur von 37,8 °C, CRP 49 mg/dl Leukozyten 15,4 Tsd./mikrol). Es fanden sich eine rechtsbetonte Gesichtsschwellung und Rötung ausgehend von einem 4,5 cm x 4,5 cm großen Ulcus frontal rechts (Abbildung 1). Temporal links stellte sich eine weitere karzinomsuspekte, ulcerierende und exophytische Hautläsion, 2 cm x 2 cm messend (Abbildung 2) dar. Okzipital zeigte sich eine weitere verkrustete Hautläsion, ungefähr 3 cm im Durchmesser (Abbildung 3). Aus der Läsion frontal rechts ließen sich dreizehn 11 mm lange, vitale Maden bergen (Abbildung 4).
Diese wurden in Hautantiseptikum (Schülke Desderman® pure) asserviert. Eine Analyse der Spezies wurde mithilfe der Abteilung für Rechtsmedizin des Universitätsklinikums Eppendorf in Hamburg sowie der Abteilung für Rechtsmedizin des Universitätsklinikums in Frankfurt durchgeführt und identifizierte die Schmeißfliegenart (Calliphoridae) Goldfliege (Lucilia sericata). Die ältesten Tiere befanden sich im Larvenstadium 3. Von einer Durchschnittstemperatur von 34 °C ausgehend, entsprach dies einer Besiedlung zwei Tage zuvor.
Die Computertomografie des Viszero- und des Neurokraniums ergab keinen Anhalt einer knöchernen Infiltration, jedoch infraaurikulär rechts zwei metastasensuspekte Lymphknoten. Eine neu aufgetretene, knöcherne Arrosion im Bereich des okzipitalen Defekts konnte nicht ausgeschlossen werden.
Somit ergaben sich folgende Diagnosen:
V. a. Plattenepithelkarzinom der Haut, frontal rechts und temporal links
V. a. Lymphknotenmetastasen infraaurikulär rechts
Fakultative Myiasis frontal rechts
Gesichtsphlegmone
Aufgrund des fortgeschrittenen Alters der Patientin und der Ablehnung jeglicher chirurgischer Interventionen wurde in Absprache mit den Angehörigen die Entscheidung zu einer rein symptomatischen Therapie getroffen und – aufgrund fehlender Konsequenz – auf eine Probeentnahme zwecks histopathologischer Diagnosesicherung der Läsionen verzichtet. Die Einleitung einer intravenösen antibiotischen und analgetischen Therapie mit Ceftriaxon und Metamizol sowie einer leichten Sedierung mit Midazolam war bereits in der Notaufnahme erfolgt. Des Weiteren wurden die Maden mit einer Pinzette entfernt, die Ulcera mit Wundantiseptikum (Schülke Octenisept®) gereinigt und mit Jodoformsalbe-Kompressen abgedeckt.
Unter dieser Therapie waren Schmerz und Entzündungssymptomatik schnell rückläufig, so dass die Patientin zeitnah wieder in die ambulante Behandlung überführt werden konnte. Der tägliche Verbandswechsel sowie eine mindestens wöchentliche ärztliche Kontrolle in der Betreuungseinrichtung wurden angeregt und organisiert. Die Angehörigen und die Patientin wünschten keine weitere Therapie. Eine erneute, geplante Vorstellung zur Verlaufskontrolle in unserer Ambulanz wurde nicht wahrgenommen.
Diskussion
Der Begriff Myiasis beschreibt die Besiedlung lebender Organismen und Vertebraten mit Fliegenlarven, die sich von nekrotischem oder vitalem Gewebe des Wirts ernähren [Bernhardt et al., 2019]. Bisher wurden rund 80 Dipteren-Spezies ermittelt, die auch den Menschen befallen. Ungefähr die Hälfte dieser Spezies zählt zu den Schmeiß- und Goldfliegen (Calliphoridae) sowie zu den Fleischfliegen (Sarcophagidae), die restlichen zu den Stuben-, Stech- und Latrinenfliegen (Muscidae), Magenfliegen (Gasterophilidae) und Dasselfliegen (Oestridae) [Beck et Pantchev, 2010].
Nach Lokalisation und Klinik können fünf verschiedene Formen der Myiasis unterschieden werden: Haut-, Kavitar-, Intestinal-, Urogenital- und Wundmyiasis. Darüber hinaus kann zwischen obligatorisch in der Haut des Menschen parasitierenden Fliegenlarven (zum Beispiel Cordylobia anthropophaga, Dermatobia hominis) und den Erregern der Haut- und Wundmyiasis unterschieden werden, letztere Form wird auch als „fakultative Myiasis“ bezeichnet [Beck et Pantchev, 2010]. Die ICD-10-Klassifikation der WHO fasst die Myiasis unter dem Code B87 zusammen, insgesamt werden sieben verschiedene Unterformen voneinander abgegrenzt: Dermatomyiasis, Wundmyiasis, Ophthalmomyiasis, nasopharyngeale Myiasis, Otomyiasis, „sonstige Lokalisationen“ und „nicht näher bezeichnet“ [DIMDI. ICD-10-WHO Version, 2019].
Bei der Myiasis handelt es sich um eine bisher in Deutschland seltene Erkrankung, die vorwiegend Patienten höheren Alters betrifft. Laut Bernhardt et al. wurden in Deutschland vom statistischen Bundesamt von 2000 bis 2016 insgesamt 230 Fälle erfasst, was ungefähr 13 Fällen pro Jahr entspricht. Zwischen 2003 und 2011 wurden elf Fälle in Pflege- und Rehabilitationseinrichtungen dokumentiert [Bernhardt et al., 2019].
Die Myiasis wird hierzulande meist aus subtropischen Regionen importiert, autochthone Myiasen treten eher selten auf, häufig handelt es sich – wie im vorliegenden Fall – um die sogenannte Wundmyiasis: Fliegenweibchen werden durch den Geruch unversorgter und putrider Wunden angelockt, legen ihre Eier in die nekrotischen Hautläsionen, in denen die Larven heranwachsen. Die auch im vorliegenden Fall ursächliche Spezies Lucilia sericata zählt mit zu den häufigsten Verursachern der Erkrankung. Die Erstlarven schlüpfen temperaturabhängig nach acht Stunden bis drei Tagen im Anschluss an die Eiablage, dringen in die Haut ein und ernähren sich von totem und lebendigem Gewebe sowie den Körperflüssigkeiten des Wirts [Beck et Pantchev, 2010].
Der parasitäre Madenbefall zählt zu den unerfreulichsten Komplikationen bei Tumorpatienten [Sesterhenn et al., 2009]. Die Risikofaktoren sind zahlreich – hierzu zählen offene Wunden wie Ulcus cruris [Anegg et al., 1990], Hauterkrankungen wie Psoriasis, das seborrhoische Ekzem oder Dekubitusläsionen [Bernhardt et al., 2019] sowie diskoider Lupus erythematodes [Bhari et al., 2016]. Besonders häufig werden humane Myiasen in tropischen Klimazonen beobachtet [Beck et Pantchev, 2010]. Die vermehrte Exposition durch die Ausübung eines landwirtschaftlichen Berufs kann ein erhöhtes Risiko für die Erkrankung mit sich bringen [Carvalho et al., 2008]. Als Risikofaktoren im Fall des intraoralen Befalls werden eine schlechte Mundhygiene [Darshiyani et al., 2012], Halitosis und ein insuffizienter Lippenschluss [Filho et al., 2018] sowie Sondenkost über mehrere Jahre [Bhansali et al., 2018] genannt.
Schmerz, Blutung und Infektionen sind mögliche Symptome der Myiasis [Wollina, 2015]. „Pulsieren“ und Bewegungsempfinden sind möglich [Carvalho et al., 2008]. Auch Juckreiz wird beschrieben [Kleine et al., 2014].
Die Diagnosestellung einer Myiasis erfolgt klinisch durch den Behandler und zuvor möglicherweise durch die Angehörigen [Filho et al., 2018], wie im hier vorliegenden Fall. Als diagnostische Ergänzung zur Erfassung des Ausmaßes und der genauen Lokalisation der Besiedlung wird die Magnetresonanztomografie [Yeung et al. 2010] oder die Sonografie [Richter et al. 2008] empfohlen.
Die Behandlung der extra- und intra-oralen Myiasis ist nicht standardisiert [Wollina et al., 2010; Al-Maweri et al., 2015]. Sie sollte die vollständige, mechanische Entfernung der Maden, die Desinfektion der Wunde sowie das Anlegen eines Wundverbands [Wollina et al., 2015] einschließen. Die Applikation von Terpentin-Öl, antihelmintische, antibiotische und analgetische Therapien stellen ergänzende Optionen dar.
Die Verlaufskontrolle kann – wie im vorliegenden Fall – mehrere Tage umfassen [Darshiyani et al., 2012]. Ein Wunddebridement sowie eine Nekrosektomie und Spülungen mit Chlorhexidingluconat 0,2 Prozent können im Fall einer intraoralen Manifestation durchgeführt werden [Biradar et al., 2015]. Die Resektion des Hauttumors, auch wenn im vorliegenden Fall nicht erfolgt, und somit die Behandlung der ursächlichen Grunderkrankung ist ein weiterer wichtiger Aspekt der Therapie [Gupta et al., 2009]. Die Prävention hat ebenso einen hohen Stellenwert.
Patienten mit chronischen Hautläsionen sollten nicht zuletzt im Urlaub dazu ermutigt werden, die betroffenen Stellen abzudecken und so vor Sonneneinstrahlung und Insektenbefall zu schützen [Kleine et al., 2014]. Bei der ambulanten und stationären Pflege von Patienten sollten Hygienerichtlinien etabliert werden, inklusive Maßnahmen zum Schutz vor Insekten [Werminghaus et al., 2008].
Die Fliegen und ihre Larven weisen ein breites Spektrum an Bakterien auf [Sesterhenn et al., 2009; Bernhardt et al., 2019]. Bakterielle Sekundärinfektionen machen – wie im vorliegenden Fall – wiederum eine zusätzliche Therapie erforderlich [Kamal et al., 2012; Bhari et al., 2016].
Dr. Johanna Wrede
Assistenzärztin
Asklepios Klinik Nord-Heidberg, Klinik für Mund-, Kiefer- und Gesichtschirurgie
Tangstedter Landstr. 400, 22417 Hamburg
j.wrede@asklepios.com
Dr. Dr. Niels Liebehenschel
Leitender Oberarzt
Asklepios Klinik Nord-Heidberg, Klinik für Mund-, Kiefer- und Gesichtschirurgie
Tangstedter Landstr. 400, 22417 Hamburg
Dipl.-Biol. Oliver Krebs
Universitätsklinikum Hamburg-Eppendorf, DiagnostikzentrumInstitut für Rechtsmedizin, Forensische Molekulargenetik und Anthropologie
Butenfeld 34, 22529 Hamburg
Lena Lutz M.Sc.
Universitätsklinikum Frankfurt am Main,Institut für Rechtsmedizin, Forensische Entomologie
Kennedyallee 104, 60596 Frankfurt/Main
Dr. Evgeny Barsukov
Oberarzt
Asklepios Klinik Nord-Heidberg, Klinik für Mund-, Kiefer- und Gesichtschirurgie
Tangstedter Landstr. 400, 22417 Hamburg
PD Dr. Jens Amendt
Universitätsklinikum Frankfurt am Main,Institut für Rechtsmedizin, Forensische Entomologie
Kennedyallee 104, 60596 Frankfurt/Main
Prof. Dr. Dr. Thomas Kreusch
Chefarzt
Asklepios Klinik Nord-Heidberg, Klinik für Mund-, Kiefer- und Gesichtschirurgie
Tangstedter Landstr. 400, 22417 Hamburg
PD Dr. Dr. Henning Hanken
Chefarzt
Asklepios Klinik Nord-Heidberg, Klinik für Mund-, Kiefer- und Gesichtschirurgie
Tangstedter Landstr. 400, 22417 Hamburg
Literaturlisteliste
1. Al-Maweri SA, Al-Sufyani GA, Tarakji B, Abdulrab S. Myiasis Associated with Oral Squamous Cell Carcinoma--A Literature Review. Asian Pac J Cancer Prev. 2015;16(12):4997–9. doi:10.7314/apjcp.2015.16.12.4997
2. Amendt, J; Krettek, R: Nießen; G, Zehner; R (2013) Forensische Entomologie: Ein Handbuch. Verlag für Polizeiwissenschaft. ISBN: 978-3935979467
3. Anegg B, Auer H, Diem E, Aspöck H. Wundmyiasis. Fakultative Myiasis [Wound myiasis. Facultative myiasis]. Hautarzt. 1990;41(8):461–3. ger.
4. Beck W, Pantchev N. Parasitäre Zoonosen: Bild-Text-Atlas: Schlütersche Verlagsgesellschaft mbH & Co. KG; 2010 [cited 2019 Sep 1].
5. Bernhardt V, Finkelmeier F, Verhoff MA, Amendt J. Myiasis in humans-a global case report evaluation and literature analysis. Parasitol Res. 2019;118(2):389–97. doi:10.1007/s00436-018-6145-7
6. Bhansali SP, Tiwari AD, Gupta DK, Bhansali S. Oral myiasis in paralytic patients with special needs: A report of three cases. Natl J Maxillofac Surg. 2018;9(1):110–2. doi:10.4103/njms.NJMS_82_17
7. Bhari N, Khaitan BK, Gupta P, Kumar T, Srivastava A. Neglect leads to extremes: maggots and malignancy in a case of discoid lupus erythematosus. Lupus. 2016;25(1):97–101. doi:10.1177/0961203315603145
8. Biradar S, Wankhede P, Munde A, Shaikh S. Extensive Myiasis infestation associated with Oral Squamous Cell Carcinoma: Report of two cases. Dent Res J (Isfahan). 2015;12(1):100–5.
9. Carvalho RWF, Santos TS, Antunes AA, Laureano Filho JR, Filho JRL, Anjos ED, Catunda RB. Oral and maxillofacial myiasis associated with epidermoid carcinoma: a case report. J Oral Sci. 2008;50(1):103–5.
10. DIMDI. ICD-10-WHO Version 2019: Kapitel l [Internet]. Köln. 2019 [cited 2019 Oct 6]. Available from: www.dimdi.de/static/de/klassifikationen/icd/icd-10-who/kode-suche/htmlamtl2019/block-b85-b89.htm
11. Dharshiyani SC, Wanjari SP, Wanjari PV, Parwani RN. Oral squamous cell carcinoma associated with myiasis. BMJ Case Rep. 2012;2012. doi:10.1136/bcr-2012-007178
12. Filho AO, Dias D, Miranda Á, Hebling E. Oral myiasis in older adult with severe Alzheimer's disease. Spec Care Dentist. 2018;38(2):99–106. doi:10.1111/scd.12277
13. Gupta PJ. Human myiasis in anal carcinomatous ulcer--a case report. Eur Rev Med Pharmacol Sci. 2009;13(6):473–4.
14. Kamal S, Bodh SA, Kumar S, Goel R. Orbital myiasis complicating squamous cell carcinoma in xeroderma pigmentosum. Orbit. 2012;31(2):137–9. doi:10.3109/01676830.2011.638103
15. Kleine C, Schoefer H, Amendt J, Bexten T, Just-Nuebling G. Cutaneous myiasis in a patient with seborrhoeic eczema. Lancet. 2014;383(9921):1012. doi:10.1016/S0140-6736(14)60199-9
16. Richter J, Schmitt M, Müller-Stöver I, Göbels K, Häussinger D. Sonographic detection of subcutaneous fly larvae in human myiasis. J Clin Ultrasound. 2008;36(3):169–73. doi:10.1002/jcu.20410
17. Sesterhenn AM, Pfützner W, Braulke DM, Wiegand S, Werner JA, Taubert A. Cutaneous manifestation of myiasis in malignant wounds of the head and neck. Eur J Dermatol. 2009;19(1):64–8. doi:10.1684/ejd.2008.0568
18. Werminghaus P, Hoffmann TK, Mehlhorn H, Bas M. Aural myiasis in a patient with Alzheimer's disease. Eur Arch Otorhinolaryngol. 2008;265(7):851–3. doi:10.1007/s00405-007-0535-2
19. Wollina U. Massive scalp myiasis with bleeding in a patient with multiple malignancies. Int Wound J. 2010;7(4):297–9. doi:10.1111/j.1742-481X.2010.00691.x
20. Wollina U. Myiasis on squamous cell carcinoma of skin. Wien Med Wochenschr. 2015;165(3-4):79–82. doi:10.1007/s10354-014-0326-5
21. Yeung JCC, Chung CF, Lai JSM. Orbital myiasis complicating squamous cell carcinoma of eyelid. Hong Kong Med J. 2010;16(1):63–5.