Die Rolle des oralen Mikrobioms bei der Periimplantitis
Die Zahl der gesetzten Implantate in Deutschland steigt von Jahr zu Jahr. Dentale Implantate bieten eine zuverlässige Versorgung des Patienten mit gesteigerter Lebensqualität, indem sie die natürliche Funktion mit nahezu identischen biologischen Eigenschaften wie am Zahn wiederherstellen. Implantat-getragene Prothesen ermöglichen im Vergleich zu rein Schleimhaut-getragenen Prothesen einen verbesserten Halt, eine leichtere Adaptation und eine höhere Kaubelastung. Auch Einzelzahnimplantate bieten eine Vielzahl an Vorteilen im Vergleich zur konventionellen Versorgung von Einzelzahnlücken. Insgesamt sind Implantate oftmals der konventionellen prothetischen Versorgung überlegen und stellen dank ihrer positiven Überlebensrate eine zuverlässige und valide Alternative dar [Buser et al., 2012; Degidi et al., 2012; Fischer und Stenberg, 2012; Gotfredsen, 2012].
Doch korrespondierend mit dem Anstieg der gesetzten dentalen Implantate steigt auch die Anzahl der periimplantären Infektionen. In der vielfach zitierten Arbeit von Derks und Tomasi wurde auf Patientenebene eine Prävalenz der periimplantären Mukositis von knapp 45 Prozent festgestellt; fast jeder vierte Implantatpatient wies eine Periimplantitis auf [Derks und Tomasi, 2015]. Das stellt uns als Behandler vor neue Herausforderungen, die zum einen aufgrund der zunehmenden Prävalenz, zum anderen aufgrund der anspruchsvollen und unvorhersagbaren Therapiemöglichkeiten stetig steigen [Berglundh et al., 2019; Claffey et al., 2008; Faggion et al., 2010; Jepsen et al., 2015; Jepsen et al., 2019; Persson et al., 2010; Renvert et al., 2009; Renvert et al., 2008; Renvert et al., 2009; Sahrmann et al., 2011; Salvi et al., 2017].
Hintergrund
In die seit 2018 geltende neue Klassifikation der parodontalen Erkrankungen wurden zum ersten Mal das periimplantäre Gewebe und damit verbundene pathologische Veränderungen aufgenommen. Dabei unterscheidet man: ‚Periimplantäre Gesundheit‘, ‚Periimplantäre Mukositis‘, ‚Periimplantitis‘ und ‚Periimplantäre Weich- und Hartgewebsdefekte‘ [Caton et al., 2018].
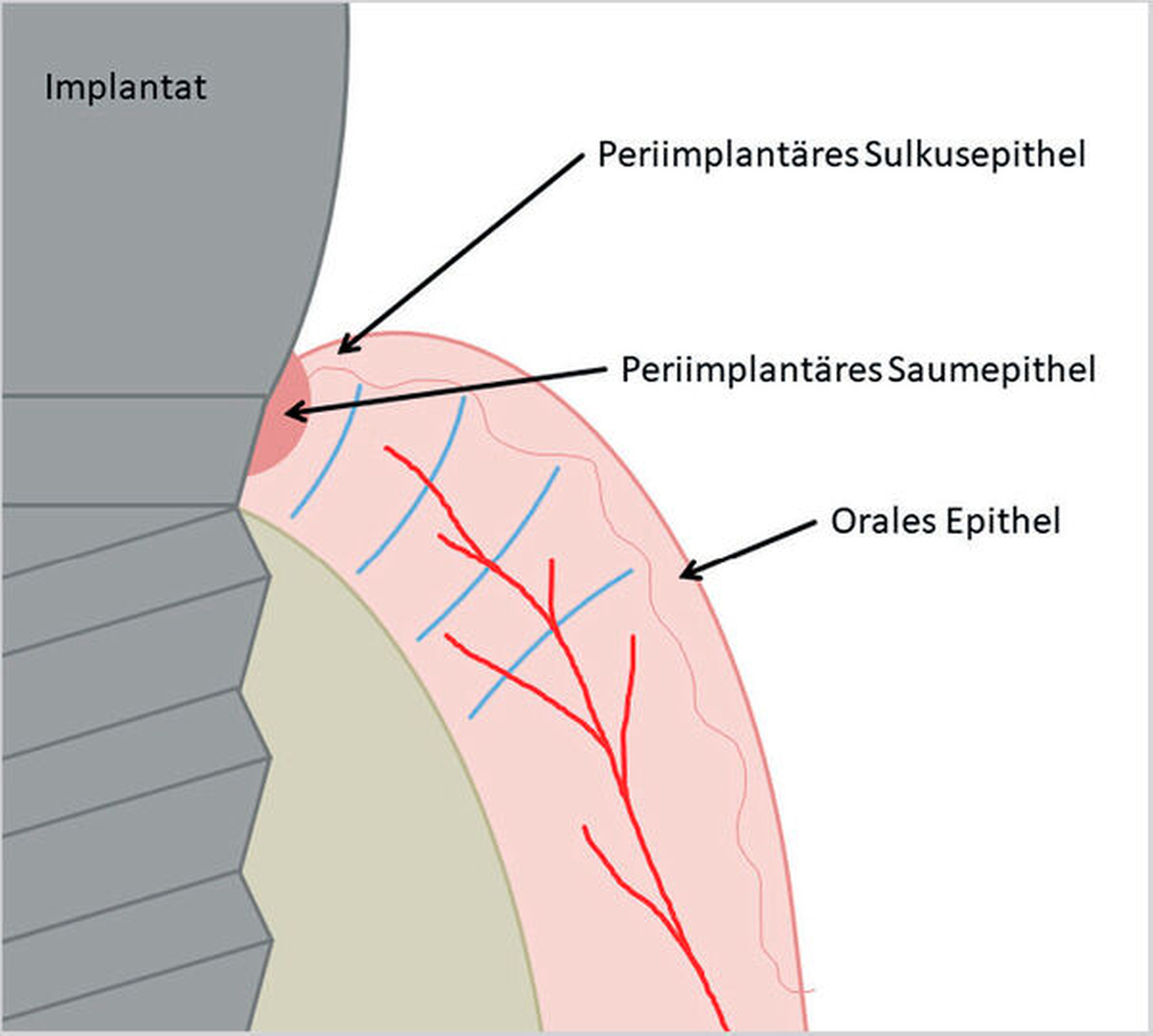
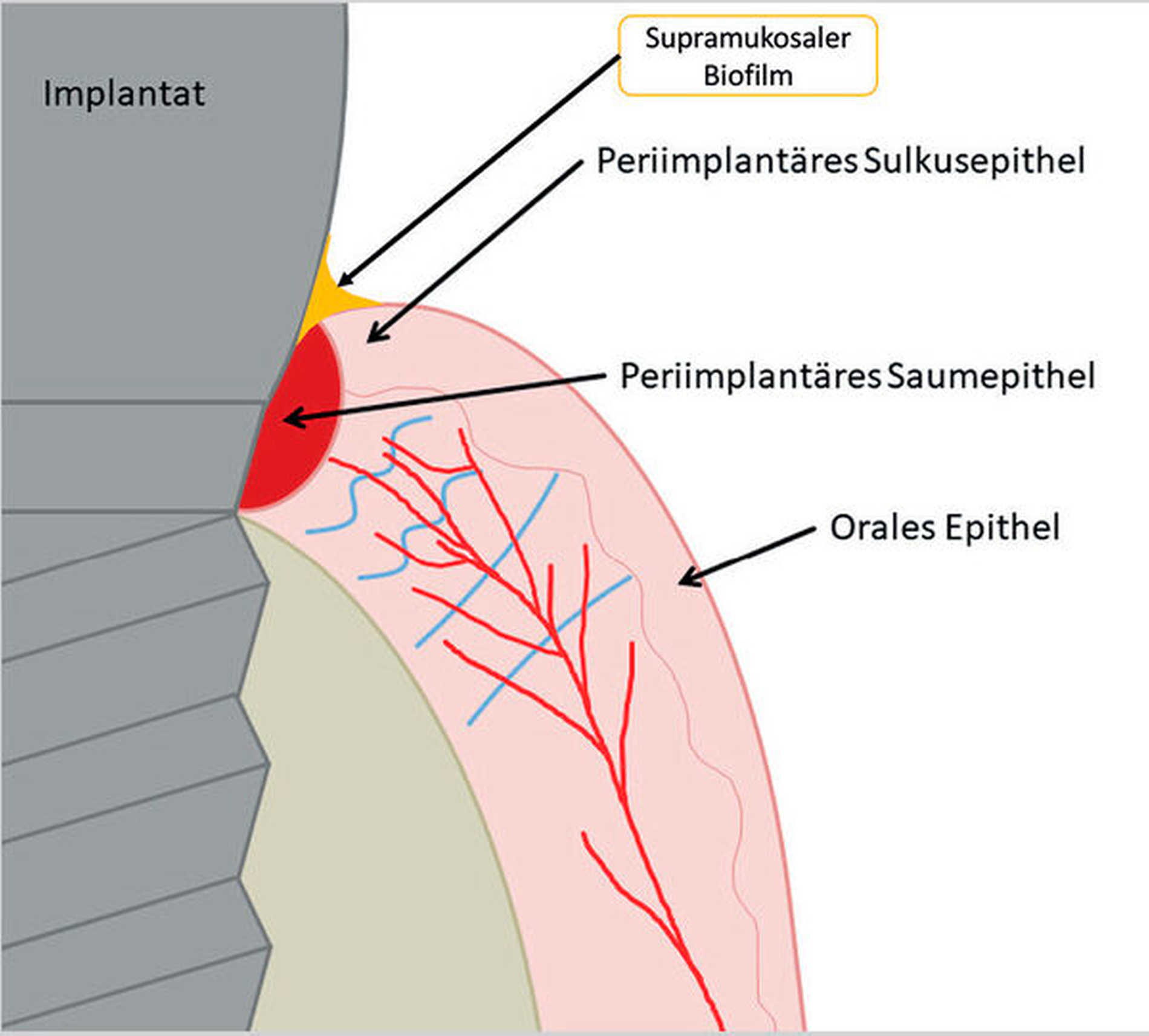
Nach Implantation heilt das dentale Implantat idealerweise ossär ein. Es bildet sich eine Knochen-Implantat-Verbindung aus – eine direkte strukturelle und funktionelle knöcherne Anlagerung an die synthetische Oberfläche des belasteten Implantats [Albrektsson et al., 1981; Albrektsson et al., 1986; Schroeder et al., 1976]. Diese Verankerung ist als Osseointegration bekannt [Branemark et al., 1969; Branemark et al., 1977]. Die periimplantäre Gesundheit ist definiert als klinisch gesundes Hart- und Weichgewebe um ein osseointegriertes Implantat. Dabei kann dies lediglich durch die Abwesenheit klassischer Entzündungszeichen beurteilt werden. Dazu gehören die Abwesenheit von Schwellung, Blutung auf Sondierung und Rötung des periimplantären Weichgewebes [Berglundh et al., 2018].
Dr. Annika T. Kröger

2010–2015: Studium der Zahnmedizinmedizin an der Rheinischen Friedrich-Wilhelms-Universität Bonn
2015: Approbation
2016–2018: wissenschaftliche Mitarbeiterin, Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde, Universitätsklinikum Bonn (Direktor: Prof. Dr. Dr. Søren Jepsen)
seit 2018: Clinical Lecturer, Department of Oral Surgery, School of Dentistry, University of Birmingham, UK (Head of Department: Prof. Dr. Dr. Thomas Dietrich)
2020: Promotion (Betreuer: Prof. Dr. Moritz Kebschull)
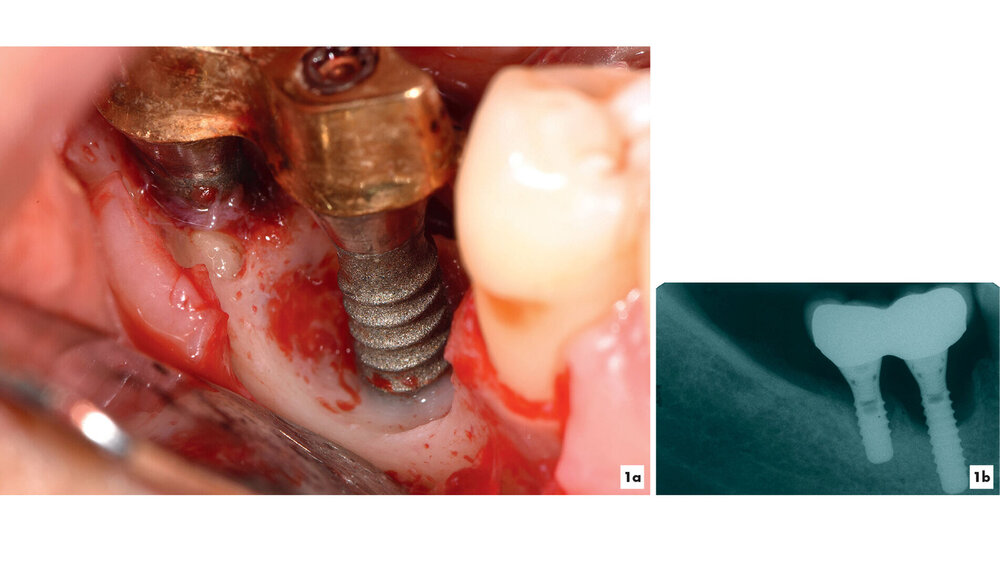
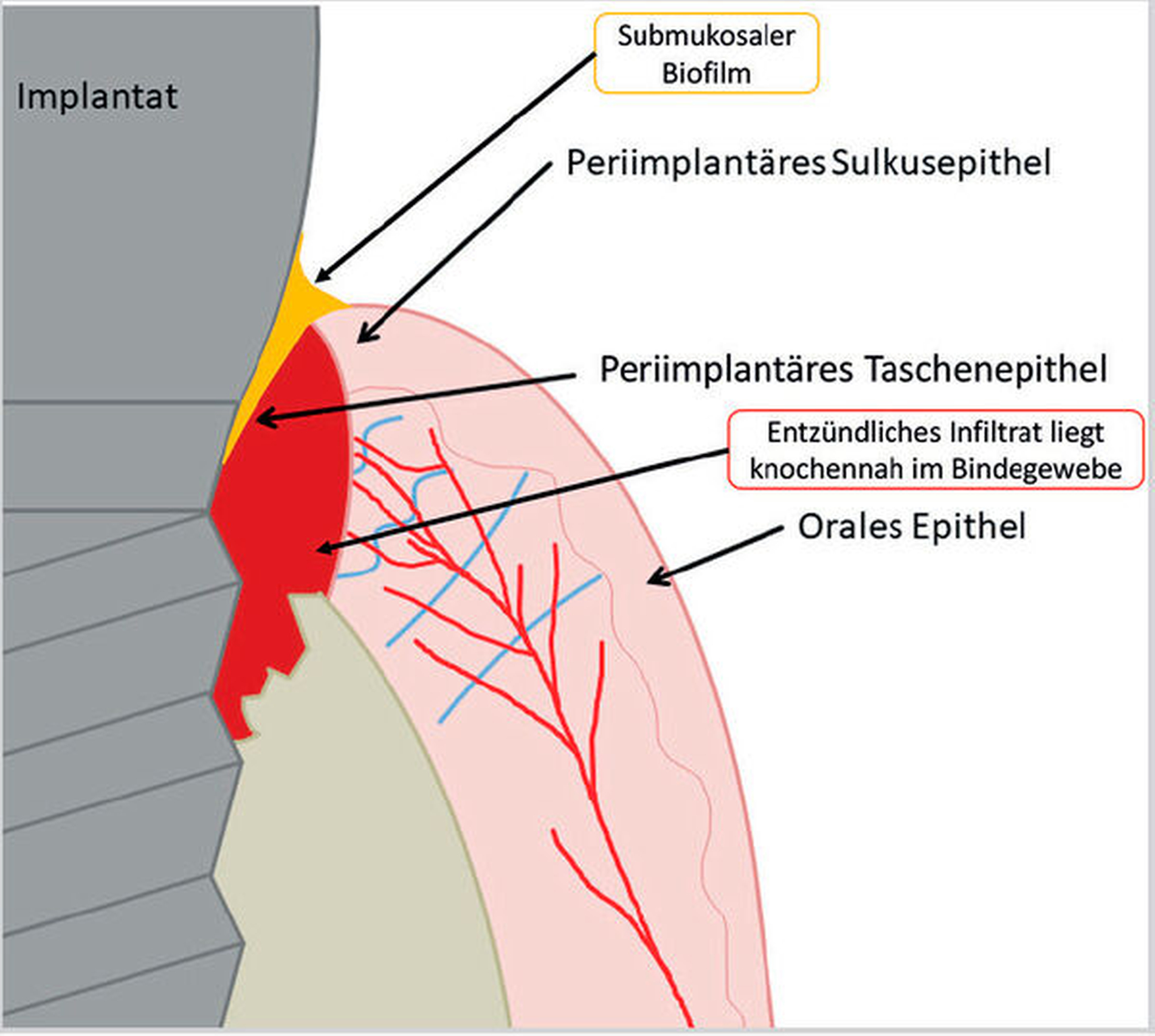
Kommt es jedoch zur Ausbildung einer Inflammation periimplantärer Gewebe ohne Knochenverlust, spricht man von einer periimplantären Mukositis. Wichtigstes Kennzeichen sind dabei die Blutung auf Sondierung und die Begrenzung der Entzündung auf das periimplantäre Saumepithel [Berglundh et al., 2018]. Breitet sich der pathologische Prozess in den Bereich des knöchernen Attachments aus, ist die Destruktion irreversibel und man spricht von einer Periimplantitis (Abbildung 1a). Zusätzlich zu den bereits genannten klinischen Kennzeichen kann man hier auch röntgenologisch den Knochenverlust feststellen, der mit erhöhten Sondierungstiefen und/oder Rezessionen einhergeht [Berglundh, 2019] (Abbildung 1b).
Obwohl sich die Forschung intensiv mit der Ätiologie und den pathologischen Prozessen, die zur Ausbildung einer Periimplantitis führen, auseinandersetzt, sind noch nicht alle Fragen geklärt [Heitz-Mayfield und Lang, 2010]. Fest steht jedoch, dass es sich bei der Periimplantitis um eine plaqueassoziierte chronische inflammatorische Erkrankung handelt. Neben einer Vielzahl von Risikofaktoren, wie eine unzureichende Mundhygiene, fehlende Nachsorge und eine parodontale Vorerkrankung, die die Ausbildung einer Periimplantitis begünstigen, ist die Ursache im Bereich der Plaque und im Gewebe zu vermuten [Renvert und Quirynen, 2015; Schwarz et al., 2018; Sousa et al., 2016; Stacchi et al., 2016].
Die submuköse Mikrobiota
Subgingivale Plaque dient als ökologische Nische für eine Vielfalt von Bakterien. Dank Sequenzierungsmethoden nach dem Hochdurchsatz-Verfahren konnte in jüngerer Vergangenheit ein umfassenderes Bild der bakteriellen Zusammensetzung des pathologischen Biofilms dieser infektiösen Umgebungen gezeichnet werden [Tamaki et al., 2011; Yang et al., 2016].
Eine Vielzahl an wissenschaftlichen Arbeiten untersucht die mikrobielle Zusammensetzung submuköser Plaque in gesunden periimplantären Situationen im Vergleich zu Periimplantitis [Al-Ahmad et al., 2018; Apatzidou et al., 2017; Koyanagi et al., 2010; Kumar et al., 2012; Maruyama et al., 2014; Sanz-Martin et al., 2017; Shiba et al., 2016; Tamura et al., 2013; H. Zheng et al., 2015]. Aktuell ist uns nur eine Arbeit bekannt, die die submuköse Plaque und deren Zusammensetzung in Abhängigkeit von dem Schweregrad der Periimplantitis-Erkrankung untersucht hat [Kröger et al., 2018].
Allgemein kann bei der Betrachtung des aktuellen Forschungsstands festgehalten werden, dass mit zunehmender Erkrankungsschwere die Häufigkeit anaerober Gram-negativer Bakterien deutlich zunimmt [Al-Ahmad et al., 2018; Apatzidou et al., 2017; Koyanagi et al., 2010; Kröger et al., 2018; Kumar et al., 2012; Sanz-Martin et al., 2017; Tamura et al., 2013]. Anaerobe Spezies sind auch in der Parodontitis mit erhöhter Erkrankungsschwere assoziiert und weisen in der Periimplantits Parallelen auf.
Des Weiteren wird deutlich, dass der Artenreichtum mit der Erkrankungsschwere abnimmt. Während bei Gesunden oder in Fällen periimplantärer Mukositis beziehungsweise bei minimalem Knochenverlust noch eine hohe Vielfalt von Bakterien zu finden ist, nimmt diese mit steigender Destruktion ab [Kröger et al., 2018]. Sowohl die Reduktion der Artenvielfalt als auch die Änderung der Charakteristika von aerob zu obligat anaerob in Abhängigkeit vom Erkrankungsschweregrad weist auf eine erhöhte Pathogenität des submukösen Mikrobioms bei tieferer Destruktion hin.
Verschiedene bakterielle Spezies wurden dabei in gesunden periimplantären Geweben oder in Situationen mit geringer Erkrankungsschwere nachgewiesen. Dazu gehören unter anderem verschiedene Streptokokken und Veillonellen, die typische Vertreter der Frühbesiedler dentaler Plaque sind und für die der Mundraum als natürliches Habitat gilt [Mashima und Nakazawa, 2014; Socransky et al., 1998; W. Zheng et al., 2016]. Auch explizit gesundheitsassoziierte Keime sind zu finden wie einige Neisseria-Spezies und Bifidobakterien [Gao et al., 2018; Hojo et al., 2007].
Besonderes Augenmerk verdienen dabei die Bifidobakterien: Zum einen erschwert die Anwesenheit dieses Taxons die Ansiedlung des bekannten parodontalpathogenen Keims P. gingivalis [Jasberg et al., 2016]. Zum anderen konnten in Laboruntersuchungen präventive und protektive Eigenschaften in Bezug zu progressivem Attachmentverlust nachgewiesen werden [Oliveira et al., 2017].
Darüber hinaus wurden bei schwerer Periimplantitis in Proben Pathogene gefunden, die in der Vergangenheit bereits mit parodontaler Destruktion in Verbindung gebracht wurden. Dazu gehören unter anderem F. nucleatum, P. intermedia, Eubakterien [Faveri et al., 2015; Jervøe-Storm et al., 2015; Koyanagi et al., 2010]. Auch T. parvum ist mit steigender Erkrankungsschwere zu finden. Interessant ist hierbei, dass dieser Keim bei dem Erkrankungs-Pendant am Zahn – der Parodontitis – gehäuft in höchst-akuten nekrotisierenden Formen auftritt [Wyss et al., 2001], wobei Treponemen allgemein ein parodontal-destruktives Verhalten ausweisen [Socransky et al., 1998].
Ein gesonderter Hinweis gilt dem Bakterium Filifactor alocis. Herkömmliche Nachweise von Bakterien konnten dieses Pathogen aufgrund seiner komplexen Kultivierbarkeit nicht nachweisen. Nur dank der neuesten Sequenziertechniken – wie die Hochdurchsatz-Sequenzierung – wurde deutlich, dass F. alocis nicht nur mit parodontalen Infektionen, sondern auch mit schweren Läsionen der Periimplantitis assoziiert ist [Aruni et al., 2015; Kröger et al., 2018]. Aufgrund seiner hochvirulenten destruktiven Eigenschaften trägt er beträchtlich zum Weich- und Hartgewebsabbau bei [Aruni et al., 2011]. Er gilt nach heutigem Stand als einer der Markerkeime bei der Parodontitis und könnte auch bei der Periimplantitis eine wichtige Rolle spielen [Aruni et al., 2014; Kröger et al., 2018].
Submuköse Bakterien-Komplexe
Der Begriff der ‚bakteriellen Komplexe‘ wurde durch Socransky et al. bei der Parodontitis geprägt [Socransky et al., 1998]. Dabei können Bakterien dank ihrer symbiotischen und pathogenen Eigenschaften in verschiedene Komplexe zusammengefasst werden, wobei jeder Komplex eine unterschiedliche Virulenz aufweist und in bestimmten Stadien der Parodontitis eine wichtige Rolle spielt. Am bekanntesten ist wohl der ‚rote Komplex‘ – dabei handelt es sich um die höchst parodontalpathogenen anaeroben Keime P. gingivalis, T. forsythia und T. denticola [Socransky et al., 1998].
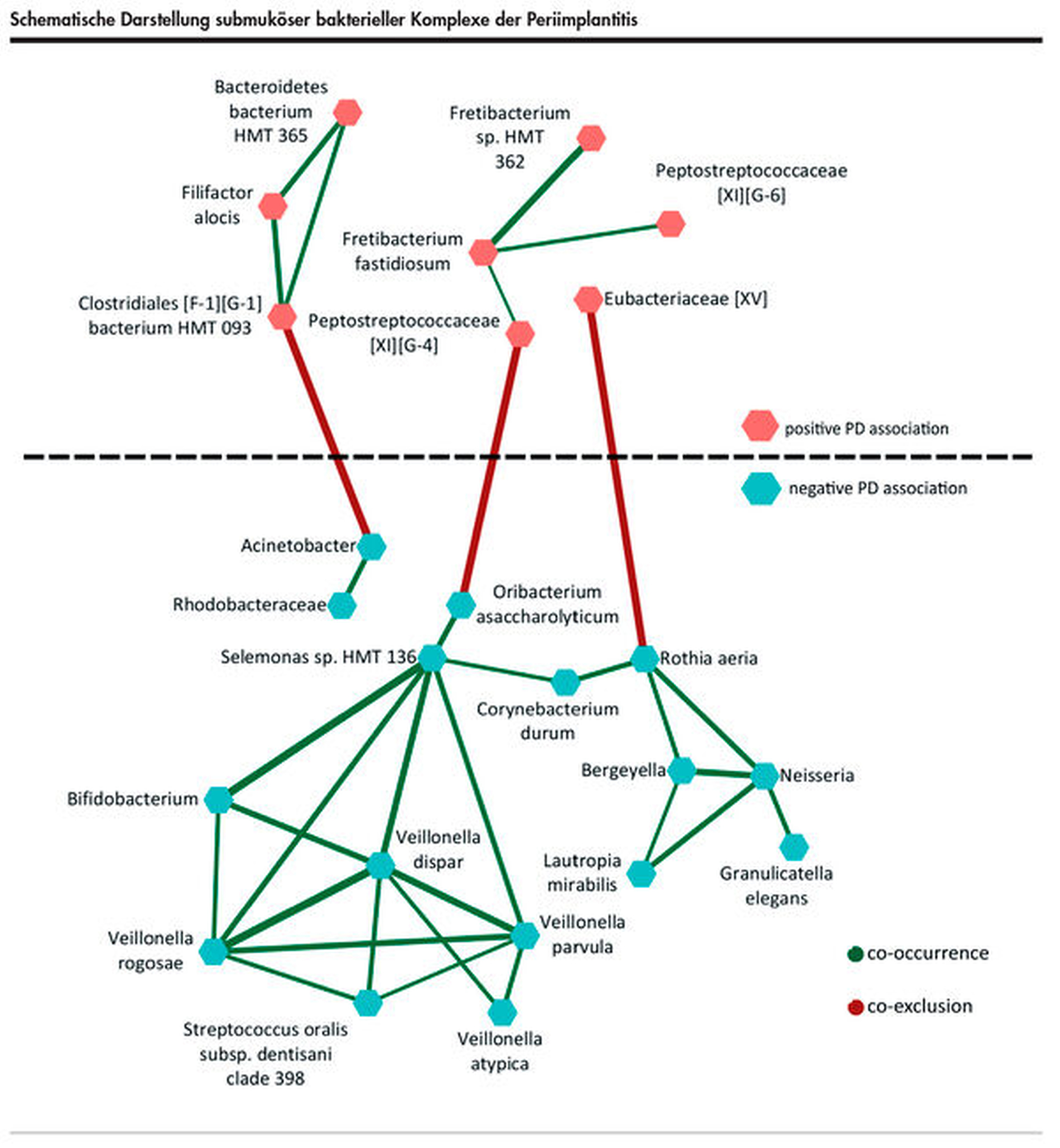
Auch im Bereich der Periimplantitis gibt es in der aktuellen Literatur Hinweise auf funktionelle bakterielle Komplexe im submukösen Biofilm [Ghensi et al., 2020; Kröger et al., 2018]. Korrelationsanalysen haben dabei mikrobielle Netzwerke aufgezeigt (Abbildung 3). Interessanterweise gruppieren sich dabei solche Spezies zu funktionellen Einheiten, die entweder mit einem erhöhten Schweregrad assoziiert sind oder umgekehrt. Die Komplexe, die aus Bakterien mit positiver Schweregradassoziation bestehen, enthalten häufig Spezies, die in der Vergangenheit bereits mit destruktiven Prozessen in Zusammenhang gebracht wurden. Umgekehrt findet man in den gesundheitsassoziierten Komplexen häufig auch gesundheitsassoziierte Spezies. Darüber hinaus scheint sich die Koexistenz von gesundheits- und destruktionsassoziierten Komplexen auszuschließen.
Dysbiose: Ursache oder Folge?
Neben bakteriellen Komplexen konnte auch eine mit der Erkrankungsschwere zunehmende Dysbiose des submukosalen Biofilms nachgewiesen werden [Kröger et al., 2018]. Dysbiose selbst ist definiert als eine Verschiebung der mikrobiologischen Zusammensetzung einer ökologischen Nische, wobei gesundheitsassoziierte Keime von (potenziellen) Pathogenen auskonkurriert werden [Marsh, 2015].
Bei einer Vielzahl von Erkrankungen wurde eine solche ökologische Verschiebung beobachtet und als kausaler Faktor festgehalten: Diabetes mellitus, Autismus, Adipositas [Boulange et al., 2016; Buffington et al., 2016; Carding et al., 2015]. Das wohl in der Zahnmedizin bekannteste Beispiel ist dabei die Parodontitis [Deng et al., 2017]. Die Ursachen für das Auftreten einer Dysbiose sind ebenso vielfältig: Häufig zu finden sind eine geschwächte Immunabwehr, eine Antibiotika-Überexposition, Ernährung, Alkoholmissbrauch [Chan et al., 2013; Mikkelsen et al., 2016; Yan et al., 2011].
Bei der Periimplantitis steigt das Ausmaß der Dysbiose mit dem Krankheitsschweregrad. Dies bedeutet: Je mehr Destruktion bereits am Implantat vorzufinden ist, desto stärker haben bereits die krankheitsassoziierten Komplexe Überhand gewonnen und die gesundheitsassoziierten Komplexe verdrängt [Kröger et al., 2018]. Die Veränderung der Zusammensetzung des submukösen Mikrobioms resultiert also in einem circulus vitiosus [Meyle und Chapple, 2015]: je schwerer die Erkrankung, desto mehr Dysbiose und desto stärker die weitere Destruktion.
Elementarer Punkt in der Therapie ist das frühzeitige Erkennen der Erkrankung und ebenso das rasche Einschreiten, um diesen pathologischen Prozess zu unterbrechen und die beschleunigte Progression zu unterbinden. Ziel der Therapie muss also die Wiederherstellung eines gesunden periimplantären Ökosystems sein – mit einem Gleichgewicht von gesundheitsassoziierten Bakterien und (potenziellen) Pathogenen [Socransky und Haffajee, 2005].
Neben der traditionellen Instrumentierung, gegebenenfalls unter Zuhilfenahme von Geräten wie einem Pulver-Wasserstrahlgerät mit Glycinpulver, die auf eine möglichst vollständige Zerstörung des submukosalen Biofilms und eine Ausbildung eines gesundheitsassoziierten Biofilms nach erfolgter Heilung setzt, sind hierfür auch Modifikatoren der Wirtsantwort und des Mikrobioms in wissenschaftlicher Erprobung. Für diese Faktoren – zum Beispiel probiotische Bakterien – konnten aber bislang trotz vielversprechender Daten aus experimentellen Studien noch keine überzeugenden klinischen Daten gewonnen werden.
Zusammenfassung und Einordnung
Aus den aktuellen Forschungsergebnissen wird ersichtlich, dass keine einzelne bakterielle Spezies ursächlich für die Ausbildung der Erkrankung sein kann. Zum Hauptteil befinden sich in der submukösen Plaque opportunistische Erreger oder Bakterien, die natürlich im oralen Milieu vorkommen [Marsh, 2015].
Es wird zunehmend deutlich, dass das Mikrobiom und dessen Eigenschaften in der Gesamtheit maßgeblich für die Ausbildung der Periimplantitis sind. Neben der variierenden Zusammensetzung abhängig vom Schweregrad der Erkrankung sind Synergien und Antagonismen der Bakterien in deren Umfeld nicht zu vernachlässigen. Der Nachweis der mit der Erkrankungsschwere assoziierten Dysbiose des submukosalen Biofilms ist ein wichtiger Wegweiser für die Pathogenität des submukosalen Mikrobioms in der Gesamtheit und in Abhängigkeit von der Zusammensetzung.
Zusätzlich weisen die Untersuchungsergebnisse darauf hin, dass es sich bei der Periimplantitis um einen multifaktoriellen Prozess handelt: Neben der bakteriellen Kontamination ist die Wirtsabwehr von entscheidender Bedeutung. Die Immunabwehr des Gewebes ist ein wesentlicher Faktor bei der Aufrechterhaltung eines gesunden Habitats. Umgekehrt ist die Ausbildung einer Dysbiose immer auch Hinweis auf eine nicht proportionale Immunantwort auf den potenziell pathogenen Biofilm.
In der Tat ist mittlerweile umstritten, ob immer die bakterielle Infektion der wesentliche Faktor für die Erkrankung ist oder ob nicht die Zusammensetzung und die ökologische Bilanz (Symbiose/Dysbiose) ganz wesentlich von der Aktivität des Immunsystems des Wirts abhängen. Diese Aktivität wird durch verschiedene veränderliche (zum Beispiel Rauchen oder Stress) sowie nicht- oder nur bedingt veränderliche Risikofaktoren (genetische Prädisposition, Diabetes mellitus) beeinflusst. Schließlich werden derzeit dentale Materialien – zum Beispiel aus der Implantatoberfläche herausgelöste Ionen und/oder Partikel – als weitere Faktoren diskutiert, die eine verstärkte Immunreaktion und somit indirekt auch eine verstärkte Dysbiose des submukosalen Biofilms auslösen könnten.
Literaturliste
Al-Ahmad, A., Muzafferiy, F., Anderson, A. C., Wölber, J. P., Ratka-Krüger, P., Fretwurst, T., . . . Hellwig, E. (2018). Shift of microbial composition of peri-implantitis-associated oral biofilm as revealed by 16S rRNA gene cloning. Journal of Medical Microbiology. doi:doi:10.1099/jmm.0.000682
Albrektsson, T., Branemark, P. I., Hansson, H. A., & Lindstrom, J. (1981). Osseointegrated titanium implants. Requirements for ensuring a long-lasting, direct bone-to-implant anchorage in man. Acta Orthop Scand, 52(2), 155-170. doi:10.3109/17453678108991776
Albrektsson, T., Jansson, T., & Lekholm, U. (1986). Osseointegrated dental implants. Dent Clin North Am, 30(1), 151-174.
Apatzidou, D., Lappin, D. F., Hamilton, G., Papadopoulos, C. A., Konstantinidis, A., & Riggio, M. P. (2017). Microbiome of peri-implantitis affected and healthy dental sites in patients with a history of chronic periodontitis. Arch Oral Biol, 83, 145-152. doi:10.1016/j.archoralbio.2017.07.007
Aruni, A. W., Mishra, A., Dou, Y., Chioma, O., Hamilton, B. N., & Fletcher, H. M. (2015). Filifactor alocis--a new emerging periodontal pathogen. Microbes Infect, 17(7), 517-530. doi:10.1016/j.micinf.2015.03.011
Aruni, A. W., Roy, F., & Fletcher, H. M. (2011). Filifactor alocis has virulence attributes that can enhance its persistence under oxidative stress conditions and mediate invasion of epithelial cells by porphyromonas gingivalis. Infect Immun, 79(10), 3872-3886. doi:10.1128/IAI.05631-11
Aruni, W., Chioma, O., & Fletcher, H. M. (2014). Filifactor alocis: The Newly Discovered Kid on the Block with Special Talents. J Dent Res, 93(8), 725-732. doi:10.1177/0022034514538283 Berglundh T, Jepsen S, Stadlinger B, Terheyden H. (2019) Peri-implantitis and its prevention. Clin Oral Implants Res, 30(2), 150-155.
Berglundh, T. (2019). Peri-implant health, peri-implant mucositis, and peri-implantitis - Guidance for clinicians. European Federation of Periodontology.
Berglundh, T., Armitage, G., Araujo, M. G., Avila-Ortiz, G., Blanco, J., Camargo, P. M., . . . Zitzmann, N. (2018). Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol, 45 Suppl 20, S286-S291. doi:10.1111/jcpe.12957
Boulange, C. L., Neves, A. L., Chilloux, J., Nicholson, J. K., & Dumas, M. E. (2016). Impact of the gut microbiota on inflammation, obesity, and metabolic disease. Genome Med, 8(1), 42. doi:10.1186/s13073-016-0303-2
Branemark, P. I., Adell, R., Breine, U., Hansson, B. O., Lindstrom, J., & Ohlsson, A. (1969). Intra-osseous anchorage of dental prostheses. I. Experimental studies. Scand J Plast Reconstr Surg, 3(2), 81-100. doi:10.3109/02844316909036699
Branemark, P. I., Hansson, B. O., Adell, R., Breine, U., Lindstrom, J., Hallen, O., & Ohman, A. (1977). Osseointegrated implants in the treatment of the edentulous jaw. Experience from a 10-year period. Scand J Plast Reconstr Surg Suppl, 16, 1-132.
Buffington, S. A., Di Prisco, G. V., Auchtung, T. A., Ajami, N. J., Petrosino, J. F., & Costa-Mattioli, M. (2016). Microbial Reconstitution Reverses Maternal Diet-Induced Social and Synaptic Deficits in Offspring. Cell, 165(7), 1762-1775. doi:10.1016/j.cell.2016.06.001
Buser, D., Janner, S. F., Wittneben, J. G., Bragger, U., Ramseier, C. A., & Salvi, G. E. (2012). 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: a retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res, 14(6), 839-851. doi:10.1111/j.1708-8208.2012.00456.x
Carding, S., Verbeke, K., Vipond, D. T., Corfe, B. M., & Owen, L. J. (2015). Dysbiosis of the gut microbiota in disease. Microb Ecol Health Dis, 26, 26191. doi:10.3402/mehd.v26.26191
Caton, J. G., Armitage, G., Berglundh, T., Chapple, I. L. C., Jepsen, S., Kornman, K. S., . . . Tonetti, M. S. (2018). A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Clin Periodontol, 45 Suppl 20, S1-S8. doi:10.1111/jcpe.12935
Chan, Y. K., Estaki, M., & Gibson, D. L. (2013). Clinical consequences of diet-induced dysbiosis. Ann Nutr Metab, 63 Suppl 2, 28-40. doi:10.1159/000354902
Claffey, N., Clarke, E., Polyzois, I., & Renvert, S. (2008). Surgical treatment of peri-implantitis. J Clin Periodontol, 35(8 Suppl), 316-332. doi:10.1111/j.1600-051X.2008.01277.x
Degidi, M., Nardi, D., & Piattelli, A. (2012). 10-year follow-up of immediately loaded implants with TiUnite porous anodized surface. Clin Implant Dent Relat Res, 14(6), 828-838. doi:10.1111/j.1708-8208.2012.00446.x
Deng, Z. L., Szafranski, S. P., Jarek, M., Bhuju, S., & Wagner-Dobler, I. (2017). Dysbiosis in chronic periodontitis: Key microbial players and interactions with the human host. Sci Rep, 7(1), 3703. doi:10.1038/s41598-017-03804-8
Derks, J., & Tomasi, C. (2015). Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol, 42 Suppl 16, S158-171. doi:10.1111/jcpe.12334
Faggion, C. M., Jr., Listl, S., & Tu, Y. K. (2010). Assessment of endpoints in studies on peri-implantitis treatment--a systematic review. J Dent, 38(6), 443-450. doi:10.1016/j.jdent.2010.03.003
Faveri, M., Figueiredo, L. C., Shibli, J. A., Perez-Chaparro, P. J., & Feres, M. (2015). Microbiological diversity of peri-implantitis biofilms. Adv Exp Med Biol, 830, 85-96. doi:10.1007/978-3-319-11038-7_5
Fischer, K., & Stenberg, T. (2012). Prospective 10-year cohort study based on a randomized controlled trial (RCT) on implant-supported full-arch maxillary prostheses. Part 1: sandblasted and acid-etched implants and mucosal tissue. Clin Implant Dent Relat Res, 14(6), 808-815. doi:10.1111/j.1708-8208.2011.00389.x
Gao, X., Zhou, J., Sun, X., Li, X., & Zhou, Y. (2018). Diversity analysis of subgingival microbial bacteria in peri-implantitis in Uygur population. Medicine (Baltimore), 97(5), e9774 doi:10.1097/MD.0000000000009774
Ghensi, P., Manghi, P., Zolfo, M., Armanini, F., Pasolli, E., Bolzan, M., . . . Segata, N. (2020). Strong oral plaque microbiome signatures for dental implant diseases identified by strain-resolution metagenomics. NPJ Biofilms Microbiomes, 6(1), 47. doi:10.1038/s41522-020-00155-7
Gotfredsen, K. (2012). A 10-year prospective study of single tooth implants placed in the anterior maxilla. Clin Implant Dent Relat Res, 14(1), 80-87. doi:10.1111/j.1708-8208.2009.00231.x
Heitz-Mayfield, L. J., & Lang, N. P. (2010). Comparative biology of chronic and aggressive periodontitis vs. peri-implantitis. Periodontol 2000, 53, 167-181. doi:10.1111/j.1600-0757.2010.00348.x
Hojo, K., Mizoguchi, C., Taketomo, N., Ohshima, T., Gomi, K., Arai, T., & Maeda, N. (2007). Distribution of salivary Lactobacillus and Bifidobacterium species in periodontal health and disease. Biosci Biotechnol Biochem, 71(1), 152-157. doi:10.1271/bbb.60420
Jasberg, H., Soderling, E., Endo, A., Beighton, D., & Haukioja, A. (2016). Bifidobacteria inhibit the growth of Porphyromonas gingivalis but not of Streptococcus mutans in an in vitro biofilm model. Eur J Oral Sci, 124(3), 251-258. doi:10.1111/eos.12266
Jepsen S, Berglundh T, Genco R, Aass AM, Demirel K, Derks J, Figuero E, Giovannoli JL, Goldstein M, Lambert F, Ortiz-Vigon A, Polyzois I, Salvi GE, Schwarz F, Serino G, Tomasi C, Zitzmann NU. (2015). Primary prevention of peri-implantitis: managing peri-implant mucositis. J Clin Periodontol. 42 Suppl 16:S152-7. doi: 10.1111/jcpe.12369.
Jepsen S, Schwarz F, Cordaro L, Derks J, Hämmerle CHF, Heitz-Mayfield LJ, Hernández-Alfaro F, Meijer HJA, Naenni N, Ortiz-Vigón A, Pjetursson B, Raghoebar GM, Renvert S, Rocchietta I, Roccuzzo M, Sanz-Sánchez I, Simion M, Tomasi C, Trombelli L, Urban I. (2019). Regeneration of alveolar ridge defects. Consensus report of group 4 of the 15th European Workshop on Periodontology on Bone Regeneration. J Clin Periodontol. 46 Suppl 21:277-286. doi: 10.1111/jcpe.13121.
Jervøe-Storm PM, Jepsen S, Jöhren P, Mericske-Stern R, Enkling N. (2015) Internal bacterial colonization of implants: association with peri-implant bone loss. Clin Oral Implants Res. 26(8):957-963. doi: 10.1111/clr.12421.
Koyanagi, T., Sakamoto, M., Takeuchi, Y., Ohkuma, M., & Izumi, Y. (2010). Analysis of microbiota associated with peri-implantitis using 16S rRNA gene clone library. J Oral Microbiol, 2. doi:10.3402/jom.v2i0.5104
Kroger, A., Hulsmann, C., Fickl, S., Spinell, T., Huttig, F., Kaufmann, F., . . . Kebschull, M. (2018). The severity of human peri-implantitis lesions correlates with the level of submucosal microbial dysbiosis. J Clin Periodontol, 45(12), 1498-1509. doi:10.1111/jcpe.13023
Kumar, P. S., Mason, M. R., Brooker, M. R., & O'Brien, K. (2012). Pyrosequencing reveals unique microbial signatures associated with healthy and failing dental implants. J Clin Periodontol, 39(5), 425-433. doi:10.1111/j.1600-051X.2012.01856.x
Marsh, P. D. (2015). The commensal microbiota and the development of human disease - an introduction. J Oral Microbiol, 7, 29128. doi:10.3402/jom.v7.29128
Maruyama, N., Maruyama, F., Takeuchi, Y., Aikawa, C., Izumi, Y., & Nakagawa, I. (2014). Intraindividual variation in core microbiota in peri-implantitis and periodontitis. Sci Rep, 4, 6602. doi:10.1038/srep06602
Mashima, I., & Nakazawa, F. (2014). The influence of oral Veillonella species on biofilms formed by Streptococcus species. Anaerobe, 28, 54-61. doi:10.1016/j.anaerobe.2014.05.003
Meyle, J., & Chapple, I. (2015). Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000, 69(1), 7-17. doi:10.1111/prd.12104
Mikkelsen, K. H., Allin, K. H., & Knop, F. K. (2016). Effect of antibiotics on gut microbiota, glucose metabolism and body weight regulation: a review of the literature. Diabetes Obes Metab, 18(5), 444-453. doi:10.1111/dom.12637
Oliveira, L. F., Salvador, S. L., Silva, P. H., Furlaneto, F. A., Figueiredo, L., Casarin, R., . . . Messora, M. R. (2017). Benefits of Bifidobacterium animalis subsp. lactis Probiotic in Experimental Periodontitis. J Periodontol, 88(2), 197-208. doi:10.1902/jop.2016.160217
Persson, G. R., Samuelsson, E., Lindahl, C., & Renvert, S. (2010). Mechanical non-surgical treatment of peri-implantitis: a single-blinded randomized longitudinal clinical study. II. Microbiological results. J Clin Periodontol, 37(6), 563-573. doi:10.1111/j.1600-051X.2010.01561.x
Renvert, S., Polyzois, I., & Maguire, R. (2009). Re-osseointegration on previously contaminated surfaces: a systematic review. Clin Oral Implants Res, 20 Suppl 4, 216-227. doi:10.1111/j.1600-0501.2009.01786.x
Renvert, S., & Quirynen, M. (2015). Risk indicators for peri-implantitis. A narrative review. Clin Oral Implants Res, 26 Suppl 11, 15-44. doi:10.1111/clr.12636
Renvert, S., Roos-Jansaker, A. M., & Claffey, N. (2008). Non-surgical treatment of peri-implant mucositis and peri-implantitis: a literature review. J Clin Periodontol, 35(8 Suppl), 305-315. doi:10.1111/j.1600-051X.2008.01276.x
Renvert, S., Samuelsson, E., Lindahl, C., & Persson, G. R. (2009). Mechanical non-surgical treatment of peri-implantitis: a double-blind randomized longitudinal clinical study. I: clinical results. J Clin Periodontol, 36(7), 604-609. doi:10.1111/j.1600-051X.2009.01421.x
Sahrmann, P., Attin, T., & Schmidlin, P. R. (2011). Regenerative treatment of peri-implantitis using bone substitutes and membrane: a systematic review. Clin Implant Dent Relat Res, 13(1), 46-57. doi:10.1111/j.1708-8208.2009.00183.x
Salvi, G. E., Cosgarea, R., & Sculean, A. (2017). Prevalence and Mechanisms of Peri-implant Diseases. J Dent Res, 96(1), 31-37. doi:10.1177/0022034516667484
Sanz-Martin, I., Doolittle-Hall, J., Teles, R. P., Patel, M., Belibasakis, G. N., Hammerle, C. H. F., . . . Teles, F. R. F. (2017). Exploring the microbiome of healthy and diseased peri-implant sites using Illumina sequencing. J Clin Periodontol, 44(12), 1274-1284. doi:10.1111/jcpe.12788
Schroeder, A., Pohler, O., & Sutter, F. (1976). [Tissue reaction to an implant of a titanium hollow cylinder with a titanium surface spray layer]. SSO Schweiz Monatsschr Zahnheilkd, 86(7), 713-727.
Schwarz, F., Derks, J., Monje, A., & Wang, H. L. (2018). Peri-implantitis. J Periodontol, 89 Suppl 1, S267-S290. doi:10.1002/JPER.16-0350
Shiba, T., Watanabe, T., Kachi, H., Koyanagi, T., Maruyama, N., Murase, K., . . . Nakagawa, I. (2016). Distinct interacting core taxa in co-occurrence networks enable discrimination of polymicrobial oral diseases with similar symptoms. Sci Rep, 6, 30997. doi:10.1038/srep30997
Socransky, S. S., & Haffajee, A. D. (2005). Periodontal microbial ecology. Periodontol 2000, 38, 135-187. doi:10.1111/j.1600-0757.2005.00107.x
Socransky, S. S., Haffajee, A. D., Cugini, M. A., Smith, C., & Kent, R. L., Jr. (1998). Microbial complexes in subgingival plaque. J Clin Periodontol, 25(2), 134-144.
Sousa, V., Mardas, N., Farias, B., Petrie, A., Needleman, I., Spratt, D., & Donos, N. (2016). A systematic review of implant outcomes in treated periodontitis patients. Clin Oral Implants Res, 27(7), 787-844. doi:10.1111/clr.12684
Stacchi, C., Berton, F., Perinetti, G., Frassetto, A., Lombardi, T., Khoury, A., . . . Di Lenarda, R. (2016). Risk Factors for Peri-Implantitis: Effect of History of Periodontal Disease and Smoking Habits. A Systematic Review and Meta-Analysis. J Oral Maxillofac Res, 7(3), e3. doi:10.5037/jomr.2016.7303
Tamaki, H., Wright, C. L., Li, X., Lin, Q., Hwang, C., Wang, S., . . . Liu, W. T. (2011). Analysis of 16S rRNA amplicon sequencing options on the Roche/454 next-generation titanium sequencing platform. PLoS One, 6(9), e25263. doi:10.1371/journal.pone.0025263
Tamura, N., Ochi, M., Miyakawa, H., & Nakazawa, F. (2013). Analysis of bacterial flora associated with peri-implantitis using obligate anaerobic culture technique and 16S rDNA gene sequence. Int J Oral Maxillofac Implants, 28(6), 1521-1529. doi:10.11607/jomi.2570
Wyss, C., Dewhirst, F. E., Gmur, R., Thurnheer, T., Xue, Y., Schupbach, P., . . . Paster, B. J. (2001). Treponema parvum sp. nov., a small, glucoronic or galacturonic acid-dependent oral spirochaete from lesions of human periodontitis and acute necrotizing ulcerative gingivitis. Int J Syst Evol Microbiol, 51(Pt 3), 955-962. doi:10.1099/00207713-51-3-955
Yan, A. W., Fouts, D. E., Brandl, J., Starkel, P., Torralba, M., Schott, E., . . . Schnabl, B. (2011). Enteric dysbiosis associated with a mouse model of alcoholic liver disease. Hepatology, 53(1), 96-105. doi:10.1002/hep.24018
Yang, B., Wang, Y., & Qian, P.-Y. (2016). Sensitivity and correlation of hypervariable regions in 16S rRNA genes in phylogenetic analysis. BMC Bioinformatics, 17(1), 135. doi:10.1186/s12859-016-0992-y
Zheng, H., Xu, L., Wang, Z., Li, L., Zhang, J., Zhang, Q., . . . Chen, F. (2015). Subgingival microbiome in patients with healthy and ailing dental implants. Sci Rep, 5, 10948. doi:10.1038/srep10948
Zheng, W., Tan, T. K., Paterson, I. C., Mutha, N. V., Siow, C. C., Tan, S. Y., . . . Choo, S. W. (2016). StreptoBase: An Oral Streptococcus mitis Group Genomic Resource and Analysis Platform. PLoS One, 11(5), e0151908. doi:10.1371/journal.pone.0151908