Implantologische Indikationen für die Anwendung von Knochenersatzmaterialien
Das ausreichende Knochenvolumen im zu implantierenden Kieferknochen ist eine Grundlage für den Langzeiterfolg der implantatgetragenen Versorgung. Wenn die ossäre Situation unzureichend ist, können verschiedene Techniken helfen, die Situation präimplantologisch oder simultan zu verbessern. Neben autologem Knochen vom Patienten selbst stehen verschiedene Knochenersatzmaterialien zu Verfügung. Da hier zum einen ein Zweiteingriff zur Gewinnung des Knochens wegfällt und Knochenersatzmaterialien zum anderen „unbegrenzt“ zur Verfügung stehen, sind diese Materialien aus der modernen Augmentationschirurgie nicht mehr wegzudenken. Allerdings sind nicht alle Materialien gleichwertig, viele zeigen individuelle Eigenschaften, die dem Praktiker beim Einsatz bekannt sein müssen. Zudem ist die wissenschaftliche Basis der Materialien sehr heterogen und nicht in allen Bereichen ausreichend.
Erklärtes Ziel der Leitlinie ist es, für den Praktiker Ordnung in die unübersichtliche Menge und die vielfältigen Applikationsmöglichkeiten von Knochenersatzmaterialien einschließlich des autologen Knochens (zusammengefasst unter „Biomaterialien“) zu bringen.
Wichtig ist , die Begriffe „Biomaterialien“ und „Knochenersatzmaterialien“ zu unterscheiden. Knochenersatzmaterialien sind allogene, xenogene oder synthetische Materialien, die nicht vom Empfänger selbst kommen. Biomaterialien umfassen diese, aber es kommt noch das autogene Material vom Patienten selbst dazu.
Univ.-Prof. Dr. Dr. Bilal Al-Nawas
Im Folgenden werden die Kernaussagen der Leitlinie aufgeführt. Die kompletten Quellenangaben für die Aussagen finden sich in der Leitlinie, hier werden nur einige wenige Beispiele aus der Literatur hinzugefügt.
Die Anamnese: Medizinische Faktoren
Obwohl die Frage der Komorbiditäten des Patienten und deren Einfluss auf den Augmentationserfolg sehr wichtig sind, gibt es hierzu wenig Literatur. Wichtige Faktoren, die das Ergebnis der Augmentation und der Implantate selbst negativ beeinflussen können, sind unter anderem:
schlecht eingestellter Diabetes Mellitus,
Rauchen,
vorausgegangene oder bestehende Parodontitis,
Bestrahlung,
Bisphosphonate und ihre Analoga,
diverse Pharmaka wie Serotonin-Wiederaufnahmeinhibitoren (SSRI), Protonenpumpeninhibitoren (PPI) und Phosphodiesterase-5-Hemmer (PDE-5)
[Heitz-Mayfield, 2008; Knabe et al., 2017; Wu et al., 2017; Carr et al., 2019].
Auch ein zu niedriger Vitamin-D-Spiegel scheint die Prognose zu verschlechtern [Fretwurst al., 2016].
Keine Hinweise auf negative Einflüsse gibt es für Leberzirrhose, Osteoarthritis, Parkinson und Demenzerkrankungen [Schimmel et al., 2018].
Auch wenn die Datenlage dünn ist, zeigen doch die vorhandenen Studien und die klinische Praxis, dass Patienten mit systemisch wirksamen Erkrankungen ein deutlich höheres Risiko für Komplikationen bei der Augmentation tragen.
PD Dr. Dr. Matthias Tröltzsch
Eine genaue Anamnese ist also wichtig und kann den späteren Augmentationserfolg deutlich beeinflussen. Der Patient sollte unbedingt über Risikofaktoren aufgeklärt werden und es sollte – wenn möglich – versucht werden, beeinflussbare Risikofaktoren zu minimieren (beispielsweise Rauchen vermeiden, Diabetes gut einstellen, Vitamin-D-Mangel beheben).
Die Defektbiologie
Vergleichbar mit den medizinischen Faktoren und deren Einfluss auf den Implantaterfolg gibt es auch zu diesem wichtigen Thema wenig Literatur. Es lässt sich gut zeigen, dass Implantate im augmentierten Knochen die gleichen Erfolgsraten haben wie Implantate, die in ortsständigen Knochen gesetzt werden [Jensen und Terheyden, 2009; Troeltzsch et al., 2016; Urban et al., 2017]. Diese Erkenntnis unterstützt das Prinzip, dass das Implantat an die Stelle gesetzt werden sollte, wo es prothetisch benötigt wird.
Falls an der Stelle, an der das Implantat gebraucht wird, nicht genügend Knochen vorhanden ist, sollte nach Risikoabschätzung der medizinischen Faktoren augmentiert werden.PD Dr. Dr. Eik Schiegnitz
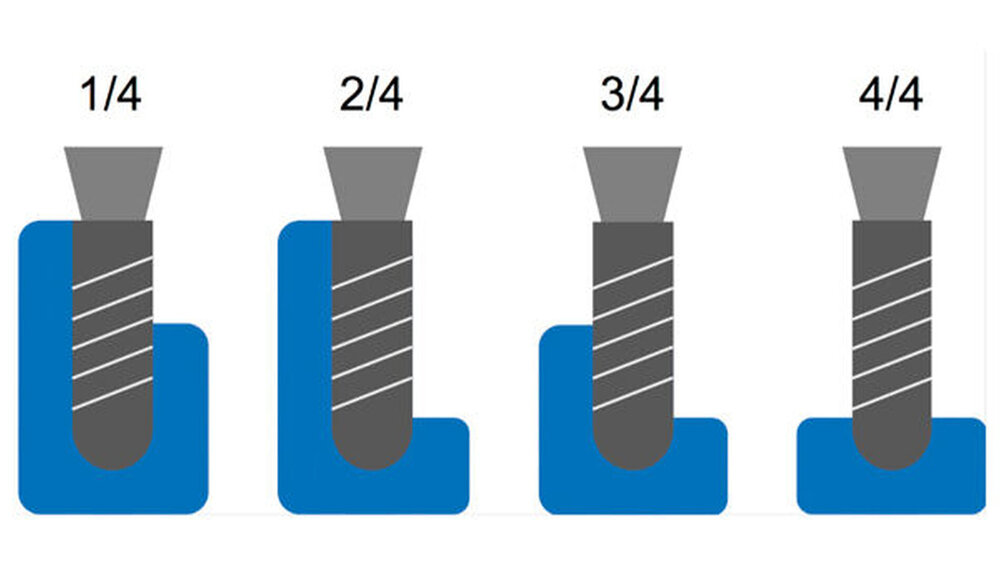
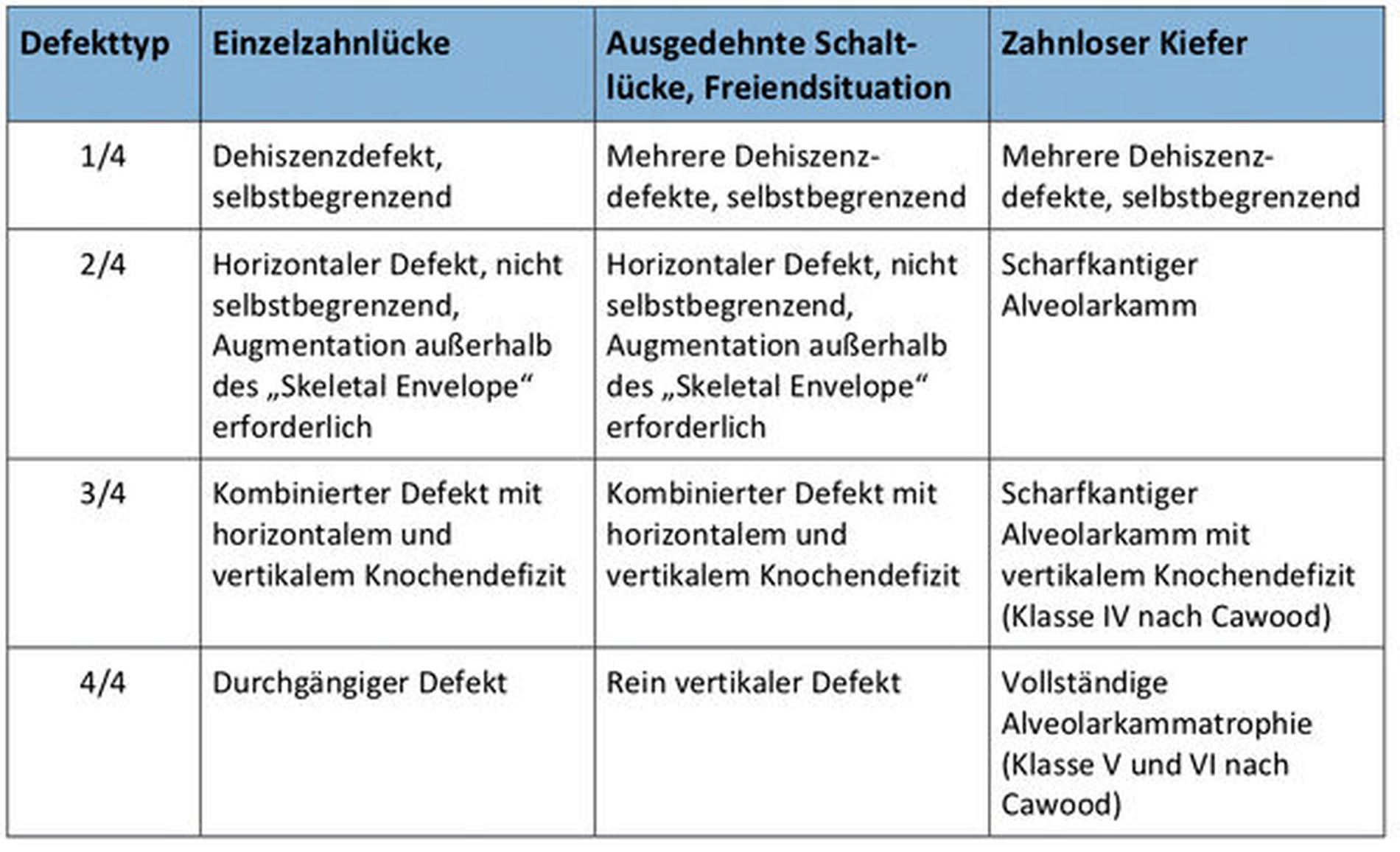
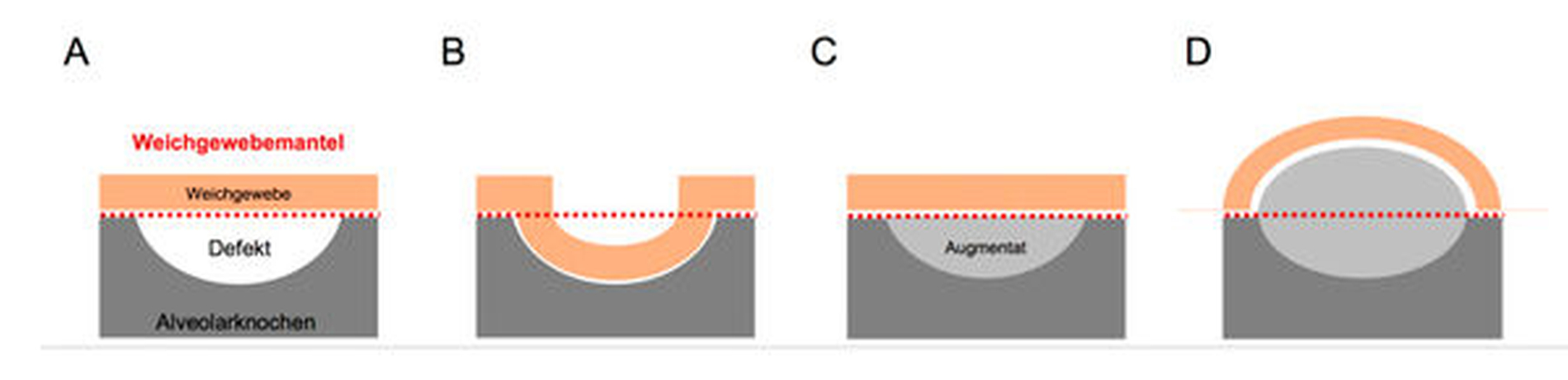
Allerdings ist die Erfolgsaussicht der Augmentation unter anderem vom vorhandenen Alveolarkammdefekt abhängig. Nach Terheyden lassen sich vier Defektarten einteilen, wobei der Aufwand und die Risiken für das Entstehen einer Komplikation mit der Defektgröße ansteigen (Abbildung 1) [Terheyden, 2010].
Besondere Bedeutung hat der den Defekt umfassende Weichgewebsmantel („Skeletal Envelope“). Diesen zu erfassen und als den den Augmentationserfolg mitbestimmenden Faktor zu definieren, war eine der zentralen Aufgaben des Autorenteams der Leitlinie (Abbildungen 2 und 3). In der wenigen Literatur [Lundgren et al., 1995; Yamada et al., 2003; Stavropoulos et al., 2005] und in der klinischen Praxis zeigt sich, dass ein Verdrängen des Weichgewebes über dessen ursprüngliche Position vor Entstehung des Defekts hinaus eine andere Art der Augmentation darstellt als eine Augmentation innerhalb der Position des Weichgewebsmantels. Dabei spielt es eine Rolle, wie weit der Weichgewebsmantel über dessen ursprüngliche Position hinaus verdrängt werden soll [Troeltzsch et al., 2016].
Markus Tröltzsch
Augmentationen, die den Weichgewebsmantel verdrängen, sind komplizierter, komplikations- und resorptionsanfälliger als Augmentationen, die das Weichgewebe nicht verdrängen müssen.
Die Defektform, die Position des Weichgewebsmantels und die konstitutionellen medizinischen Faktoren des Patienten bestimmen zusammen die biologische Kapazität des zu regenerierenden Areals. Je schlechter diese biologische Kapazität einzustufen ist, desto komplikationsträchtiger muss der Eingriff eingeschätzt werden.
Die Einteilung der Biomaterialien
Autologer Knochen
ist selbstredend biologisch am weitesten kompatibel zum Empfänger, da in dem Fall Spender und Empfänger identisch sind. Allerdings ist die Wertigkeit des Knochens von der Entnahmestelle abhängig, so ist Knochen vom Becken anders als Knochen vom Unterkiefer einzuschätzen. Als potenzielle Nachteile sind das grundsätzlich limitierte Knochenangebot des Patienten, mögliche Resorptionen und der entstehende Entnahmedefekt zu nennen.
Allogener Knochen
kommt von menschlichen Spendern und wird in verschiedenen Verfahren aufbereitet und gereinigt. Klinisch wird von der Unbedenklichkeit des Materials (wenn nach deutschen Richtlinien aufbereitet, sind dies Arzneimittel nach dem deutschen Arzneimittelgesetz) ausgegangen [Stopa et al., 2018; Solakoglu et al., 2019; Solakoglu et al., 2019], wobei aber diverse immunologische und infektiologische Fragestellungen bisher ungeklärt sind [Fretwurst et al., 2014; Ghanaati et al., 2014; Fretwurst et al., 2018; Li et al., 2019]. Zudem findet sich durch die unterschiedlichen Aufbereitungsprozesse wenig Literatur für die individuellen Materialien und klinischen Fragestellungen.
Xenogener Knochen
kommt von nichtmenschlichen Spendern, im Gebrauch ist Material vom Rind (bovin), Schwein (porcin), Pferd (equin), aber auch nicht unbedingt naheliegenden Spendern wie beispielsweise Korallen. Bei xenogenen Knochen handelt es sich um Medizinprodukte. Für diese Produkte wurden 2020 die Zulassungskriterien verschärft. Wichtig ist zu beachten, dass das jeweilige Produkt auch wirklich eine gute Datenlage aufweist und nicht nur die jeweilige Materialgruppe. Insbesondere einige bovine Produkte weisen eine gute Datenlage auf und sind resorptionsstabil [Klein et al., 2013; Majzoub et al., 2019; Mendoza-Azpur et al., 2019; Thoma et al., 2019].
Synthetische (alloplastische) Materialien
werden komplett künstlich hergestellt und sind daher aus Infektions- und immunologischen Gesichtspunkten unbedenklich. Sie sind bestenfalls als gleichwertig, eher noch als unterlegen zu anderen Knochenersatzmaterialien einzustufen, was die Regenerationskapazität angeht [Sanz und Vignoletti, 2015; Dau et al., 2016; Lorenz et al., 2016; Troeltzsch et al., 2016; Hung, Fu et al., 2019], können aber bei individueller Indikation klinisch äquivalent zu anderen Materialien genutzt werden. Ähnlich wie bei den Allografts gibt es aufgrund der großen Vielfalt wenig Literatur für die jeweiligen Materialien und spezielle Fragestellungen.
Auf dem Markt findet sich eine unübersichtliche Menge an Materialien. In der Leitlinie haben wir eine eigene umfangreiche Tabelle aufgeführt, bei der auch vermerkt ist, welche Materialien resorptionsstabil sind. Bitte beachten Sie bei der Auswahl des Materials, dass es für das infrage stehende Produkt auch für den Einsatzzweck ausreichend Literatur gibt. Häufig ist das nicht der Fall, sondern es wird sich allgemein auf die Stoffgruppe bezogen.
Augmentation einfacher Defizite und Defekte
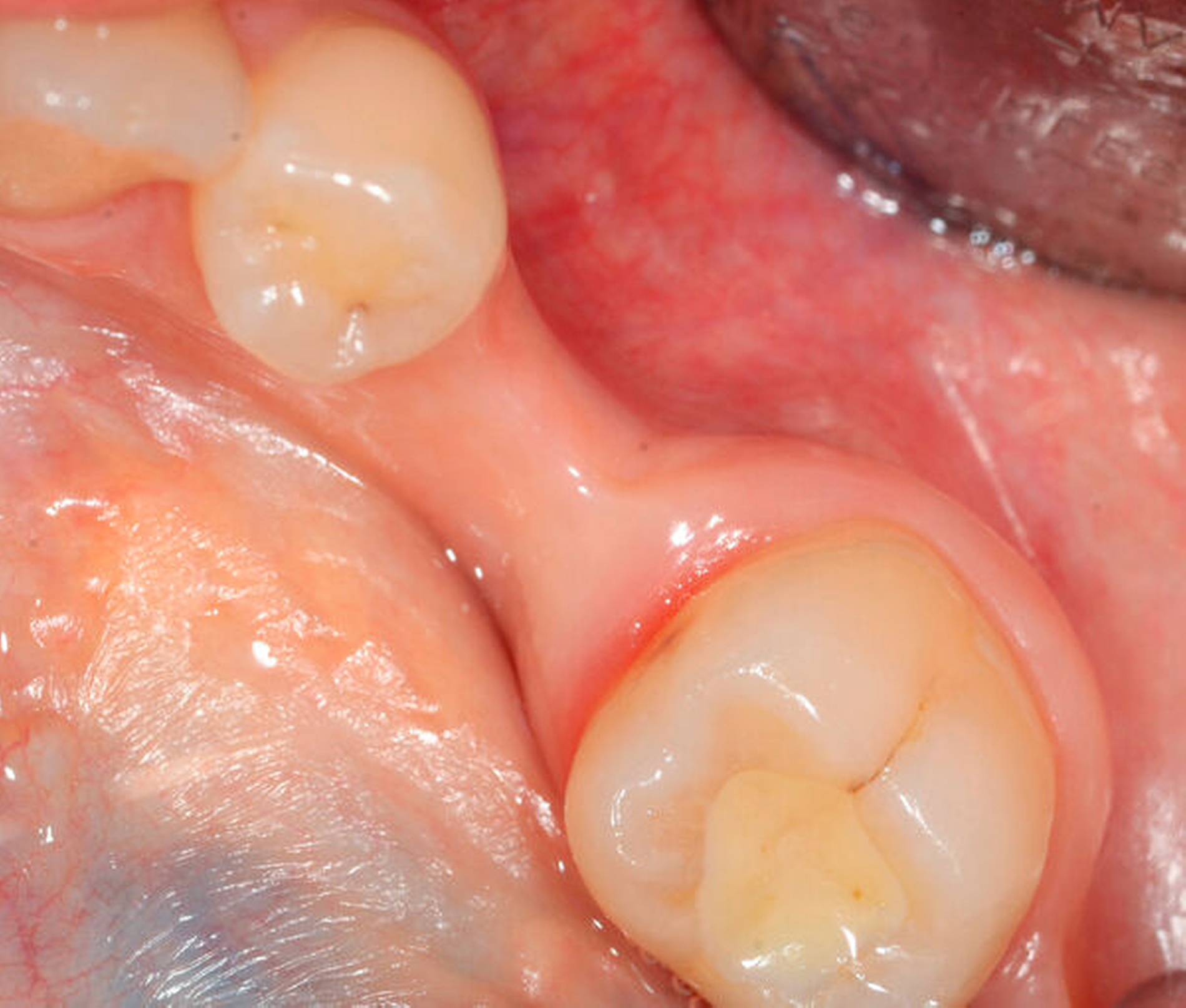
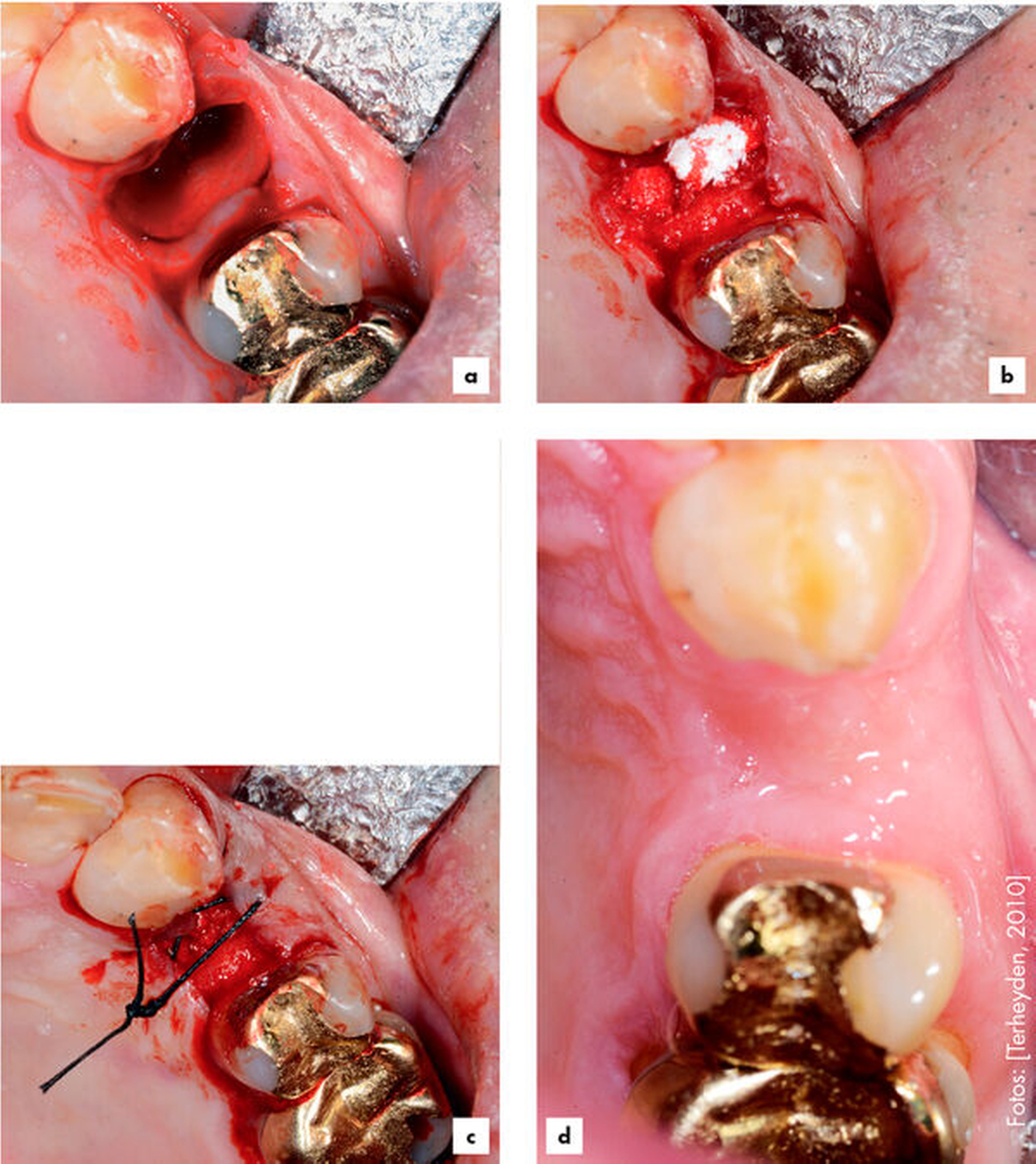
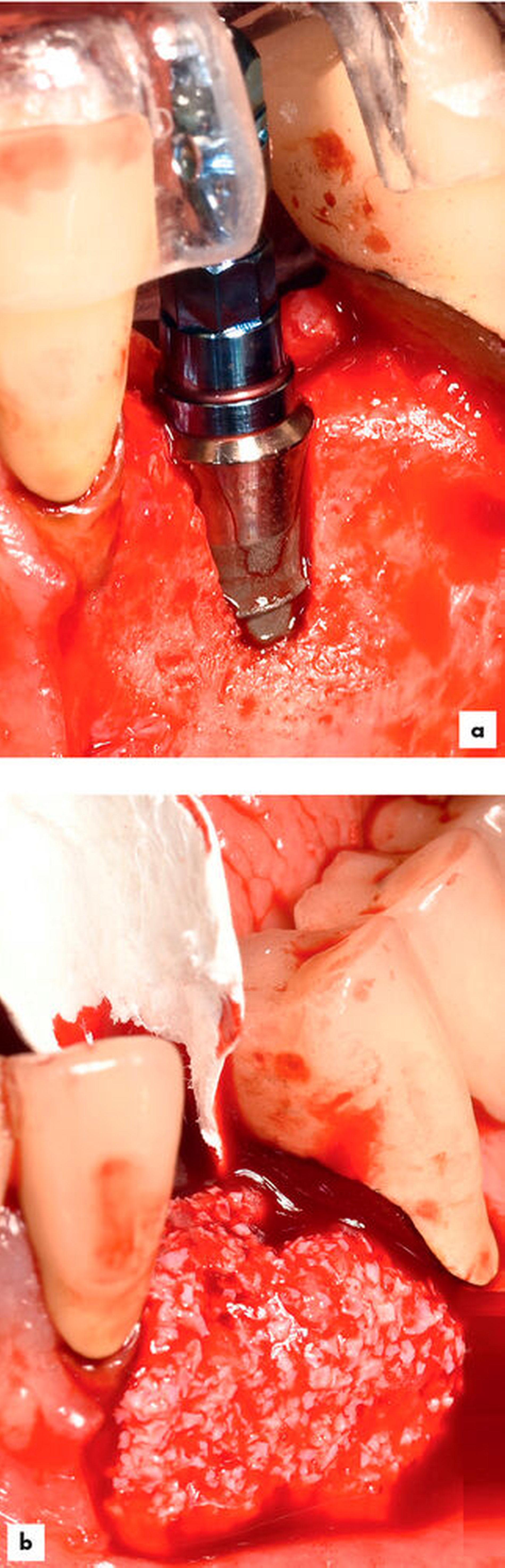
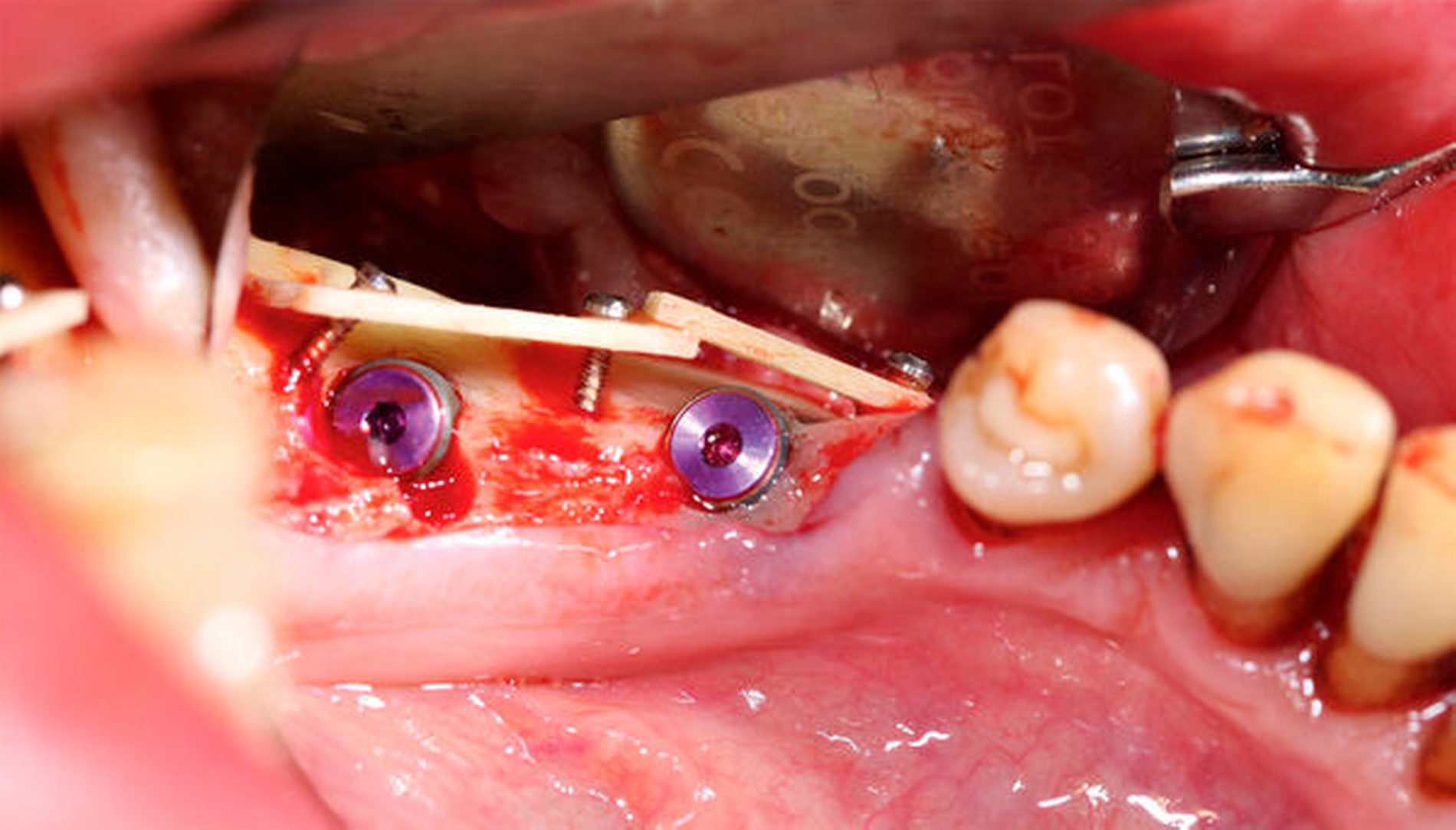
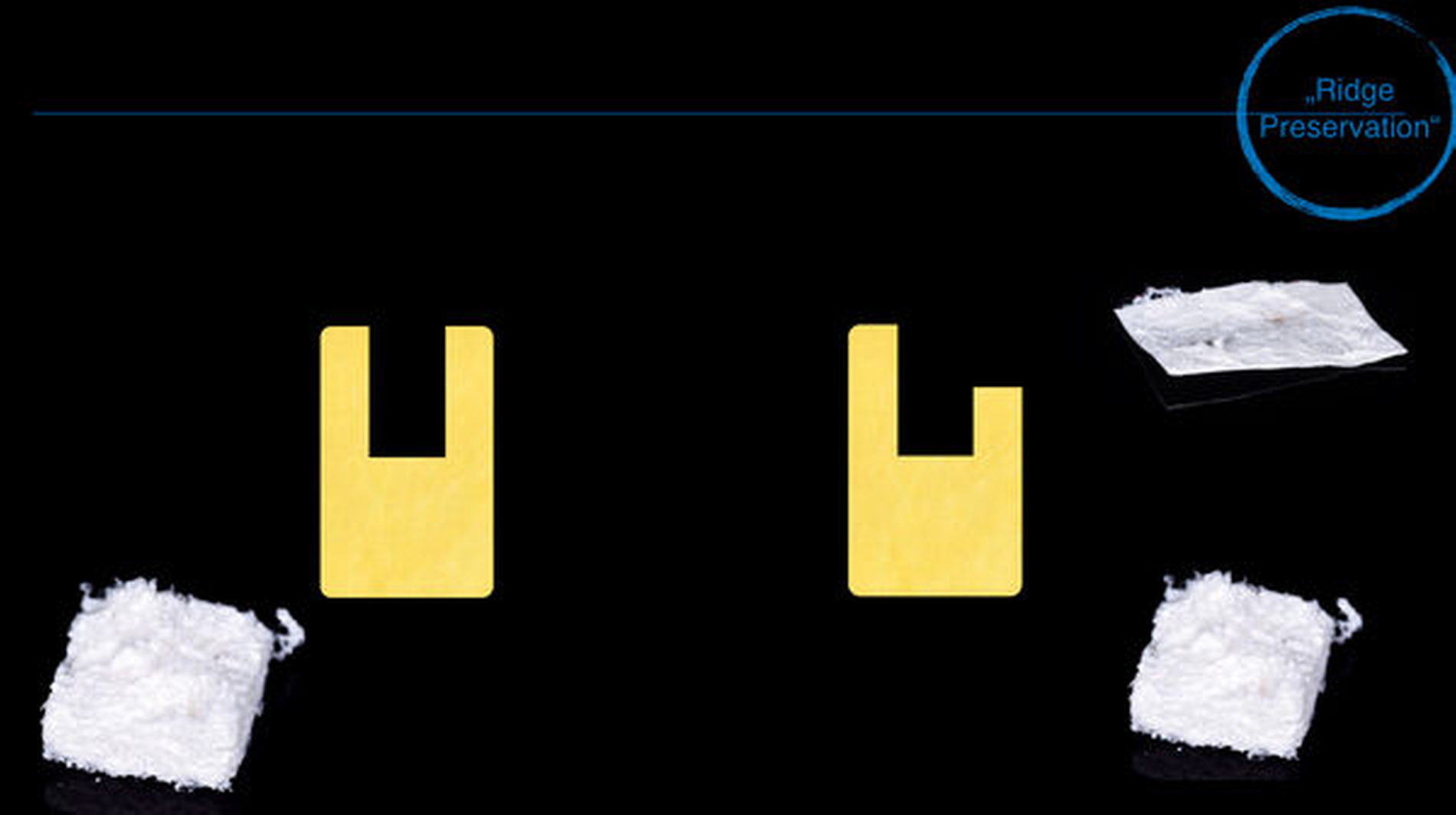
Ridge Preservation und Dehiszenzdefekte (Abbildungen 4 bis 6)
Die Ridge Preservation ist die Augmentation eines Defekts mit hoher biologischer Kapazität, nämlich der mehr oder weniger knochenbegrenzten frischen Extraktionsalveole, wodurch ein deutlich besserer Erhalt des Kieferkamms erreicht wird [Avila-Ortiz et al., 2014; Bonanini et al., 2014]. Beim Dehiszenzdefekt am Implantat wird eine kleine knöcherne Rezession an einer Implantatoberfläche beim Implantieren mit versorgt, hierbei wird der Weichgewebsmantel verdrängt, aber nicht über dessen ursprüngliche Position vor Entstehung des Defekts [Troeltzsch et al., 2016]. In beiden Fällen kommt partikuläres Material zum Einsatz. Wenn eine knöcherne Wand fehlt (also immer beim Dehiszenzdefekt), wird zusätzlich noch eine Membran verwendet [Llambes et al., 2007; Hassan, 2009; Jung et al., 2015; Troeltzsch et al., 2016]. Für diese Augmentationsmethoden können alle verfügbaren Materialien verwendet werden (wenn auch mit unterschiedlichem regenerativem Potenzial). Sogar für Platelet rich fibrin (PRF) [Schliephake et al., 2018], autologes Material aus extrahierten Zähnen [Ji-Young Lee, 2013; Kim et al., 2014; Schwarz et al., 2019] sowie Sonderwege wie die Socket-Shield-Technik [Gluckman et al., 2018] gibt es Literatur. Die meiste Evidenz findet sich aber für xenogenes und allogenes Material in absteigender Reihenfolge [Troeltzsch et al., 2019]. Ebenso können alle Membranarten verwendet werden, wobei resorbierbare Kollagenmembranen ein besonders günstiges Wirkungs-Risiko-Profil zu haben scheinen [Le und Borzabadi-Farahani, 2014; Troeltzsch et al., 2016].
Markus Tröltzsch
In diesen Defekten kann jedes Biomaterial verwendet werden, besondere Bedeutung kommt dem richtigen Einsatz der Membran zu. Die Ridge Preservation ist sehr gut dokumentiert und zeigt einen deutlichen Benefit für den Patienten.
Sinuslift/Sinusbodenelevation
Auch diese Defektkonfiguration weist eine hohe biologische Regenerationskapazität auf, da hier ein Raum mit vielen erhaltenen Knochenwänden innerhalb des Skeletal Envelope vorliegt. Es ist wichtig anzumerken, dass durch das Elevieren der Schneiderschen Membran nur Platz geschaffen wird, dies wirkt sich nicht wie der Weichgewebsmantel aus. Es lassen sich keine Unterschiede zwischen Sinuslift mit autogenem Material oder mit Knochenersatzmaterial in Bezug auf die Implantaterfolgsrate finden [Al-Nawas und Schiegnitz, 2014; Danesh-Sani et al., 2017; Starch-Jensen et al., 2018; Starch-Jensen et al., 2018a]. Auch die verschiedenen Techniken scheinen keine signifikanten Unterschiede aufzuzeigen [Esposito et al., 2014].
Der Sinuslift wurde in dieses Kapitel eingegliedert, da der Defekt eine hohe biologische Kapazität aufweist. Technisch ist diese Operation sicher nicht als einfach zu bezeichnen. Auch hier kann jedes verfügbare Biomaterial verwendet werden.
Horizontale und vertikale Defekte des Alveolarkamms
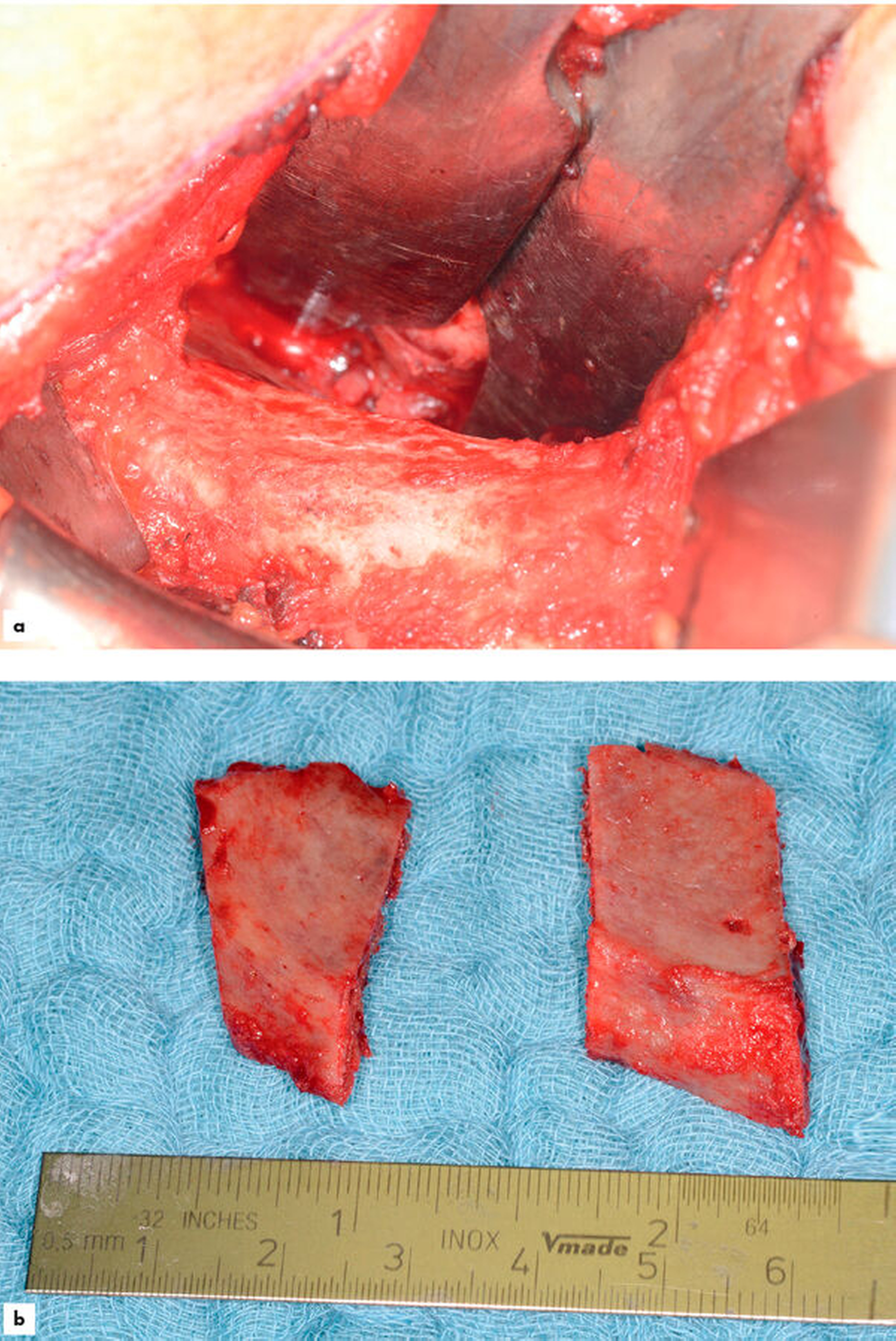
Bei diesen Defekten kommen nun die Fragen der zu augmentierenden Distanzen als Unterscheidungskriterium für das Prozedere auf. Strecken um 3 mm horizontal und vertikal können mit einer Kombination aus partikulärem Biomaterial und einer Membran erfolgreich augmentiert werden [Beitlitum et al., 2010; Kuchler und von Arx, 2014; Troeltzsch et al., 2016; Tolstunov et al., 2019]. Größere Strecken benötigen entweder stabile Barrieren (zum Beispiel Titan) oder Knochenblöcke [Troeltzsch et al., 2016]. Insgesamt weisen diese Techniken im Vergleich zu den im vorangegangenen Kapitel beschriebenen ein höheres Komplikations- und Misserfolgspotenzial auf.
Als Blockmaterial stehen autogener Knochen von extra- oder intraoralen Spenderregionen, allogene, xenogene und synthetische/alloplastische Blöcke zur Verfügung. Für synthetische Blöcke ist die klinische Datenlage nicht ausreichend, für xenogene und allogene Blöcke ist die Datenlage „sehr heterogen, teilweise kontrovers und insgesamt unzureichend“ (Leitlinie).
Somit verbleiben autogene Blöcke, wobei Blöcke aus intraoralen Regionen insgesamt eine geringere regenerative Kapazität aufweisen als Knochen aus extraoralen Spenderregionen – hier ist insbesondere der Beckenkamm zu nennen [Wein et al., 2015; Wein et al., 2019; Khojasteh et al., 2012; Khojasteh et al., 2012; Troeltzsch et al., 2016]. Allerdings ist in diesem Kontext auf den Entnahmedefekt und die damit eingehende Morbidität und mögliche assoziierte Komplikationen hinzuweisen.
Komplexe Augmentationen haben per se ein gewisses Komplikationspotenzial. Für die gewählte Operationstechnik sollte unbedingt ausreichend Evidenz zur Verfügung stehen.
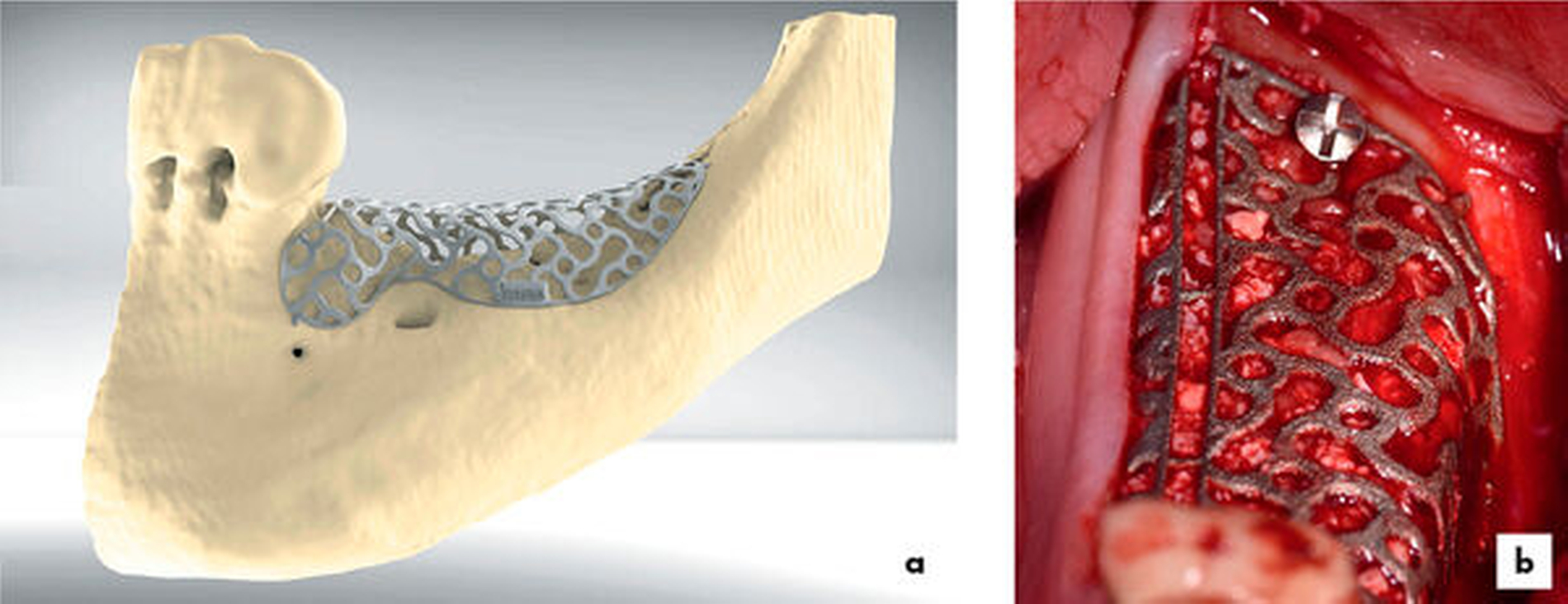
Alternativ zu den Blöcken kann auch mit GBR-Techniken (Guided Bone Regeneration) mit stabilen Barrieren gearbeitet werden, also partikuläres Material, das in einen Hohlraum gefüllt wird, der mit einer Titan-verstärkten Membran, einer Schalentechnik oder einem Titangitter offen gehalten wird [Cucchi et al., 2017; Tunkel et al., 2018; Briguglio et al., 2019]. Titangitter zeigen das Potenzial für ähnliche Regenerationsstrecken wie extraorale Blöcke und profitieren möglicherweise von der zusätzlichen Abdeckung mit einer Membran [Troeltzsch et al., 2016]. Bei den GBR-Techniken ist nicht primär das in den Hohlraum gefüllte Biomaterial, sondern die Barriere an sich für die zu erreichende Strecke und die Komplikationswahrscheinlichkeit verantwortlich [Troeltzsch et al., 2016; Stimmelmayr et al., 2014; Stimmelmayr et al., 2014a; Rocchietta et al., 2016; Sagheb et al., 2017; Tunkel et al., 2018].
Zusammenfassung
Der Praktiker trägt die Verantwortung für das eingesetzte Biomaterial und die daraus entstehenden Folgen, daher ist die Auswahl der Materialien nach der verfügbaren Evidenz wichtig. Hierbei sind nicht Tierstudien, sondern klinische Untersuchungen mit Langzeitdaten und hohem Evidenzgrad entscheidend.
Viele Aspekte, Methoden und Situationen sind trotz der insgesamt hohen Studienzahl nicht ausreichend untersucht; klar ist aber, dass Implantate in erfolgreich augmentierten Arealen die gleiche Prognose haben wie Implantate, für die nicht augmentiert werden musste.
Für Defekte mit hoher biologischer Regenerationskapazität sind alle verfügbaren Biomaterialien einsetzbar, für komplexe Defekte, die ein geringeres biologisches Regenerationspotenzial aufweisen, stehen insbesondere autologe Blöcke oder GBR-Techniken auch unter Zuhilfenahme von Titangittern oder anderen stabilen Barrieren im Fokus.
Die Augmentation der komplexen Defekte ist deutlich risikobehafteter als die Ridge Preservation oder die Regeneration eines Dehiszenszdefekts am Implantat. Der Weichgewebsmantel und dessen ursprüngliche Position vor Entstehung des Defekts spielen dabei eine entscheidende Rolle.
Link zur Leitlinie:www.dgzmk.de/leitlinien
Dr. Dr. Markus Tröltzsch
Zentrum für Zahn-, Mund- und Kieferheilkunde Ansbach Dr. Dr. Tröltzsch
Maximilianstr. 5, 91522 Ansbach
PD Dr. Dr. Peer W. Kämmerer, MA, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Oberstabsarzt Dr. Med. Dr. Med. Dent. Andreas Pabst
Klinik VII; Mund-, Kiefer- und plastische Gesichtschirurgie
Bundeswehrzentralkrankenhaus
Rübenacherstr. 170, 56072 Koblenz
Andreas1Pabst@bundeswehr.org
PD Dr. Med. Dr. Med. Dent. Philipp Kauffmann
Leitender Oberarzt
Klinik für Mund-, Kiefer- und Gesichtschirurgie,
Universitätsmedizin Göttingen
Robert-Koch-Str. 40, 37075 Göttingen
PD Dr. Med. Dr. MEd. Dent. Matthias Tröltzsch
Zentrum für Zahn-, Mund- und Kieferheilkunde Ansbach Dr. Dr. Tröltzsch
Maximilianstr. 5, 91522 Ansbach
und
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Ludwig-Maximilians-Universität München
Lindwurmstr. 2a, 80337 München
PD Dr. Dr. Eik Schiegnitz
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie – Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
PD Dr. Med. Dr. Med. Dent. Phillipp Brockmeyer
Klinik für Mund-, Kiefer- und Gesichtschirugie,
Universitätsmedizin Göttingen
Robert-Koch-Str. 40, 37075 Göttingen
Univ.-Prof. Dr. Med. Dr. Med. Dent. Bilal Al-Nawas
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
Literaturliste
Al-Nawas, B. and E. Schiegnitz (2014). „Augmentation procedures using bone substitute materials or autogenous bone - a systematic review and meta-analysis.“ Eur J Oral Implantol 7 Suppl 2: S219-234.
Avila-Ortiz, G., S. Elangovan, K. W. Kramer, D. Blanchette and D. V. Dawson (2014). „Effect of alveolar ridge preservation after tooth extraction: a systematic review and meta-analysis.“ J Dent Res 93(10): 950-958.
Beitlitum, I., Z. Artzi and C. E. Nemcovsky (2010). „Clinical evaluation of particulate allogeneic with and without autogenous bone grafts and resorbable collagen membranes for bone augmentation of atrophic alveolar ridges.“ Clin Oral Implants Res 21(11): 1242-1250.
Bonanini, M., A. Salgarelli, G. M. Macaluso, G. Avila-Ortiz, S. Elangovan, K. W. Kramer, D. Blanchette and D. V. Dawson (2014). „Effect of alveolar ridge preservation after tooth extraction: a systematic review and meta-analysis.“ Biomed Res Int 93(10): 950-958.
Briguglio, F., D. Falcomata, S. Marconcini, L. Fiorillo, R. Briguglio and D. Farronato (2019). „The Use of Titanium Mesh in Guided Bone Regeneration: A Systematic Review.“ Int J Dent 2019: 9065423.
Carr, A. B., R. L. V. Gonzalez, L. Jia and C. M. Lohse (2019). „Relationship between Selective Serotonin Reuptake Inhibitors and Risk of Dental Implant Failure.“ J Prosthodont 28(3): 252-257.
Cucchi, A., E. Vignudelli, A. Napolitano, C. Marchetti and G. Corinaldesi (2017). „Evaluation of complication rates and vertical bone gain after guided bone regeneration with non-resorbable membranes versus titanium meshes and resorbable membranes. A randomized clinical trial.“ Clin Implant Dent Relat Res 19(5): 821-832.
Danesh-Sani, S. A., S. P. Engebretson and M. N. Janal (2017). „Histomorphometric results of different grafting materials and effect of healing time on bone maturation after sinus floor augmentation: a systematic review and meta-analysis.“ J Periodontal Res 52(3): 301-312.
Dau, M., P. W. Kämmerer, K. O. Henkel, T. Gerber, B. Frerich and K. K. Gundlach (2016). „Bone formation in mono cortical mandibular critical size defects after augmentation with two synthetic nanostructured and one xenogenous hydroxyapatite bone substitute - in vivo animal study.“ Clin Oral Implants Res 27(5): 597-603.
Esposito, M., P. Felice and H. V. Worthington (2014). „Interventions for replacing missing teeth: augmentation procedures of the maxillary sinus.“ Cochrane Database Syst Rev(5): Cd008397.
Fretwurst, T., L. M. Gad, T. Steinberg, H. Schmal, R. Zeiser, A. K. Amler, K. Nelson and B. Altmann (2018). „Detection of major histocompatibility complex molecules in processed allogeneic bone blocks for use in alveolar ridge reconstruction.“ Oral Surg Oral Med Oral Pathol Oral Radiol.
Fretwurst, T., S. Grunert, J. P. Woelber, K. Nelson and W. Semper-Hogg (2016). „Vitamin D deficiency in early implant failure: two case reports.“ Int J Implant Dent 2(1): 24.
Fretwurst, T., A. Spanou, K. Nelson, M. Wein, T. Steinberg and A. Stricker (2014). „Comparison of four different allogeneic bone grafts for alveolar ridge reconstruction: a preliminary histologic and biochemical analysis.“ Oral Surg Oral Med Oral Pathol Oral Radiol 118(4): 424-431.
Ghanaati, S., M. Barbeck, P. Booms, J. Lorenz, C. J. Kirkpatrick and R. A. Sader (2014). „Potential lack of “standardized„ processing techniques for production of allogeneic and xenogeneic bone blocks for application in humans.“ Acta Biomater 10(8): 3557-3562.
Gluckman, H., M. Salama and J. Du Toit (2018). „A retrospective evaluation of 128 socket-shield cases in the esthetic zone and posterior sites: Partial extraction therapy with up to 4 years follow-up.“ Clin Implant Dent Relat Res 20(2): 122-129.
Hassan, K. S. (2009). „Autogenous bone graft combined with polylactic polyglycolic acid polymer for treatment of dehiscence around immediate dental implants.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 108(5): e19-25.
Heitz-Mayfield, L. J. (2008). „Peri-implant diseases: diagnosis and risk indicators.“ J Clin Periodontol 35(8 Suppl): 292-304.
Hung, C. C., E. Fu, H. C. Chiu and H. C. Liang (2019). „Bone formation following sinus grafting with an alloplastic biphasic calcium phosphate in Lanyu Taiwanese mini-pigs.“ J Periodontol.
Jensen, S. S. and H. Terheyden (2009). „Bone augmentation procedures in localized defects in the alveolar ridge: clinical results with different bone grafts and bone-substitute materials.“ Int J Oral Maxillofac Implants 24 Suppl: 218-236.
Ji-Young Lee, Y.-K. K., Yang-Jin Yi, Joon-Ho Choi (2013). „Clinical evaluation of ridge augmentation using autogenous tooth bone graft material: case series study.“ J Korean Assoc Oral Maxillofac Surg 39(4): 156–160.
Jung, R. E., G. I. Benic, D. Scherrer and C. H. Hammerle (2015). „Cone beam computed tomography evaluation of regenerated buccal bone 5 years after simultaneous implant placement and guided bone regeneration procedures--a randomized, controlled clinical trial.“ Clin Oral Implants Res 26(1): 28-34.
Khojasteh, A., H. Behnia, Y. S. Shayesteh, G. Morad and M. Alikhasi (2012). „Localized bone augmentation with cortical bone blocks tented over different particulate bone substitutes: a retrospective study.“ Int J Oral Maxillofac Implants 27(6): 1481-1493.
Khojasteh, A., G. Morad and H. Behnia (2012). „Clinical importance of recipient site characteristics for vertical ridge augmentation: A systematic review of literature and proposal of a classification.“ J Oral Implantol.
Kim, Y. K., P. Y. Yun, I. W. Um, H. J. Lee, Y. J. Yi, J. H. Bae and J. Lee (2014). „Alveolar ridge preservation of an extraction socket using autogenous tooth bone graft material for implant site development: prospective case series.“ J Adv Prosthodont 6(6): 521-527.
Klein, M. O., P. W. Kämmerer, H. Gotz, H. Duschner and W. Wagner (2013). „Long-term bony integration and resorption kinetics of a xenogeneic bone substitute after sinus floor augmentation: histomorphometric analyses of human biopsy specimens.“ Int J Periodontics Restorative Dent 33(4): e101-110.
Knabe, C., A. Mele, P. H. Kann, B. Peleska, D. Adel-Khattab, H. Renz, A. Reuss, M. Bohner and M. Stiller (2017).
„Effect of sex-hormone levels, sex, body mass index and other host factors on human craniofacial bone regeneration with bioactive tricalcium phosphate grafts.“ Biomaterials 123: 48-62.
Kuchler, U. and T. von Arx (2014). „Horizontal ridge augmentation in conjunction with or prior to implant placement in the anterior maxilla: a systematic review.“ Int J Oral Maxillofac Implants 29 Suppl: 14-24.
Le, B. T. and A. Borzabadi-Farahani (2014). „Simultaneous implant placement and bone grafting with particulate mineralized allograft in sites with buccal wall defects, a three-year follow-up and review of literature.“ J Craniomaxillofac Surg 42(5): 552-559.
Li, G., P. Li, Q. Chen, H. E. Thu and Z. Hussain (2019). „Current Updates on Bone Grafting Biomaterials and Recombinant Human Growth Factors Implanted Biotherapy for Spinal Fusion: A Review of Human Clinical Studies.“ Curr Drug Deliv 16(2): 94-110.
Llambes, F., F. J. Silvestre and R. Caffesse (2007). „Vertical guided bone regeneration with bioabsorbable barriers.“ J Periodontol 78(10): 2036-2042.
Lorenz, J., K. Eichler, M. Barbeck, H. Lerner, S. Stubinger, C. Seipel, T. J. Vogl, A. F. Kovacs, S. Ghanaati and R. A. Sader (2016). „Volumetric analysis of bone substitute material performance within the human sinus cavity of former head and neck cancer patients: A prospective, randomized clinical trial.“ Ann Maxillofac Surg 6(2): 175-181.
Lundgren, D., A. K. Lundgren, L. Sennerby and S. Nyman (1995). „Augmentation of intramembraneous bone beyond the skeletal envelope using an occlusive titanium barrier. An experimental study in the rabbit.“ Clin Oral Implants Res 6(2): 67-72.
Majzoub, J., A. Ravida, T. Starch-Jensen, M. Tattan and F. Suarez-Lopez Del Amo (2019). „The Influence of Different Grafting Materials on Alveolar Ridge Preservation: a Systematic Review.“ J Oral Maxillofac Res 10(3): e6.
Mendoza-Azpur, G., A. de la Fuente, E. Chavez, E. Valdivia and I. Khouly (2019). „Horizontal ridge augmentation with guided bone regeneration using particulate xenogenic bone substitutes with or without autogenous block grafts: A randomized controlled trial.“ Clin Implant Dent Relat Res 21(4): 521-530.
Rocchietta, I., M. Simion, M. Hoffmann, D. Trisciuoglio, M. Benigni and C. Dahlin (2016). „Vertical Bone Augmentation with an Autogenous Block or Particles in Combination with Guided Bone Regeneration: A Clinical and Histological Preliminary Study in Humans.“ Clin Implant Dent Relat Res 18(1): 19-29.
Sagheb, K., E. Schiegnitz, M. Moergel, C. Walter, B. Al-Nawas and W. Wagner (2017). „Clinical outcome of alveolar ridge augmentation with individualized CAD-CAM-produced titanium mesh.“ Int J Implant Dent 3(1): 36.
Sanz, M. and F. Vignoletti (2015). „Key aspects on the use of bone substitutes for bone regeneration of edentulous ridges.“ Dent Mater 31(6): 640-647.
Schimmel, M., M. Srinivasan, G. McKenna and F. Muller (2018). „Effect of advanced age and/or systemic medical conditions on dental implant survival: A systematic review and meta-analysis.“ Clin Oral Implants Res 29 Suppl 16: 311-330.
Schliephake, H., A. Sicilia, B. A. Nawas, N. Donos, R. Gruber, S. Jepsen, I. Milinkovic, A. Mombelli, J. M. Navarro, M. Quirynen, I. Rocchietta, M. Schiodt, S. Schou, A. Stahli and A. Stavropoulos (2018). „Drugs and diseases: Summary and consensus statements of group 1. The 5(th) EAO Consensus Conference 2018.“ Clin Oral Implants Res 29 Suppl 18: 93-99.
Schwarz, F., D. Sahin, K. Becker, R. Sader and J. Becker (2019). „Autogenous tooth roots for lateral extraction socket augmentation and staged implant placement. A prospective observational study.“ Clin Oral Implants Res.
Solakoglu, O., W. Gotz, G. Heydecke and H. Schwarzenbach (2019). „Histological and immunohistochemical comparison of two different allogeneic bone grafting materials for alveolar ridge reconstruction: A prospective randomized trial in humans.“ Clin Implant Dent Relat Res 21(5): 1002-1016.
Solakoglu, O., B. Steinbach, W. Gotz, G. Heydecke, K. Pantel and H. Schwarzenbach (2019). „Characterization of circulating DNA in plasma of patients after allogeneic bone grafting.“ Clin Oral Investig 23(12): 4243-4253.
Starch-Jensen, T., H. Aludden, M. Hallman, C. Dahlin, A. E. Christensen and A. Mordenfeld (2018). „A systematic review and meta-analysis of long-term studies (five or more years) assessing maxillary sinus floor augmentation.“ Int J Oral Maxillofac Surg 47(1): 103-116.
Starch-Jensen, T., A. Mordenfeld, J. P. Becktor and S. S. Jensen (2018a). „Maxillary Sinus Floor Augmentation With Synthetic Bone Substitutes Compared With Other Grafting Materials: A Systematic Review and Meta-analysis.“ Implant Dent 27(3): 363-374.
Stavropoulos, A., J. R. Nyengaard, L. Kostopoulos and T. Karring (2005). „Implant placement in bone formed beyond the skeletal envelope by means of guided tissue regeneration: an experimental study in the rat.“ J Clin Periodontol 32(10): 1108-1115.
Stimmelmayr, M., W. Gernet, D. Edelhoff, J. F. Guth, A. Happe and F. Beuer (2014). „Two-stage horizontal bone grafting with the modified shell technique for subsequent implant placement: a case series.“ Int J Periodontics Restorative Dent 34(2): 269-276.
Stimmelmayr, M., J. F. Guth, M. Schlee and F. Beuer (2014a). „Vertical ridge augmentation using the modified shell technique--a case report.“ J Oral Maxillofac Surg 72(2): 286-291.
Stopa, Z., M. Siewert-Gutowska, K. Abed, D. Szubinska-Lelonkiewicz, A. Kaminski and P. Fiedor (2018). „Evaluation of the Safety and Clinical Efficacy of Allogeneic Bone Grafts in the Reconstruction of the Maxilla and Mandible.“ Transplant Proc 50(7): 2199-2201.
Terheyden, H. (2010). „Knochenaugmentationen in der Implantologie.“ Deutsche Zahnärztliche Zeitung 2010(6): 320-330.
Thoma, D. S., S. P. Bienz, E. Figuero, R. E. Jung and I. Sanz-Martin (2019). „Efficacy of lateral bone augmentation performed simultaneously with dental implant placement: A systematic review and meta-analysis.“ J Clin Periodontol 46 Suppl 21: 257-276.
Tolstunov, L., J. F. E. Hamrick, V. Broumand, D. Shilo and A. Rachmiel (2019). „Bone Augmentation Techniques for Horizontal and Vertical Alveolar Ridge Deficiency in Oral Implantology.“ Oral Maxillofac Surg Clin North Am 31(2): 163-191.
Troeltzsch, M., S. Burg, M. Troeltzsch, M. Gosau and R. Smeets (2019). „Augmentation mit allogenen Knochenersatzmaterialien.“ Implantologie 27(4): 351–360.
Troeltzsch, M., P. Kämmerer, A. Pabst, M. Tröltzsch, P. Kauffmann, E. Schiegnitz, P. Brockmeyer and B. Al-Nawas. (2020). „Implantologische Indikationen für die Anwendung von Knochenersatzmaterialien.“ AWMF-Registriernummer: 083-009,. from www.awmf.org/leitlinien/detail/ll/083-009.html
Troeltzsch, M., P. Kämmerer, A. Pabst, M. Tröltzsch, P. Kauffmann, E. Schiegnitz, P. Brockmeyer and B. Al-Nawas. (2020). „Methodenreport zur Leitlinie Implantologische Indikationen für die Anwendung von Knochenersatzmaterialien.“ from www.awmf.org/leitlinien/detail/ll/083-009.html
Troeltzsch, M., M. Troeltzsch, P. Kauffmann, R. Gruber, P. Brockmeyer, N. Moser, A. Rau and H. Schliephake (2016). „Clinical efficacy of grafting materials in alveolar ridge augmentation: A systematic review.“ J Craniomaxillofac Surg 44(10): 1618-1629.
Tunkel, J., R. Wurdinger and L. de Stavola (2018). „Vertical 3D Bone Reconstruction with Simultaneous Implantation: A Case Series Report.“ Int J Periodontics Restorative Dent 38(3): 413-421.
Urban, I. A., A. Monje, J. L. Lozada and H. L. Wang (2017). „Long-term Evaluation of Peri-implant Bone Level after Reconstruction of Severely Atrophic Edentulous Maxilla via Vertical and Horizontal Guided Bone Regeneration in Combination with Sinus Augmentation: A Case Series with 1 to 15 Years of Loading.“ Clin Implant Dent Relat Res 19(1): 46-55.
Wein, M., T. Fretwurst, S. Nahles, F. Duttenhoefer, P. Tomakidi, T. Steinberg and K. Nelson (2015). „Pilot investigation of the molecular discrimination of human osteoblasts from different bone entities.“ J Craniomaxillofac Surg 43(8): 1487-1493.
Wein, M., D. Huelter-Hassler, K. Nelson, T. Fretwurst, S. Nahles, G. Finkenzeller, B. Altmann and T. Steinberg (2019). „Differential osteopontin expression in human osteoblasts derived from iliac crest and alveolar bone and its role in early stages of angiogenesis.“ J Bone Miner Metab 37(1): 105-117.
Wu, X., K. Al-Abedalla, S. Abi-Nader, N. G. Daniel, B. Nicolau and F. Tamimi (2017). „Proton Pump Inhibitors and the Risk of Osseointegrated Dental Implant Failure: A Cohort Study.“ Clin Implant Dent Relat Res 19(2): 222-232.
Yamada, Y., K. Nanba and K. Ito (2003). „Effects of occlusiveness of a titanium cap on bone generation beyond the skeletal envelope in the rabbit calvarium.“ Clin Oral Implants Res 14(4): 455-463.