PRF: Biologie und Wirkungsweise, Indikationen, klinische Anwendung
Erstmals wurde die Anwendung autologer Thrombozytenkonzentrate 1940 beschrieben, hier zur Rekonstruktion peripherer Nerven [Ghanaati et al., 2018]. Die Anwendung eines autologen, thrombozytenreichen Humanplasmas aufgrund seiner hämostatischen und adhäsiven Eigenschaften in der Chirurgie wurde 1954 von Kingsley beschrieben [Kingsley, 1954; Mozzati et al., 2010]. Daraus entwickelte sich bereits in den frühen 1970er- und 1980er-Jahren das Konzept des Fibrinklebers – ein Blutkoagel aus Fibrinogen und Thrombin, das zur Defektdeckung zunächst in Tierexperimenten und später in der klinischen Applikation genutzt wurde [Matras, 1982]. Nachteile dieses frühen Fibrinklebesystems wurden in der möglichen Übertragung von Viren aufgrund der Verwendung von Spender-Kryopräzipitaten gesehen.
Fibrinogen wurde daraufhin alternativ bald aus autologem Plasma gewonnen und mit Rinderthrombin und Kalzium versetzt, um final Fibrin zu bilden. Fibrin wird aufgrund seiner hohen Biokompatibilität, die eine hervorragende Nische für Stamm- oder Vorläuferzellen darstellt, zur Regeneration mannigfaltiger Organsysteme genutzt [Ahmed et al., 2008]. Die Addition der Thrombozyten in dieses Konzept erfolgte erst später [Alsousou et al., 2009]. Whitman et al. demonstrierten ein Thrombozytengel, das nach autologer Blutentnahme in einem zweistufigen Zentrifugationsverfahren unter Zugabe von Thrombin zur Thrombozytenaktivierung präpariert werden konnte [Whitman et al., 1997]. Aufbauend auf Arbeiten von Knighton et al., die erstmals das Konzept zur Wundheilung von kutanen Ulcera mittels Wachstumsfaktorapplikation aus autologen Thrombozytenkonzentraten einführten [Knighton et al., 1986], entwickelte sich die erste Generation der autologen Thrombozytenkonzentrate [Marx et al., 1998].
Platelet-Rich Plasma (PRP) gilt als wichtigster Vertreter dieser Klasse [Moraes et al., 2013]. PRP kann definiert werden als Volumenanteil des Plasmas im autologen Vollblut, der eine um bis zu fünffach erhöhte Thrombozytenkonzentration im Vergleich zum Spenderblut aufweisen kann [Marx et al., 1998]. Nach venöser Blutentnahme über ein spezifisches Entnahmeset mit Plastik-Tubes wird das gewonnene Blut mit einer Antikoagulanz (hauptsächlich Thrombin oder Calcium-Chlorid) versetzt und anhand unterschiedlicher Gravitationskräfte bei zweimaliger Zentrifugation mittels Tischzentrifugationssystem in verschiedene Phasen getrennt. Hieraus können nun die Thrombozyten als sogenannter PRP-Clot extrahiert werden [Alsousou et al., 2009]. Diese Verfahren werden weiterhin erfolgreich in weiten Teilen der regenerativen Medizin verwendet. Dennoch werden einige Nachteile dieser Methoden in der aktuellen Literatur diskutiert: Zum einen kommt es wegen des Zeitbedarfs bei der PRP-Herstellung zum obligaten Einsatz einer Antikoagulanz, was das Konzept einer rein autologen Applikation konterkariert und einen negativen Einfluss auf die Wachstumsfaktorexpression zu haben scheint. Außerdem ist der Zentrifugationsprozess mit zwei Durchgängen aufwendig und bei der Wundheilung beteiligte Zellen wie Leukozyten werden zum Großteil vor der Anwendung exkludiert [Ghanaati et al., 2018].
Darüber hinaus gilt es, auch interindividuelle Unterschiede des Spender-/Empfängersystems zu berücksichtigen, die sowohl in der Thrombozytenkonzentration als auch in der Wachstumsfaktorexpression stark variieren können und sich gegenseitig zu bedingen scheinen [Weibrich et al., 2002]. Unterschiedliche PRP-Konzentrationen scheinen bei der Anwendung somit einen variablen Effekt auf die Wundheilungsprozesse auszuüben [Alsousou et al., 2009], die sich in In-vitro-Analysen bestätigen lassen [Dohan Ehrenfest et al., 2012].
Um diese Nachteile zu beheben, wurde die „second generation“ der autologen Thrombozytenkonzentrate entwickelt, deren wichtigster Vertreter die durch Choukroun et al. erstmals 2001 präsentierte PRF darstellt [Miron et al., 2017]. PRF zeichnet sich durch einen einmaligen Zentrifugationsprozess aus, der insbesondere ohne Zusatz einer Antikoagulanz abläuft [Fujioka-Kobayashi et al., 2017]. Es kommt zu einer Aktivierung der Thrombozyten und einer Polymerisierung des Fibrins. Je nach gewählter Zentrifugalkraft und nach Tube-System (Glas- oder Plastikbeschichtung) entstehen drei Phasen: ein roter Thrombus, der in Kontakt mit der Basis der roten Blutkörperchen steht, ein azelluläres Fibringel und ein „Buffy coat“ als weißliche Linien, die der Ansammlung von Thrombozyten innerhalb der PRF-Fibrinmatrix entsprechen [Dohan et al., 2006]. Zur weiteren Anwendung kann je nach klinischer Indikation ein fester oder ein flüssiger PRF-Fibrinclot extrahiert werden.
Biologische Wirkweise
Um die Integrität des Gewebes nach einer Verletzung, nach einem chirurgischen Eingriff oder nach einer Fremdkörperimplantation wiederherzustellen, kommt es durch das Zusammenspiel von Immunzellen, Wachstumsfaktoren, Extrazellularmatrix und den sich im Wundbett befindenden Zellen zur Gewebsregeneration. Bei der Heilung werden grob zwei Prozesse unterschieden: die inflammatorische und die proliferative Phase. In der inflammatorischen Phase wird durch die Aktivität von peripheren Monozyten aus dem Blut die Wunde von pathogenen Fremdkörpern gereinigt. In der proliferativen Phase wird die Wunde durch eine Gefäßneubildung de novo (Angiogenese), die Wiederherstellung von peripheren Nerven und die Reorganisation des Gewebes wieder verschlossen [Canedo-Dorantes und Canedo-Ayala, 2019]. Das PRF kann diese Prozesse maßgeblich beeinflussen, insbesondere durch sein herausragendes pro-angiogenes Potenzial.
Das PRF besteht aus Thrombozyten, Leukozyten, Zytokinen, glykämischen Ketten sowie Glykoproteinen, vermischt mit einem langsam polymerisierenden Fibrinnetzwerk. In diesem „Fibrinnetz“ sind die verschiedenen Zelltypen „gefangen“, durch deren Zusammenspiel die Proliferation und die Differenzierung von weiteren Zelllinien vorangetrieben und somit die örtliche Regeneration wie oben beschrieben initiiert, zeitlich orchestriert und verkürzt werden können [Miron et al., 2017]. Fibrin gilt hierbei als natürlicher Angiogeneseinitiator und stellt durch das Anlocken von zirkulierenden Stammzellen den Nährboden für eine epithelial optimierte Wundheilung [Faot et al., 2017]. Dadurch kommt dem Fibrinnetzwerk eine gesonderte Stellung zu: Während es bei Erstgenerationspräparaten zu einem einmaligen „outburst“ der Wachstumsfaktoren kommt, ermöglicht das Fibrinnetzwerk die räumliche Zell-Zell-Interaktion und ist maßgeblich für die (im Vergleich zur PRP) langsamere und kontinuierliche (physiologischere) Wachstumsfaktorfreisetzung aus den alpha-Granula der Thrombozyten verantwortlich [Miron et al., 2019]. In dem PRF enthaltene und für die Angiogenese wichtige Zytokine sind vor allem TGFβ-1, VEGF, PDGF, IGF I und II, IL-1β, IL-4, IL-6 sowie TNF-α [Dohan et al., 2006a; 2006b; Miron et al., 2017]. Im Zusammenspiel kann durch die Zugabe von PRF somit der komplexe Prozess der weichgeweblichen Wundheilung optimiert werden.
Es gibt derzeit eine Vielzahl an Tischzentrifugen und Abnahmesystemen zur Herstellung verschiedener PRF-Protokolle auf dem Markt. Neuere Untersuchungen zeigen, dass unterschiedliche Zentrifugationsverfahren und -zeiten einen signifikanten Einfluss auf die Wachstumsfaktorexpression haben [Miron et al., 2019]. Dies könnte daran liegen, dass bestimmte Zelltypen in Abhängigkeit von der kumulativen Zentrifugalkraft unterschiedlich verteilt werden. Außerdem wurden für jede Zentrifuge verschiedene Vibrationsprotokolle festgestellt, die jeweils zu unterschiedlichem Zellgehalt und Aufbau der PRF-Membran führen [Dohan Ehrenfest et al., 2009]. Die exakte Darstellung und die begründete Auswahl unter den diversen Protokollen der Herstellungsmethoden werden demzufolge immer mehr in den Mittelpunkt der aktuellen Literaturdiskussion gestellt [Dohan Ehrenfest et al., 2018]. Die Frankfurter Arbeitsgruppe um Ghanaati et al. verglich erstmals wissenschaftlich die unterschiedlichen Protokolle und zeigte immunhistochemisch die Auswirkungen der Zentrifugalkraft auf die Verteilung von Monozyten, T- und B-Lymphozyten, neutrophilen Granulozyten, CD34-positiven Stammzellen und Thrombozyten als für die Wundheilung und die Geweberegeneration relevante Zellpopulationen innerhalb der PRF [Ghanaati et al., 2014]. Daraus entwickelte sich das „low speed centrifugation concept“ (LSCC) was in autologen PRF-basierten Matrizen zu einem signifikanten und vor allem längerfristigen Anstieg der Leukozyten- und der Thrombozytenzahl sowie der Wachstumsfaktorkonzentration führen kann [Choukroun und Ghanaati, 2018]. In Tiermodellen konnte gezeigt werden, dass die bei In-vitro-Versuchen nachgewiesenen Wachstumsfaktoren auch in vivo zu einer vermehrten Gefäßneubildung und einer schnelleren Weichgewebsregeneration führen [Miron et al., 2017].
Eine eindeutige Evidenz und wissenschaftlich fundierte präklinische Studien zum möglichen Einfluss der PRF auf die ossäre Regeneration fehlen bis dato in der aktuellen Literaturdiskussion [Miron et al., 2017]. Zwar zeigen vereinzelte In-vitro-Studien einen positiven Einfluss auf die Differenzierung, die Proliferation und die Vitalität von Osteoblasten und die Inhibierung der Osteoklastogenese [Strauss et al., 2019]. In anderen, In-vivo-Studien konnte dieser Effekt jedoch nicht bestätigt werden [Faot et al., 2017]. Die kontroverse Datenlage spiegelt jedoch nicht die aktuell sehr häufige klinische Anwendung der PRF auch im Rahmen der „guided bone regeneration“ wider. Weitere (insbesondere klinische) Studien sollten daher hier dringend initiiert werden, um den praktischen Gebrauch autologer Thrombozytenkonzentrate auch in dieser Indikation wissenschaftlich fundieren zu können.
Indikationen zur klinischen Anwendung
Im Bereich der dento-alveolären Chirurgie hat die Anwendung autologer Thromboyztenkonzentrate heute einen hohen Stellenwert in der klinischen Anwendung (Tabelle 1). PRF findet Anwendung sowohl in Form eines Clots, als Membran oder flüssig in Kombination mit unterschiedlichen Biomaterialien wie zum Beispiel Membranen oder partikulären Knochenersatzmaterialien. Der Clot kann nach der Zentrifugation in die Form einer Membran gepresst und mit einer sterilen Pinzette und Schere auf die benötigte Größe und Form getrimmt werden. Multiple Studien konnten bis dato einen pro-angiogenen Effekt der PRF insbesondere auf die weichgewebliche Regeneration darstellen, der mit einer optimierten Wundheilungsrate einhergeht [Ghanaati et al., 2018].
PRF kann bei der Behandlung von Extraktionsalveolen zur Alveolar Ridge Preservation eingesetzt werden (Abbildung 1). Hier führt es zu einer schnelleren Regeneration und Wundheilung und kann die postoperativen Komplikationsraten signifikant senken. Auch der Einsatz bei operativer Weisheitszahnentfernung ist in diesem Kontext beschrieben und geht mit einer geminderten postoperativen Komplikationsrate und weniger postoperativen Schmerzen einher [Choukroun et al., 2006; Hoaglin und Lines, 2013; He et al., 2017; Pan et al., 2019]. Weiterhin kommt PRF in der parodontalen Chirurgie bei Rezessionsdeckungen zum Einsatz [Lekovic et al., 2012], wo es die Regeneration parodontaler Defekte signifikant optimieren kann [Miron et al., 2017, Shah et al., 2015].
In der Implantologie findet PRF neben der Ridge Preservation und der Auflagerungsosteoplastik auch bei Sinusliftprozeduren Anwendung (Abbildung 2) [Damsaz et al., 2020]. Im Rahmen einer klinischen Studie konnte gezeigt werden, dass der Einsatz von PRF als alleiniges Füllmaterial zu einer suffizienten Implantatstabilität und Verknöcherung im Langzeit-Follow-up führen kann [Simonpieri et al., 2011].
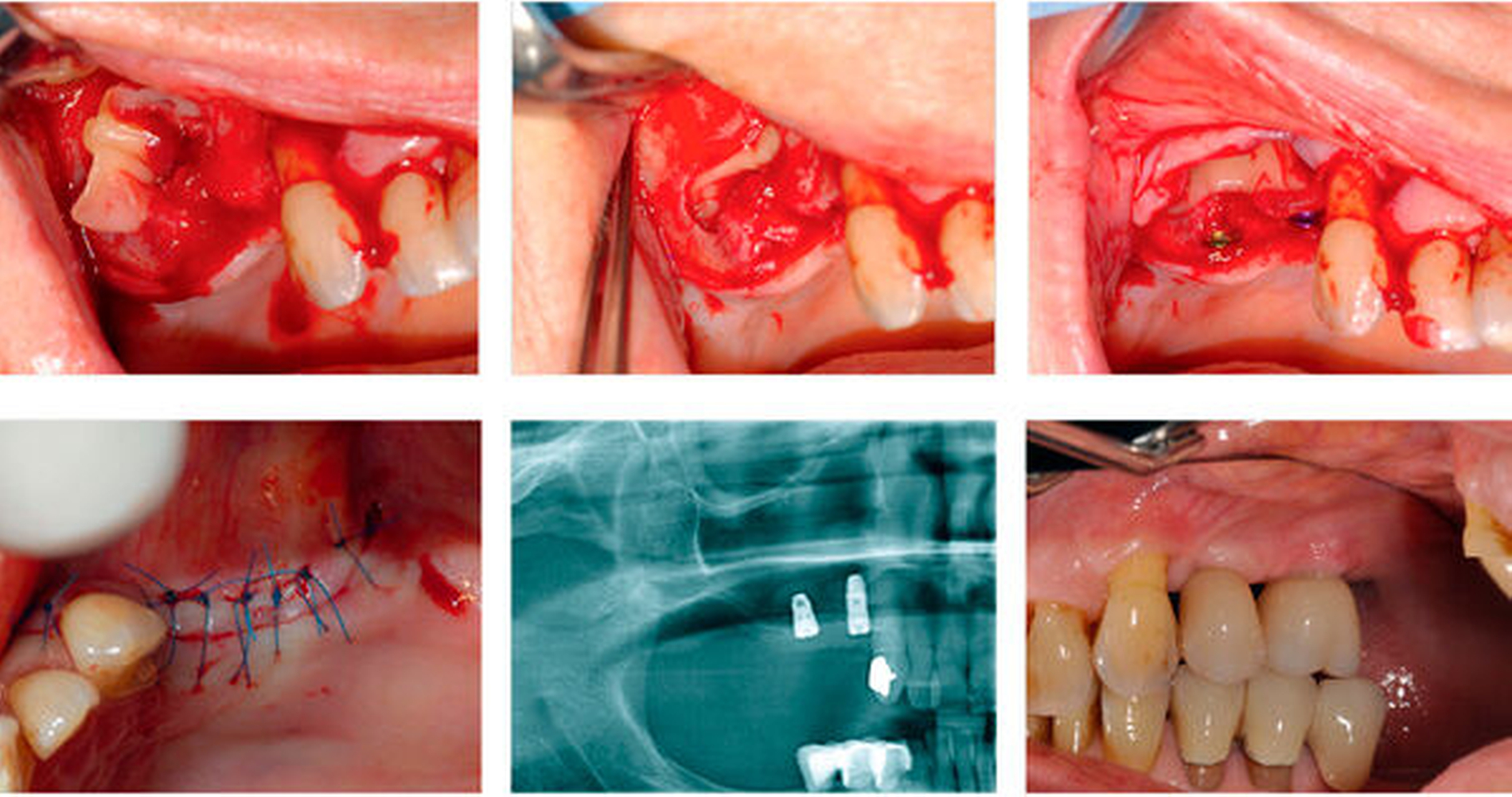
Weite Verbreitung findet die Kombination von PRF und Knochenersatzmaterial zur intraoralen Knochenaugmentation / guided bone regeneration procedures (Abbildung 3). Eine eindeutige Evidenz muss jedoch – wie angesprochen – bei teils kontroversen Ergebnissen diskutiert werden [Liu et al., 2019; Pripatnanont et al., 2013; Yoon et al., 2014]. Eine mögliche Erklärung für die unterschiedlichen Ergebnisse der Studien könnte in der Diversität der analysierten Materialien und deren spezifischen biophysikalischen Eigenschaften sowie den unterschiedlichen Untersuchungszeitpunkten liegen. Insbesondere die frühe Scaffold/Gewebe-Reaktion scheint hier von herausragender Bedeutung, die initial eine stabile Osteointegration bedingt und eine subsequente Einheilung erreichen lässt [Khalil et al., 2011].
Auch in der „großen“ MKG- und plastischen Chirurgie wird PRF mannigfaltig verwendet, so zum Beispiel bei der operativen fazialen Narben- und Faltenkorrektur [Sclafani, 2011; Hassan et al., 2020]. Auch bei onkologischen Fragestellungen und insbesondere zur Therapie der Medikamenten-assoziierten Kiefernekrose kann die Anwendung von PRF indiziert sein [Ghanaati et al., 2018], hier zeigt sich jedoch ebenfalls bis dato eine widersprüchliche Evidenz zum Einfluss auf die weichgewebliche Abheilung und die Minderung des Auftretens von Rezidiven [Blatt et al., 2022].
Aktuell wird die bestehende Evidenz zur klinischen Indikation und Anwendung der PRF kritisch evaluiert und durch die Deutsche Gesellschaft für Implantologie (DGI) unter Schirmherrschaft der „Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften“ (AWMF) in einer konsensusbasierten S3-Leitlinie („Der Einsatz von Platelet Rich Fibrin in der dentalen Implantologie“) erarbeitet. Eine Veröffentlichung der Leitlinie ist für Ende 2022 geplant.
Zusammenfassung und Ausblick
Autologe Thrombozytenkonzentrate wie die PRF stellen ein wichtiges therapeutisches Additivum in der regenerativen und rekonstruktiven Kopf-Hals-Chirurgie dar. Durch ihr pro-angiogenes Potenzial haben sie insbesondere Einfluss auf eine weichgeweblich optimierte Regeneration mit belastbarer Evidenz für einen Nutzen bei der dento-alveolären Chirurgie, bei parodontal-chirurgischen und bei (prä)implantologischen Eingriffen. Weiterführende Studien sind jedoch unabdingbar, um den möglichen Einfluss autologer Thrombozytenkonzentrate auch auf Prozeduren der knöchernen Regeneration wissenschaftlich fundiert bewerten zu können. Insbesondere die Regeneration kombinierter hart- und weichgeweblicher Defekte stellt eine häufige klinische Herausforderung in der regenerativen oralen und fazialen Chirurgie dar [Turnbull et al., 2018].
<image seo-title="" alt-text="" aspect-ratio="16-9" xlink:href="https://hcms-cms.medtrix.group/zm/hcms/v3.1/entity/pictures/151917" xlink:role="censhare:///service/masterdata/asset_rel_typedef;key=actual."/>
| Hendrik Naujokat
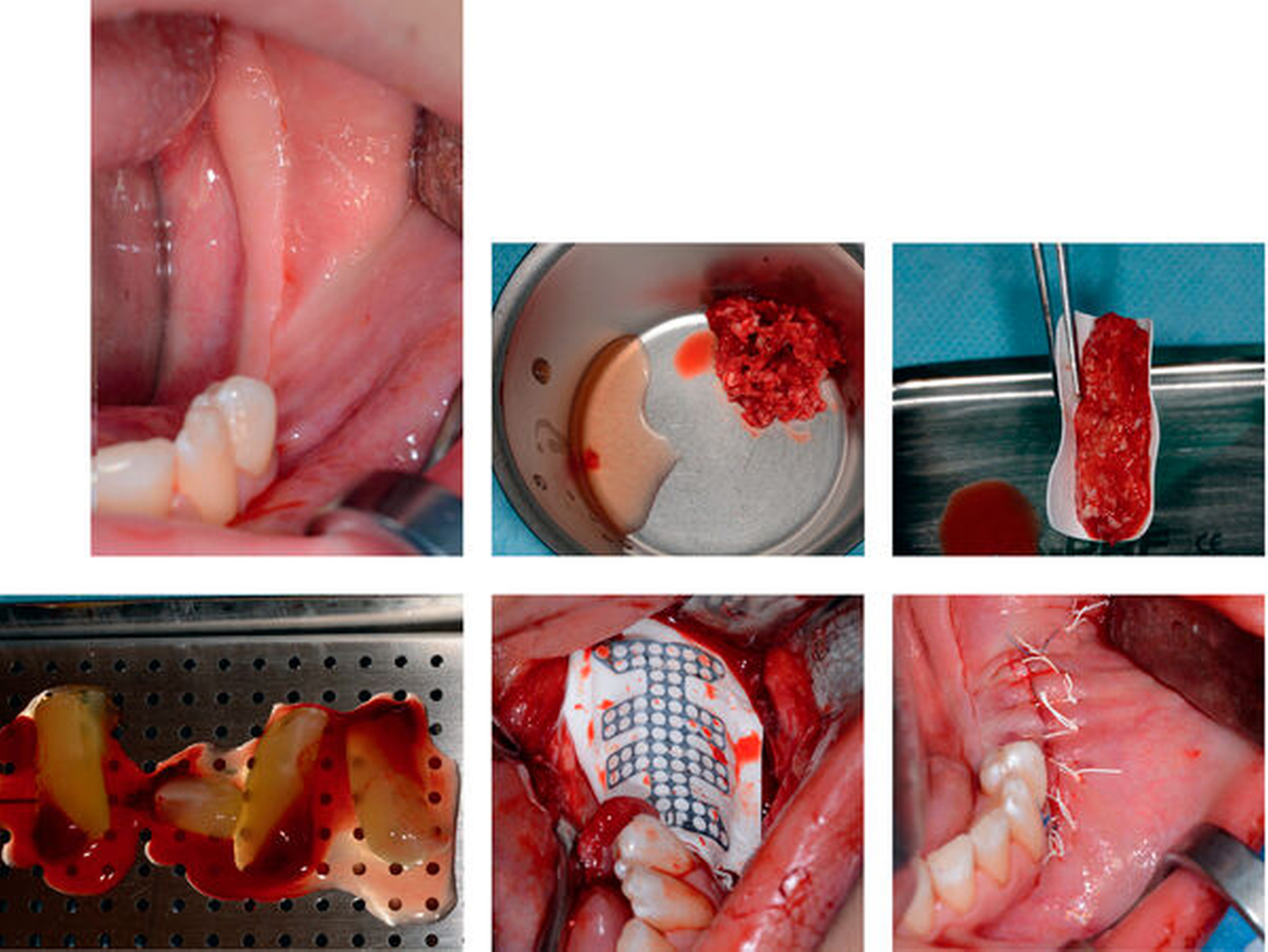
Für die Herstellung des PRF wird ein geschlossenes System mit Vakuumröhrchen aus Glas verwendet (A).
Die Blutentnahme erfolgt peripher-venös, typischerweise am Arm (B).
DurchdasVakuumergibtsicheinegleichmäßigeFüllungderRöhrchen(C).
Nach der Zentrifugation zeigen sich die charakteristischen Banden (D).
Der PRF-Clot kann mit einer Pinzette entnommen werden, gegebenenfalls ist eine Trennung von der roten Phase mit einer sterilen Schere notwendig (E).
Übersicht der unterschiedlichen Applikationsformen von oben nach unten: flüssiges PRF, PRF-Membran, PRF-Clot (F)
Ist der Goldstandard des autologen Gewebetransfers zum Beispiel bei schwerer Co-Morbidität der Patienten nicht oder nur eingeschränkt möglich, kommen Ersatzmaterialien unterschiedlichen Ursprungs zum Einsatz [Tatullo et al., 2012]. Eine initiale suffiziente Gefäßversorgung/-anschluss des eingebrachten Gewebes/Fremdmaterials scheint für die gewünschte Einheilung und Regeneration hier unabdingbar [Rather et al., 2019]. Diese kann durch den Einsatz von Knochenersatzmaterialien – unabhängig von ihrem Ursprung – nur unzureichend erreicht werden, was den Einsatz der Materialien in der klinischen Indikation oftmals beschränkt [Bhatt und Rozental, 2012]. Eine Prä-Vaskularisierung unter Steigerung der pro-angiogenen Eigenschaften dieser Materialien könnte diese Limitation überwinden, das regenerative Potenzial steigern und somit die klinische Indikationsstellung erweitern [Rather et al., 2019]. Verschiedene Methoden wurden in diesem Zusammenhang genutzt, um die Vaskularisierung zu erhöhen, insbesondere durch den Einsatz von Stammzelltherapie und oft in Kombination mit neuartigen 3-D-Druck-Verfahren [Pirosa et al., 2018]. Die Implementierung dieser Verfahren in die klinischen Arbeitsabläufe scheiterte bis dato jedoch nicht zuletzt an komplexen Zulassungsverfahren und -bedingungen. Als eine „klinische Alternative“ könnten hier autologe Thrombozytenkonzentrate dienen, die die Gefäßversorgung steigern und so zur biologischen Funktionalisierung von Biomaterialien nutzbar gemacht werden könnten [Blatt et al., 2021; 2021a; 2020]. Autologe Thrombozytenkonzentrate wie PRF stellen demnach eine zukunftsträchtige Methode in der regenerativen Chirurgie dar, die die Gewebsregeneration in der klinischen Translation direkt oder indirekt über Tissue-Engineering-Methoden initiieren, steuern und optimieren könnten.
Literaturliste
1. Ghanaati, S., et al., Fifteen Years of Platelet Rich Fibrin in Dentistry and Oromaxillofacial Surgery: How High is the Level of Scientific Evidence? J Oral Implantol, 2018. 44(6): p. 471-492.
2. Kingsley, C.S., Blood Coagulation: Evidence of an Antagonist to Factor VI in Platelet-Rich Human Plasma. Nature, 1954. 173(4407): p. 723-724.
3. Mozzati, M., et al., The impact of plasma rich in growth factors on clinical and biological factors involved in healing processes after third molar extraction. Journal of Biomedical Materials Research Part A, 2010. 95A(3): p. 741-746.
4. Matras, H., The use of fibrin sealant in oral and maxillofacial surgery. J Oral Maxillofac Surg, 1982. 40(10): p. 617-22.
5. Ahmed, T.A., E.V. Dare, and M. Hincke, Fibrin: a versatile scaffold for tissue engineering applications. Tissue Eng Part B Rev, 2008. 14(2): p. 199-215.
6. Alsousou, J., et al., The biology of platelet-rich plasma and its application in trauma and orthopaedic surgery: a review of the literature. J Bone Joint Surg Br, 2009. 91(8): p. 987-96.
7. Whitman, D.H., R.L. Berry, and D.M. Green, Platelet gel: an autologous alternative to fibrin glue with applications in oral and maxillofacial surgery. J Oral Maxillofac Surg, 1997. 55(11): p. 1294-9.
8. Knighton, D.R., et al., Classification and treatment of chronic nonhealing wounds. Successful treatment with autologous platelet-derived wound healing factors (PDWHF). Ann Surg, 1986. 204(3): p. 322-30.
9. Marx, R.E., et al., Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 1998. 85(6): p. 638-46.
10. Moraes, V.Y., et al., Platelet-rich therapies for musculoskeletal soft tissue injuries. Cochrane Database Syst Rev, 2013(12): p. Cd010071.
11. Weibrich, G., et al., Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg, 2002. 30(2): p. 97-102.
12. Dohan Ehrenfest, D.M., et al., In search of a consensus terminology in the field of platelet concentrates for surgical use: platelet-rich plasma (PRP), platelet-rich fibrin (PRF), fibrin gel polymerization and leukocytes. Curr Pharm Biotechnol, 2012. 13(7): p. 1131-7.
13. Miron, R.J., et al., Use of platelet-rich fibrin in regenerative dentistry: a systematic review. Clin Oral Investig, 2017. 21(6): p. 1913-1927.
14. Fujioka-Kobayashi, M., et al., Optimized Platelet-Rich Fibrin With the Low-Speed Concept: Growth Factor Release, Biocompatibility, and Cellular Response. J Periodontol, 2017. 88(1): p. 112-121.
15. Dohan, D.M., et al., Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part II: platelet-related biologic features. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006. 101(3): p. e45-50.
16. Canedo-Dorantes, L. and M. Canedo-Ayala, Skin Acute Wound Healing: A Comprehensive Review. Int J Inflam, 2019. 2019: p. 3706315.
17. Faot, F., et al., The effect of L-PRF membranes on bone healing in rabbit tibiae bone defects: micro-CT and biomarker results. Sci Rep, 2017. 7: p. 46452.
18. Miron, R.J., et al., A novel method for evaluating and quantifying cell types in platelet rich fibrin and an introduction to horizontal centrifugation. J Biomed Mater Res A, 2019. 107(10): p. 2257-2271.
19. Dohan, D.M., et al., Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part II: Platelet-related biologic features. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 2006a. 101(3): p. e45-e50.
20. Dohan, D.M., et al., Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part III: Leucocyte activation: A new feature for platelet concentrates? Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 2006b. 101(3): p. e51-e55.
21. Miron, R.J., et al., Platelet-Rich Fibrin and Soft Tissue Wound Healing: A Systematic Review. Tissue Eng Part B Rev, 2017. 23(1): p. 83-99.
22. Miron, R.J., et al., Standardization of relative centrifugal forces in studies related to platelet-rich fibrin. J Periodontol, 2019. 90(8): p. 817-820.
23. Dohan Ehrenfest, D.M., L. Rasmusson, and T. Albrektsson, Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol, 2009. 27(3): p. 158-67.
24. Dohan Ehrenfest, D.M., et al., The impact of the centrifuge characteristics and centrifugation protocols on the cells, growth factors, and fibrin architecture of a leukocyte- and platelet-rich fibrin (L-PRF) clot and membrane. Platelets, 2018. 29(2): p. 171-184.
25. Ghanaati, S., et al., Advanced Platelet-Rich Fibrin: A New Concept for Cell-Based Tissue Engineering by Means of Inflammatory Cells. Journal of Oral Implantology, 2014. 40(6): p. 679-689.
26. Choukroun, J. and S. Ghanaati, Reduction of relative centrifugation force within injectable platelet-rich-fibrin (PRF) concentrates advances patients' own inflammatory cells, platelets and growth factors: the first introduction to the low speed centrifugation concept. Eur J Trauma Emerg Surg, 2018. 44(1): p. 87-95.
27. Miron, R.J., et al., Use of platelet-rich fibrin in regenerative dentistry: a systematic review. Clinical Oral Investigations, 2017. 21(6): p. 1913-1927.
28. Strauss, F.-J., et al., Effect of platelet-rich fibrin on cell proliferation, migration, differentiation, inflammation, and osteoclastogenesis: a systematic review of in vitro studies. Clinical Oral Investigations, 2019.
29. Choukroun, J., et al., Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part IV: Clinical effects on tissue healing. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology, 2006. 101(3): p. e56-e60.
30. Hoaglin, D.R. and G.K. Lines, Prevention of localized osteitis in mandibular third-molar sites using platelet-rich fibrin. Int J Dent, 2013. 2013: p. 875380.
31. He, Y., et al., Local Application of Platelet-Rich Fibrin During Lower Third Molar Extraction Improves Treatment Outcomes. Journal of Oral and Maxillofacial Surgery, 2017. 75(12): p. 2497-2506.
32. Pan, J., et al., Effect of platelet-rich fibrin on alveolar ridge preservation: A systematic review. The Journal of the American Dental Association, 2019. 150(9): p. 766-778.
33. Lekovic, V., et al., Platelet-rich fibrin and bovine porous bone mineral vs. platelet-rich fibrin in the treatment of intrabony periodontal defects. J Periodontal Res, 2012. 47(4): p. 409-17.
34. Shah, M., et al., Comparative evaluation of platelet-rich fibrin with demineralized freeze-dried bone allograft in periodontal infrabony defects: A randomized controlled clinical study. J Indian Soc Periodontol, 2015. 19(1): p. 56-60.
35. Damsaz, M., et al., Evidence-Based Clinical Efficacy of Leukocyte and Platelet-Rich Fibrin in Maxillary Sinus Floor Lift, Graft and Surgical Augmentation Procedures. Front Surg, 2020. 7: p. 537138.
36. Simonpieri, A., et al., Simultaneous sinus-lift and implantation using microthreaded implants and leukocyte- and platelet-rich fibrin as sole grafting material: a six-year experience. Implant Dent, 2011. 20(1): p. 2-12.
37. Liu, Y., et al., Platelet-Rich Fibrin as a Bone Graft Material in Oral and Maxillofacial Bone Regeneration: Classification and Summary for Better Application. Biomed Res Int, 2019. 2019: p. 3295756.
38. Pripatnanont, P., et al., The primacy of platelet-rich fibrin on bone regeneration of various grafts in rabbit's calvarial defects. J Craniomaxillofac Surg, 2013. 41(8): p. e191-200.
39. Yoon, J.S., S.H. Lee, and H.J. Yoon, The influence of platelet-rich fibrin on angiogenesis in guided bone regeneration using xenogenic bone substitutes: a study of rabbit cranial defects. J Craniomaxillofac Surg, 2014. 42(7): p. 1071-7.
40. Khalil, G., et al., Wave front migration of endothelial cells in a bone-implant interface. J Biomech, 2011. 44(10): p. 1980-6.
41. Sclafani, A.P., Safety, efficacy, and utility of platelet-rich fibrin matrix in facial plastic surgery. Arch Facial Plast Surg, 2011. 13(4): p. 247-51.
42. Hassan, H., D.J. Quinlan, and A. Ghanem, Injectable platelet-rich fibrin for facial rejuvenation: A prospective, single-center study. Journal of Cosmetic Dermatology, 2020. 19(12): p. 3213-3221.
43. Blatt, S., et al., Non-Interventional Prospective Observational Study of Platelet Rich Fibrin as a Therapy Adjunctive in Patients with Medication-Related Osteonecrosis of the Jaw. J Clin Med, 2022. 11(3).
44. Turnbull, G., et al., 3D bioactive composite scaffolds for bone tissue engineering. Bioact Mater, 2018. 3(3): p. 278-314.
45. Tatullo, M., et al., Platelet Rich Fibrin (P.R.F.) in reconstructive surgery of atrophied maxillary bones: clinical and histological evaluations. Int J Med Sci, 2012. 9(10): p. 872-80.
46. Rather, H.A., D. Jhala, and R. Vasita, Dual functional approaches for osteogenesis coupled angiogenesis in bone tissue engineering. Mater Sci Eng C Mater Biol Appl, 2019. 103: p. 109761.
47. Bhatt, R.A. and T.D. Rozental, Bone graft substitutes. Hand Clin, 2012. 28(4): p. 457-68.
48. Pirosa, A., et al., Engineering in-vitro stem cell-based vascularized bone models for drug screening and predictive toxicology. Stem Cell Res Ther, 2018. 9(1): p. 112.
49. Blatt, S., et al., Possible Implications for Improved Osteogenesis? The Combination of Platelet-Rich Fibrin With Different Bone Substitute Materials. Front Bioeng Biotechnol, 2021. 9: p. 640053.
50. Blatt, S., et al., Does Platelet-Rich Fibrin Enhance the Early Angiogenetic Potential of Different Bone Substitute Materials? An In Vitro and In Vivo Analysis. Biomedicines, 2021a. 9(1).
51. Blatt, S., et al., Biofunctionalization of porcine-derived collagen matrices with platelet rich fibrin: influence on angiogenesis in vitro and in vivo. Clin Oral Investig, 2020. 24(10): p. 3425-3436.






