Vorgehen bei einer Radio- und/oder Chemotherapie-induzierten oralen Mukositis
Bei der oralen Mukositis handelt es sich um eine Entzündung der Mundschleimhaut, die als akute oder chronische Nebenwirkung einer laufenden oder vorangegangenen Radio- und/oder Chemotherapie auftreten kann. Die Ätiologie beruht vermutlich auf einer Schädigung der Epithelzellen der oralen Mukosa, wobei verschiedene pathophysiologische Ansätze diskutiert werden. Klinisch können nach der WHO-Einteilung fünf Schweregrade (0 bis IV) unterschieden werden, die von einem einfachen Erythem bis hin zu schwersten und generalisierten Ulzerationen der gesamten oralen Mukosa reichen. Neben einem generalisierten Befall der oralen Mukosa und sogar der Schleimhaut des gesamten Verdauungstrakts von den Lippen bis zum Rektum werden teilweise auch lokal begrenzte Befunde beobachtet. Die Diagnose wird anhand der Anamnese und des klinischen Befunds gestellt und kann durch eine Biopsie verifiziert werden.
Radio- und/oder Chemotherapie
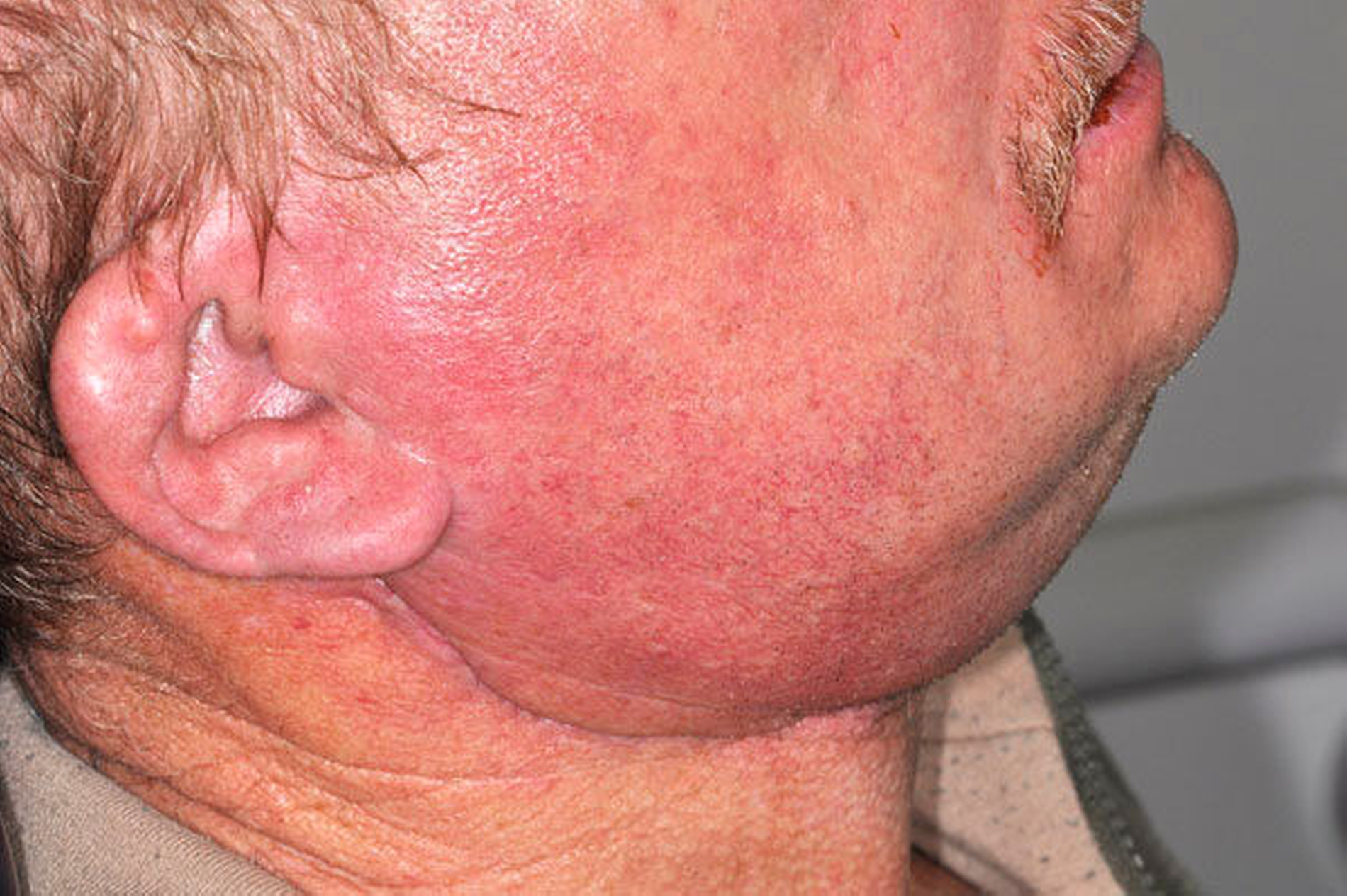
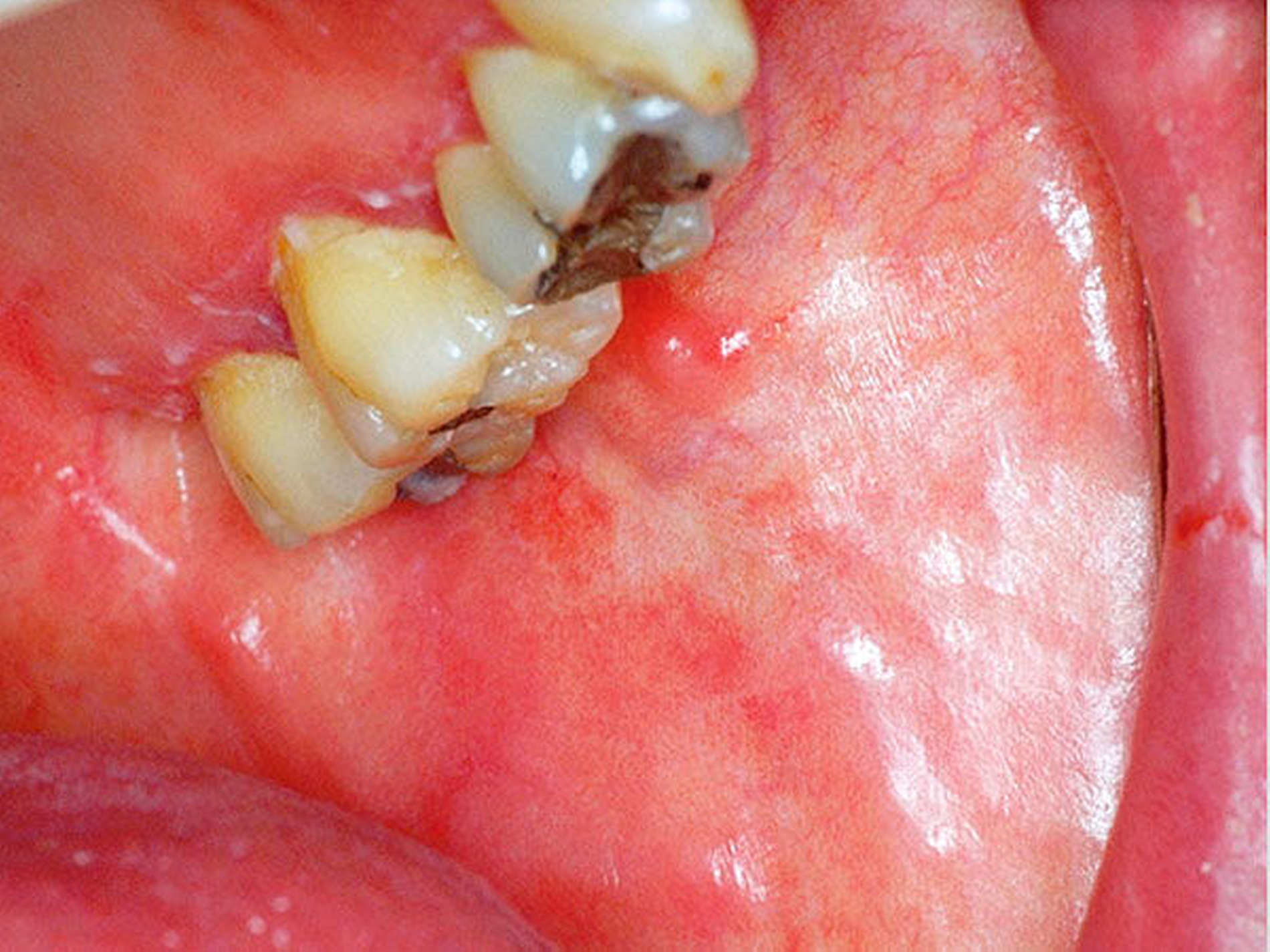
Die Radio- und Chemotherapie sind Eckpfeiler moderner onkologischer Therapiekonzepte. Während die Chemotherapie mit wenigen Ausnahmen immer systemisch verabreicht wird, wird bei einer Radiotherapie zwischen der lokalen (zum Beispiel Bestrahlung eines Lymphabflussgebiets) und der Ganzkörperbestrahlung (zum Beispiel vor einer Stammzelltransplantation) unterschieden. Dabei kann die Radiotherapie sowohl alleine als auch in Kombination mit einer Chemotherapie angewendet werden. Die Vorteile dieser Kombination liegen unter anderem in einer Zytostatika-induzierten Radiosensibilisierung von Tumorzellen sowie im Schluss möglicher therapeutischer Lücken. Dabei werden nach der Intention der Therapie präventive, kurative und palliative Ansätze bei neoadjuvanten und adjuvanten Konzepten unterschieden. Beim oralen Plattenepithelkarzinom, dem häufigsten malignen Tumor der Mundhöhle und einem der zahlenmäßig häufigsten Tumoren weltweit, gehört die adjuvante Radio- beziehungsweise kombinierte Radiochemotherapie – zum Beispiel bei zervikalen Lymphknotenmetastasen – zum leitliniengerechten Therapiestandard (AWMF S3-Leitlinie Mundhöhlenkarzinom). Hinsichtlich der Radiotherapie hat sich mittlerweile die IntensitätsModulierte RadioTherapie (IMRT) mit einer Gesamtdosis von ca. 60 bis 70 Gy etabliert. Bezüglich der Chemotherapie bilden die platinhaltigen Derivate (zum Beispiel Cisplatin, Carboplatin) den Therapiestandard, der im Zweitlinienprotokoll (bei Rezidiven oder Therapieversagen) durch MTX (Methotrexat), Taxane und/oder Cetuximab (EGFR-Antikörper) ersetzt werden kann. Die akuten und chronischen Nebenwirkungen sind vielfältig. Bei der Radiotherapie im Kopf-Hals-Bereich werden zum Beispiel akute Hautirritationen im Strahlenfeld beschrieben (Abbildung 1). Als Langzeitfolgen gelten unter anderem die Xerostomie (Abbildung 2), die Strahlenkaries und die infizierte Osteoradionekrose (Abbildung 3). Bei der Chemotherapie gelten das Zytostatika-induzierte Erbrechen sowie nephro- und neurotoxische Effekte als bekannte Nebenwirkungen. Eine gemeinsame, akute Nebenwirkung ist die Mukositis, die neben der Mundhöhle (orale Mukositis, Abbildungen 4 und 5) die Schleimhaut des gesamten Gastrointestinaltrakts betreffen kann.
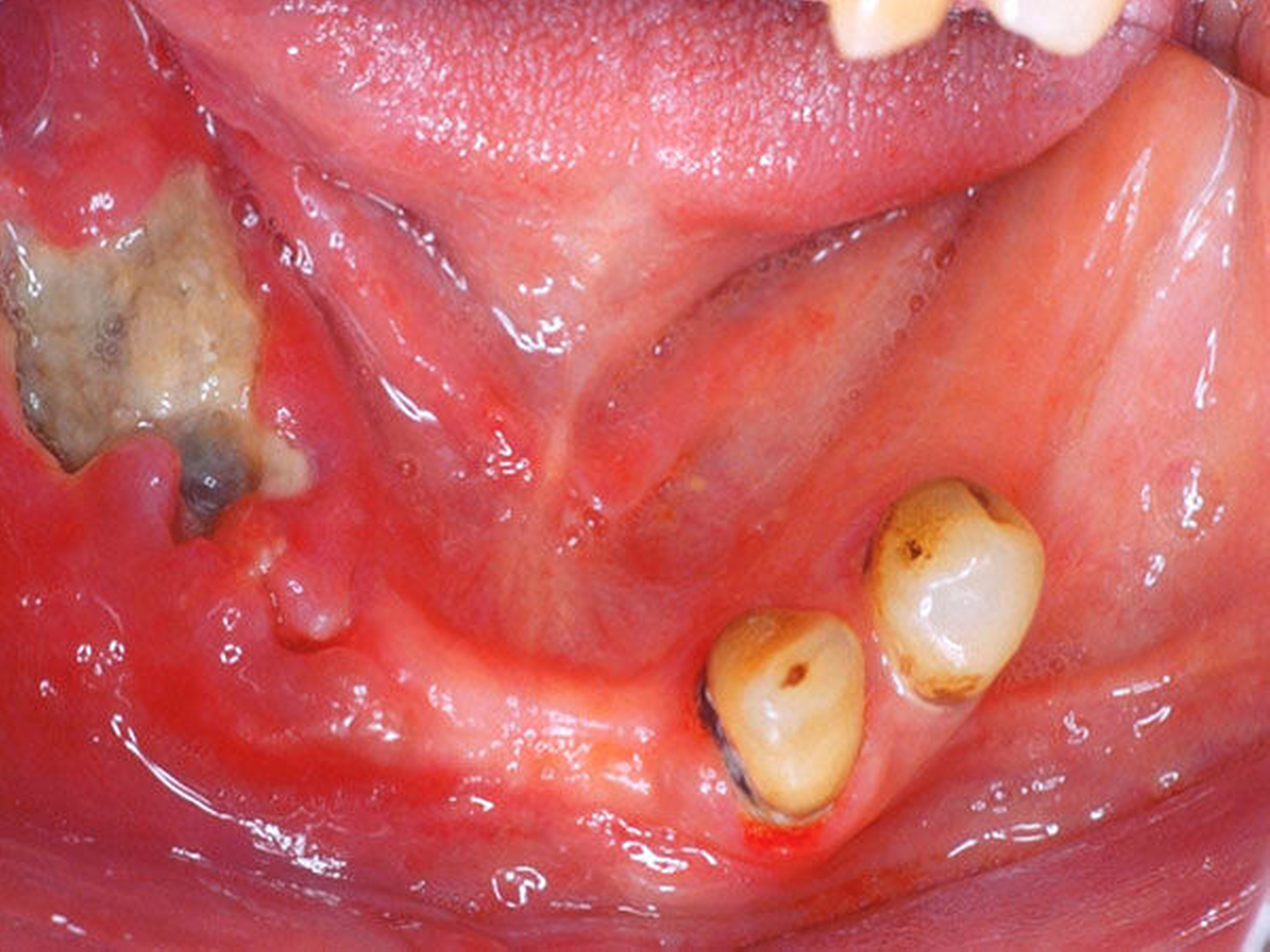
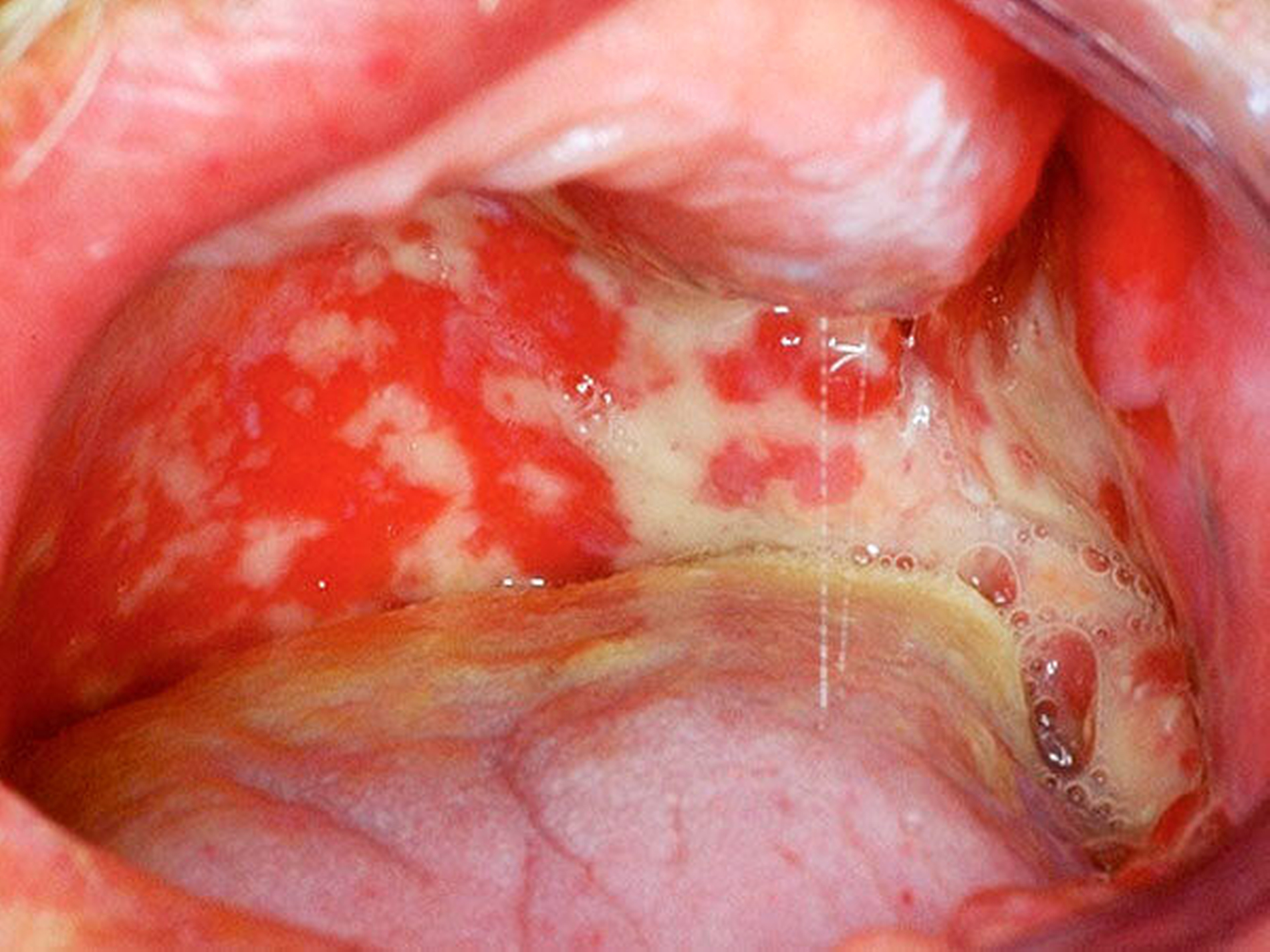
Orale Mukositis infolge einer Krebstherapie
Bei der Mukositis handelt es sich allgemein per definitionem um eine Entzündung beziehungsweise eine entzündliche Veränderung der Mukosa. Diese kann in der Mundhöhle durch eine Vielzahl verschiedener Ursachen, zum Beispiel durch einen bakteriellen Biofilm, hervorgerufen werden [Heitz-Mayfield and Salvi, 2018]. Als Folge einer Radio- und/oder Chemotherapie kann die Mukositis das auskleidende Epithel des gesamten Gastrointestinaltrakts betreffen, von der Mundhöhle bis zum Rektum [Lalla et al., 2016]. Die Pathophysiologie der Mukositis ist komplex und noch nicht abschließend geklärt. Nach einer vorangegangenen oder während einer laufenden Radio- und/oder Chemotherapie lässt sich ihre Entstehung – ähnlich wie der Haarausfall – durch den starken Effekt der Strahlung und der Zytostatika auf sich schnell teilende Zellen und Gewebe mit einer hohen Proliferationsrate erklären. Die Schleimhaut des Gastrointestinaltrakts und besonders die orale Mukosa hat eines der höchsten Regenerationspotenziale des menschlichen Körpers. Die Epithelzellen, besonders die stark proliferierenden Zellen des Stratum basale, durchlaufen den Zell-zyklus in einer hohen Frequenz. Innerhalb dieses Zellzyklus gibt es bestimmte Phasen (zum Beispiel G1, G2), in der die Zellen – sowohl benigne als auch maligne – besonders empfindlich gegenüber den zytostatischen und zytotoxischen Effekten einer Radio- und/oder Chemotherapie sind. Daher werden in der oralen Mukosa die basalen Epithelzellen in der kutanen Basalschicht besonders geschädigt, wodurch das Regenerationspotenzial der Mukosa deutlich negativ beeinträchtigt wird und es es zu einer Atrophie und zu Ulzerationen der Mukosa kommt. Es entstehen zunehmend Defekte in der Integrität der Schleimhaut, die diese für verschiedenste Noxen anfälliger machen (mechanisch, chemisch, thermisch, bakteriell, viral und muzin). Der Verlauf einer Mukositis lässt sich in einem Fünf-Phasen-Modell beschreiben [Bollig 2016]:
(I) Initiation
(II) Inflammation und Freisetzung von Zytokinen
(III) Signalverstärkung
(IV) Ulzeration
(V) Abheilung
Eine interessante Theorie hinsichtlich der Pathophysiologie der Mukositis beschreibt strahlungsinduzierte Veränderungen in der inflammatorischen Signalkaskade durch NF-ҡB (nuclear factor-kappa B), einem wichtigen Transkriptionsfaktor, der neben Immunreaktionen und der Apoptose von Zellen bei einer Aktivierung auch inflammatorische Reaktionen induzieren kann [Frings et al., 2016]. Insgesamt ist die Bedeutung von NF-ҡB im Kontext der oralen Mukositis aber noch wenig im Detail verstanden. Interessanterweise zeigten Curra et al. bei einer durch 5-FU (5-Fluoruracil) im Tiermodell induzierten oralen Mukositis und einer experimentellen, therapeutischen Photobiomodulation mildere Schweregrade der Mukositis bei einer Aktivierung des NF-ҡB-Signalwegs [Curra et al., 2015]. Zusammenfassend muss hinsichtlich der Pathophysiologie der Mukositis von einem multifaktoriellen Geschehen ausgegangen werden, das in seiner Gesamtheit noch nicht geklärt ist.
Klinik
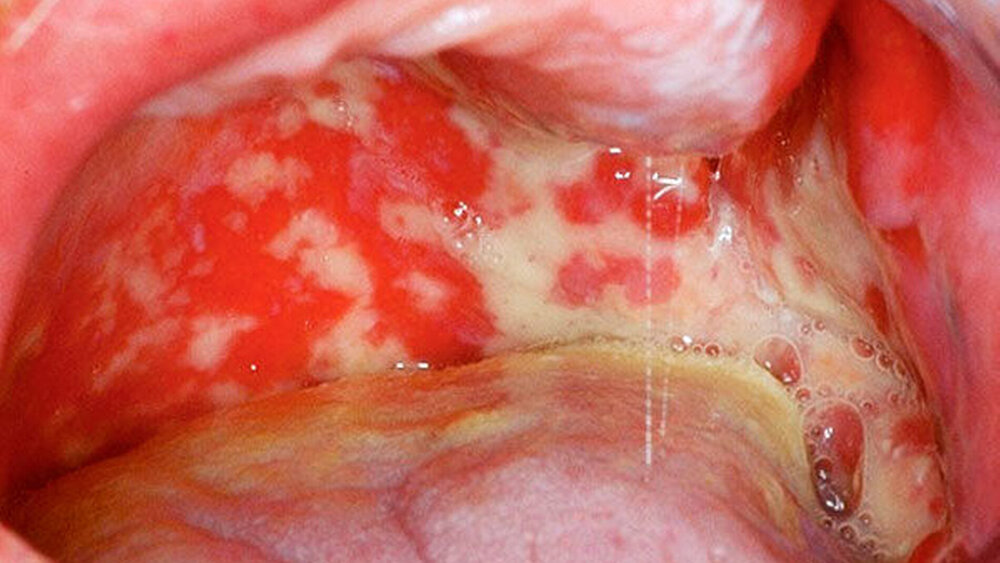
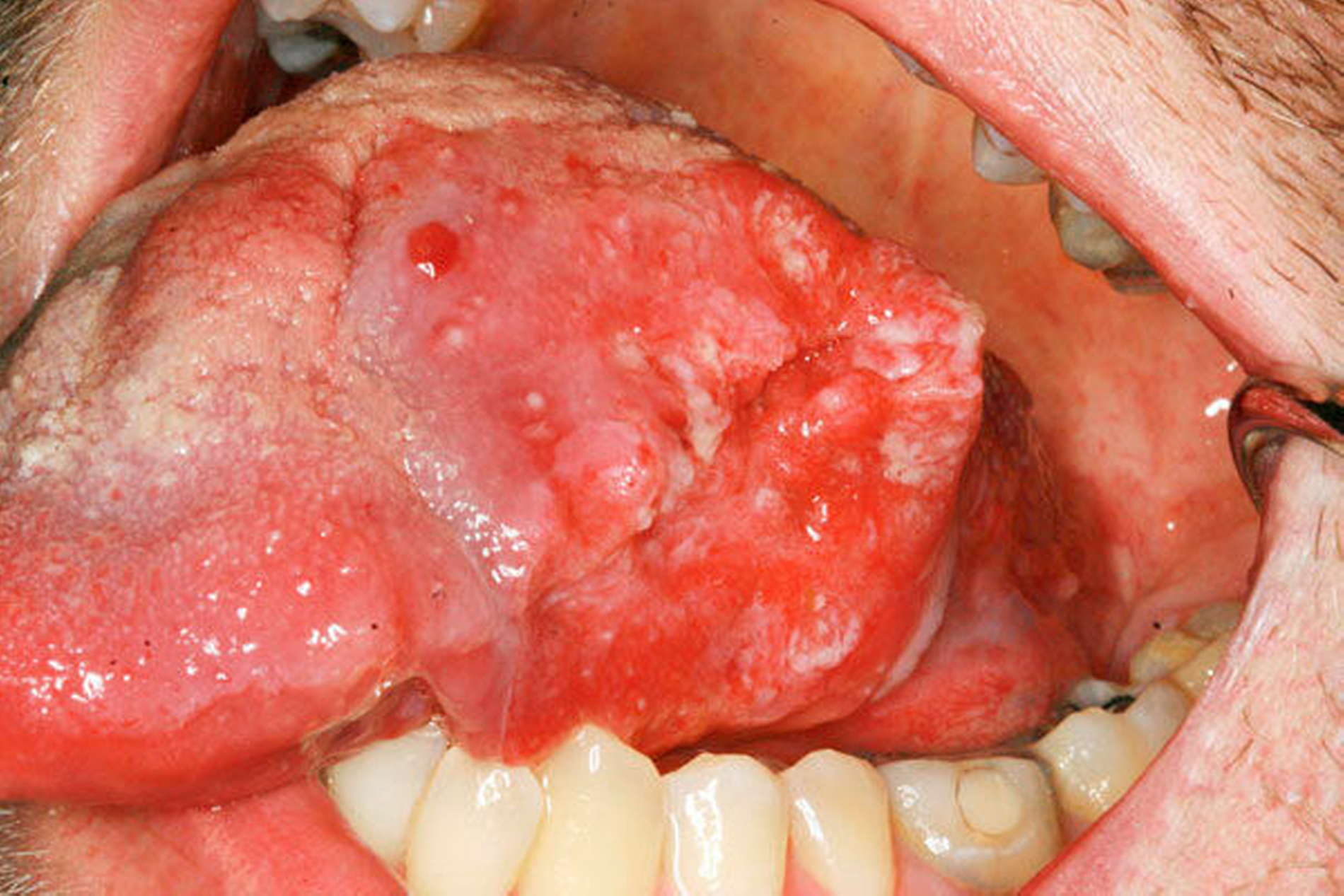
Das klinische Bild der oralen Mukositis ist vielschichtig und reicht von einfachen, lokalisierten Schleimhautirritationen bis hin zu schwersten Ulzera der gesamten oralen Mukosa [Bollig et al., 2016] (Abbildungen 4 und 5). In der Regel entwickeln sich die ersten Symptome innerhalb der ersten zwei Wochen nach Therapiebeginn. Das klinische Bild beinhaltet Irritationen, Erytheme, Inflammationen, Ulzera, Blutungen, Xerostomie und Geschmacksstörungen. Zusätzlich beklagen die Patienten starke Schmerzen und Parästhesien. Es kommt im Verlauf häufig zu Superinfektionen (Bakterien, Viren, Pilze), Kau- und Schluckbeschwerden, Einschränkungen in der Flüssigkeits- und Nahrungsaufnahme, Dehydrierung, Sprachproblemen, einer möglichen Behinderung der weiteren Tumortherapie und einer generellen Beeinträchtigung der Lebensqualität. Für das Gesundheitswesen entstehen außerdem hohe Kosten, unter anderem aufgrund der verlängerten Hospitalisierungszeit [Lalla et al., 2016; Panahi et al., 2016]. Der zeitliche Ablauf der beschriebenen klinischen Symptome und der Zeitpunkt ihres Auftretens können dabei variieren. Nach der WHO wird die orale Mukositis in fünf verschiedene Schweregrade (0 bis IV) eingeteilt [Bollig, 2016]:
Grad 0 = keine Mukositis
Grad I = Erythem, Wundgefühl
Grad II = Ulzeration (Aufnahme fester Nahrung noch möglich)
Grad III = Ulzeration (Aufnahme von Flüssigkeit und flüssiger Nahrung noch möglich)
Grad IV = Ulzeration (keine Flüssigkeits- und Nahrungsaufnahme möglich)
Wie ersichtlich ist hierbei vor allem die Klinik führend [Bollig, 2016]:
(I) die klinische Symptomatik (zum Beispiel Schmerzen),
(II) das klinische Bild (zum Beispiel Ulzerationen) und
(III) die klinischen Konsequenzen (zum Beispiel Beeinträchtigung der Nahrungsaufnahme)
Allgemein kommt es bei einer Radio- und/oder Chemotherapie im Kopf-Hals-Bereich ab einer Strahlenintensität von etwa 30 Gy in fast 100 Prozent der Fälle zu einer oralen Mukositis (im histopathologischen Sinne) in unterschiedlichen Schweregraden, selbst wenn diese klinisch nicht symptomatisch wird [Bollig, 2016]. Das Risiko der Entstehung einer oralen Mukositis und deren klinische Ausprägung sind unter anderem von der Gesamtdosis der Strahlentherapie (in Gy) und von den eingesetzten Chemotherapeutika abhängig. Während bei einer Radiotherapie das Risiko und die klinische Ausprägung der oralen Mukositis vom Zielvolumen und von der applizierten Strahlendosis abhängig sind, ist bei einer Chemotherapie die Inzidenz und Prävalenz stark von den eingesetzten Wirkstoffen abhängig, wobei Wirkstoffe wie zum Beispiel 5-FU (5-Fluoruracil), MTX (Methotrexat) oder Taxane ein besonders hohes Risiko einer oralen Mukositis mit sich bringen. Das Risiko einer oralen Schleimhautentzündung und deren Schweregrad können aber auch von patientenindividuellen Risikofaktoren abhängen, wie beispielsweise Alter, Geschlecht, Mundhygiene und Grunderkrankungen [Bollig, 2016].
Prävention und Therapie
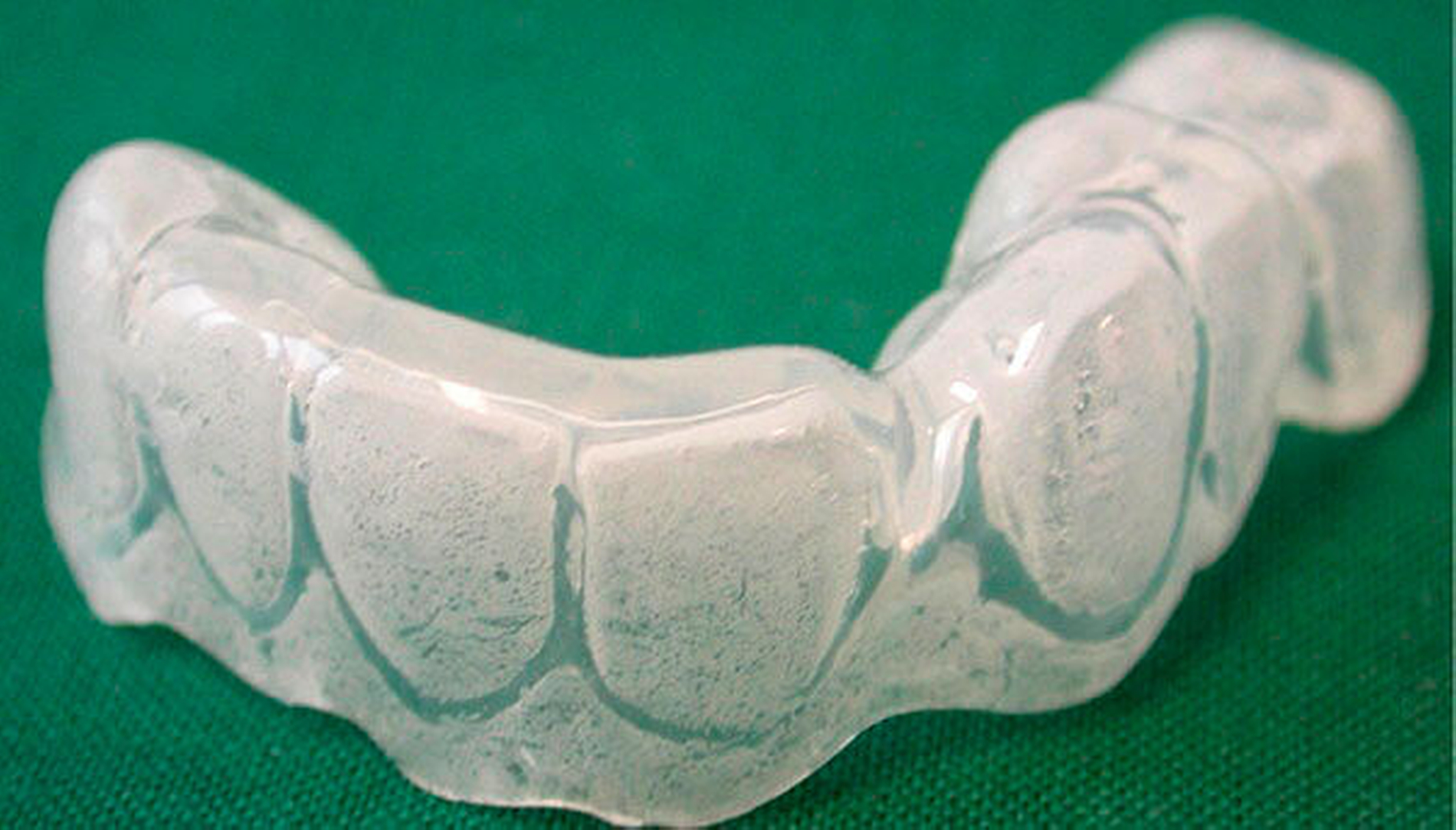
Die Prävention und Therapie der oralen Mukositis ist komplex, wobei der Prävention insgesamt bei fehlenden kausalen Ansätzen der größte Stellenwert zugesprochen wird. In der Literatur werden über 40 Optionen zur Prävention und Therapie beschrieben, wobei viele nur in einer der fünf beschriebenen Phasen der oralen Mukositis wirken [Keiner, 2010]. Hinsichtlich der Prävention nehmen Zahnpflege, Optimierung der Mundhygiene, Schleimhautpflege und der engmaschige zahnärztliche Recall eine besondere Rolle ein. Neben den bekannten Maßnahmen, die im Zuge einer geplanten Bestrahlung im Kopf-Hals-Bereich durchzuführen sind, wie zum Beispiel der Fluoridierung mittels Fluoridierungsschiene zur Prophylaxe der Strahlenkaries als Folge der Xerostomie (Abbildung 6) und der Anfertigung eines Weichgeweberetraktors/Strahlenschutzschiene (3 bis 5 mm dicke PMMA-Folien) als Abstandhalter zwischen metallischen Restaurationen und den Schleimhäuten und somit zur Dosisreduktion der Strahlung an den Schleimhäuten, gilt besonders die prätherapeutische Zahnsanierung als eine der effizientesten Maßnahmen, die sowohl der Prophylaxe einer infizierten Osteoradionekrose (Abbildung 3) als auch einer oralen Mukositis (Abbildungen 4 und 5) zugute kommen. In diesem Zusammenhang sollten sowohl zur Prophylaxe der infizierten Osteoradionekrose als auch der Mukositis alle konservierenden und prothetischen Maßnahmen abgeschlossen, laufende Parodontalbehandlungen beendet und entzündlich beherdete oder nicht erhaltungswürdige Zähne vor Therapiebeginn entfernt sein. Sollten während einer laufenden Radio- und/oder Chemotherapie und einer möglicherweise auftretenden oralen Mukositis zahnärztliche und/oder zahnärztliche-chirurgische Behandlungen erforderlich sein, sollten diese nach Möglichkeit und kritischer Prüfung der Indikation in Anlehnung an die aktuelle S2k-Leitlinie zur Infizierten Osteoradionekrose nach Abschluss der Akuttoxizität, also etwa sechs bis acht Wochen nach Abschluss der Radio- und/oder Chemotherapie, durchgeführt werden [Krüger et al., 2018].
Verzicht auf reizauslösende Nahrungs- und Genussmittel
Zusätzlich gilt der Verzicht auf scharfe Speisen, säurehaltige Getränke, Alkohol und Tabak als wichtige Maßnahme. Daneben spielt die Therapie der Symptome (zum Beispiel Schmerztherapie) und der Begleiterscheinungen (Mangelernährung, Dehydrierung, Mykosen) eine wichtige Rolle [Höller et al., 2015; Bockel et al., 2018].
Benzydamin-Hydrochlorid
Als vielversprechende prophylaktische Option wird Benzydamin-Hydrochlorid beschrieben, das als Spüllösung und/oder Gel drei- bis fünfmal täglich angewendet werden kann. Dieser Substanz werden analgetische, antiphlogistische und antimikrobielle Eigenschaften bescheinigt. Bestandteile sind neben Benzydamin-Hydrochlorid auch Natrium-Hydrogencarbonat, Saccharin-Na, Polysorbat 20, Povidon K 25, Glycerol 85 Prozent, Hydroxyethylcellulose-Schleim 4 Prozent, Pfefferminzöl und Tartrazin [Keiner, 2010].
Zusätzlich wird als Prophylaxe die Anwendung der antimikrobiellen Therapie, der Kryotherapie, der Lasertherapie, von Amifostin (ein zytoprotektiver Radikalfänger, der Zellen im Rahmen einer Radio- und/oder Chemotherapie schützen kann) und weiteren Substanzen postuliert (zum Beispiel Bethametason), die allerdings anhand der verfügbaren Literatur nicht abschließend und evidenzbasiert bewertet werden können [Gobbo et al., 2014; Höller et al., 2015; Riley et al., 2015; Bollig, 2016].
Kein Nutzen für Sucralfat und GM-CSF
Für Sucralfat (ein schleimhautschützender Wirkstoff, der vor der Einführung der Protonenpumpenhemmer zur Prophylaxe und Therapie des Magenulkus eingesetzt wurde) und GM-CSF (Granulozyten-Monozyten-Kolonie-stimulierender Faktor; Granulozyten-Monozyten Wachstumsfaktor) konnte kein Nutzen nachgewiesen werden. Auch die Anwendung von Chlorhexidin (CHX) wird von einigen Autoren kritisch diskutiert [Höller et al., 2015].
Mucosamin zeigte Wirkung
Ruggiero et al. untersuchten den klinischen Effekt von Mucosamin (ein Spray aus Hyaluronsäure und verschiedenen Aminosäuren) bei Patienten mit oraler Mukositis nach Stammzelltransplantation. Zusätzlich zu einer optimierten Mundhygiene und einer Hospitalisierung konnte durch die Mucosaminanwendung eine Besserung der Beschwerden gezeigt werden [Ruggiero et al., 2018].
Weitere Behandlungsoptionen
Auch Therapien mit Curcumin (ein gelblicher Farbstoff aus der Pflanze Kurkuma), Dermatan-Sulfat (ein Glykosaminoglykan, das als natürliche Verbindung beispielsweise in der Haut vorkommt) und Lactobacillus brevis (ein grampositives Stäbchenbakterium mit probiotischen Eigenschaften) werden in der Literatur beschrieben [Patil et al., 2015; Sharma et al., 2017; Gruber et al., 2018]. Eine weitere Studie untersuchte die Effektivität einer Glutamin-Applikation (eine nicht essenzielle Aminosäure) zur Reduktion der Inzidenz und des Schweregrades einer Radio- und/oder Chemotherapie induzierten oralen Mukositis, wobei im Vergleich zur Placebogruppe täglich 3 x 10g Glutamin oral eingenommen wurden. Obwohl die Ergebnisse eine Signifikanz verfehlten, konnte klinisch eine Besserung der Mukositis gezeigt werden [Lopez-Vaquero et al., 2017]. Auch einer Therapie mit Melatonin (ein Hormon, das in der Epiphyse produziert wird und unter anderem eine antioxidative Wirkung besitzt) wird ein positiver Effekt bescheinigt [Abdel Moneim et al., 2017]. Ebenso wurde von Frings et al. der NF-ҡB-Inhibitor Thalidomid mit Hinblick auf die Prävention und Therapie der oralen Mukositis untersucht [Frings et al., 2016].
Nicht immer evidenzbasiert, aber vielversprechend
Auch Platlet Gel Supernatant (PGS) wurde untersucht und zeigte vielversprechende klinische Ergebnisse [Bonfili et al., 2017]. In einem murinen In-vivo-Modell wurde der Effekt von Pentoxyfylline (PTX; ein Xanthin-Derivat mit antiinflammatorischen Eigenschaften) untersucht. Diese Therapie zeigte dabei eine signifikante Reduktion der Mukositis nach IMRT, was auf eine verbesserte Zellregeneration zurückgeführt wurde [Gruber et al., 2015]. Auch eine β1-Integrininhibition (ein membranständiger Zellrezeptor, der im Rahmen von Immunreaktionen eine Rolle spielt) wurde erfolgreich getestet [Albert et al., 2012]. Eine placebokontrollierte, verblindete, prospektive klinische Studie testete die Wirkung von Samital, einem Cocktail aus verschiedenen Pflanzenextrakten, in der Behandlung der oralen Mukositis. Neben der Reduktion des Schweregrades der Mukositis konnten auch eine Schmerzreduktion und eine Steigerung der Lebensqualität nachgewiesen werden [Pawar et al., 2013]. Auch Rebamipid, ein Wirkstoff zur Prophylaxe und Therapie des Magenulkus, wurde getestet [Chaitanya et al., 2017]. Panahi et al. wiesen darauf hin, dass in jüngerer Zeit ein Trend zu natürlichen Medikamenten und Naturheilverfahren bei der Prophylaxe und Therapie der oralen Mukositis zu beobachten sei [Panahi et al., 2016]. Zusammenfassend wurde bislang eine Vielzahl verschiedener prophylaktischer und therapeutischer Optionen beschrieben, die allerdings nicht abschließend evidenzbasiert bewertet werden können.
Interdisziplinäre Kommunikation ist wichtig
Tabelle 1 gibt eine systematische Übersicht über mögliche prophylaktische und therapeutische Maßnahmen im Rahmen der oralen Mukositis, die nicht vollständig evidenzbasiert sind, aber in der Praxis im Sinne des Patienten angewendet werden können. Daneben spielt die interdisziplinäre Kommunikation zwischen Zahnmedizin, MKG-Chirurgie/HNO, Onkologie und Strahlentherapie eine wichtige Rolle, um bei möglichen schwerwiegenden Verläufen gegebenenfalls weiterführende therapeutische und supportive Maßnahmen (Schmerztherapie unter stationären Bedingungen, PEG-Anlage) bei Bedarf zeitnah einleiten zu können.
Fazit
Die orale Mukositis ist eine ernstzunehmende und unter Umständen sehr schwerwiegende und komplikationsträchtige Nebenwirkung während oder nach einer Radio- und/oder Chemotherapie. Die Extremform führt unter Umständen zu einer intensivmedizinischen Betreuung der Patienten mit morphinbasierter Schmerztherapie und parenteraler Ernährung. Die wichtigsten prophylaktischen Maßnahmen sind neben der konservierenden, prothetischen und gegebenenfalls chirurgischen Zahnsanierung die Optimierung der Mundhygiene und Mundpflege. Therapeutisch finden in erster Linie symptomatische Therapien Anwendung, zum Beispiel die Schmerztherapie und die Anwendung pflegender, analgetischer und antiphlogistischer Mundspüllösungen und Gele. Betroffene Patienten sollten neben einer engen chirurgischen, onkologischen und strahlentherapeutischen Anbindung auch in ein engmaschiges zahnärztliches Monitoring (kurze Recall-Intervalle) aufgenommen und kontinuierlich zu einer Optimierung der Mundhygiene angeleitet werden.
Zukünftig könnte es interessant sein, ob möglicherweise auch neuere onkologische Konzepte, wie der Einsatz von Tyrosinkinaseinhibitoren (Cetuximab) oder von Checkpointinhibitoren (Nivolumab), eine Mukositis-ähnliche Symptomatik verursachen können [Vermorken et al., 2008; Ferris et al., 2016; Harrington et al., 2017].
Dr. med. Dr. med. dent. Andreas Pabst
Klinik für Mund-, Kiefer- und Plastische Gesichtschirurgie
Bundeswehrzentralkrankenhaus Koblenz
Rübenacherstr. 170
56072 Koblenz
Andreas1Pabst@bundeswehr.org
Dr. Elisabeth Goetze und
Priv.-Doz. Dr. Dr. Peer W. Kämmerer, M.A., FEBOMFS
Klinik für Mund-, Kiefer- und Gesichtschirurgie – Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2
55131 Mainz
elisabeth.goetze@unimedizin-mainz.de
peer.kaemmerer@unimedizin-mainz.de
Prophylaxe und Therapie der oralen Mukositis
Maßnahmen vor einer geplanten Radio- und/oder Chemotherapie:
Optimierung der Mundhygiene und Beratung des Patienten hinsichtlich der hohen Relevanz der Mundhygiene, Mundhygieneinstruktionen
Zahnsanierung: konservierende und prothetische Maßnahmen, parodontologische Maßnahmen, gegebenenfalls chirurgische Maßnahmen, Entfernung entzündlich beherdeter und nicht erhaltungswürdiger Zähne
Herstellung Weichgeweberetraktor (bei bezahnten Patienten, v. a. mit metallischen Restaurationen)
Fluoridierung, Herstellung Fluoridierungsschiene (ein- bis zweimal täglich, 10–15 min., zum Beispiel mit elmex Gelée®)
Maßnahmen während einer Radio- und/oder Chemotherapie:
Optimierung der Mundhygiene
Recall durch MKG-Chirurgie etwa alle 3–4 Wochen während einer laufenden Radio- und/oder Radiochemotherapie, mindestens nach der Hälfte und am Ende der Therapie
Fluoridierung, Fluoridierungsschiene (ein- bis zweimal täglich, 10–15 min., zum Beispiel mit elmex Gelée®)
Falls möglich in dieser Zeit keine inva‧siven zahnärztlichen Maßnahmen (zum Beispiel Extraktionen, Wurzelspitzenresek‧tionen, Wurzelkanalbehandlungen)
Lippen- und Hautpflege
Maßnahmen nach einer Radio- und/oder Chemotherapie:
Optimierung der Mundhygiene
Zahnärztlicher Recall circa alle 3–6 Monate
Leitliniengerechte Tumornachsorge durch MKG-Chirurgie
Fluoridierung, Fluoridierungsschiene (ein- bis zweimal täglich, 10–15 min., zum Beispiel mit elmex Gelée®)
Falls möglich in den ersten acht Wochen nach Radio- und/oder Chemotherapie keine invasiven zahnärztlichen Maßnahmen (zum Beispiel Extraktionen, Wurzelspitzenresektionen, Wurzelkanalbehandlungen)
Im weiteren Verlauf zahnärztliche und chirurgische Maßnahmen unter entsprechenden Vorsichtsmaßnahmen (vgl. S2k-Leitlinie „Infizierte Osteo‧radionekrose“, [Krüger et al., 2018]); Ein den ersten zwölf Monaten nach abgeschlossener Radio- und/oder Chemotherapie grundsätzlich restriktive Chirurgie
Maßnahmen zur Mundhygiene und Mundpflege:
Manuelle Zahnbürste mit sehr weichem Bürstenkopf
Keine Zahnseide, gegebenenfalls sehr weiche Interdentalbürsten und/oder Superflos
Schonende Mundduschen
Fluoridhaltige, milde, mentholfreie Zahnpasta
Keine reizenden, stark alkoholhaltigen Mundspüllösungen
Verwendung milder Mundspüllösungen (zum Beispiel Bepanthen Mundspüllösung, CHX Mundspüllösung verdünnt, zum Beispiel 0,2 % CHX 1:4 verdünnt, nicht unter 0,01 % verdünnen, dreimal täglich)
Kein Tabak und/oder Alkohol
Keine stark gewürzten, salzigen oder säurehaltigen Speisen und Getränke, wie beispielsweise Pökelfleisch oder Cola
Bei bakteriellen Superinfektionen oder Pilzinfektionen Beginn einer systemischen, antibakteriellen Therapie (zum Beispiel Amoxicillin/Clavulansäure) bzw. einer lokalen, antimykotischen Therapie (zum Beispiel Amphomoronal Suspension dreimal täglich beziehungsweise soweit tolerierbar Amphomoronal Lutschtabletten dreimal täglich)
Maßnahmen zur Schmerztherapie:
Eiswürfel beziehungsweise kalten Wackelpudding lutschen
Mundspüllösung aus Dexpanthenol (zum Beispiel Bepanthen) und Lidocain 0,01 % bzw. Tetracain 0,02 % (aus Apotheke, gegebenenfalls individuelle Rezeptur)
Schmerztherapie nach dem WHO-Stufenschema mit Nicht-Opioidanalgetika (Stufe I) bzw. niederpotenten Opioid‧analgetika und Nicht-Opioidanalgetika (Stufe II)
Literaturliste
Abdel Moneim AE, Guerra-Librero A, Florido J, Shen YQ, Fernández-Gil B, Acuña-Castroviejo D, Escames G: Oral Mucositis: Melatonin Gel an Effective New Treatment. Int J Mol Sci. 18:E1003, 2017.
Albert M, Schmidt M, Cordes N, Dörr W: Modulation of radiation-induced oral mucositis (mouse) by selective inhibition of β1 integrin. Radiother Oncol. 104:230-4, 2012.
Bockel S, Vallard A, Lévy A, François S, Bourdis M, Le Gallic C, Riccobono D, Annede P, Drouet M, Tao Y, Blanchard P, Deutsch É, Magné N, Chargari C: Pharmacological modulation of radiation-induced oral mucosal complications. Cancer Radiother. 2018 [Epub ahead of print]
Bollig A: Die Krankheitslast der oralen Mukositis. Dissertation. Medizinische Fakultät der Ludwig-Maximilians-Universität zu München, 2016.
Bonfili P, Gravina GL, Marampon F, Rughetti A, Di Staso M, Dell'Orso L, Vittorini F, Moro R, La Verghetta ME, Parente S, Reale M, Ruggieri V, Franzese P, Tombolini V, Masciocchi C, Di Cesare E: Oral Platelet Gel Supernatant Plus Supportive Medical Treatment Versus Supportive Medical Treatment in the Management of Radiation-induced Oral Mucositis: A Matched Explorative Active Control Trial by Propensity Analysis. Am J Clin Oncol. 40:336-41, 2017.
Chaitanya B, Pai KM, Yathiraj PH, Fernandes D, Chhaparwal Y: Rebamipide gargle in preventive management of chemo-radiotherapy induced oral mucositis. Oral Oncol. 72:179-82, 2017.
Curra M, Pellicioli AC, Filho NA, Ochs G, Matte Ú, Filho MS, Martins MA, Martins MD: Photobiomodulation reduces oral mucositis by modulating NF-kB. J Biomed Opt. 20:125008, 2015.
Ferris RL, Blumenschein G Jr, Fayette J, Guigay J, Colevas AD, Licitra L, Harrington K, Kasper S, Vokes EE, Even C, Worden F, Saba NF, Iglesias Docampo LC, Haddad R, Rordorf T, Kiyota N, Tahara M, Monga M, Lynch M, Geese WJ, Kopit J, Shaw JW, Gillison ML: Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med. 375:1856-67, 2016.
Frings K, Gruber S, Kuess P, Kleiter M, Dörr W: Modulation of radiation-induced oral mucositis by thalidomide: Preclinical studies. Strahlenther Onkol. 192:561-8, 2016.
Gobbo M, Ottaviani G, Perinetti G, Ciriello F, Beorchia A, Giacca M, Di Lenarda R, Rupel K, Tirelli G, Zacchigna S, Biasotto M: Evaluation of nutritional status in head and neck radio-treated patients affected by oral mucositis: efficacy of class IV laser therapy. Support Care Cancer. 22:1851-6, 2014.
Gruber S, Schmidt M, Bozsaky E, Wolfram K, Haagen J, Habelt B, Puttrich M, Dörr W: Modulation of radiation-induced oral mucositis by pentoxifylline: preclinical studies. Strahlenther Onkol. 191:242-7, 2015.
Gruber S, Frings K, Kuess P, Dörr W: Protective effects of systemic dermatan sulfate treatment in a preclinical model of radiation-induced oral mucositis. Strahlenther Onkol. 194:675-85, 2018.
Harrington KJ, Ferris RL, Blumenschein G Jr, Colevas AD, Fayette J, Licitra L, Kasper S, Even C, Vokes EE, Worden F, Saba NF, Kiyota N, Haddad R, Tahara M, Grünwald V, Shaw JW, Monga M, Lynch M, Taylor F, DeRosa M, Morrissey L, Cocks K, Gillison ML, Guigay J: Nivolumab versus standard, single-agent therapy of investigator's choice in recurrent or metastatic squamous cell carcinoma of the head and neck (CheckMate 141): health-related quality-of-life results from a randomised, phase 3 trial. Lancet Oncol. 18:1104-15, 2017.
Heitz-Mayfield LJA, Salvi GE: Peri-implant mucositis. J Periodontol. 89 Suppl 1:257-66, 2018.
Höller U et al.: Supportive Maßnahmen in der Radioonkologie. S2e-Leitlinien, AWMF online, Stand 02/2015.
Kämmerer PW, Thiem D, Eisenbeiß C, Dau M, Schulze R, Al-Nawas B, Draenert GF: Surgical evaluation of panoramic x-ray and cone beam computed tomography for therapy planning of bisphosphonate related osteonecrosis of the jaws. Oral Surg Oral Med Oral Pathol Oral Radiol 121:419-24, 2016.
Keiner D: Mukositis bei Tumorpatienten schonend behandeln. Deutsche Apotheker Zeitung 9/2010.
Krüger M, Hautmann M, Bartella A, Al-Nawas B, Grötz K: Infizierte Osteoradionekrose (IORN) der Kiefer. S2k-Leitlinie, AWMF-Registernummer 007/046, publiziert bei AWMF online, 2018.
Lalla RV, Saunders DP, Peterson DE: Chemotherapy or radiation-induced oral mucositis. Dent Clin North Am. 58:341-9, 2014.
Lopez-Vaquero D, Gutierrez-Bayard L, Rodriguez-Ruiz JA, Saldaña-Valderas M, Infante-Cossio P: Double-blind randomized study of oral glutamine on the management of radio/chemotherapy-induced mucositis and dermatitis in head and neck cancer. Mol Clin Oncol. 6:931-36, 2017.
Panahi Y, Saadat A, Shadboorestan A, Ahmadi A: An Updated Review of Natural Products Intended to Prevent or Treat Oral Mucositis in Patients Undergoing Radio-Chemotherapy. Curr Pharm Biotechnol. 17:949-61, 2016.
Patil K, Guledgud MV, Kulkarni PK, Keshari D, Tayal S: Use of Curcumin Mouthrinse in Radio-Chemotherapy Induced Oral Mucositis Patients: A Pilot Study. J Clin Diagn Res. 9:59-62, 2015.
Pawar D, Neve RS, Kalgane S, Riva A, Bombardelli E, Ronchi M, Petrangolini G, Morazzoni P: SAMITAL® improves chemo/radiotherapy-induced oral mucositis in patients with head and neck cancer: results of a randomized, placebo-controlled, single-blind Phase II study. Support Care Cancer. 21:827-34, 2013.
Riley P, Glenny AM, Worthington HV, Littlewood A, Clarkson JE, McCabe MG: Interventions for preventing oral mucositis in patients with cancer receiving treatment: oralcryotherapy. Cochrane Database Syst Rev. 23:CD011552, 2015.
Ruggiero T, Pol R, Camisassa D, Simiele S, Giaccone L, Carossa S: Treatment of symptomatic oral mucositis with sodium hyaluronate and synthetic amino acid precursors of collagen in patients undergoing haematopoietic stem cell transplantation. J Biol Regul Homeost Agents. 32:737-43, 2018.
Sharma A, Tilak T, Bakhshi S, Raina V, Kumar L, Chaudhary SP, Sahoo RK, Gupta R, Thulkar S: Lactobacillus brevis CD2 lozenges prevent oral mucositis in patients undergoing high dose chemotherapy followed by haematopoietic stem cell transplantation. ESMO Open. 1:e000138, 2017.
Vermorken JB, Mesia R, Rivera F, Remenar E, Kawecki A, Rottey S, Erfan J, Zabolotnyy D, Kienzer HR, Cupissol D, Peyrade F, Benasso M, Vynnychenko I, De Raucourt D, Bokemeyer C, Schueler A, Amellal N, Hitt R: Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med. 359:1116-27, 2008.