Biofilme auf dentalen Werkstoffen
In Biofilmen organisiert besiedeln Bakterien und Pilze Zähne, Schleimhäute und zahnärztliche Restaurationen. Bislang konnten über 750 verschiedene Bakterienarten als Teil des oralen Mikrobioms identifiziert werden [The Forsyth Institute, 2021]. Aufgrund der schwierigeren Kultivierbarkeit von Pilzen ist deren Vielfalt in der Mundhöhle bislang schwer einzuschätzen. Nichtsdestotrotz gehören diese Organismen zu einer gesunden Mundflora, spielen aber auch bei der Strukturierung von Biofilmen eine wichtige Rolle [Valm, 2019].
Wie überall im menschlichen Körper gibt es in der Mundhöhle neben nützlichen auch potenziell pathogene Mikroorganismen. Die Anwesenheit krankheitserregender Bakterien und Pilze allein führt jedoch nicht zur Erkrankung. Vielmehr bestimmen die dynamischen Interaktionen zwischen den Mikroorganismen und der Immunabwehr des Wirtes, ob eine Biofilm-assoziierte Erkrankung entsteht [Kornman et al., 1997]. Dabei können potenziell pathogene Biofilme sowohl mit lokalen als auch mit systemischen gesundheitlichen Folgen in Verbindung gebracht werden.
Entstehung oraler Biofilme
Dentale Biofilme werden als dreidimensionales Gebilde aus interagierenden Mikroorganismen definiert. Sie bestehen aus Bakterien und Pilzen, ihren Stoffwechselprodukten sowie Nahrungs- und Speichelbestandteilen. Biofilme haften an Oberflächen und sind in ein Gefüge extrazellulärer Substanzen – bestehend aus Polysacchariden, Proteinen und Lipiden – eingebettet [Meyer-Lückel et al., 2012; Marsh, 1994]. Grundsätzlich bietet die Mundhöhle unterschiedliche Lebensräume für Bakterien und Pilze: Man kann im Wesentlichen die sich regenerierenden Habitate wie die Mundschleimhaut und die Zunge von den sich nicht regenerierenden Lebensräumen wie Zahnoberflächen und zahnärztlichen Restaurationen abgrenzen [Marsh/Martin, 2010].
Die Biofilmgemeinschaften auf Zahn- und Restaurationsoberflächen sind besonders komplex strukturiert und artenreich, was vermutlich mit dem nicht abschilfernden Charakter dieser Oberflächen zusammenhängt [Lamont et al., 2018]. Zudem unterscheidet sich die Zusammensetzung der Mikroorganismen in den verschiedenen Lebensräumen aufgrund der dort vorherrschenden Lebensbedingungen (beispielsweise Verfügbarkeit von Sauerstoff, Kohlenhydraten, Sulkusflüssigkeit und Nischen). Darüber hinaus können entgegen früherer Annahmen das Genom sowie genetische Mutationen des Wirtsorganismus die Diversität, Zusammensetzung und das Vorhandensein bestimmter Mikroorganismen beeinflussen. So besitzen eineiige Zwillinge ähnlichere Mikrobiota als zweieiige Zwillinge und vor allem als nicht verwandte Individuen [Weyrich, 2021].
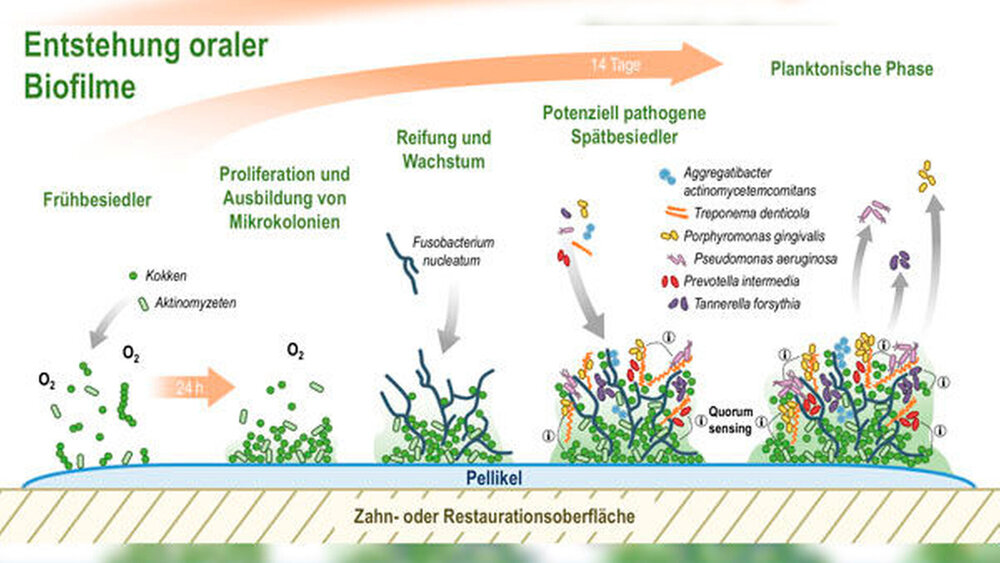
Die Biofilmformation beginnt binnen weniger Sekunden bis Minuten nach dem Zähneputzen mit der Bildung der sogenannten erworbenen Pellikel [Hannig, 1999; Jong et al., 1984] (Abbildung 1). Diese ist ein azellulärer, semipermeabler Film insbesondere aus Speichelproteinen, der auf allen Oberflächen der Mundhöhle und dentaler Restaurationen entsteht. Die Pellikel dient unter anderem der Befeuchtung und dem Schutz des Zahnes. Gleichzeitig bildet sie die Voraussetzung für das Attachment sogenannter Frühbesiedler-Mikroorganismen wie grampositiver Kokken und Aktinomyzeten. Diese vermehren sich und bilden Mikrokolonien innerhalb des ersten Tages. Erfolgt keine Reinigung der Zahn- oder Restaurationsoberfläche, so binden diese Mikrokolonien im Laufe der Zeit weitere Bakterien sowie Pilze im reifenden Biofilm. Dabei spielt das sogenannte Brückenbakterium Fusobacterium nucleatum eine zentrale Rolle. Dieses ermöglicht eine Anknüpfung von potenziell pathogenen Spätbesiedlern wie Aggregatibacter actinomycetemcomitans, Treponema denticola, Porphyromonas gingivalis und Prevotella intermedia an die Frühbesiedler. Vereinfacht lässt sich sagen, dass zu den Frühbesiedlern häufig grampositive, aerotolerante Kokken gehören, während zu den Spätbesiedlern eher gramnegative und anaerobe Stäbchen oder Filamente zählen. Während supragingival häufig aerobe Mikroorganismen vorzufinden sind, leben in der Tiefe des Sulkus vornehmlich anaerobe Bakterien [Mark Welch et al., 2016]. Dabei können aerobe Mikroorganismen wie Streptokokken Sauerstoff verstoffwechseln und dadurch anaerobe Verhältnisse schaffen [Mark Welch et al., 2016].
Dieser Vorgang spielt beim Übergang von der Symbiose zur Dysbiose des Mikrobioms eine wesentliche Rolle, da viele Pathobionten strikte Anaerobier sind [Valm, 2019]. Nach etwa 14 Tagen beobachtet man die Loslösung von Mikroorganismen aus dem Biofilm. Bakterien wie Porphyromonas gingivalis, Tannerella forsythia und Pseudomonas aeruginosa können dann im sogenannten planktonischen Zustand vorzufinden sein (Abbildung 1). Nicht organisierte Mikroorganismen sind in aller Regel schlechter vor äußeren Einflüssen geschützt als sessile und weisen seltener Antibiotikaresistenzen auf als im Biofilm eingebundene Mikroorganismen [Kouidhi et al., 2015]. Die Kleinstlebewesen dieser komplex organisierten Gemeinschaft kommunizieren und interagieren mithilfe von Signalmolekülen miteinander. Es kommt zu wechselseitigen metabolischen Beziehungen, zur Modulation von Genexpressionen und nicht zuletzt zur Weitergabe von Antibiotikaresistenzen. Diese Kommunikation zwischen den Mikroorganismen wird als „Quorum sensing“ bezeichnet und beeinflusst die Virulenz eines Biofilms maßgeblich [Abisado et al., 2018].
Grundsätzlich gilt, dass potenziell pathogene Keime in der physiologischen Mikroflora vorhanden sind. Besteht ein Gleichgewicht zwischen apathogenen und pathogenen Mikroorganismen, herrschen gesunde Verhältnisse. Kommt es jedoch zu ökologischen Veränderungen wie einer Ernährungsumstellung oder einer Immunschwäche durch Krankheit, Medikation oder Umwelteinflüsse, so kann ein sogenannter ökologischer Shift in Richtung potenzieller Pathogene stattfinden (ökologische Plaquehypothese) [Valm, 2019]. Die dadurch entstehende Dysbiose ist durch eine veränderte Diversität der Mikroorganismen sowie ihrer relativen Anteile am Mikrobiom gekennzeichnet und kann die Entwicklung von Erkrankungen begünstigen [Samaranayake et al., 2021].
Biofilm-assoziierte Erkrankungen
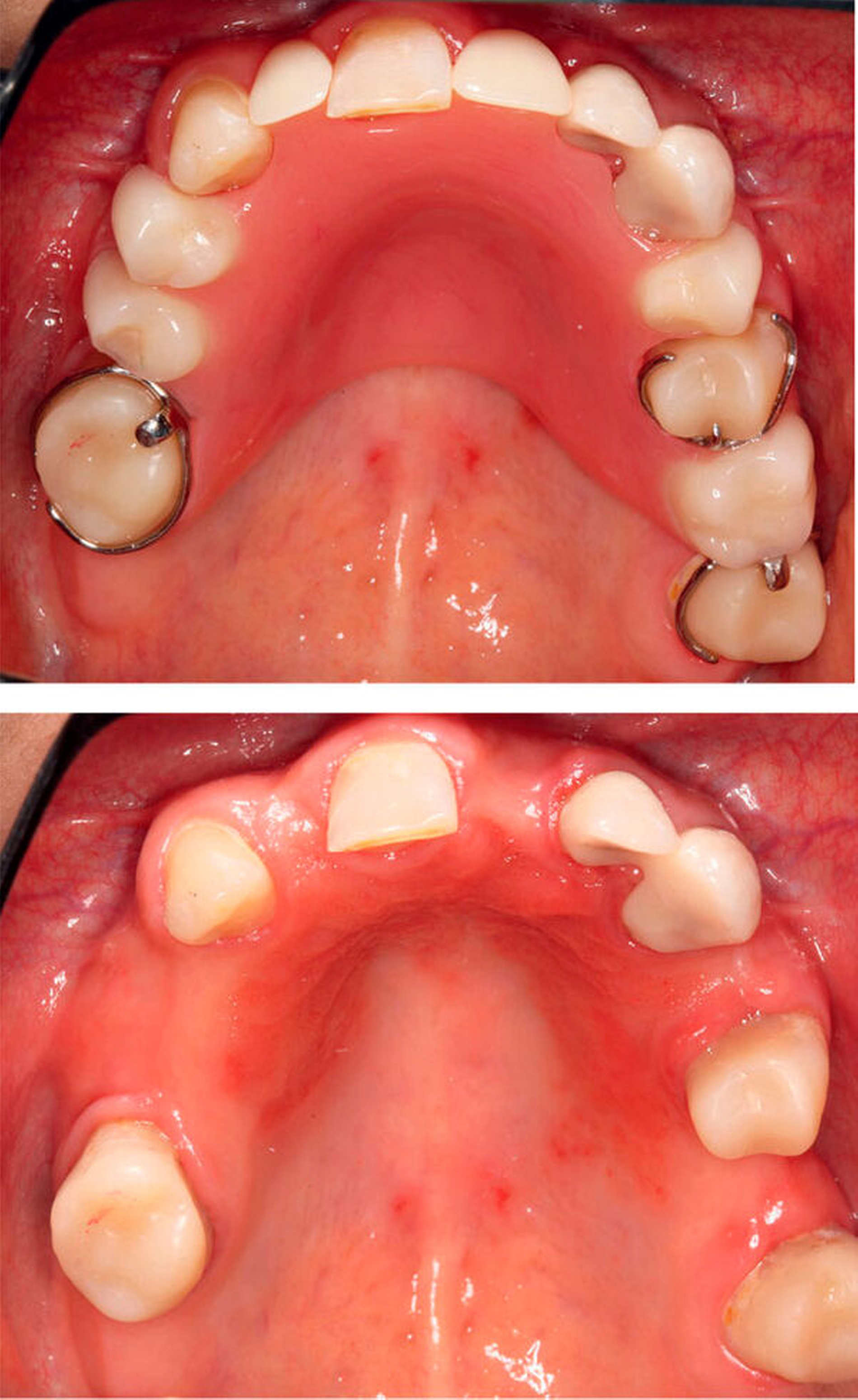
Das mittel- bis langfristige Verweilen potenziell pathogener Biofilme auf Zähnen, Füllungsmaterialien, oralen Weichgeweben, Implantaten und anderem Zahnersatz kann gesundheitliche Folgen haben – lokal wie auch systemisch. Selbst wenn keine Zähne mehr vorhanden sind, die von Karies oder Parodontitis betroffen sein können, stellen Biofilme weiterhin ein Risiko für die Entstehung oraler Erkrankungen dar. Epidemiologischen Studien zufolge leiden zwischen 15 Prozent bis über 70 Prozent aller Prothesenträger an einer Prothesenstomatitis [Gendreau/Loewy, 2011]. Großflächig extendierter Zahnersatz bietet dabei optimale Voraussetzungen für die Anheftung und Vermehrung von Pilzen wie Candida albicans. Ist die Prothesenhygiene unzureichend, steigt das Risiko, an einer Pilzinfektion zu erkranken. Diese zeigt sich oft als prothesenkongruente Rötung und Reizung der von Zahnersatz bedeckten Schleimhaut und kann von Brennen, Geschmacksbeeinträchtigungen und Schmerzen begleitet sein (Abbildung 2). Pilze sind in der Lage, in tiefere Schleimhautschichten vorzudringen [Leberer et al., 1997] und Prothesenmaterialien zu invadieren und zu degradieren. Dabei kann der Prothesenwerkstoff aufgeraut werden und zu weiteren Irritationen der betroffenen Schleimhaut führen [Pereira-Cenci et al., 2008]. Neben einer antimykotischen Therapie der Mundschleimhaut und des Zahnersatzes kann eine Rebasierung oder Neuanfertigung der Prothese sinnvoll sein, da tief in das Material eingedrungene Pilze für die antimykotische Therapie unerreichbar bleiben können.
Das orale Mikrobiom kann auch systemisch auf den gesamten Organismus Einfluss nehmen. Parodontale Infektionen können beispielsweise die Zellalterung verstärken [Melk et al., 2014], das Risiko für Arteriosklerose steigern und somit Herzinfarkte [Gomes-Filho et al., 2020] und Hirninfarkte [Fagundes et al., 2019] begünstigen sowie die Entstehung und Einstellung von Diabetes beeinflussen [Preshaw/Bissett, 2019]. Weiterhin gehören gastrointestinale Infektionen und Aspirationspneumonien zu disseminierten Infektionen, die durch die Ansammlungen von Mikroorganismen auf Restaurationsmaterialien verursacht werden können. Respiratorische Pathogene können zudem regelmäßig in Biofilmen auf Prothesenoberflächen detektiert werden [O‘Donnell et al., 2016], was einen Zusammenhang zwischen dem Auftreten von Lungenentzündungen und dem Tragen von abnehmbarem Zahnersatz nahelegt [El-Solh, 2011]. Begünstigende Faktoren wie das ganztägige Tragen unzureichend gepflegter Prothesen, eine schwache Abwehrlage des Patienten und im Alter zunehmende Schluckstörungen können zur Entstehung von Pneumonien und zur Progression chronisch obstruktiver Lungenerkrankungen führen [Mojon, 2002; Scannapieco et al., 1998]. Lungenentzündungen gehören bei älteren Patienten mit einer Mortalitätsrate von etwa 25 Prozent zu einer der häufigsten Todesursachen. Somit ist eine gründliche Mund- und Prothesenhygiene von großer Bedeutung und kann Pneumonie-bedingte Todesfälle reduzieren [Sjögren et al., 2008].
Biofilme auf zahnärztlichen Werkstoffen
Grundsätzlich verläuft die Biofilmbildung auf zahnärztlichen Werkstoffen ähnlich zu der auf Zähnen. Nach der Entstehung der erworbenen Pellikel kommt es zur initialen Anlagerung von Bakterienzellen. Darauf folgt die sekundäre Kolonisation während der Biofilmreifung und schließlich die Loslösung von Mikroorganismen aus dem Biofilm während der planktonischen Phase. Dennoch unterscheiden sich Biofilme je nach Werkstoff, auf dem sie haften. Materialeigenschaften wie die Oberflächenrauigkeit, die Oberflächentopografie und die chemische Zusammensetzung eines zahnärztlichen Restaurationsmaterials können die Affinität der Bioadhäsion beeinflussen.
Dabei ist zu beachten, dass die Untersuchungen zur Bioadhärenz auf dentalen Werkstoffen nicht unbedingt immer miteinander vergleichbar sind, da die Ergebnisse stark vom Design der Untersuchung abhängen. Allgemein gilt jedoch, dass Mikroorganismen vermehrt an raue Werkstoffe adhärieren. Materialunebenheiten wie Porositäten, Kratzer, Lücken und Frakturen können von Speichelproteinen benetzt und teilweise kaschiert werden. Diese Pellikelschicht reduziert die Rauigkeit des Werkstoffs signifikant. Allerdings ist dieser Effekt auf besonders rauen Oberflächen weniger deutlich ausgeprägt.
Unabhängig von der Oberflächenrauigkeit können Materialien unterschiedliche Oberflächentopografien besitzen. So zeigen einige in der Natur vorkommende biologische Systeme besonders Biofilm-abweisende Oberflächenstrukturen – zum Beispiel der Lotusblüteneffekt. Solche Oberflächentopografien können bei der Entwicklung neuer Biomaterialien genutzt werden.
Biofilme auf Werkstoffen für die direkte Restauration
Die Bioadhäsion auf direkten Restaurationswerkstoffen wie Komposit, Amalgam und Zement weist einige Gemeinsamkeiten, aber auch Unterschiede auf. Die bakterielle Zusammensetzung von Biofilmen unter Komposit- und Amalgamrestaurationen sind beispielsweise ähnlich [Splieth et al., 2003]. Betrachtet man jedoch die Biofilmvitalität, so beherbergen Amalgam und Glasionomerzement (GIZ) weniger lebende Mikroorganismen als Komposit [Auschill et al., 2002]. Auch die bakteriellen Adhäsionskräfte waren auf Glasionomerzement kleiner als auf Komposit, stiegen jedoch für beide Materialien mit zunehmender Rauigkeit an [Sainan et al., 2016].
Klinisch beobachtet man häufiger Karies am Restaurationsrand von Kompositfüllungen als an dem von Amalgamfüllungen [Askar et al., 2017]. Die Überlebensrate direkter Restaurationen aus Komposit kann insbesondere bei Patienten mit hohem Kariesrisiko kürzer sein als die von Amalgamrestaurationen. Schrumpfung und daraus resultierende Microleakages, die Freisetzung wachstumsfördernder Substanzen und ein Mangel an antibakteriellen und Säure abpuffernden Bestandteilen von Kompositwerkstoffen können mögliche Gründe für diese Beobachtung sein. Vergleicht man das Risiko für die Entstehung kariöser Läsionen am Restaurationsrand von Glasionomerzement und Kompositversorgungen, so ist trotz der Fluoridfreisetzung des Glasionomerzements kein signifikanter Unterschied hinsichtlich des Sekundärkariesrisikos festzustellen [Brambilla/Ionescu, 2021].
Mikroorganismen sind zudem in der Lage, einen Werkstoff zu verändern und teilweise abzubauen. Die Degradation direkter Restaurationen aus Komposit ist dabei stärker als die von Amalgam, wobei hochgefüllte Komposite weniger abgebaut werden als niedriggefüllte [Finer/Santerre, 2007]. Durch diesen Prozess können Verfärbungen und kariöse Läsionen an der Grenzfläche von Komposit zu Zahn entstehen [Delaviz et al., 2014]. Weiterhin bewirkt die Werkstoffdegradation einen Anstieg der Rauigkeit, eine Veränderung der Oberflächentopografie und eine Zunahme der Bioadhäsion [Nedeljkovic et al., 2017; Bourbia et al., 2013] – sowohl bei Kompositen als auch bei Glasionomerzementen [Busscher et al., 2010]. Auch Amalgamrestaurationen werden durch die Auflagerung von Mikroorganismen verändert. Es kommt zu einer sogenannten Biokorrosion. Allerdings sind die Korrosionsprodukte in der Lage, potenzielle Lücken zwischen Zahn und Füllung zu versiegeln und damit Komplikationen wie Überempfindlichkeiten oder Sekundärkaries zu minimieren [Mahler et al., 2009]. Häufig entsteht durch die Ablagerung von Korrosionsprodukten ein gräulicher Schimmer in der Zahnsubstanz, der von kariösem Gewebe abzugrenzen ist.
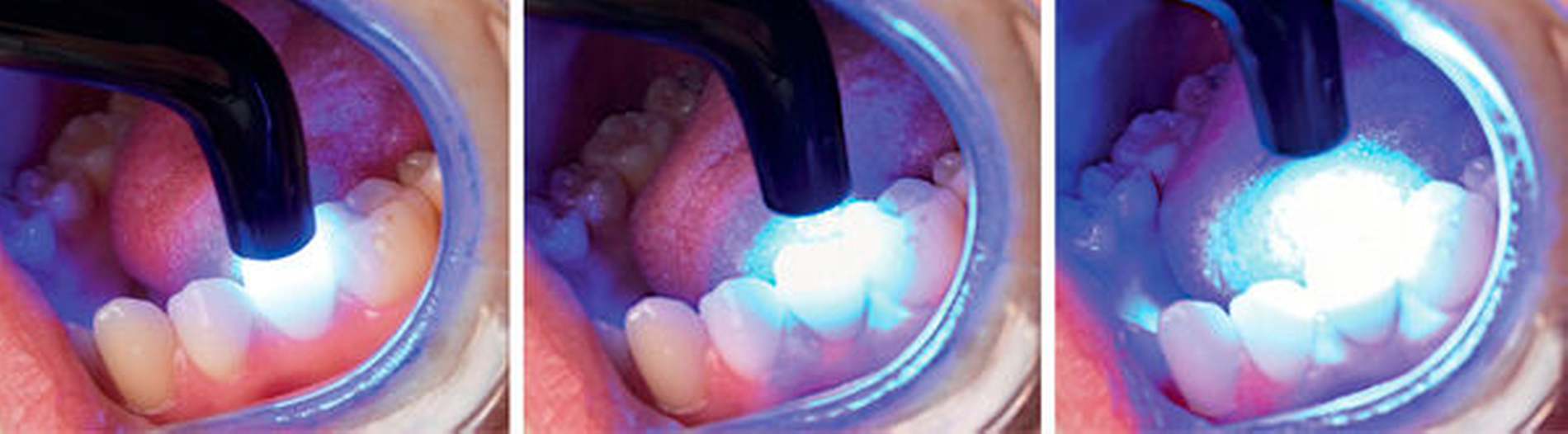
Eine weitere Einflussgröße auf das Biofilmattachment ist die chemische Zusammensetzung des direkten Restaurationsmaterials. Amalgamversorgungen weisen beispielsweise aufgrund ihres Silbergehalts einen deutlichen antibakteriellen Effekt auf. Glasionomerzemente wirken aufgrund des Fluoridgehalts wachstumshemmend auf Biofilme sowie remineralisierend auf die Zahnhartsubstanz [Hegde et al., 2018]. Bei Kompositen scheint unter anderem der Monomeranteil einen Einfluss auf die Bioadhäsion zu nehmen. Bei der Polymerisation von Komposit sinkt mit zunehmendem Polymerisationsgrad der unpolymerisierte Monomeranteil und damit auch die Bakterienanheftung [Brambilla et al., 2009]. Aus mechanischen und biologischen Gründen ist daher eine gründliche Polymerisation unabdingbar. Dabei sollte die Lichtpolymerisation des Komposits ausreichend lange von allen Seiten und mit möglichst kleinem Abstand erfolgen, um die vom Hersteller angegebene Lichtleistung zu gewährleisten (Abbildung 3). Zudem sollte das Polymerisationsgerät die Wellenlänge abdecken, bei dem der Komposit-spezifische Lichtinitiator aktiviert wird.
Biofilme auf festsitzendem Zahnersatz
Zur Herstellung von Kronen und Brücken stehen grundsätzlich Metalle (Nichtedel- und Edelmetalle), zahnfarbene Werkstoffe (Keramiken, Polymer-infiltrierte Keramiken, Komposite) sowie provisorische Materialien (Polymethylmethacrylat) zur Verfügung. Diese können im konventionellen Verfahren oder mithilfe der CAD/CAM (computer-aided design/computer-aided manufacturing)-Technologie gefertigt werden.
Werden Metalllegierungen in die Mundhöhle eingebracht, wechselwirken diese mit oralen Mikroorganismen und deren Stoffwechselprodukten. Folglich kann es zur Freisetzung von Metallionen kommen, die teilweise antibakteriell wirken, aber auch zu einer eingeschränkten Biokompatibilität führen können [Hao et al., 2018]. Hochgoldhaltige Legierungen wiesen nur etwa ein Viertel der Bakterienmenge im Vergleich zu natürlichen Zahnoberflächen auf, wobei die bakterielle Zusammensetzung vergleichbar war [Goodson et al., 2001]. Weiterhin wirkt in Edelmetalllegierungen enthaltenes Kupfer bakterizid, indem es die bakterielle Zellmembran zerstört und den Zelltod einleitet [Hans et al., 2015]. Eine Studie identifizierte auf Cobalt-Chrom-Legierungen eine größere Biofilmdichte und -vitalität als auf Titan, Feldspat- und Zirkoniumdioxidkeramiken [Souza et al., 2016]. Metalllegierungen und Biofilme beeinflussen sich wechselseitig, da mikrobielle Stoffwechselprodukte wie Säuren Metalloberflächen korrodieren und dadurch aufrauen können. Dies kann zum einen die Bioadhäsion fördern und zum anderen die mechanischen Eigenschaften der Metallrestauration beeinträchtigen [Zhang et al., 2016].
Immer mehr Patienten äußern den Wunsch, mit einem zahnfarbenen Restaurationsmaterial versorgt zu werden. Neben Keramiken stehen insbesondere Polymer-infiltrierte Keramiken und Komposite für die definitive zahnärztliche Rehabilitation zur Verfügung. Weiterhin finden Polymere wie Polymethylmethacrylat zur Herstellung (langzeit)provisorischer Restaurationen Anwendung. Keramischen Restaurationen wird eine hohe Biokompatibilität zugesprochen. So verwundert es nicht, dass Keramiken einen im Vergleich zu anderen Werkstoffen höheren Anteil vitalen Biofilms beherbergen [Auschill et al., 2002]. Eine Schweizer Forschungsgruppe untersuchte die Anheftung von Biofilmen auf Zirkoniumdioxid, einer Polymer-infiltrierten Keramik und einem Polymer. Dabei wies das Polymer die geringste Bioadhärenz auf, gefolgt von der Polymer-infiltrierten Keramik und der Zirkoniumdioxidkeramik [Astasov-Frauenhoffer et al., 2018].
Die Datenlage zur Bioadhäsion auf zahnfarbenen Werkstoffen ist insgesamt jedoch kontrovers. So zeigten einige Forschungsgruppen, dass keramische Werkstoffe mehr Biofilm als Komposite akkumulieren [Hauser-Gersprach et al., 2007], andere Untersuchungen wiederum kamen zu gegenteiligen Ergebnissen [Aykent et al., 2010; Tanner et al., 2005; Eick et al., 2004]. Lange Zeit galt die herkömmliche Meinung, dass Komposite eine stärkere Biofilmbildung begünstigen als Keramiken [Svanberg et al., 1990]. Da jedoch die Gruppe der Komposite durch ihre teilweise sehr unterschiedliche Zusammensetzung heterogen ist, kann diese Aussage nicht pauschal getroffen werden. Makrogefüllte Komposite älterer Generationen haben beispielsweise eine höhere Rauigkeit und bedingen in der Tat eine stärkere Biofilmakkumulation als moderne hybridgefüllte Komposite [Ionescu et al., 2012]. Sicherlich hängen die Forschungsergebnisse von den verwendeten Werkstoffen, deren Verarbeitung, den genutzten Bakterienstämmen und nicht zuletzt vom Studiendesign ab; viele Studien wurden zudem unter Laborbedingungen durchgeführt, daher können die Ergebnisse nicht in toto in die Klinik übertragen werden.
Mittlerweile können Komposite auch im indirekten, computergestützten Verfahren verarbeitet werden (CAD/CAM) und für die Herstellung provisorischer und definitiver Einzelzahnversorgungen dienen. Die Materialblöcke, aus denen die Restaurationen gefräst werden, sind industriell vorgefertigt und weisen eine homogene Zusammensetzung sowie eine optimale Polymerisation auf. Es ist denkbar, dass CAD/CAM-gefertigte Werkstücke neben vorteilhaften mechanischen Eigenschaften [Stawarczyk et al., 2015] auch über eine geringere Biofilmanheftung verfügen [Ionescu et al., 2020].
Biofilme auf herausnehmbarem Zahnersatz
Mit zunehmendem Alter steigt die Wahrscheinlichkeit für die Entstehung von Allgemeinerkrankungen und den damit verbundenen Einbußen bei der Bewältigung alltäglicher Aufgaben. Mit abnehmender Sehkraft und sich verschlechternden kognitiven und feinmotorischen Fähigkeiten wird die Mund- und Prothesenhygiene für den alternden Patienten zur Herausforderung. Etwa 30 Prozent der pflegebedürftigen älteren Senioren zwischen 75 und 100 Jahren geben an, Hilfe bei der täglichen Zahn- und Prothesenpflege zu benötigen [Jordan/Micheelis, 2016]. Aufgrund der hohen pflegerischen Arbeitslast des Pflegepersonals bleibt teilweise nur wenig Zeit, um die Bewohner von Pflegeeinrichtungen bei ihrer täglichen Mund- und Prothesenhygiene zu unterstützen. Zudem können Berührungsängste, Schwierigkeiten bei der Erkennung von Zahnersatz, der Ein- und Ausgliederung (Abbildung 4) sowie ihrer Pflege auftreten, was die Situation verschärft [Barbe et al., 2019; Jordan et al., 2012; Nitschke/Kaschke, 2011]. In diesem Fall kann bei der zahnärztlichen Rehabilitation die Wahl eines Materials mit geringerer Biofilmanheftung hilfreich sein, das eine leichtere Reinigung erlaubt.
Optimale Prothesenpflege
Tab. 1 | Quelle: Fermandes et al., 2007; Hahnel et al., 2012; Budtz-Jørgensen, 1979; Aslanimehr et al., 2018; Ribeiro et al., 2009; Buergers et al., 2008; Webb et al., 2005; Ribeiro et al., 2012
Reinigung einer Oberkiefertotalprothese mit einer Prothesenbürste und Prothesenschaum: Die Prothesenbürste besitzt im Gegensatz zur Zahnbürste zwei Köpfe mit unterschiedlichen Borstenlängen und -anordnungen zur besseren Zugänglichkeit der verschiedenen Bereiche des Zahnersatzes und ist damit der Zahnbürste vorzuziehen. | Anne Katharina Schmutzler, Florian Fuchs
Die Vielfalt möglicher Reinigungsmethoden spiegelt sich auch in der Heterogenität der klinischen Studien zum Thema. Insgesamt ist die Datenlage bezüglich der Effektivität der Biofilmentfernung und Eliminierung von Mikroorganismen uneinheitlich [Souza et al., 2009]. Während die mechanische Reinigung von Prothesen die Oberflächenbedeckung mit Biofilm wirksam reduziert, zeigen chemische Reinigungsmethoden eine signifikante Beseitigung von Bakterien und Pilzen wie C. species [Papadiochou/Polyzois, 2018]. Daraus lässt sich schlussfolgern, dass die kombinierte Anwendung von mechanischen und chemischen Reinigungsmethoden derzeit die besten Ergebnisse hinsichtlich einer Reduktion von Biofilm und Mikroorganismen auf abnehmbarem Zahnersatz liefert [Papadiochou/Polyzois, 2018; Felton et al., 2011].
Bisher existiert keine systematisch entwickelte Leitlinie zur Reinigung herausnehmbaren Zahnersatzes. Jedoch sind Empfehlungen der Bundeszahnärztekammer (BZÄK) ans Pflegepersonal und unterstützende Personen hinsichtlich der Prothesenpflege pflegebedürftiger Senioren in einem Ratgeber veröffentlicht [Elsäßer/Ludwig, 2017] (Tabelle 2). Zusätzlich stellt die BZÄK in Kooperation mit anderen Organisationen Erklärvideos für Patienten und Angehörige zur korrekten Prothesenreinigung sowie zur Zahn- und Mundhygiene bei pflegebedürftigen Senioren bereit [Bundeszahnärztekammer / Zentrum für Qualität in der Pflege, 2016a, 2016b]. Im Herbst 2021 wird zudem vom Deutschen Netzwerk für Qualitätsentwicklung in der Pflege (DNQP) die Veröffentlichung eines neuen Expertenstandards zum Thema Mundgesundheit erwartet (siehe zm 11/2021 und zm 12/2021).
Tab. 2 | Quelle: Elsäßer/Ludwig, 2017
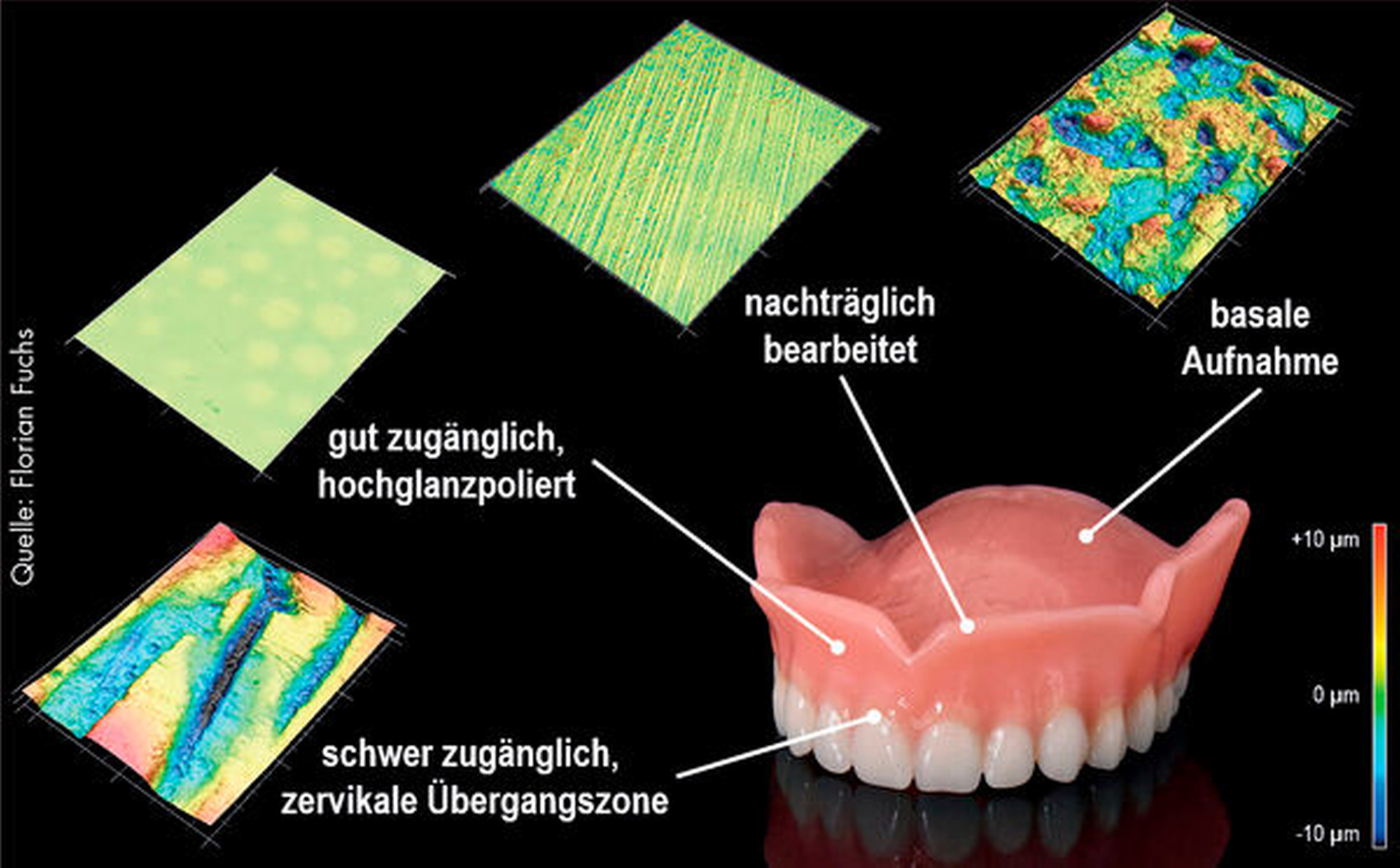
Während die Studienlage nicht zuletzt aufgrund der Heterogenität der Methodik unübersichtlich ist, ist allgemein akzeptiert, dass raue Prothesenmaterialien eine größere Anheftungsoberfläche für Mikroorganismen bieten. Gleichermaßen bilden schwer zugängliche Abschnitte des Zahnersatzes Nischen für die Anheftung von Biofilm (beispielsweise am Übergang zwischen Prothesenzahn und Prothesenkörper; Abbildung 5). Ist die Mundhygiene des betagten Patienten stark eingeschränkt, ist bei der Ausgestaltung des Zahnersatzes insbesondere auf die leichte Reinigungsfähigkeit zu achten. Möglicherweise kann die Prothese oral und vestibulär mit einem glasklaren Kunststoff überzogen werden (beispielsweise mit Polymethylmethacrylat), um für die Prothesenhygiene kritische Übergänge zu nivellieren. Dadurch kann die Speiseretention reduziert und die Reinigung des Zahnersatzes erleichtert werden. Darüber hinaus sollte bei dieser Patientengruppe auf Versorgungen verzichtet werden, die eine ausgeprägte Geschicklichkeit bei der Mundhygiene erfordern.
Des Weiteren gibt es materialspezifische Unterschiede hinsichtlich des Attachments von Mikroorganismen, wobei die Studienergebnisse auch hier vom Studiendesign abhängen. Betrachtet man Prothesenwerkstoffe, so findet man Untersuchungen, die zeigen, dass beispielsweise Polyamid einer höheren C.-albicans-Akkumulation unterliegt als Polymethylmethacrylat [Freitas-Fernandes et al., 2014]. Weiterhin ist die C.-albicans-Anheftung auf hydrophoben Oberflächen größer ist als auf hydrophilen [Yoshijima et al., 2010]. Dies ist bei der Verwendung hydrophober Unterfütterungsmaterialien auf Acrylat- oder Silikonbasis zu beachten. Sie können für weichbleibende Unterfütterungen genutzt werden, weisen jedoch höhere Pilzanheftungen auf als beispielsweise Prothesenbasen aus Polymethylmethacrylat (PMMA) oder Urethandimethacrylat (UDMA) [Susewind et al., 2015].
Werkstoffinnovationen und Limitationen
Bei der Akkumulation von Biofilmen auf zahnärztlichen Restaurationen spielt die Oberflächentopografie eine wichtige Rolle. Zahlreiche biologische Systeme reduzieren durch eine ausgeklügelte Oberflächenbeschaffenheit die Bioadhäsion und können als Vorbild für die Weiterentwicklung von Dentalwerkstoffen dienen – zum Beispiel die Haihaut [Sakamoto et al., 2014] oder der Lotusblüteneffekt [Li/Guo, 2019]. Materialien gleicher Rauigkeit, aber unterschiedlicher Oberflächentopografie können folglich unterschiedliche Affinitäten für die Biofilmanheftung aufweisen [Hahnel et al., 2014; Ionescu et al., 2012; Park et al., 2012]. Das zugrunde liegende Prinzip beruht auf der Annahme, dass Mikrostrukturierungen den Wasser-Kontakt-Winkel und somit die Hydrophobie des Werkstoffs erhöhen. Eine geringere Benetzung der Oberfläche führt zu Lufteinschlüssen, die wiederum die potenzielle Kontaktfläche zwischen Mikroorganismen und dem Werkstoff reduzieren [Frenzel et al., 2016]. Gleichzeitig wird das Quorum Sensing durch die topografischen Barrieren minimiert und die Virulenz des Biofilms beeinflusst. Denkbare klinische Implikationen wären die Substrukturierung zahnärztlicher Werkstoffoberflächen durch spezielle Politurregimes. Des Weiteren könnten mithilfe der Lasertechnik auch metallene Werkstoffe mit einer Biofilm-reduzierenden Topografie versehen werden [Doll et al., 2017]. Im Bereich der direkten Restaurationen können mikrostrukturierte Matrizen bei der Füllungslegung zur Schaffung einer günstigen Oberflächenbeschaffenheit beitragen [Frenzel et al., 2016]. Grundsätzlich sinkt der Einfluss der Werkstoffoberfläche jedoch mit zunehmender Dicke des Biofilms [Hahnel et al., 2015]. Selbst die dünne Bedeckung zahnärztlicher Restaurationen mit einer Pellikelschicht scheint aktuellen Erkenntnissen nach die Biofilm-abweisenden Oberflächeneigenschaften moderner Werkstoffmodifikationen zu beeinträchtigen [Sterzenbach et al., 2020].
Ausblick
Die Entwicklung zahnärztlicher Werkstoffe, die ein geringes Biofilmattachment zulassen, eine einfache Reinigung ermöglichen und gleichzeitig robust gegenüber Hygienemaßnahmen sind, wird weiterhin ein wichtiger Forschungsgegenstand moderner Zahnmedizin bleiben. So scheinen Werkstoffe, die beispielsweise im CAD/CAM-Verfahren gefertigt werden oder über antibakterielle Eigenschaften verfügen, vielversprechend. Um erste Erkenntnisse von Laborstudien auf deren Übertragbarkeit in den klinischen Alltag zu prüfen, sind gut konzipierte klinische Studien notwendig. Weiterhin ist die klinische Untersuchung von Werkstoffen hinsichtlich ihrer Veränderungen durch Reinigungsmethoden im zeitlichen Verlauf sinnvoll, um materialspezifische Reinigungsempfehlungen beziehungsweise mundhygienespezifische Materialempfehlungen entwickeln zu können.
Dr. Med. Dent. Elena Günther
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig
Liebigstr. 12, Haus 1, 04103 Leipzig
elena.guenther@medizin.uni-leipzig.de
Florian Fuchs, M. Sc.
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig
Liebigstr. 12, Haus 1, 04103 Leipzig
Prof. Dr. Med. Dent. Sebastian Hahnel
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig
Liebigstr. 12, Haus 1, 04103 Leipzig
Anne Katharina Schmutzler
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig
Liebigstr. 12, Haus 1, 04103 Leipzig
Literaturliste
Abisado, R.G., Benomar, S., Klaus, J.R., Dandekar, A.A., Chandler, J.R. (2018): Bacterial Quorum Sensing and Microbial Community Interactions. in: mBio, 9, 3.
Askar, H., Tu, Y.-K., Paris, S., Yeh, Y.-C., Schwendicke, F. (2017): Risk of caries adjacent to different restoration materials: Systematic review of in situ studies. in: J Dent, 56, S. 1–10.
Astasov-Frauenhoffer, M., Glauser, S., Fischer, J., Schmidli, F., Waltimo, T., Rohr, N. (2018): Biofilm formation on restorative materials and resin composite cements. in: Dent Mater.
Auschill, T.M., Arweiler, N.B., Brecx, M., Reich, E., Sculean, A., Netuschil, L. (2002): The effect of dental restorative materials on dental biofilm. in: Eur J Oral Sci, 110, 1, S. 48–53.
Aykent, F., Yondem, I., Ozyesil, A.G., Gunal, S.K., Avunduk, M.C., Ozkan, S. (2010): Effect of different finishing techniques for restorative materials on surface roughness and bacterial adhesion. in: J Prosthet Dent, 103, 4, S. 221–27.
Barbe, A.G., Kottmann, H.E., Müller, D., Simic, D., Derman, S.H.M., Wicht, M.J., Noack, M.J. (2019): Evaluation of time and resources required for professional dental cleaning in nursing home residents. in: Spec Care Dentist, 39, 2, S. 89–96.
Bourbia, M., Ma, D., Cvitkovitch, D.G., Santerre, J.P., Finer, Y. (2013): Cariogenic bacteria degrade dental resin composites and adhesives. in: J Dent Res, 92, 11, S. 989–94.
Brambilla, E., Gagliani, M., Ionescu, A.C., Fadini, L., García-Godoy, F. (2009): The influence of light-curing time on the bacterial colonization of resin composite surfaces. in: Dent Mater, 25, 9, S. 1067–72.
Brambilla, E., Ionescu, A.C. (2021): Oral Biofilms and Secondary Caries Formation. in: Ionescu, A.C., Hahnel, S.: Oral biofilms and modern dental materials, Advances toward bioactivity, S. 19–36.
Bundeszahnärztekammer, Zentrum für Qualität in der Pflege (2016a): Herausnehmbarer Zahnersatz - Prothesen richtig reinigen.
Bundeszahnärztekammer, Zentrum für Qualität in der Pflege (2016b): Tipps zur Zahn- und Mundpflege bei pflegebedürftigen Senioren.
Busscher, H.J., Rinastiti, M., Siswomihardjo, W., van der Mei, H C (2010): Biofilm formation on dental restorative and implant materials. in: J Dent Res, 89, 7, S. 657–65.
Delaviz, Y., Finer, Y., Santerre, J.P. (2014): Biodegradation of resin composites and adhesives by oral bacteria and saliva: a rationale for new material designs that consider the clinical environment and treatment challenges. in: Dent Mater, 30, 1, S. 16–32.
Doll, K., Fadeeva, E., Schaeske, J., Ehmke, T., Winkel, A., Heisterkamp, A., Chichkov, B.N., Stiesch, M., Stumpp, N.S. (2017): Development of Laser-Structured Liquid-Infused Titanium with Strong Biofilm-Repellent Properties. in: ACS Appl Mater Interfaces, 9, 11, S. 9359–68.
Eick, S., Glockmann, E., Brandl, B., Pfister, W. (2004): Adherence of Streptococcus mutans to various restorative materials in a continuous flow system. in: J Oral Rehabil, 31, 3, S. 278–85.
Elsäßer, G., Ludwig, E. (2017): Handbuch der Mundhygiene, Zahn-, Mund- und Zahnersatzpflege für Menschen mit Pflege- und Unterstützungsbedarf. Ein Ratgeber für Pflegepersonal und unterstützende Personen. www.bzaek.de/fileadmin/PDFs/p/Handbuch_Mundhygiene.pdf (22.08.2021)
El-Solh, A.A. (2011): Association between pneumonia and oral care in nursing home residents. in: Lung, 189, 3, S. 173–80.
Fagundes, N.C.F., Almeida, Anna Paula Costa Ponte Sousa Carvalho, Vilhena, K.F.B., Magno, M.B., Maia, L.C., Lima, R.R. (2019): Periodontitis As A Risk Factor For Stroke: A Systematic Review And Meta-Analysis. in: Vasc Health Risk Manag, 15, S. 519–32.
Felton, D., Cooper, L., Duqum, I., Minsley, G., Guckes, A., Haug, S., Meredith, P., Solie, C., Avery, D., Deal Chandler, N. (2011): Evidence-based guidelines for the care and maintenance of complete dentures: a publication of the American College of Prosthodontists. in: J Prosthodont, 20 Suppl 1, S1-S12.
Finer, Y., Santerre, J.P. (2007): Influence of silanated filler content on the biodegradation of bisGMA/TEGDMA dental composite resins. in: J Biomed Mater Res A, 81, 1, S. 75–84.
Freitas-Fernandes, F.S., Cavalcanti, Y.W., Ricomini Filho, A.P., Silva, W.J., Del Bel Cury, Altair Antoninha, Bertolini, M.M. (2014): Effect of daily use of an enzymatic denture cleanser on Candida albicans biofilms formed on polyamide and poly(methyl methacrylate) resins: an in vitro study. in: J Prosthet Dent, 112, 6, S. 1349–55.
Frenzel, N., Maenz, S., Sanz Beltrán, V., Völpel, A., Heyder, M., Sigusch, B.W., Lüdecke, C., Jandt, K.D. (2016): Template assisted surface microstructuring of flowable dental composites and its effect on microbial adhesion properties. in: Dent Mater, 32, 3, S. 476–87.
Gendreau, L., Loewy, Z.G. (2011): Epidemiology and etiology of denture stomatitis. in: J Prosthodont, 20, 4, S. 251–60.
Gomes-Filho, I.S., Coelho, J.M.F., Miranda, S.S., Cruz, S.S., Trindade, S.C., Cerqueira, E.M.M., Passos-Soares, J.S., Costa, Maria da Conceição N, Vianna, M.I.P., Figueiredo, Ana Cláudia M G, Hintz, A.M., Coelho, A.F., Passos, L.C.S., Barreto, M.L., Scannapieco, F. (2020): Severe and moderate periodontitis are associated with acute myocardial infarction. in: J Periodontol, 91, 11, S. 1444–52.
Goodson, J.M., Shoher, I., Imber, S., Som, S., Nathanson, D. (2001): Reduced dental plaque accumulation on composite gold alloy margins. in: J Periodontal Res, 36, 4, S. 252–59.
Hahnel, S., Wastl, D.S., Schneider-Feyrer, S., Giessibl, F.J., Brambilla, E., Cazzaniga, G., Ionescu, A.C. (2014): Streptococcus mutans biofilm formation and release of fluoride from experimental resin-based composites depending on surface treatment and S-PRG filler particle fraction. in: J Adhes Dent, 16, 4, S. 313–21.
Hahnel, S., Wieser, A., Lang, R., Rosentritt, M. (2015): Biofilm formation on the surface of modern implant abutment materials. in: Clin Oral Implants Res, 26, 11, S. 1297–301.
Hannig, M. (1999): Ultrastructural investigation of pellicle morphogenesis at two different intraoral sites during a 24-h period. in: Clin Oral Investig, 3, 2, S. 88–95.
Hans, M., Mathews, S., Mücklich, F., Solioz, M. (2015): Physicochemical properties of copper important for its antibacterial activity and development of a unified model. in: Biointerphases, 11, 1, S. 18902.
Hao, Y., Huang, X., Zhou, X., Li, M., Ren, B., Peng, X., Cheng, L. (2018): Influence of Dental Prosthesis and Restorative Materials Interface on Oral Biofilms. in: Int J Mol Sci, 19, 10.
Hauser-Gersprach, I., KULIK, E.M., WEIGER, R., DECKER, E.-M., OHLE, C. von, MEYER, J. (2007): Adhesion of Streptococcus sanguinis to Dental Implant and Restorative Materials in vitro. in: Dent. Mater. J., 26, 3, S. 361–66.
Hegde, N.N., Attavar, S.H., Hegde, M.N., Priya, G. (2018): Antibacterial activity of dental restorative material: An in vitro study. in: J Conserv Dent, 21, 1, S. 42–46.
Ionescu, A.C., Hahnel, S., König, A., Brambilla, E. (2020): Resin composite blocks for dental CAD/CAM applications reduce biofilm formation in vitro. in: Dent Mater, 36, 5, S. 603–16.
Ionescu, A.C., Wutscher, E., Brambilla, E., Schneider-Feyrer, S., Giessibl, F.J., Hahnel, S. (2012): Influence of surface properties of resin-based composites on in vitro Streptococcus mutans biofilm development. in: Eur J Oral Sci, 120, 5, S. 458–65.
Jong, H.P. de, Boer, P. de, Busscher, H.J., van Pelt, A.W., Arends, J. (1984): Surface free energy changes of human enamel during pellicle formation. An in vivo study. in: Caries Res, 18, 5, S. 408–15.
Jordan, A.R., Micheelis, W. (2016): Fünfte Deutsche Mundgesundheitsstudie (DMS V).
Jordan, R., Sirsch, E., Gesch, D., Zimmer, S., Bartholomeyczik, S. (2012): Verbesserung der zahnmedizinischen Betreuung in der Altenpflege durch Schulungen von Pflegekräften. in: Pflege, 25, 2, S. 97–105.
Kornman, K.S., Page, R.C., Tonetti, M.S. (1997): The host response to the microbial challenge in periodontitis: assembling the players. in: Periodontol 2000, 14, S. 33–53.
Kouidhi, B., Al Qurashi, Yasir Mohammed A, Chaieb, K. (2015): Drug resistance of bacterial dental biofilm and the potential use of natural compounds as alternative for prevention and treatment. in: Microb Pathog, 80, S. 39–49.
Lamont, R.J., Koo, H., Hajishengallis, G. (2018): The oral microbiota: dynamic communities and host interactions. in: Nat Rev Microbiol, 16, 12, S. 745–59.
Leberer, E., Ziegelbauer, K., Schmidt, A., Harcus, D., Dignard, D., Ash, J., Johnson, L., Thomas, D.Y. (1997): Virulence and hyphal formation of Candida albicans require the Ste20p-like protein kinase CaCla4p. in: Current Biology, 7, 8, S. 539–46.
Li, Z., Guo, Z. (2019): Bioinspired surfaces with wettability for antifouling application. in: Nanoscale, 11, 47, S. 22636–63.
Mahler, D.B., Pham, B.V., Adey, J.D. (2009): Corrosion sealing of amalgam restorations in vitro. in: Oper Dent, 34, 3, S. 312–20.
Mark Welch, J.L., Rossetti, B.J., Rieken, C.W., Dewhirst, F.E., Borisy, G.G. (2016): Biogeography of a human oral microbiome at the micron scale. in: Proc Natl Acad Sci U S A, 113, 6, E791-800.
Marsh, P., Martin, M. (2010): Oral microbiology. 5. Aufl., Edinburgh, New York.
Marsh, P.D. (1994): Microbial ecology of dental plaque and its significance in health and disease. in: Adv Dent Res, 8, 2, S. 263–71.
Melk, A., Tegtbur, U., Hilfiker-Kleiner, D., Eberhard, J., Saretzki, G., Eulert, C., Kerling, A., Nelius, A.-K., Hömme, M., Strunk, D., Berliner, D., Röntgen, P., Kück, M., Bauersachs, J., Hilfiker, A., Haverich, A., Bara, C., Stiesch, M. (2014): Improvement of biological age by physical activity. in: Int J Cardiol, 176, 3, S. 1187–89.
Meyer-Lückel, H., Paris, S., Ekstrand, K.R. (Hrsg.) (2012): Karies, Wissenschaft und Klinische Praxis, Stuttgart.
Mojon, P. (2002): Oral health and respiratory infection. in: J Can Dent Assoc, 68, 6, S. 340–45.
Nedeljkovic, I., Munck, J. de, Ungureanu, A.-A., Slomka, V., Bartic, C., Vananroye, A., Clasen, C., Teughels, W., van Meerbeek, B., van Landuyt, K.L. (2017): Biofilm-induced changes to the composite surface. in: J Dent, 63, S. 36–43.
Nikawa, H., Hamada, T., Yamashiro, H., Kumagai, H. (1999): A review of in vitro and in vivo methods to evaluate the efficacy of denture cleansers. in: Int J Prosthodont, 12, 2, S. 153–59.
Nitschke, I., Kaschke, I. (2011): Zahnmedizinische Betreuung von Pflegebedürftigen und Menschen mit Behinderungen. in: Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz, 54, 9, S. 1073–82.
O'Donnell, L.E., Smith, K., Williams, C., Nile, C.J., Lappin, D.F., Bradshaw, D., Lambert, M., Robertson, D.P., Bagg, J., Hannah, V., Ramage, G. (2016): Dentures are a Reservoir for Respiratory Pathogens. in: J Prosthodont, 25, 2, S. 99–104.
Papadiochou, S., Polyzois, G. (2018): Hygiene practices in removable prosthodontics: A systematic review. in: Int J Dent Hyg, 16, 2, S. 179–201.
Park, J.W., Song, C.W., Jung, J.H., Ahn, S.J., Ferracane, J.L. (2012): The effects of surface roughness of composite resin on biofilm formation of Streptococcus mutans in the presence of saliva. in: Oper Dent, 37, 5, S. 532–39.
Pereira-Cenci, T., Deng, D.M., Kraneveld, E.A., Manders, E.M.M., Del Bel Cury, Altair Antoninha, Cate, J.M. ten, Crielaard, W. (2008): The effect of Streptococcus mutans and Candida glabrata on Candida albicans biofilms formed on different surfaces. in: Arch Oral Biol, 53, 8, S. 755–64.
Preshaw, P.M., Bissett, S.M. (2019): Periodontitis and diabetes. in: Br Dent J, 227, 7, S. 577–84.
Sainan, Z., Li, J., Lei, Z., Liying, H., Lu, Y., Wei, L. (2016): Influence of surface roughness on oral streptococcal adhesion forces to dental filling materials. in: Hua Xi Kou Qiang Yi Xue Za Zhi, 34, 5, S. 448–53.
Sakamoto, A., Terui, Y., Horie, C., Fukui, T., Masuzawa, T., Sugawara, S., Shigeta, K., Shigeta, T., Igarashi, K., Kashiwagi, K. (2014): Antibacterial effects of protruding and recessed shark skin micropatterned surfaces of polyacrylate plate with a shallow groove. in: FEMS Microbiol Lett, 361, 1, S. 10–16.
Samaranayake, L., Bandara, N., Pesee, S. (2021): Oral Biofilms: What Are They? in: Ionescu, A.C., Hahnel, S.: Oral biofilms and modern dental materials, Advances toward bioactivity, S. 1–7.
Scannapieco, F.A., Papandonatos, G.D., Dunford, R.G. (1998): Associations between oral conditions and respiratory disease in a national sample survey population. in: Ann Periodontol, 3, 1, S. 251–56.
Sjögren, P., Nilsson, E., Forsell, M., Johansson, O., Hoogstraate, J. (2008): A systematic review of the preventive effect of oral hygiene on pneumonia and respiratory tract infection in elderly people in hospitals and nursing homes: effect estimates and methodological quality of randomized controlled trials. in: J Am Geriatr Soc, 56, 11, S. 2124–30.
Souza, J.C.M., Mota, R.R.C., Sordi, M.B., Passoni, B.B., Benfatti, C.A.M., Magini, R.S. (2016): Biofilm Formation on Different Materials Used in Oral Rehabilitation. in: Braz Dent J, 27, 2, S. 141–47.
Souza, R.F. de, de Freitas Oliveira Paranhos, Helena, Lovato da Silva, Claudia H, Abu-Naba'a, L., Fedorowicz, Z., Gurgan, C.A. (2009): Interventions for cleaning dentures in adults. in: Cochrane Database Syst Rev, 4, CD007395.
Splieth, C., Bernhardt, O., Heinrich, A., Bernhardt, H., Meyer, G. (2003): Anaerobic microflora under Class I and Class II composite and amalgam restorations. in: Quintessence Int, 34, 7, S. 497–503.
Stawarczyk, B., Eichberger, M., Uhrenbacher, J., Wimmer, T., Edelhoff, D., Schmidlin, P.R. (2015): Three-unit reinforced polyetheretherketone composite FDPs: influence of fabrication method on load-bearing capacity and failure types. in: Dent Mater J, 34, 1, S. 7–12.
Sterzenbach, T., Helbig, R., Hannig, C., Hannig, M. (2020): Bioadhesion in the oral cavity and approaches for biofilm management by surface modifications. in: Clin Oral Investig, 24, 12, S. 4237–60.
Susewind, S., Lang, R., Hahnel, S. (2015): Biofilm formation and Candida albicans morphology on the surface of denture base materials. in: Mycoses, 58, 12, S. 719–27.
Svanberg, M., Mjör, I.A., Orstavik, D. (1990): Mutans streptococci in plaque from margins of amalgam, composite, and glass-ionomer restorations. in: J Dent Res, 69, 3, S. 861–64.
Tanner, J., Robinson, C., Söderling, E., Vallittu, P. (2005): Early plaque formation on fibre-reinforced composites in vivo. in: Clin Oral Investig, 9, 3, S. 154–60.
The Forsyth Institute (2021): expanded Human Oral Microbiome Database. www.homd.org (10.07.2021)
Valm, A.M. (2019): The Structure of Dental Plaque Microbial Communities in the Transition from Health to Dental Caries and Periodontal Disease. in: J Mol Biol, 431, 16, S. 2957–69.
Weyrich, L.S. (2021): The evolutionary history of the human oral microbiota and its implications for modern health. in: Periodontol 2000, 85, 1, S. 90–100.
Yoshijima, Y., Murakami, K., Kayama, S., Liu, D., Hirota, K., Ichikawa, T., Miyake, Y. (2010): Effect of substrate surface hydrophobicity on the adherence of yeast and hyphal Candida. in: Mycoses, 53, 3, S. 221–26.
Zhang, S., Qiu, J., Ren, Y., Yu, W., Zhang, F., Liu, X. (2016): Reciprocal interaction between dental alloy biocorrosion and Streptococcus mutans virulent gene expression. in: J Mater Sci Mater Med, 27, 4, S. 78.