Konkomitierende Neoplasien in den großen Speicheldrüsen
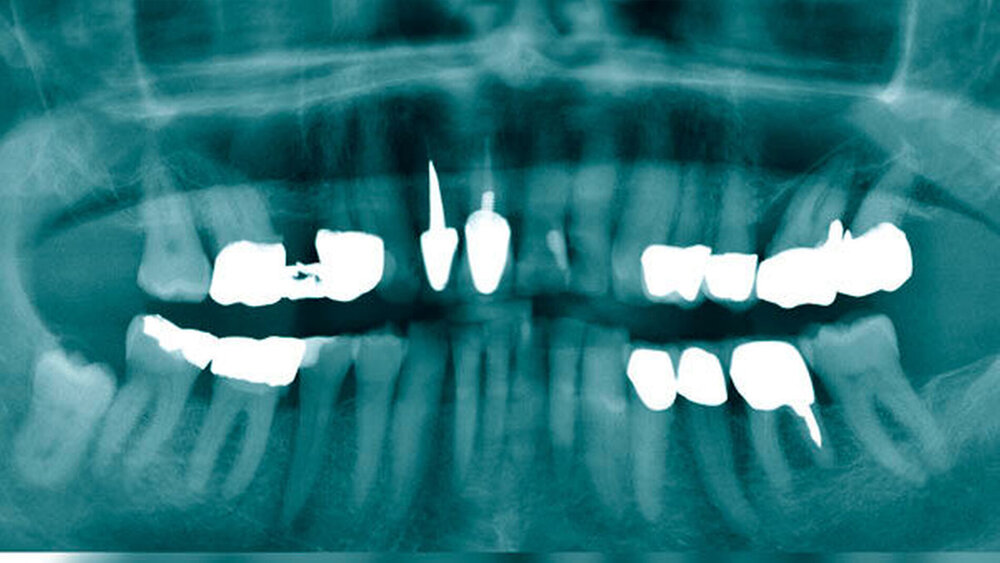
Ein 83-jähriger Mann stellte sich nach Überweisung der niedergelassenen Kollegen mit Bitte auf Therapieübernahme mit einer Schwellung der Glandula parotis links vor. Bei der zuvor durchgeführten zahnärztlichen Diagnostik waren in der Panoramaschichtaufnahme (Abbildung 1) keine Auffälligkeiten der knöcherneren Strukturen zu erkennen. Das extern veranlasste CT zeigte eine Raumforderung der Glandula parotis links.
Allgemeinanamnestisch waren eine benigne Prostatahyperplasie, eine arterielle Hypertonie und eine Hyperlipidämie bekannt, die mit Antihypertensiva, Statinen und Tamsulosin therapiert wurden. Nikotinkonsum oder andere mögliche Noxen wurden verneint.
Bei der klinischen Untersuchung zeigte sich eine Schwellung der Regio parotideo-masseterica links. An der Glandula parotis war linksseitig kaudal eine Raumforderung palpabel, die prall-elastisch und verschieblich anmutete. Hinweise auf eine Infektion in Form der klassischen Entzündungszeichen lagen nicht vor. Aus beiden Stenon-Gängen ließ sich klares Speichelsekret exprimieren. Die Sensibilität und die Motorik im Gesichtsbereich zeigten keinen pathologischen Befund. Der enorale Befund der Mundschleimhaut erwies sich als unauffällig bei suffizientem Zahnersatz. Konservierend zeigten sich Zahn 26 und 27 jedoch als nicht erhaltungswürdig.
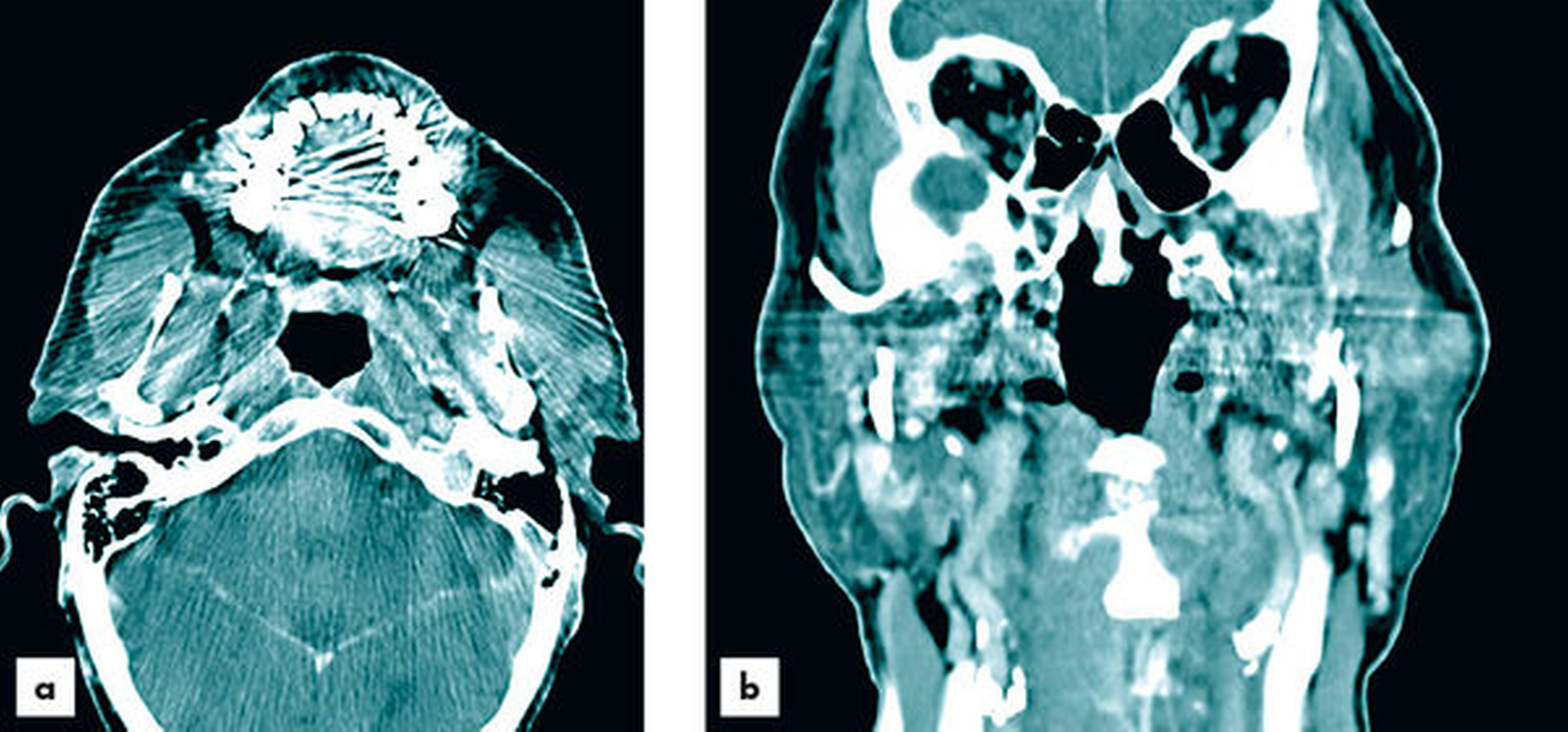
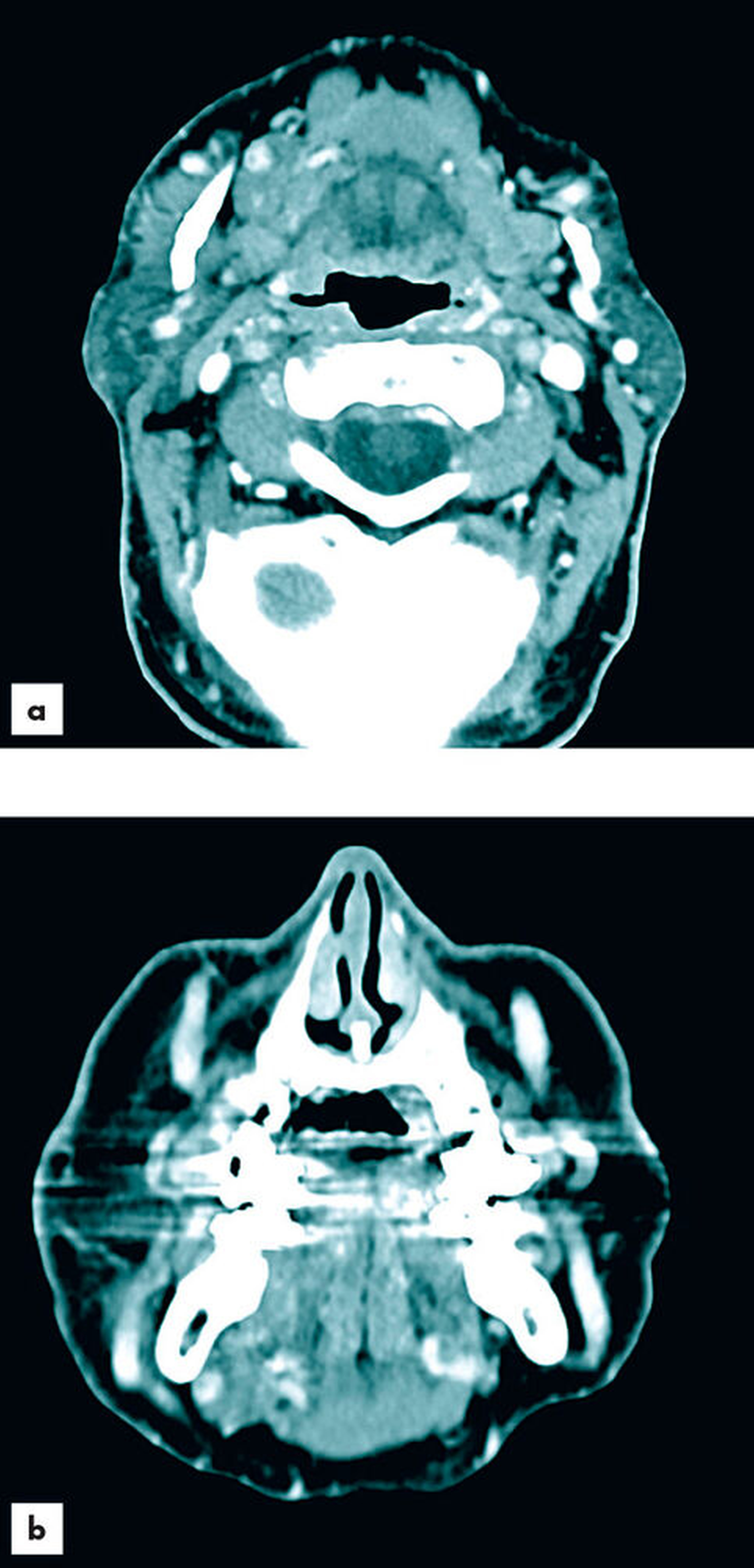
Zur aktualisierten Diagnostik wurde ein Kontrastmittel-CT (Abbildungen 2 und 3) durchgeführt, bei dem neben der bereits bekannten Raumforderung der Glandula parotis links ebenfalls Raumforderungen in der Glandula submandibularis und der Glandula sublingualis rechts festgestellt wurden. Das CT wies im Bereich der Parotis multifokale hypodense, zystische Komponenten sowie dünne Wände und Septen auf. Die Ausdehnung der Neoplasie erstreckte sich bis in die tieferen Anteile des Drüsenparenchyms. Verkalkungen waren nicht nachweisbar und die Kontrastmittelaufnahme erwies sich als moderat. Die Glandula submandibularis und die Glandula sublingualis rechts imponierten ebenfalls durch unklare Kontrastmittelaufnahme. Bildmorphologisch bestand kein Hinweis auf Malignität. Nebenbefundlich lag bildmorphologisch eine chronische Sinusitis maxillaris mit dentogenem Fokus 26 und 27 vor. Die radiologische Verdachtsdiagnose lautete: Verdacht auf bifokalen Warthin-Tumor und bildmorphologisch nicht eindeutig einzuordnende, aber verdächtige Veränderungen der Glandula submandibularis und der Glandula sublingualis rechts.
Zur Dignitätssicherung erfolgten die Entfernung der Speicheldrüsentumore im Sinne einer subtotalen Parotidektomie (Abbildung 4) links und die Exstirpation der Glandula submandibularis und der Glandula sublingualis rechts. Diese wurden mit begleitendem Schnellschnittverfahren unter Erhalt des N. facialis durchgeführt. Im Schnellschnitt zeigte sich kein Anhalt für Malignität. Zusätzlich wurden die Zähne 26 und 27 entfernt und eine Kieferhöhlenrevision mit Anlage eines unteren Nasenfensters durchgeführt. Die klinischen Nachkontrollen und die postoperative Bildgebung erwiesen sich als unauffällig.
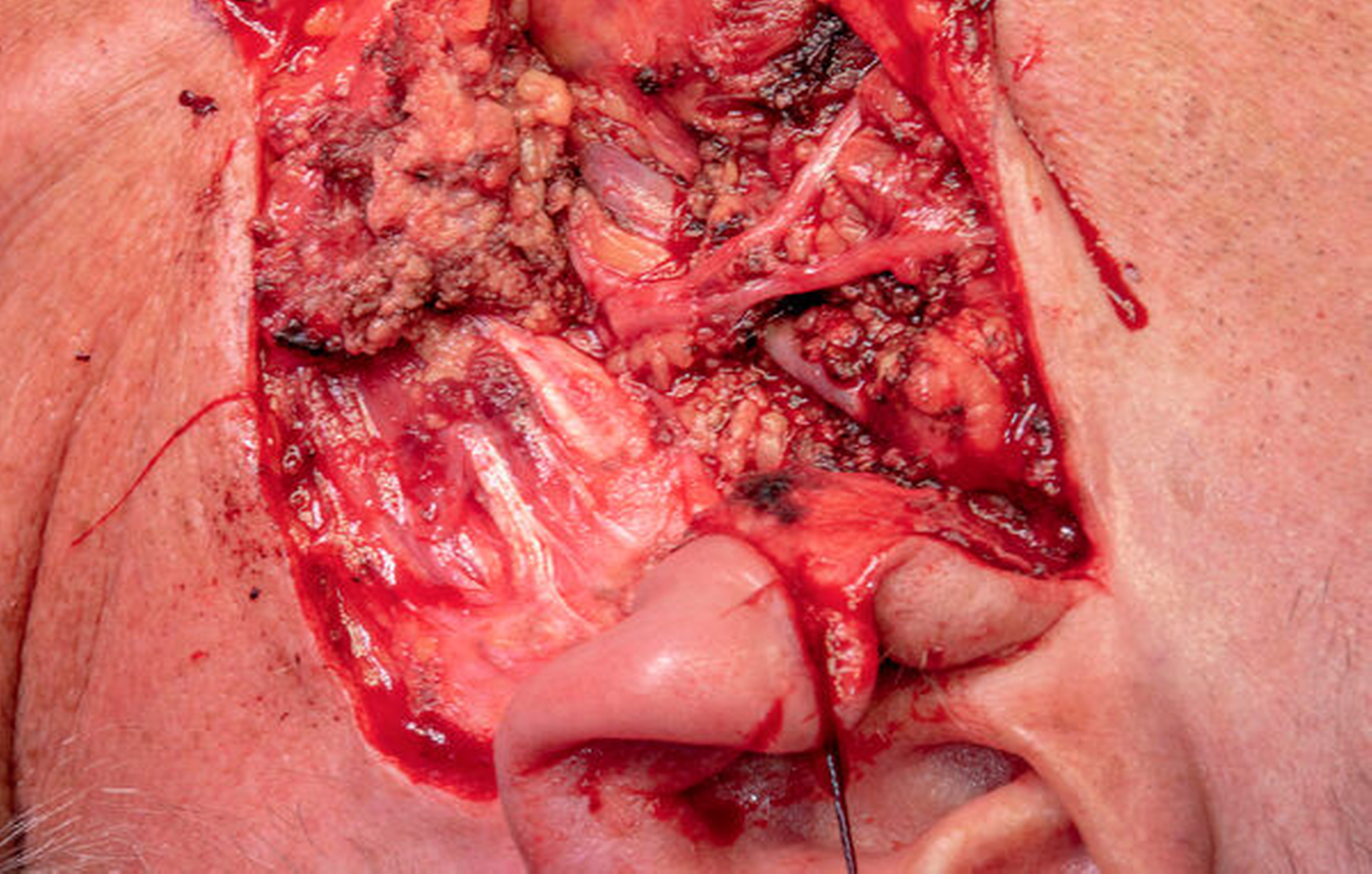
Es gelang die vollständige Entfernung aller Raumforderungen bei Erhalt der Fazialisfunktion. Der postoperative Verlauf war komplikationslos. Die histopathologische Beurteilung ergab einen bifokalen Warthin-Tumor der Glandula parotis links und eine multifokale noduläre onkozytäre Hyperplasie (MNOH) der Glandula submandibularis und der Glandula sublingualis. Der Patient befindet sich seither im regelmäßigen Recall und zeigte bis dato keinen Anhalt auf ein Rezidiv.
Diskussion
Von den gutartigen Speicheldrüsentumoren – wie dem in diesem Fall beschriebenen Warthin-Tumor – und dem pleomorphen Adenom lassen sich maligne Tumorentitäten wie beispielsweise Mukoepidermoidkarzinome oder Azinuszellkarzinome abgrenzen. Diese imponieren in der Klinik vor allem durch infiltratives Wachstum und eine damit einhergehende Schädigung des N. facialis. Außerdem sind Ulzerationen der Haut sowie die nicht-vorhandene Verschieblichkeit der Haut über dem Tumorgebiet Hinweise auf ein malignes Geschehen.
Der Warthin-Tumor, veraltet auch papilläres Cystadenoma lymphomatosum oder Adenolymphom genannt, ist nach dem pleomorphen Adenom die zweithäufigste gutartige Neoplasie der Glandula parotis [Eveson, 1999]. Er befällt fast ausschließlich die Parotisdrüse (meist oberflächlich am unteren Pol) und nur gelegentlich die periparotidealen Lymphknoten. Zu sechs Prozent ist auch die Ohrspeicheldrüse der Gegenseite betroffen. Eine klinische Manifestation an anderer Stelle ist selten [Palma et al., 2009].
Der Warthin-Tumor macht etwa 20 Prozent aller erfassten Parotis-Tumoren aus und entsteht meist im Alter von 60 bis 70 Jahren, vermehrt bei Männern (Verhältnis männlich/weiblich 3:1) [Donath und Ussmüller, 2020]. Außerdem besteht bei Rauchern ein erhöhtes relatives Risiko, an Warthin-Tumoren zu erkranken [Cadier et al., 1992]. Warthin-Tumore stellen sich für gewöhnlich als schmerzlose, gut abgekapselte, prall-elastische, verschiebliche Raumforderungen, häufig mit fluktuierendem Tastbefund, dar [Riede und Weyer, 2009]. Zur Standarddiagnostik zählen Sonografie, Computertomografie und die Magnetresonanztomografie.
Bildmorphologisch sind Warthin-Tumore von einer Kapsel umschlossen und erreichen durchschnittlich eine Größe von 3 bis 4 cm [Donath und Ussmüller, 2020]. Im CT zeigen die Raumforderungen hypodense Dichtewerte mit anteilig zystischen Veränderungen [Kloth et al., 2015]. Es treten dünne Wände und Septen auf, wobei es nicht zu Verkalkungen kommt [Janssen et al., 2010].
Bei der histopathologischen Untersuchung des Warthin-Tumors zeigt sich ein gut umschriebener Tumor, der mikroskopisch aus papillärem oder zystischem Zylinderepithel besteht, das von einem Stroma aus lymphatischem Gewebe und Lymphfollikeln umgeben ist [Riede und Weyer, 2009]. Eine maligne Transformation eines Warthin-Tumors kann nach Literaturangaben in weniger als einem Prozent der Fälle beobachtet werden. Bei einem solchen Geschehen sind entweder die epithelialen oder die lymphatischen Anteile betroffen, was dazu führt, dass entweder Karzinome oder Lymphome entstehen. [Yoo et al., 1994; Palma et al., 2009].
Beim pleomorphen Adenom, das circa 80 Prozent aller gutartigen Neubildungen der Glandula parotis ausmacht [Donath und Ussmüller, 2020], ist eine indolente Schwellung der Regio parotideo-masseterica und ein fester, solider Tumor mit höckeriger Oberfläche zu erwarten [Wagner, 2007]. Im CT zeigen sich zystische Veränderungen mit fokalen Hämorrhagien und begleitende Nekrosen. Die Kontrastmittelaufnahme erfolgt teils homogen, teils inhomogen und erzeugt höhere Dichtewerte als das umliegende Drüsengewebe [Kloth et al., 2015]. In der histopathologischen Untersuchung sind strang- und gangförmige epitheliale Tumoranteile erkennbar, das Tumorstroma ist pleomorph und folglich fibrös mukoid, myxoid oder auch chondroid [Riede und Weyer, 2009].
Die Standardtherapie des Warthin-Tumors ist die vollständige chirurgische Resektion, meist in Form einer oberflächlichen Parotidektomie [Klussmann et al., 2006] oder einer subkapsulären Enukleation. Die Rezidivrate nach chirurgischer Therapie ist mit 2,5 bis 5 Prozent gering, das Risiko eines Rezidivs steigt bei unvollständiger Entfernung oder Multizentrizität [Eveson et al., 2000]. Das im Patientenfall geschilderte Auftreten einer Multizentrizität wird bei etwa zwölf Prozent der betroffenen Patienten mit einem Warthin-Tumor beschrieben [Palma et al., 2009] und sollte Anlass zur Verkürzung der Recallintervalle geben, um dem erhöhten Rezidivrisiko Rechnung zu tragen.
Die im vorliegenden Fall ebenfalls beschriebene MNOH ist für gewöhnlich eine Läsion der Glandula parotis und tritt in der Regel selten in anderen Unterkieferspeicheldrüsen auf. Sie macht 0,1 Prozent der Ohrspeicheldrüsenerkrankungen aus und wird meist nach dem sechsten Lebensjahrzehnt diagnostiziert [Strassburger et al., 1999; Goyal et al., 2007]. Risikofaktoren für die Entstehung einer MNOH sind nicht bekannt. Eine MNOH ist eine gutartige Läsion, jedoch besteht bei Bestrahlung (zum Beispiel im Rahmen der Behandlung eines Mundhöhlenkarzinoms) das Risiko einer radioinduzierten malignen Transformation [Lidang-Jensen, 1989]. Klinisch tritt eine MNOH als schmerzlose Schwellung der Glandula parotis auf, die meist zufällig entdeckt wird. Bei der Untersuchung der Parotis wird diese als derb, nicht druckdolent und verschieblich beschrieben. Zu den üblicherweise angewendeten bildgebenden Untersuchungsverfahren zur Abklärung zählen die Sonografie und das CT.
Zur Abgrenzung des häufigeren pleomorphen Adenoms und des Warthin-Tumors kann eine Biopsie mittels Feinnadeldiagnostik durchgeführt werden. Histopathologisch ist die MNOH durch multifokal auftretende noduläre Zellanhäufungen von Onkozyten in der Drüse gekennzeichnet. Diese Knötchen sind in lobulärer Verteilung vorhanden und nicht von einer Kapsel umgeben [Goyal et al., 2007]. Es wird davon ausgegangen, dass ein Metaplasie-bedingter Prozess in den Gang- und Azinusepithelien die Speicheldrüsenläppchen allmählich durch onkozytäre Epithelien ersetzt. Dies führt schlussendlich zur multinodulären tumorähnlichen Neubildung im betroffenen Bereich [Treutlein et al., 2013]. Aufgrund der histologischen Ähnlichkeiten zur onkozytären Neoplasie ist die MNOH als Differenzialdiagnose durch sorgfältige histologische Sicherung abzugrenzen. Therapie der Wahl ist die chirurgische Exzision im Gesunden. Bei einer Teilresektion ist mit Rezidiven zu rechnen. Die onkozytären Läsionen sind strahleninsensitiv [Esser und Kosmehl, 2012].
Bei unklaren Veränderungen der großen Speicheldrüsen kann es trotz sehr geringer Wahrscheinlichkeit zu unerwarteten Kombinationen von Diagnosen kommen. Bei erfolgreicher Exzision der Raumforderungen und regelmäßigem Recall zur Nachsorge besteht für betroffene Patienten eine langfristig gute Prognose.
Julia Brettel
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Dr. Med. Christopher-Philipp Nobis
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Prof. Dr. Med. Dr. Med. Dent. Marco Kesting, FEBOMFS
Mund-, Kiefer-, Gesichtschirurgische Klinik,
Universitätsklinik der Friedrich-Alexander-Universität Erlangen-Nürnberg
Glückstr. 11, 91054 Erlangen
Dr. Med. Elisabeth Goetze
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Fazit für die Praxis
Sollte bei der zahnärztlichen Untersuchung eine Beeinträchtigung des N. facialis auftreten, kann dies ein Hinweis auf eine maligne Raumforderung im Bereich der Glandula parotis sein.
Bei Schwellungen im Bereich der Glandula parotis kommen neben den pleomorphen Adenomen und Warthin-Tumoren auch seltene Differenzialdiagnosen wie die MNOH infrage.
Ein gleichzeitiges Vorkommen von Tumoren der Speicheldrüsen unterschiedlicher Art ist durchaus möglich. Diagnostisch sollte daher bei der Abklärung von Speicheldrüsentumoren auch eine Untersuchung der anderen paarigen Speicheldrüsen erfolgen.
Literaturliste:
Cadier, M., Watkin, G., & Hobsley, M. (1992). Smoking predisposes to parotid adenolymphoma. Br J Surg, 79(9), 928-930. doi: 10.1002/bjs.1800790925
Donath, K., & Ussmüller, J. (2020). Ätiopathogenese und Histopathologie der Speicheldrüsenerkrankungen. Laryngo-Rhino-Otologie doi: 10.1055/s-2001-13925
Esser, E., & Kosmehl, H. (2012). Das Spektrum der gutartigen organtypischen Speicheldrüsentumoren: Eine Systematik.
Eveson, J. W. (1999). Oncocytic and squamous differentiation in salivary glands and tumors. Revista Española de Patología 32:433−434.
Eveson, J. W., Barnes, L., Simpson, R. H., Reichart, P., & Sidransky, D. (2000). Warthin tumour. . In Pathology and Genetics of Head and Neck Tumours: IARCPress, Lyon 2000.
Goyal, R., Ahuja, A., Gupta, N., Singh, G., & Vaiphei, K. (2007). Multifocal nodular oncocytic hyperplasia in parotid gland: a case report. Acta Cytol, 51(4), 621-623. doi: 10.1159/000325811
Janssen, H., Saleh, A., & Turowski, B. (2010). Bildgebung der Kopfspeicheldrüsen. Radiologie up2date 2010; 10(2): 163-179. doi: 10.1055/s-0029-1244033
Kloth, C., Horger, M., Haap, M., Ioanoviciu, S., & H, B. (2015). Imaging guided differentiation of parotid tumors – Bildgebende Differenzierung von Parotistumoren. Rofo 2015; 187(09): 735-740. doi: 10.1055/s-0035-1552191
Klussmann, P., Wittekindt, C., Florian Preuss, S., Al Attab, A., Schroeder, U., & Guntinas-Lichius, O. (2006). High risk for bilateral Warthin tumor in heavy smokers--review of 185 cases. Acta Otolaryngol, 126(11), 1213-1217. doi: 10.1080/00016480600740605
Lidang-Jensen, M. (1989). Multifocal adenomatous oncocytic hyperplasia in parotid glands with metastatic deposits or primary malignant transformation? Pathology - Research and Practice, 185(4), 514-521. doi: 10.1016/S0344-0338(89)80078-0
Palma, S., Simpson, R., Skálová, A., & Leivo, I. (2009). Große und kleine Speicheldrüsen. In Pathologie: Kopf-Hals-Region, Weichgewebstumoren, Haut.
Riede, U., & Weyer, N. (2009). Basiswissen Allgemeine und Spezielle Pathologie. In: Springer Medizin Verlag Heidelberg.
Strassburger, S., Hyckel, P., & Kosmehl, H. (1999). Multifocal oncocytic adenomatous hyperplasia of the parotid gland. A case report. Int J Oral Maxillofac Surg, 28(6), 457-458.
Treutlein, E., Agaimy, A., Koch, M., & Zenk, J. (2013). Bilaterale multifokale noduläre onkozytäre Hyperplasie der Glandula parotidea: Ein Fallbericht Deutsche Gesellschaft für Hals-Nasen-Ohren-Heilkunde, Kopf- und Hals-Chirurgie e.V GMS Publishing House. doi: 10.3205/13hnod751
Yoo, G. H., Eisele, D. W., Askin, F. B., Driben, J. S., & Johns, M. E. (1994). Warthin's tumor: a 40-year experience at The Johns Hopkins Hospital. Laryngoscope, 104(7), 799-803. doi: 10.1288/00005537-199407000-00004