Diabetes-Früherkennung und individualpräventive Betreuung
Der erste Teil des Beitrags (zm 13/2022, S. 36–43) diente der Darstellung von Grundlagen zum Verständnis der Wechselwirkungen zwischen oraler Gesundheit und Diabetes. Dabei wurden neben der bekannten Bidirektionalität zwischen Diabetes mellitus und Parodontitis auch andere orale Auswirkungen einer Diabeteserkrankung beschrieben. Ebenso wurden Risikoprofile für Diabetespatienten in der zahnmedizinischen Betreuung dargestellt. Im zweiten Teil werden nun die klinischen Konsequenzen aufgezeigt und wesentliche Implikationen für die Praxis herausgearbeitet.
Klinische Auswirkungen der Bidirektionalität
Einfluss der glykämischen Kontrolle auf die parodontale Therapie
Zunächst ist es von klinischem Interesse, den Effekt des Diabetes mellitus beziehungsweise der glykämischen Einstellgüte auf einen möglichen Therapieerfolg der Parodontalbehandlung zu bewerten. In einer systematischen Übersichtsarbeit von Kocher et al. wurde gezeigt, dass bei Patienten mit einem vorliegenden Diabetes mellitus (HbA1c-Wert zwischen 6 und 10 Prozent) und ohne spezifische Betrachtung des HbA1c-Wertes (Einstellgüte) drei Monate nach aktiver Parodontitistherapie (Scaling and Root Planing: SRP) im Mittel eine Sondierungstiefenreduktion von 0,58 mm möglich ist; der Attachmentgewinn betrug 0,55 mm [Kocher et al., 2018]. Es scheint demnach so, dass die kurzfristige parodontale Rehabilitation bei Patienten mit Diabetes vergleichbar zu allgemeingesunden Patienten ist [Kocher et al., 2018].
Betrachtet man hingegen Langzeitergebnisse (Fünfjahres-Follow-up), so wird ersichtlich, dass Patienten mit einem schlecht eingestellten Diabetes (HbA1c: > 9,1 Prozent) mehr Taschen mit einer Sondierungstiefe von ≥ 5 mm und zudem einen Attachmentverlust von ≥ 5 mm haben; darüber hinaus verliert diese Patientengruppe mehr eigene Zähne als Patienten mit einem gut eingestellten Diabetes beziehungsweise als allgemeingesunde Patienten [Costa et al., 2013]. Das Risiko für die weitere Progression einer parodontalen Erkrankung und nachfolgend von Zahnverlust ist bei einem schlecht eingestellten Diabetes im Vergleich zum gut eingestellten Diabetes (Schwellenwert: HbA1c = 6,5 Prozent) etwa dreimal so hoch [Costa et al., 2013].
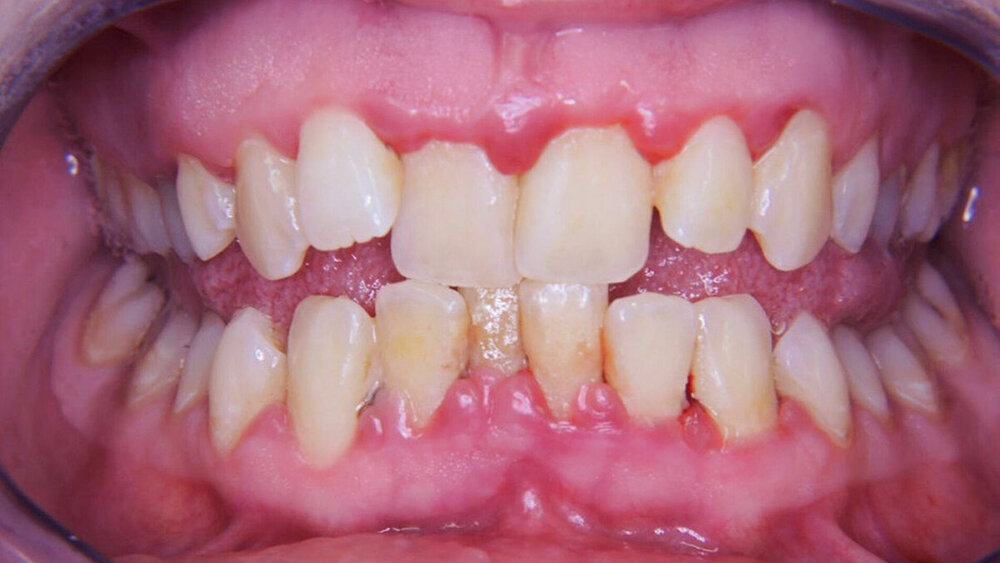
Demnach lässt sich festhalten, dass die glykämische Einstellgüte insbesondere das langfristige Behandlungsergebnis und dabei die Progression/Instabilität parodontaler Erkrankungen wie auch den Zahnverlust betroffener Patienten nachhaltig beeinflussen kann. Daher muss bei Diabetespatienten in der zahnmedizinischen Betreuung die Einstellgüte stetig und rekurrierend berücksichtigt werden. Folglich empfiehlt die aktuelle S3-Leitlinie zur Behandlung von Parodontitis Stadium I–III, zielgerichtete Interventionen zur Diabeteskontrolle in der initialen Therapiephase (Therapiestufe 1) wie auch bei der unterstützenden Parodontitistherapie (Therapiestufe 4) einzubeziehen [Ramseier et al., 2020; DG PARO, 2020]. Bei suffizienter glykämischer Kontrolle und risikoadaptierter individualpräventiver Betreuung können auch bei Diabetespatienten langfristig stabile, mundgesunde Verhältnisse erhalten werden (Abbildung 1). Entsprechend wurde in der aktuell gültigen Klassifikation parodontaler Erkrankungen für die Diagnosestellung Parodontitis und hier zur Beurteilung des Progressionsrisikos (Grading) die Einstellgüte (Grad A = normoglykämisch mit oder ohne vorherige Diagnose von Diabetes, Grad B = HbA1c < 7,0 Prozent und Grad C = HbA1c ≥ 7,0 Prozent) inkludiert.
Einsatz adjuvanter Antibiotika
Neben der glykämischen Einstellgüte als wesentlicher Ansatzpunkt zur Verbesserung des klinischen Outcomes der Parodontaltherapie kann der Einsatz adjuvanter Antibiotika diskutiert werden. Patienten, die neben der behandlungsbedürftigen Parodontitis zusätzlich einen Diabetes aufweisen, könnten grundsätzlich von der Gabe adjuvanter systemischer Antibiotika profitieren. So kann die Kombination SRP und systemische Antibiose kurzfristig zu einer stärkeren Verringerung der Sondierungstiefen führen als beim SRP allein [Grellmann et al., 2016; Santos et al., 2015]. Hingegen scheint eine lokale Antibiose nur bei Patienten mit einem gut eingestellten Diabetes einen positiven Effekt zu haben; für Patienten mit einem schlecht eingestellten Diabetes konnte hierbei kein Mehrgewinn im Vergleich zum SRP allein aufgezeigt werden [Rovai et al., 2016].
Der Blick in die aktuelle Leitlinie zeigt zudem, dass das Vorliegen eines Diabetes mellitus keine pauschale Indikationsstellung für eine systemische adjuvante Antibiose darstellt [DG PARO, DGZMK S3-Leitlinie, 2020]. Die Frage nach dem Einsatz von Antibiotika (systemisch oder lokal) sollte stets eine individuelle Entscheidung sein, die sich abhängig vom Ausmaß der parodontalen Destruktion sowie vom Progressionsrisiko (Grading: Grad C) und eventuellen Ko-Faktoren gestalten muss (zum Beispiel Alter) [DG PARO, DGZMK S3-Leitlinie, 2020; Keestra et al., 2015; Harks et al., 2015; Smiley et al., 2015].
Darüber hinaus bleibt zu berücksichtigen, dass adjuvante Antibiotika generell nur einen geringen Effekt im Hinblick auf klinische parodontale Befunde haben, wie zum Beispiel die Reduktion der Sondierungstiefe und/oder klinischer Attachmentgewinn [Teughels et al., 2020]. Entsprechend ist der Einsatz systemischer Antibiotika unter einer strengen Indikationsstellung und unter Abwägung von potenziellen Nebenwirkungen sowie einer potenziellen Resistenzbildung nur bei wenigen ausgewählten Patientenfällen angezeigt [DG PARO, DGZMK S3-Leitlinie, 2020].
Wirkung zahnärztlicher Behandlungen auf die glykämische Kontrolle
Bei Patienten, die sowohl unter einer Parodontitis als auch unter Diabetes mellitus leiden, kann mit einer Parodontaltherapie der HbA1c-Wert positiv beeinflusst werden [Borgnakke, 2015]. Bereits im Jahr 2013 wurde in einer Übersichtsarbeit festgestellt, dass eine Parodontaltherapie zu einer (geringen) Senkung des Blutzuckerwertes führen kann [Engebretson und Kocher, 2013]. Dabei sollte jedoch berücksichtigt werden, dass der Einfluss der Parodontitistherapie von verschiedenen Faktoren abhängt, unter anderem von der aktuellen Einstellgüte, der Schwere der Parodontitis und der Art der parodontalen Behandlungsmaßnahmen [Engebretson und Kocher, 2013].
Eine Übersichtsarbeit aus dem Jahr 2020 bestätigt diese Erkenntnisse: durch ein indikationsbezogenes SRP kann sowohl eine Beeinflussung des HbA1c-Wertes als auch des CRP (C-reaktives Protein) erreicht werden [Baeza et al., 2020]. Durch eine systematische parodontale Therapie kann demnach unter Berücksichtigung verfügbarer Studien eine Verringerung des HbA1c-Wertes um 0,36 Prozent [Engebretson und Kocher, 2013] beziehungsweise 0,56 Prozent [Baeza et al., 2020] erzielt werden. Im Weiteren kann eine parodontale Therapie die Konzentration von TNF-alpha und CRP im Blut von Diabetespatienten senken. Eine Verringerung der Entzündungslast, widergespiegelt durch diese Zytokine, kann nachfolgend positive Auswirkungen auf die glykämische Einstellung des Diabetes haben [Artese et al., 2015].
Die positiven Effekte einer adäquaten Parodontitistherapie unterstreichen, welche bedeutende Rolle das zahnmedizinische Team in der Betreuung von Diabetespatienten einnehmen kann, und sind ein gutes Argument für die interdisziplinäre Zusammenarbeit/Kommunikation zwischen betreuenden Hausärzten, Internisten, Diabetesassistenten und Zahnärzten [Allauddin et al., 2022].
Interdisziplinäre Betreuungsansätze
Die Bidirektionalität von Parodontitis und Diabetes wie auch die Vielfalt möglicher Auswirkungen auf die systemische und die orale Gesundheit legen einen interdisziplinären Betreuungsansatz zur gemeinsamen Therapie und Prävention beider Erkrankungen nahe. In der Realität ist dies jedoch aktuell nur sehr unzureichend abgebildet. Eine Befragungsstudie mit Zahn- und Allgemeinmedizinern zeigte hier nicht nur beträchtliche Lücken in der Zusammenarbeit, sondern auch eine unterschiedliche Sichtweise beider Fachrichtungen auf die Thematik auf [Ziebolz et al., 2018]. Während Allgemeinmediziner in der Befragung angaben, jeden Risikopatienten in ihrer Praxis adäquat zu identifizieren, war dies nur bei der Hälfte der Zahnärzte der Fall. Außerdem empfanden beide Fachrichtungen die interdisziplinäre Zusammenarbeit mit den Kollegen als unzureichend; eine regelmäßige Zusammenarbeit mit der jeweils anderen Fachrichtung gaben nur 68 Prozent der Zahn- und 40 Prozent der Allgemeinmediziner an [Ziebolz et al., 2018].
Als Grund für diese Defizite findet sich in der Literatur der Hinweis auf die (oft) fehlenden Kenntnisse über die bidirektionalen Beziehungen zwischen Parodontitis und Diabetes. Dies mündet nicht selten in einer unzureichenden Aufklärung und Information der Patienten [Allauddin et al., 2022; Bissett et al., 2020]. Zusätzlich wurden Hindernisse beim Kommunikationsweg zwischen den Fachrichtungen beschrieben; so folgen in der Praxis oftmals defensive oder auch vollständig ausbleibende Rückmeldungen auf nicht adäquat empfundene Anfragen [Bissett et al., 2020]. Hier werden als Lösungsvorschlag kurze, klar formulierte Anweisungen über die Zuweisung der Patienten zur jeweils anderen Fachrichtung angegeben, während auf sehr ausführliche schriftliche oder telefonische Kontaktaufnahmen eher verzichtet werden soll [Bissett et al., 2020].
Ein weiteres Problem sind die unzureichenden Kenntnisse der Patienten über die Interaktionen zwischen Mund- und Allgemeingesundheit – hier von Parodontitis und Diabetes [Siddiqi et al., 2020]; weniger als die Hälfte der Patienten mit chronischen Erkrankungen wissen überhaupt, dass derartige Zusammenhänge existieren [Akl et al., 2021; Siddiqi et al., 2020]. Daraus ergibt sich ein gesteigerter Bedarf an Patientenaufklärung, die Notwendigkeit der Verbesserung der (Zahn-)Arzt-Patienten-Kommunikation sowie für das Erarbeiten zielgerichteter Interventionsprogramme für betroffene Patienten [Akl et al., 2021]. Erste Ansätze hierzu sind in der Literatur bereits beschrieben: Einerseits wurde versucht, Dentalhygienikerinnen direkt ins medizinische Team der Betreuung von Diabetespatienten einzubinden; diese betreuten Patienten mithilfe mobiler Behandlungseinheiten, was von diesen sehr gut angenommen wurde [Simon et al., 2019]. Einen völlig anderen, sehr zeitgemäßen Ansatz stellen mobile und digitale Lösungen für betroffene Patienten dar; diese sprechen den Patienten als Zielgruppe direkt an und adressieren damit das entscheidende Bindeglied in der Interaktion zwischen Zahn- und Allgemeinmedizin [Seitz et al., 2021].
Risikoscreening und Früherkennung
Besonders bei Patienten mit einer schweren oder gar therapieresistenten Parodontitis sollte stets auch eine systemische Erkrankung wie beispielsweise ein Diabetes als modifizierender Faktor (Erkrankungs- und/oder Progressionsrisiko) in Betracht gezogen werden. Aufgrund der hohen Zahl an unerkannten Diabetes-Fällen bietet sich ein Risikoscreening zur Früherkennung von Diabetes mellitus an [Genco et al., 2014; Estrich et al., 2019]. Dazu stehen verschiedene Methoden für die Praxis zur Verfügung.
Fragebögen zur Risikoidentifikation
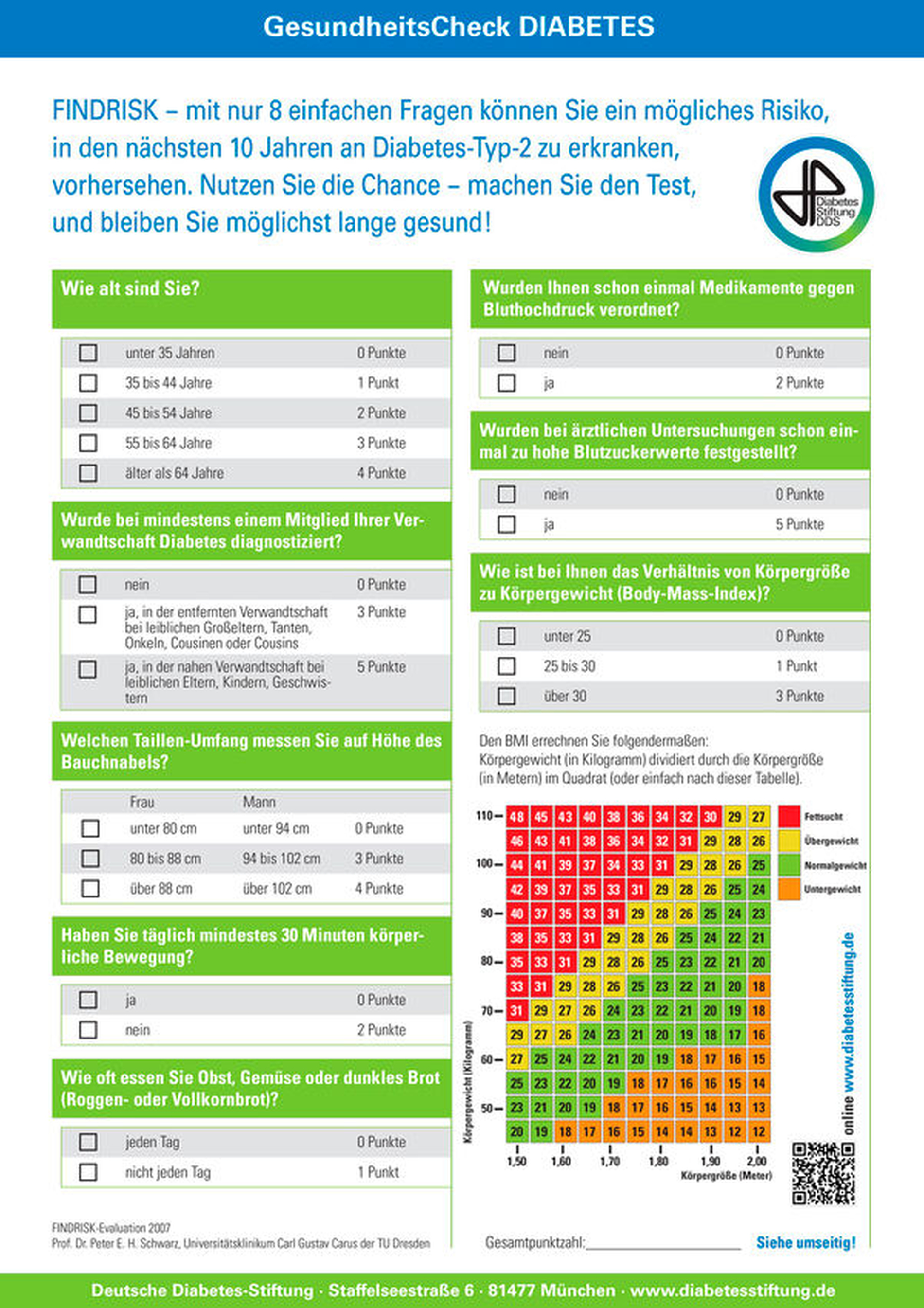
Fragebögen zur Ermittlung eines möglichen Risikos für einen (Prä-) Diabetes sind ein zeitsparendes und non-invasives Instrument. Die am besten untersuchte Variante stellt hier das sogenannte Finnish Diabetes Risk Score (FINDRISK; Abbildung 2) dar [Tuomilehto et al., 2001]. Als zweites validiertes Verfahren existiert darüber hinaus der Diabetes-Risiko-Test (DRT) des Deutschen Instituts für Ernährungsforschung [Schulze et al., 2007a, 2007b]. Ein Vorteil dieser Fragebögen ist die Möglichkeit, nicht nur das Risiko für das Vorliegen eines manifesten Diabetes, sondern auch das Risiko für die zukünftige Entwicklung einer Diabeteserkrankung zu ermitteln.
Hierbei beantwortet der Patient acht Fragen, aus denen ein Punktwert ermittelt werden kann. Aus diesem Score kann anschließend das Diabetesrisiko abgeleitet werden (Abbildung 2), was die Umsetzung in der Praxis schnell und die Interpretation des Ergebnisses sowie dessen Kommunikation mit dem Patienten vereinfacht. Die maximale Punktzahl liegt bei 26 Punkten. Hat ein Patient einen Punktwert von ≥ 12, erscheint die Vorstellung beim Hausarzt empfehlenswert, die mittels schriftlicher Zuweisung erfolgen sollte [Schmalz et al., 2021]. Eine zusätzliche (invasive) Untersuchung der Patienten ist nicht notwendig. Auch wenn (noch) kein Diabetes vorliegt, können die Fragebogen-basierten Instrumente zu einer Patientensensibilisierung und einer Bewusstseinssteigerung für die orale und systemische Gesundheit beitragen. Das Ergebnis des Fragebogens liefert zudem eine gute Argumentationsgrundlage dafür, dass eine weiterführende allgemeinmedizinische Untersuchung vorgenommen werden sollte, und stellt somit ein einfaches und direktes Kommunikationshilfsmittel zum betreuenden Hausarzt oder Internisten dar.
Labormedizinische Screeningverfahren
Als biochemische Untersuchungsverfahren können in der Zahnarztpraxis auch die Bestimmung der Glukosekonzentration und/oder des glykosylierten Hämoglobins (HbA1c) zur Feststellung eines möglichen Prädiabetes oder Diabetes mellitus eingesetzt werden. Wenngleich dies inzwischen minimalinvasiv möglich ist, wird in beiden Fällen eine Blutentnahme notwendig. Für die Praxis sind aktuell „point of care“-Tests (POC-Test) verfügbar, die eine schnelle und unkomplizierte Erfassung von Blutglukose- oder HbA1c-Werten ermöglichen (zum Beispiel Accu Check-Systeme, Roche Diabetes Care Deutschland GmbH, Mannheim). Wenngleich spezifischere Analysemethoden vorhanden sind (zum Beispiel AfinionTM, Alere GmbH, Köln), die exakte Messwerte wiedergeben, scheint deren Einsatz ein unverhältnismäßiger finanzieller, apparativer und diagnostischer Aufwand für die zahnärztliche Praxis zu sein.
Unabhängig von der Validität und der Spezifizität der verwendeten Untersuchungsverfahren ist immer eine weiterführende beziehungsweise absichernde Diagnostik durch den Hausarzt oder Internisten erforderlich. Dort erfolgt zur diagnostischen Sicherung eine laboranalytische Erfassung des Blutglukose- und/oder HbA1c-Wertes sowie in der Regel weiterführend ein oraler Glukosetoleranztest (oGTT). Bei letzterem wird die Blutglukosekonzentration sowohl nüchtern als auch zwei Stunden nach der Einnahme einer Glukoselösung bestimmt [Müller-Wieland et al., 2016]. Anhand dieser Untersuchungen ist final die Unterscheidung zwischen abnormer Nüchternglukose, gestörter Glukosetoleranz und manifestiertem Diabetes mellitus möglich.
Bewertung der Verfahren in der Praxis
Die Bestimmung des Glukose- und/oder HbA1c-Wertes im Blut hat eine hohe Sensitivität [Glurich et al., 2018], allerdings gehören solche Untersuchungen (noch) nicht zum Standardrepertoire zahnärztlicher Leistungen – auch im Hinblick auf die aufwendige Abrechnung über eine private Analogposition. Ohnehin darf aktuell durch den Zahnarzt keine Diagnose bezüglich einer Diabeteserkrankung erfolgen und es bleibt immer die Diagnosesicherung durch den Hausarzt/Internisten erforderlich [Ziebolz et al., 2019]. Insgesamt sind die Invasivität der Blutentnahme, für den Patienten entstehende Kosten und die Tatsache, dass Blutentnahmen in der Zahnarztpraxis eher ungewöhnlich für Patienten sind, mögliche Hemmnisse.
Ein Fragebogen-basiertes Screening bietet dagegen eine noninvasive Option, die sowohl im Praxisalltag umsetzbar ist als auch von den Patienten gut akzeptiert wird [Schmalz et al., 2021; Ziebolz et al., 2019; Grennberg et al., 2010; Cevik Akyil et al., 2014]. Mit dem FINDRISK-Fragebogens können Patienten, die ein erhöhtes Risiko für eine Diabetes-Erkrankung haben, ermittelt werden [Schmalz et al., 2021; Ziebolz et al., 2019]. Das Screening kann zwar bei allen Patienten in der zahnärztlichen Praxis Anwendung finden, jedoch scheint der gezielte Einsatz bei älteren Patienten (> 64 Jahre) und bei Patienten mit einer schweren (behandlungsbedürftigen) und/oder therapierefraktären Parodontitis (Stadien 3 und 4) mit aktiven Entzündungszeichen (insbesondere Suppuration) sinnvoll zu sein [Schmalz et al., 2021].
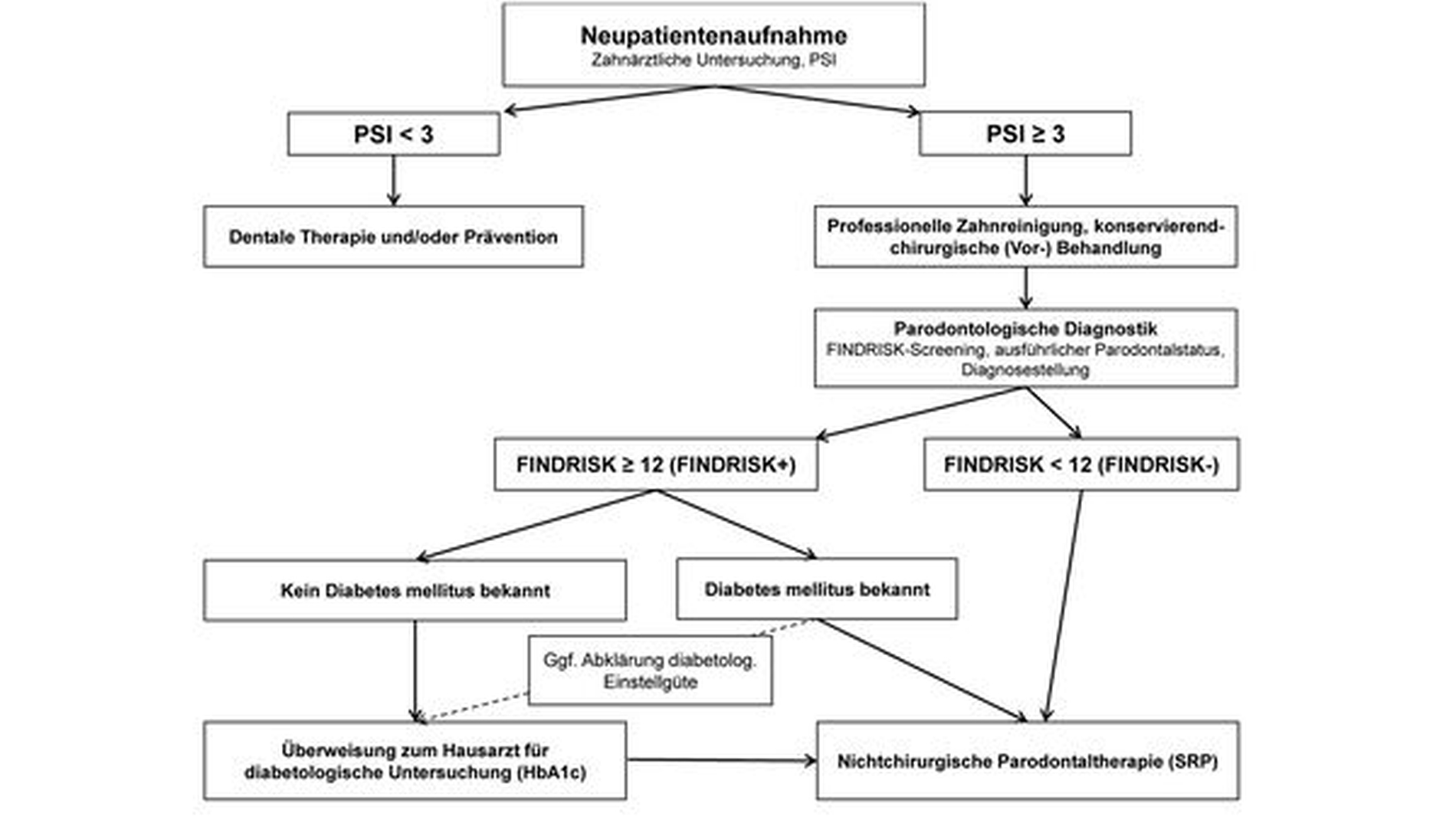
Insgesamt weist die Methode sowohl eine hohe Sensitivität als auch Spezifität auf (75 bis 80 Prozent). So können mittels FINDRISK-Fragebogen acht bis zehn Prozent der Fälle mit einem zuvor unbekannten Diabetes mellitus aus einem Patientenpool von parodontal vorerkrankten Patienten identifiziert werden [Schmalz et al., 2021; Ziebolz et al., 2019]. Das FINDRISK-basierte Screening ist zeitlich und apparativ wenig aufwendig; so kann die Beantwortung des Fragebogens im Wartebereich oder Zuhause erfolgen, während die Auswertung des Punktwerts und die Zuweisung zum Hausarzt mittels (standardisiertem) Arztbrief wenige Minuten in Anspruch nehmen. Eine mögliche Implikation dieses Ansatzes in die Therapiestufe 1 der systematischen Parodontitistherapie zeigt Abbildung 3.
Insgesamt ist das Diabetes-Screening eine effektive Methode, um vor allem bei Patienten mit einer schweren oder therapieresistenten Parodontitis eine systemische Komponente im Sinne einer Diabetes-mellitus-Erkrankung zu detektieren (Abbildung 4).
Implikationen zur Betreuung von DiabetesPatienten in der Praxis
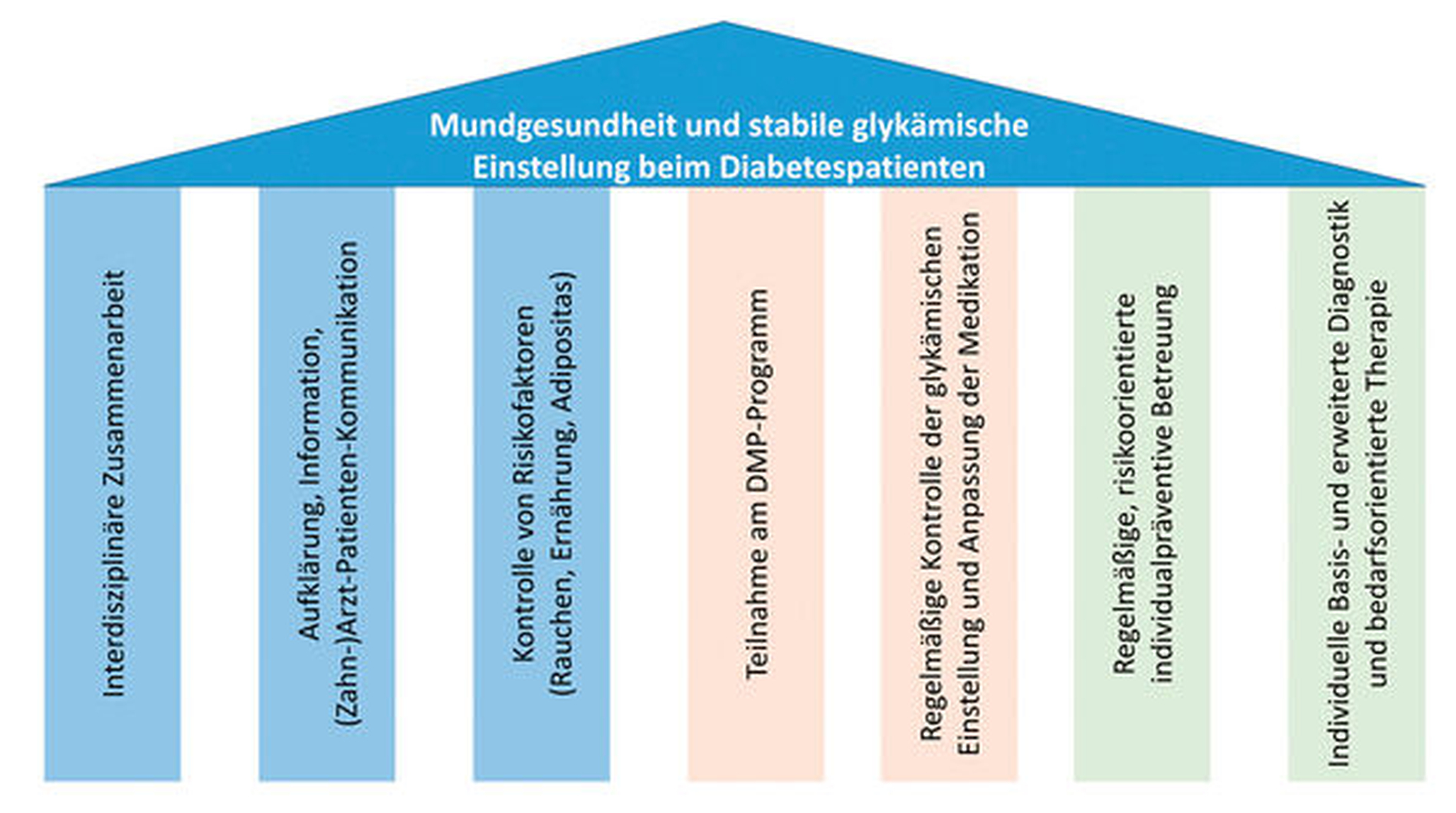
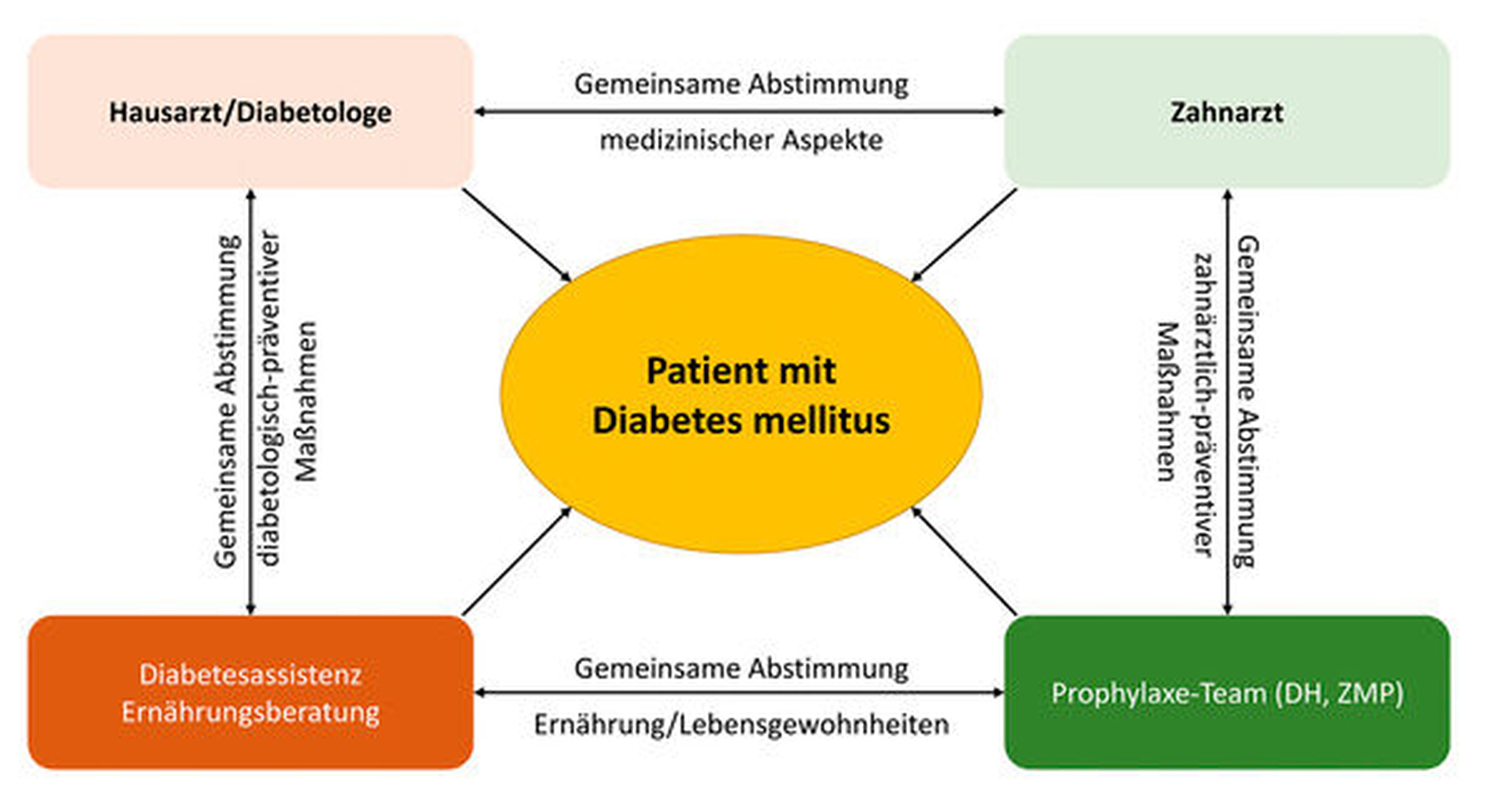
Aus diesem Beitrag ergeben sich einige Punkte, die für ein zielgerichtetes Fürsorgekonzept von Diabetespatienten in der zahnärztlichen Praxis relevant sind – diese sollten in einem vollumfänglichen, fallorientierten Betreuungskonzept zusammengesetzt werden. Grundsätzlich funktioniert eine optimale Therapie und präventive Nachsorge nur in einem gemeinsamen interdisziplinären/synoptischen Ansatz zwischen Zahn- und Allgemeinmedizinern, wobei die Mundgesundheit und die Stabilität der glykämischen Einstellung auf verschiedenen Säulen fußen (Abbildung 5). Sinnvoll ist, dabei alle Mitglieder des zahnmedizinischen Teams (Zahnarzt, DH, ZMP) wie auch des allgemeinmedizinischen Teams (Hausarzt, Diabetologe, Diabetesassistenz, Ernährungsberatung) sowie den Patienten selbst und gegebenenfalls Angehörige einzubeziehen (Abbildung 6).
Bereits im ersten Teil erfolgte die Einordnung von Diabetespatienten in Risikoprofile, angelehnt ans Prinzip der individualisierten Prävention [Schmalz und Ziebolz, 2020]. Bei der Therapie oraler Erkrankungen, insbesondere bei invasiven Behandlungen mit (hohem) Bakteriämierisiko ist die glykämische Einstellgüte zu beachten. Bei schlecht eingestellten Diabetikern (HbA1c über 8 Prozent) kann dabei das Risiko für systemische Infektionen erhöht sein [Carey et al., 2018], was entsprechend in Abhängigkeit von der Art des Eingriffs und der oralen Bakterien- beziehungsweise Entzündungslast eine prätherapeutische Antibiotikaprophylaxe (2 g Amoxicillin, alternativ 600 mg Clindamycin bei Penicillinallergie) erforderlich macht [Schmalz und Ziebolz, 2019].
Ansonsten können Behandlungsoptionen bei vorliegenden oralen Erkrankungen (zum Beispiel Karies, Erosion, Gingivitis und/oder Parodontitis) analog zum allgemeingesunden Patienten durchgeführt werden. Im Hinblick auf das erhöhte Risiko für Komplikationen bei Implantatsetzung und/oder das Risiko für periimplantäre Erkrankungen gibt es aktuell eine teils widersprüchliche Studienlage beziehungsweise eine nur limitierte Evidenz [Monje et al., 2017]. Dieser Teilaspekt bedarf immer einer individuellen Therapieentscheidung und -planung.
Entscheidende Adaptionen sind jedoch im Bereich der präventiven Betreuung vonnöten; aus parodontologischer Sicht gibt das HbA1c-abhängige Grading ein entsprechendes Nachsorgeintervall vor: Grad B (HbA1c < 7,0 Prozent) und Grad C (HbA1c ≥ 7,0 Prozent) zwei- beziehungsweise dreimal jährlich [Jepsen et al., 2018]. Darüber hinaus bedingt die Wechselwirkung von Diabetes und anderen oralen Veränderungen wie Mundtrockenheit, (Wurzel-)Kariesrisiko und potenziellen Mundschleimhautveränderungen auch unabhängig von der parodontalen Situation einen erhöhten Präventionsbedarf.
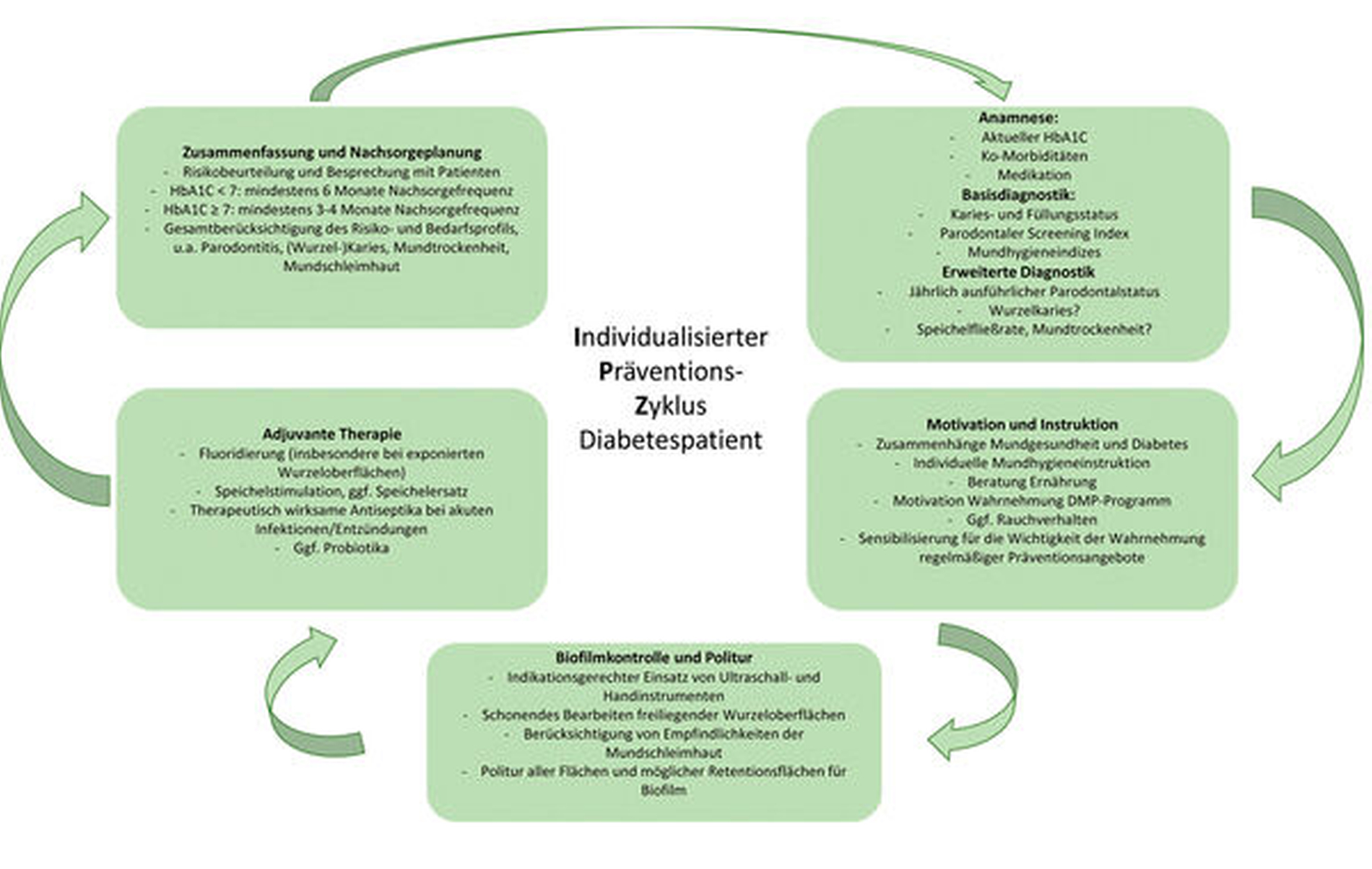
Hinzu kommt der Aspekt der Primärprävention; auch mundgesunde Diabetiker bedürfen mundgesundheitsunabhängig einer intensiven und engmaschigen Prävention, da ihr orales Erkrankungsrisiko grundsätzlich erhöht ist [Schmalz und Ziebolz, 2019]. Primär geht es in der individualisierten Prävention und Medizin stets um die Erhöhung der Sicherheit, Effizienz und Effektivität der Therapiemaßnahmen [Schmalz und Ziebolz, 2020; Schleidgen et al., 2013]. Entsprechend müssen die Inhalte der individuellen Präventionssitzung beim Diabetiker fallorientiert angepasst werden. Eine Übersicht hierzu liefert Abbildung 7.
Fazit
Die zahnmedizinische Betreuung von Diabetespatienten enthält komplexe Implikationen. Während die Bidirektionalität zwischen Diabetes und Parodontitis vielfach beschrieben und ausführlich dargestellt ist, gehen die oralen Besonderheiten von Diabetespatienten deutlich darüber hinaus. Folgende Kernpunkte zu Mundgesundheit und Diabetes sollten berücksichtigt und für die Betreuung dieser Patienten in der zahnärztlichen Praxis bedacht werden:
Diabetespatienten haben immer ein erhöhtes (HbA1c-abhängiges) Risiko für orale Erkrankungen. Dies betrifft vorrangig Parodontalerkrankungen, aber auch Karies und Mundschleimhautveränderungen. Folglich ist bereits der mundgesunde Diabetiker ein Patient, der einer gesteigerten Aufmerksamkeit in der zahnärztlichen Praxis bedarf. Hierbei müssen auch gemeinsame Risikofaktoren wie Rauchen, Übergewicht oder Ernährung adressiert werden.
Die diabetologische Einstellgüte der Patienten ist essenziell für den Behandlungserfolg. Demnach ist eine effektive Betreuung der Diabetespatienten nur in einer Verzahnung mit dem medizinischen Team (Hausarzt, Diabetologen, Diabetesassistenten, Ernährungsberatern) möglich. Hier finden sich aktuell enorme Defizite; es sollte an der Etablierung von interdisziplinären Strukturen gearbeitet werden.
Diabetespatienten sind oftmals unzureichend über die Bedeutung der Mundgesundheit beziehungsweise ihr orales Erkrankungsrisiko aufgeklärt. Hierin liegt eine besondere Aufgabe des gesamten (zahnärztlichen/ärztlichen) Betreuungsteams.
Die Therapie oraler Erkrankungen, insbesondere der Parodontitis, kann sich positiv auf die glykämische Einstellgüte der Patienten auswirken. Dies ist ein großer Ansporn für die zielgerichtete Therapie und ein wirkungsvolles Argument für die Kommunikation mit den betreuenden Allgemeinmedizinern.
Diabetespatienten haben – je nach Einstellgüte – ein mögliches Komplikationsrisiko (Infektionsgefährdung) bei zahnärztlichen Eingriffen. Daher müssen eventuelle Maßnahmen wie beispielsweise die Notwendigkeit einer prätherapeutischen Antibiotikaprophylaxe stets individuell, in Abhängigkeit vom Mundgesundheitszustand und vom Bakteriämierisiko der zahnmedizinischen Intervention, abgewogen werden.
Basierend auf dem Risiko für orale Erkrankungen – das betrifft sowohl die Neuentstehung als auch die Progression – ist ein fallorientiertes Betreuungskonzept erforderlich. Auf dieser Grundlage müssen Inhalte und Rahmenbedingungen der Präventionssitzung, beispielsweise nach dem Prinzip der individualisierten Prävention, fallorientiert angepasst werden.
Auf Grundlage der bekannten Bidirektionalität zwischen Parodontitis und Diabetes spielt die Zahnarztpraxis eine bedeutende Rolle in der Diabetesfrüherkennung. Insbesondere bei Parodontitispatienten kann ein Fragebogen-basiertes Diabetes-Screening (FINDRISK) mit anschließender Zuweisung zum Hausarzt/Diabetologen zur frühzeitigen Diagnosestellung bisher unbekannter Diabetesfälle beitragen.
Die Möglichkeit der Diabetesfrüherkennung in der Praxis und die Bedeutung der Parodontaltherapie zur Verbesserung der glykämischen Einstellgüte für die Verringerung des Risikos für Diabetes-Folgeerkrankungen unterstreicht die zeitgemäße Rolle der Zahnmedizin als integralen Baustein der medizinischen Versorgung. Gleichzeitig belegt dies auch die Verantwortung, die das zahnmedizinische Team für die Gesunderhaltung der Patienten haben kann.
Die zeitgemäße interdisziplinäre Versorgung von Diabetespatienten reiht sich ein in eine Reihe grundsätzlicher Entwicklungen der Zahnmedizin, die oft als Paradigmenwechsel beschrieben werden: Zunächst weitet sich der „Zuständigkeitsbereich“ der Zahnmedizin vom oralen Fokus hin zur interdisziplinären Mitbehandlung hochprävalenter Allgemeinerkrankungen aus. Damit verbunden ist eine auch innerhalb der Zahnmedizin zu beobachtende Verschiebung von der Kuration zur Prävention. Und schlussendlich zeigt das Beispiel der Behandlung von Diabetespatienten, wie bedeutsam inzwischen die patientenindividuelle Prävention und Therapie in einer evidenzbasierten und zeitgemäßen Versorgung geworden ist.
Literaturliste
Akl S, Ranatunga M, Long S, Jennings E, Nimmo A. A systematic review investigating patient knowledge and awareness on the association between oral health and their systemic condition. BMC Public Health. 2021; 21 (1): 2077. doi: 10.1186/s12889-021-12016-9.
Allauddin Siddiqi, S Zafar, A Sharma, A Quaranta. Diabetes mellitus and periodontal disease: The call for interprofessional education and interprofessional collaborative care - A systematic review of the literature. J Interprof Care. 2022; 36 (1): 93-101. doi: 10.1080/13561820.2020.1825354.
Artese HP, Foz AM, Rabelo Mde S, Gomes GH, Orlandi M, Suvan J, D'Aiuto F, Romito GA. Periodontal therapy and systemic inflammation in type 2 diabetes mellitus: a meta-analysis. PLoS One. 2015; 10 (5): e0128344. doi: 10.1371/journal.pone.0128344
Baeza M, Morales A, Cisterna C, Cavalla F, Jara G, Isamitt Y, Pino P, Gamonal J. Effect of periodontal treatment in patients with periodontitis and diabetes: systematic review and meta-analysis. J Appl Oral Sci. 2020 Jan; 28: e20190248. doi: 10.1590/1678-7757-2019-0248.
Barasch A, Gilbert GH, Spurlock N, Funkhouser E, Persson LL, Safford MM; DPBRN Collaborative Group. Random plasma glucose values measured in community dental practices: findings from the Dental Practice-Based Research Network. Clin Oral Investig. 2013; 17 (5): 1383-8. doi: 10.1007/s00784-012-0825-y.
Birch S, Bridgman C, Brocklehurst P, Ellwood R, Gomez J, Helgeson M, Ismail A, Macey R, Mariotti A, Twetman S, Preshaw PM, Pretty IA, Whelton H. Prevention in practice--a summary. BMC Oral Health. 2015; 15 Suppl 1: S12.
Bissett SM, Preshaw PM, Presseau J, Rapley T. A qualitative study exploring strategies to improve the inter-professional management of diabetes and periodontitis. Prim Care Diabetes. 2020; 14 (2): 126-132. doi: 10.1016/j.pcd.2019.11.010.
Borgnakke WS. Does Treatment of Periodontal Disease Influence Systemic Disease? Dent Clin North Am. 2015; 59 (4): 885-917. doi: 10.1016/j.cden.2015.06.007.
Carey IM, Critchley JA, DeWilde S, Harris T, Hosking FJ, Cook DG. Risk of Infection in Type 1 and Type 2 Diabetes Compared With the General Population: A Matched Cohort Study. Diabetes Care. 2018; 41 (3): 513-521.
Cevik Akyil R, Miloglu O, Olgun N, Sevki Bayrakdar I. A comparison of three different diabetes screening methods among dental patients in Turkey. Pak J Med Sci. 2014; 30 (1): 65-9. doi: 10.12669/pjms.301.4238.
Costa FO, Miranda Cota LO, Pereira Lages EJ, Soares Dutra Oliveira AM, Dutra Oliveira PA, Cyrino RM, Medeiros Lorentz TC, Cortelli SC, Cortelli JR. Progression of periodontitis and tooth loss associated with glycemic control in individuals undergoing periodontal maintenance therapy: a 5-year follow-up study. J Periodontol. 2013; 84 (5): 595-605. doi: 10.1902/jop.2012.120255.
DGParo, DGZMK: „Die Behandlung von Parodontitis Stadium I bis III - Die deutsche Implementierung der S3-Leitlinie: „Treatment of Stage I–III Periodontitis“ der European Federation of Periodontology (EFP)“, Langfassung 2020, Version 1.0, AWMF-Registriernummer 083-043, www.awmf.org/leitlinien/detail/ll/083-043.html, (Zugriff am: 29.03.2022)
Engebretson S, Kocher T. Evidence that periodontal treatment improves diabetes outcomes: a systematic review and meta-analysis. J Periodontol. 2013; 84 (4 Suppl): S153-69. doi: 10.1902/jop.2013.1340017.
Estrich CG, Araujo MWB, Lipman RD. Prediabetes and Diabetes Screening in Dental Care Settings: NHANES 2013 to 2016. JDR Clin Trans Res. 2019 Jan; 4 (1): 76-85. doi: 10.1177/2380084418798818.
Genco RJ, Schifferle RE, Dunford RG, Falkner KL, Hsu WC, Balukjian J. Screening for diabetes mellitus in dental practices: a field trial. J Am Dent Assoc. 2014; 145 (1): 57-64. doi: 10.14219/jada.2013.7.
Glurich I, Bartkowiak B, Berg RL, Acharya A. Screening for dysglycaemia in dental primary care practice settings: systematic review of the evidence. Int Dent J. 2018; 68 (6): 369-377. doi: 10.1111/idj.12405.
Greenberg BL, Glick M, Frantsve-Hawley J, Kantor ML. Dentists' attitudes toward chairside screening for medical conditions. J Am Dent Assoc. 2010; 141 (1): 52-62. doi: 10.14219/jada.archive.2010.0021.
Grellmann AP, Sfreddo CS, Maier J, Lenzi TL, Zanatta FB. Systemic antimicrobials adjuvant to periodontal therapy in diabetic subjects: a meta-analysis. J Clin Periodontol. 2016; 43 (3): 250-60. doi: 10.1111/jcpe.12514.
Harks I, Koch R, Eickholz P, Hoffmann T, Kim TS, Kocher T, Meyle J, Kaner D, Schlagenhauf U, Doering S, Holtfreter B, Gravemeier M, Harmsen D, Ehmke B. Is progression of periodontitis relevantly influenced by systemic antibiotics? A clinical randomized trial. J Clin Periodontol. 2015; 42 (9): 832-842. doi: 10.1111/jcpe.12441
Herman WH, Taylor GW, Jacobson JJ, Burke R, Brown MB. Screening for prediabetes and type 2 diabetes in dental offices. J Public Health Dent. 2015 Summer; 75 (3): 175-82. doi: 10.1111/jphd.12082.
Jepsen S, Caton JG, Albandar JM, Bissada NF, Bouchard P, Cortellini P, Demirel K, de Sanctis M, Ercoli C, Fan J, Geurs NC, Hughes FJ, Jin L, Kantarci A, Lalla E, Madianos PN, Matthews D, McGuire MK, Mills MP, Preshaw PM, Reynolds MA, Sculean A, Susin C, West NX, Yamazaki K. Periodontal manifestations of systemic diseases and developmental and acquired conditions: Consensus report of workgroup 3 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018; 89 Suppl 1: S237-S248. doi: 10.1002/JPER.17-0733.
Keestra JA, Grosjean I, Coucke W, Quirynen M, Teughels W. Non-surgical periodontal therapy with systemic antibiotics in patients with untreated chronic periodontitis: a systematic review and meta-analysis. J Periodontal Res. 2015; 50 (3): 294-314. doi: 10.1111/jre.12221. Epub 2014 Aug 21.
Kocher T, König J, Borgnakke WS, Pink C, Meisel P. Periodontal complications of hyperglycemia/diabetes mellitus: Epidemiologic complexity and clinical challenge. Periodontol 2000. 2018; 78 (1): 59-97. doi: 10.1111/prd.12235.
Monje A, Catena A, Borgnakke WS. Association between diabetes mellitus/hyperglycaemia and peri-implant diseases: Systematic review and meta-analysis. J Clin Periodontol. 2017; 44 (6): 636-648. doi: 10.1111/jcpe.12724.
Müller-Wieland D, Petermann A, Nauck M, Heinemann L, Kerner W, Müller U, Landgraf R. Definition, Klassifikation und Diagnostik des Diabetes mellitus. Diabetologie und Stoffwechsel. 2016; 11 (S02): 78-81
Ramseier CA, Woelber JP, Kitzmann J, Detzen L, Carra MC, Bouchard P. Impact of risk factor control interventions for smoking cessation and promotion of healthy lifestyles in patients with periodontitis: A systematic review. J Clin Periodontol. 2020; 47 Suppl 22: 90-106. doi: 10.1111/jcpe.13240.
Rovai ES, Souto ML, Ganhito JA, Holzhausen M, Chambrone L, Pannuti CM. Efficacy of Local Antimicrobials in the Non-Surgical Treatment of Patients With Periodontitis and Diabetes: A Systematic Review. J Periodontol. 2016; 87 (12): 1406-1417. doi: 10.1902/jop.2016.160214.
Santos CM, Lira-Junior R, Fischer RG, Santos AP, Oliveira BH. Systemic Antibiotics in Periodontal Treatment of Diabetic Patients: A Systematic Review. PLoS One. 2015; 10 (12): e0145262. doi: 10.1371/journal.pone.0145262.
Schleidgen S, Klingler C, Bertram T, Rogowski WH, Marckmann G. What is personalized medicine: sharpening a vague term based on a systematic literature review. BMC Med Ethics. 2013; 14: 55
Schmalz G, Ziebolz D. Individualisierte Prävention – Implikation allgemeingesundheitlicher Faktoren. ZWR 2019; 128 (06): 295-304
Schmalz G, Ziebolz D. Changing the Focus to the Whole Patient instead of One Oral Disease: The Concept of Individualized Prevention. Adv Prev Med. 2020; 2020: 6752342. doi: 10.1155/2020/6752342.
Schmalz G, Wolf C, Merle C, Kottmann T, Haak R, Ziebolz D. Evaluation of a questionnaire-based diabetes screening concept in German patients with Stage III or IV periodontitis: A practice-based study. J Periodontol. 2021; 92 (8): 1163-1170. doi: 10.1002/JPER.20-0297. Epub 2020 Nov 25.
Schulze MB, Homberg K, Hoffmann K, Boeing H, Joost HG. Kurzfragebogen zur Bestimmung des Diabetesrisikos auf Grundlage des Deutschen Diabetes-Risiko-Scores. Ernährungs Umschau. 2007; 54: 698-703. a.
Schulze MB, Hoffmann K, Boeing H, Linseisen J, Rohrmann S, Mohlig M, Pfeiffer AF, Spranger J, Thamer C, Haring HU, Fritsche A, Joost HG. An accurate risk score based on anthropometric, dietary, and lifestyle factors to predict the development of type 2 diabetes. Diabetes Care. 2007; 30: 510-15. b.
Seitz MW, Haux C, Smits KPJ, Kalmus O, Van Der Zande MM, Lutyj J, Listl S. Development and evaluation of a mobile patient application to enhance medical-dental integration for the treatment of periodontitis and diabetes. Int J Med Inform. 2021; 152: 104495. doi: 10.1016/j.ijmedinf.2021.104495.
Siddiqi A, Zafar S, Sharma A, Quaranta A. Awareness of Diabetic Patients Regarding the Bidirectional Association between Periodontal Disease and Diabetes Mellitus: A Public Oral Health Concern. J Contemp Dent Pract. 2020; 21 (11): 1270-1274.
Simon L, Tobey M, Wilson M. Feasibility of integrating a dental hygienist into an inpatient medical team for patients with diabetes mellitus. J Public Health Dent. 2019; 79 (3): 188-192. doi: 10.1111/jphd.12320.
Smiley CJ, Tracy SL, Abt E, Michalowicz BS, John MT, Gunsolley J, Cobb CM, Rossmann J, Harrel SK, Forrest JL, Hujoel PP, Noraian KW, Greenwell H, Frantsve-Hawley J, Estrich C, Hanson N. Systematic review and meta-analysis on the nonsurgical treatment of chronic periodontitis by means of scaling and root planing with or without adjuncts. J Am Dent Assoc. 2015 Jul; 146 (7): 508-24.e5. doi: 10.1016/j.adaj.2015.01.028.
Strauss SM, Rosedale M, Pesce MA, Juterbock C, Kaur N, DePaola J, Goetz D, Wolff MS, Malaspina D, Danoff A. Point-of-Care HbA1c Testing with the A1cNow Test Kit in General Practice Dental Clinics: A Pilot Study Involving Its Accuracy and Practical Issues in Its Use. Point Care. 2014 Dec; 13 (4): 142-147. doi: 10.1097/POC.0000000000000039.
Teughels W, Feres M, Oud V, Martín C, Matesanz P, Herrera D. Adjunctive effect of systemic antimicrobials in periodontitis therapy: A systematic review and meta-analysis. J Clin Periodontol. 2020; 47 Suppl 22: 257-281. doi: 10.1111/jcpe.13264.
Tuomilehto J, Lindström J, Eriksson JG et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344: 1343-1350
Ziebolz D, Bauwe I, Schmidt J, Kottmann T, Rinke S, Schmalz G. Diabetes Screening in Dental Practice Using the Find-Risk Questionnaire - A Practice-based Pilot Study. Oral Health Prev Dent. 2019; 17 (2): 147-156. doi: 10.3290/j.ohpd.a42370.
Ziebolz D, Reiss L, Schmalz G, Krause F, Haak R, Mausberg RF. Different views of dentists and general medical practitioners on dental care for patients with diabetes mellitus and coronary heart diseases: results of a questionnaire-based survey in a district of Germany. Int Dent J. 2018; 68 (3): 197-203. doi: 10.1111/idj.12353.