Zahnärztliche Pharmakotherapie in der Stillzeit
Stillende Patientinnen sind im Hinblick auf Arzneimittel oft ähnlich sensibel wie Schwangere. Nicht selten brechen sie aus Angst vor einem ungewollten Übertritt des Arzneistoffs in die Muttermilch und der damit potenziellen Gefährdung des Säuglings (definiert als Kind im ersten Lebensjahr) das Stillen ab oder verzichten auf eine notwendige Therapie. Diese Vorsicht ist aber nur bei wenigen Arzneistoffgruppen wirklich notwendig.
Eine medikamentöse Behandlung während der Stillzeit bringt eine Komplexität mit sich, die für die meisten Zahnmediziner eher ungewohnt ist. Die Nutzen-Risiko-Bewertung muss hier nicht nur die Gesundheit der Mutter, sondern auch die des Säuglings berücksichtigen, bei dem ebenfalls ein Behandlungsnutzen oder aber unerwünschte Nebenwirkungen auftreten können. Um sich rechtlich abzusichern, empfehlen die Fachinformationen fast aller Medikamente eine Stillpause für 24 Stunden nach Medikamenteneinnahme und gar das Verwerfen der in dieser Zeit gebildeten Milch. Dies gilt jedoch in der klinischen Praxis als veraltet [Nassen et al., 2014]. Vor diesem Hintergrund sollten auch Zahnmediziner über die Pharmakotherapie in der Stillzeit grundlegende Kenntnisse besitzen, um die stillenden Patientinnen adäquat informieren und sicher therapieren zu können. Wie bei der Beratung von Schwangeren ist die Plattform Embryotox der Charité in Berlin (www.embryotox.de) auch für pharmakologische Fragen im Umfeld des Stillens eine wertvolle Hilfe.
Das Stillen
Grundsätzlich ist die Muttermilch im ersten halben Lebensjahr die ideale Ernährung für Säuglinge [Koletzko et al., 2016]. Stillen, also die ausschließliche Ernährung des Säuglings oder Kleinkindes an der Brust, hat vielfältige positive Auswirkungen auf die Gesundheit des Kindes [Brettschneider et al., 2018; Horta und Victora, 2013].
Sowohl unter dem ganzheitlich medizinischen Aspekt als auch mit zahnmedizinisch-kieferorthopädischem Fokus profitieren Kinder vom Stillem in vielerlei Hinsicht. Vor diesem Hintergrund raten verschiedene Autoren sogar dazu, über das erste Lebensjahr hinaus ergänzend zur Beikost zu stillen [Kuminek et al., 2021; Mittelhammer, 2023]. Für das ausschließliche Stillen, das heißt, der Säugling erhält neben der Muttermilch keine weiteren Flüssigkeiten oder Beikost, hat die Nationale Stillkommission im Jahr 2004 vor dem Hintergrund der Empfehlungen der Weltgesundheitsorganisation (WHO) folgende Empfehlung gegeben [Bundesinstitut für Risikobewertung, 2020]:
Ausschließliches Stillen stellt in den ersten sechs Monaten für die Mehrzahl der Säuglinge die optimale Ernährung dar.
Beikost sollte – in Abhängigkeit vom Gedeihen und der Essfähigkeit des Kindes – nicht später als zu Beginn des siebten Lebensmonats und keinesfalls vor dem Beginn des fünften Monats gegeben werden.
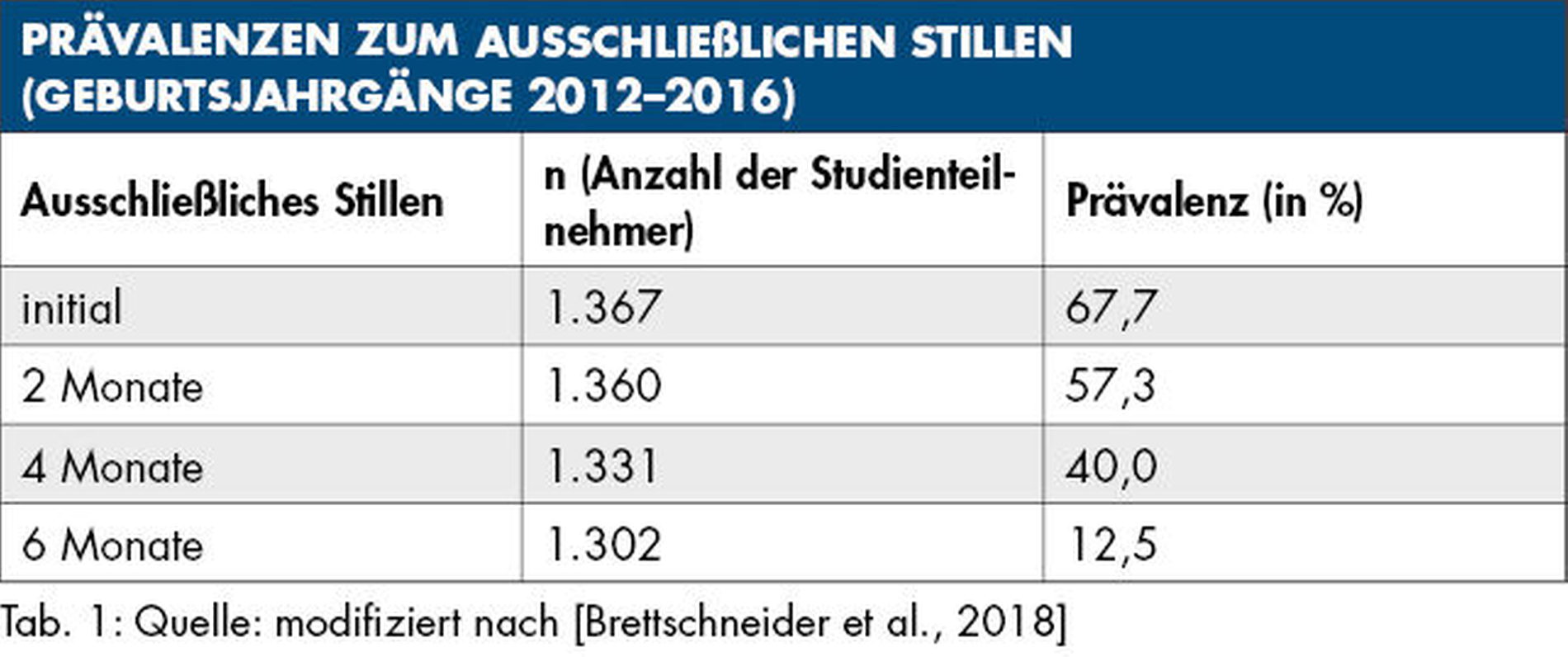
Die Daten der repräsentativen „Studie zur Gesundheit von Kindern und Jugendlichen in Deutschland“ (KiGGS) zeigen, dass nur sehr wenige Kinder bis zum sechsten Lebensmonat ausschließlich gestillt werden (Tabelle 1). Die mittlere Stilldauer für ausschließliches Stillen lag in der Untersuchungsgruppe der Geburtsjahrgänge 2012 bis 2016 bei 3,9 Monaten [Brettschneider et al., 2018]. Allerdings beendet knapp ein Viertel aller Frauen das Stillen aufgrund einer Medikamenteneinnahme [Gupta und Dadhich, 2007]. Die durchschnittliche Stilldauer (jegliches Stillen) beträgt seit Langem etwa acht Monate [Robert Koch-Institut, 2020].
Physiologische Aspekte des Stillens
Zahlreiche Faktoren beeinflussen die Verteilung eines von der Mutter eingenommenen Medikaments im Körper und die Auswirkungen auf den gestillten Säugling. Die Wirkstoffe des Arzneimittels werden von der Mutter aufgenommen, verteilt, verstoffwechselt und substanzspezifisch renal oder hepatisch eliminiert. Nur ein Teil gelangt über die Blutbahn ins Milchbildungsgewebe. Der Substanzgehalt in der Muttermilch wird während der Laktation zumeist durch transzelluläre Transportprozesse (überwiegend passive Diffusion, seltener aktiver Transport) reguliert [Schäfer, 2010; Fischer et al., 2019; Ude und Burkhardt, 2020].
Medikamente gehen besonders leicht in die Milch über, wenn die Substanz
gut fettlöslich / schlecht wasserlöslich ist,
eine geringe Molekülmasse hat (< 200 g/mol),
alkalisch ist,
einen geringen Ionisationsgrad hat,
nur eine geringe Proteinbindung aufweist [Schäfer und Koch, 1998; Schäfer, 2010; Fischer et al., 2019; Ude und Burkhardt, 2020].
Besonders das Ausmaß der Proteinbindung eines Arzneistoffs entscheidet darüber, in welchem Umfang der Wirkstoff beim Stillen vom Säugling aufgenommen wird. So ist bekannt, dass bei einer Proteinbindung von mehr als 85 Prozent beim gestillten Kind praktisch keine messbaren Konzentrationen des Arzneistoffs mehr nachweisbar sind [Anderson, 2006].
Ähnlich wie bei der Blut-Hirn-Schranke müssen Arzneimittel sowohl die Lipidmembranen der kapillaren Blutgefäße als auch die der Alveolarzellen der Mamma durchdringen, um in die Muttermilch zu gelangen. Bereits eine Woche nach der Geburt sind Arzneimittel nur noch in kleinen Mengen im Milchkompartiment nachweisbar, so dass beim Säugling meist nur eine verschwindend geringe absolute Wirkstoffdosis ankommt [Hale und Baker, 2018]. Durch Abwarten von ein bis zwei Halbwertszeiten bis zum nächsten Stillen können Konzentrationsspitzen sicher umgangen werden [Horn und Kirch, 2000]. Nach Ablauf der fünffachen Dauer der Halbwertszeit ist das Arzneimittel im Allgemeinen nicht mehr im mütterlichen Blut nachweisbar [Ude und Burkhardt, 2020].
Eine bekannte Methode zur standardisierten Beurteilung der Sicherheit eines Arzneimittels besteht darin, die relative Säuglingsdosis (Relative Infant Dose, RID) zu bestimmen. Die RID beschreibt die prozentual vom Baby über die Muttermilch aufgenommene gewichtsbezogene Arzneistoffdosis in 24 Stunden (mg/kg/Tag) relativ zur Dosis der Mutter (mg/kg/Tag), und dient der Risikoabschätzung für den Übertrittsgrad eines Arzneistoffs in die Muttermilch. Prinzipiell gilt ein Medikament mit einer relativen Dosis unter zehn Prozent als sicher für die Anwendung während der Stillzeit. Bei einer relativen Dosis zwischen zehn und 25 Prozent ist Vorsicht geboten und ab 25 Prozent ist die Anwendung während der Stillzeit kontraindiziert [Bennett, 1996; Hotham und Hotham, 2015], wenn von der Substanz potenziell eine Gefahr ausgehen könnte oder gesicherte Erkenntnisse fehlen.
Pharmakologische Besonderheiten bei Säuglingen
Generell gilt, dass Frühgeborene gegenüber jeglichen Arzneimitteln besonders empfindlich sind. Nach der Geburt des Säuglings verändert sich der Organismus in den ersten Monaten relativ rasch. Aufgrund unvollständiger Organbarrieren ist die Arzneimittelresorption bei Neugeborenen und Säuglingen im Vergleich zu einem Erwachsenen deutlich anders. Bei Säuglingen ist es daher auch extrem schwierig, die mit der Muttermilch aufgenommene Dosis mit einer normalen klinischen Dosis zu vergleichen, weil es meist keine Dosierungsschemata für diese Altersgruppe gibt.
Die wichtigsten pharmakologisch relevanten Stoffwechseländerungen dieser Lebensphase sind in Tabelle 2 zusammengefasst. Typisch für Neugeborene und Säuglinge sind die Besonderheiten des Magen-Darm-Trakts und die unvollständigen hepatischen und renalen Eliminationsmechanismen in den ersten Lebensmonaten. Dies kann insgesamt zu erheblichen Verzögerungen bei der Wirkstoffelimination führen [Ude und Burkhardt, 2020].
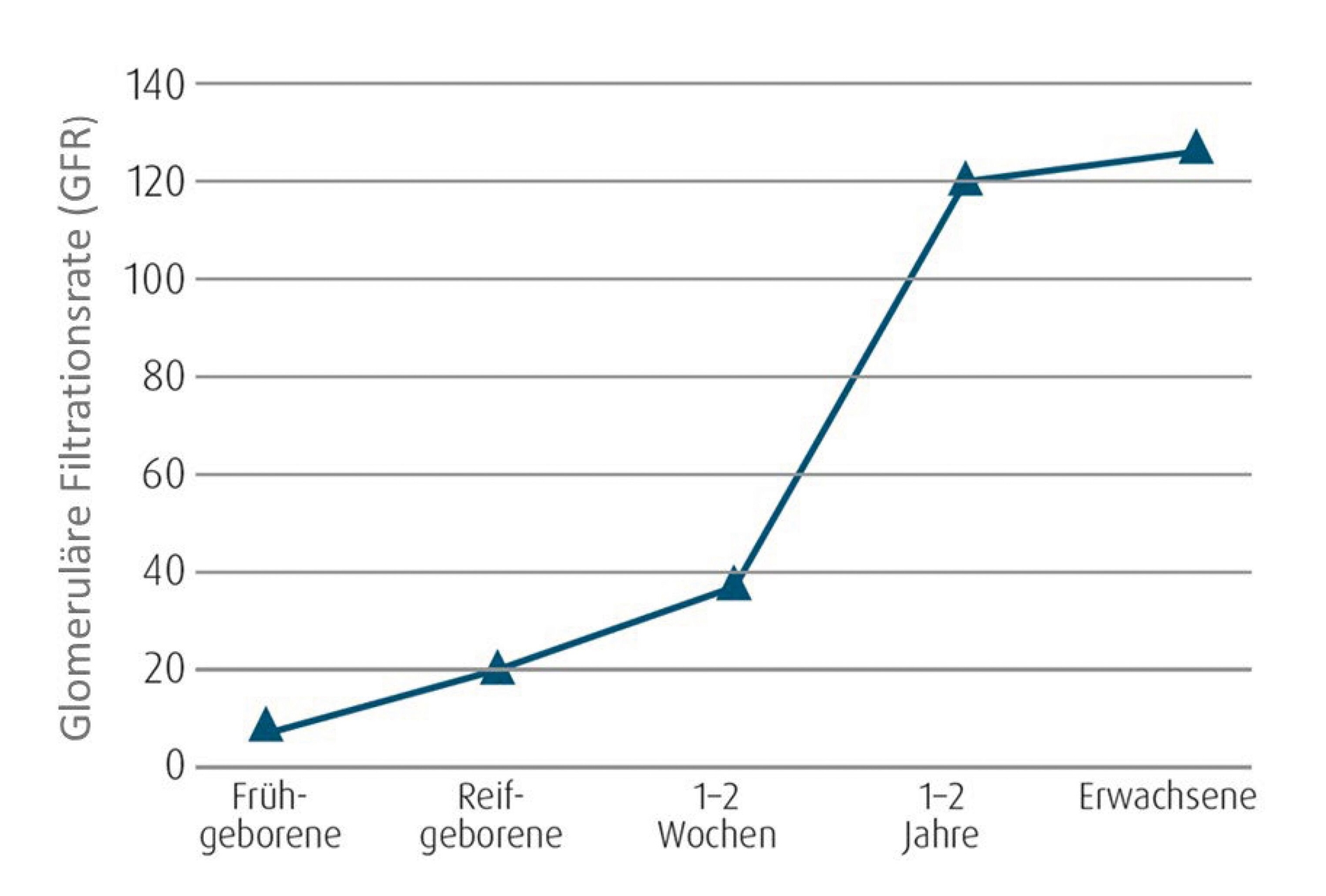
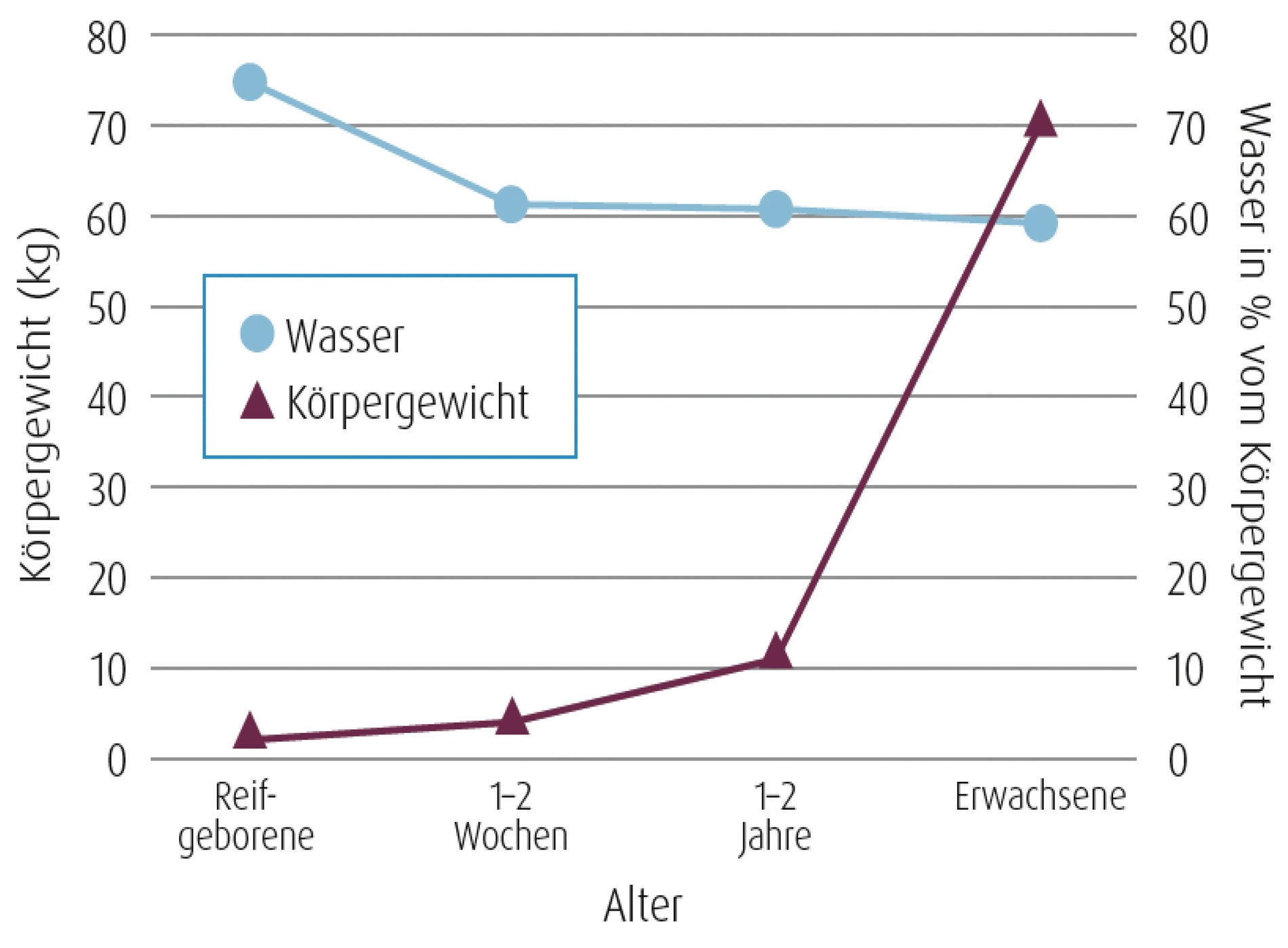
So ist die glomeruläre Filtrationsrate (GFR), die die relevante Funktion der Nieren für die Ausscheidung von Arzneimitteln darstellt, bei Säuglingen gegenüber Erwachsenen deutlich reduziert (Abbildung 1). Dadurch ist die Elimination über die Niere verlangsamt und es kann zu einer längeren Verweildauer von Arzneistoffen im Körper kommen. Andererseits haben Säuglinge in Relation zum Körpergewicht ein wesentlich höheres Extrazellularvolumen und einen höheren Körperwasseranteil als Erwachsene (Abbildung 2). Dies bedingt ein höheres Verteilungsvolumen aller wasserlöslichen Arzneistoffe [Ude und Burkhardt, 2020].
Eine Übersichtsarbeit ergab, dass die meisten Nebenwirkungen von Arzneimitteln bei gestillten Kindern unter zwei Monaten zu verzeichnen waren [Ilett et al., 1997]. Ab einem Säuglingsalter von sechs Monaten geht von den meisten Arzneimitteln eine geringere Gefahr aus, da die Nierenfunktion und die Atmungssteuerung des Kindes zu diesem Zeitpunkt recht gut ausgebildet sind, so dass Wirkstoffe besser über den Stoffwechsel eliminiert werden können [Hale und Baker, 2018].
Zahnärztliche Medikamente in der Stillzeit
Analgetika
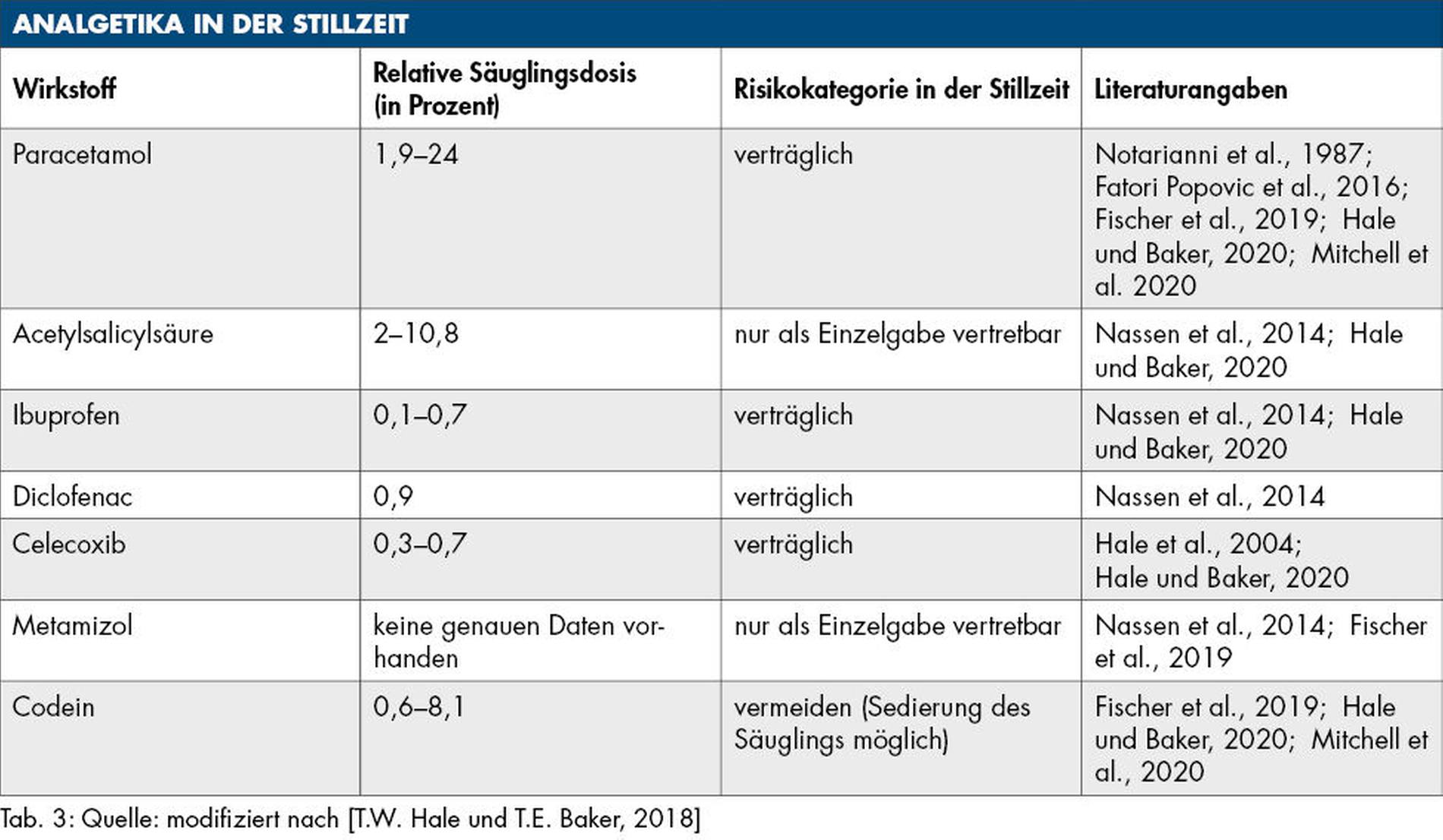
Unter den nichtsteroidalen Antirheumatika (NSAR) ist Ibuprofen während der Stillzeit das Mittel der Wahl [Horn und Kirch, 2000]. Aufgrund der hohen mütterlichen Plasmaeiweißbindung (> 99 Prozent) und der geringen Lipidlöslichkeit geht nur ein sehr geringer Anteil in die Muttermilch über (Tabelle 3) [Nassen et al., 2014; Hale und Baker, 2018; Fischer et al., 2020; Ude und Burkhardt, 2020].
Auch bei der Einnahme von Diclofenac und Celecoxib sind bisher keine negativen Folgen beim gestillten Säugling bekannt, daher ist die Unterbrechung des Stillens bei kurzfristiger Einnahme nicht zwingend notwendig [Hale et al., 2004; Nassen et al., 2014; Hale und Baker, 2018]. Da Acetylsalicylsäure (ASS) in höheren Konzentrationen in die Muttermilch übertritt (Tabelle 3), sollte es in der Stillzeit möglichst vermieden werden [Ude und Burkhardt, 2020]. Das gilt besonders in den ersten Lebenswochen, da hier die plasmatische Gerinnung beim Neugeborenen erst aufgebaut wird und so Blutungskomplikationen durch die Thrombozytenaggregationshemmung nicht ausgeschlossen werden können. Als Einzelgabe kann ASS aber eingesetzt werden [Schäfer, 2010].
Obwohl es zu Paracetamol sehr unterschiedliche Angaben zur RID gibt (Tabelle 3), wird es als sicheres und verträgliches Analgetikum eingestuft [Notarianni et al., 1987; Fatori Popovic et al., 2016; Fischer et al., 2019; Hale und Baker, 2020; Ude und Burkhardt, 2020]. Nimmt die Mutter Paracetamol in einer üblichen Menge ein, liegt die Konzentration beim Säugling weit unter der pädiatrisch-therapeutischen Dosis [Mitchell et al., 2020]. Im Übrigen ist Paracetamol bei Neugeborenen weniger hepatotoxisch als bei älteren Kindern, da erstere eine geringere Aktivität der Cytochrom-P450-Enzyme haben, die Paracetamol in toxische Metabolite umwandeln [Sachs, 2013].
Novaminsulfon beziehungsweise Metamizol kann unter anderem bei akuten postoperativen Schmerzen eingesetzt werden. In der Stillzeit muss vor allem eine wiederholte Anwendung des Wirkstoffs vermieden werden, da Novaminsulfon auch wegen der deutlich geringeren Proteinbindung (circa 60 Prozent) eher in größerer Menge in die Muttermilch übergeht und ein Risiko für den gestillten Säugling daher nicht ausgeschlossen werden kann [Fischer et al., 2018; Ude und Burkhardt, 2020]. Bei wiederholter Anwendung wird ein mögliches Zyanoserisiko durch eine Methämoglobinbildung beim Säugling diskutiert [Schäfer, 2010; Ude und Burkhardt, 2020]. Bei Einzelanwendungen wird empfohlen, dass die Stillende die Muttermilch für die nächsten 48 Stunden auffängt oder abpumpt und anschließend verwerfen sollte [Ude und Burkhardt, 2020].
Codein wird wie alle Opioide in der Stillzeit als kritisch angesehen [Mitchell et al., 2020]. Dies gilt besonders, nachdem 2006 ein Fallbericht über den Todesfall eines Säuglings publiziert wurde, dessen Mutter während der Stillzeit Codein eingenommen hatte [Koren et al., 2006]. In einer 2012 veröffentlichten Kohortenstudie mit 210 stillenden Müttern wurde bei 16,7 Prozent der Säuglinge eine Sedierung festgestellt [Lam et al., 2012].
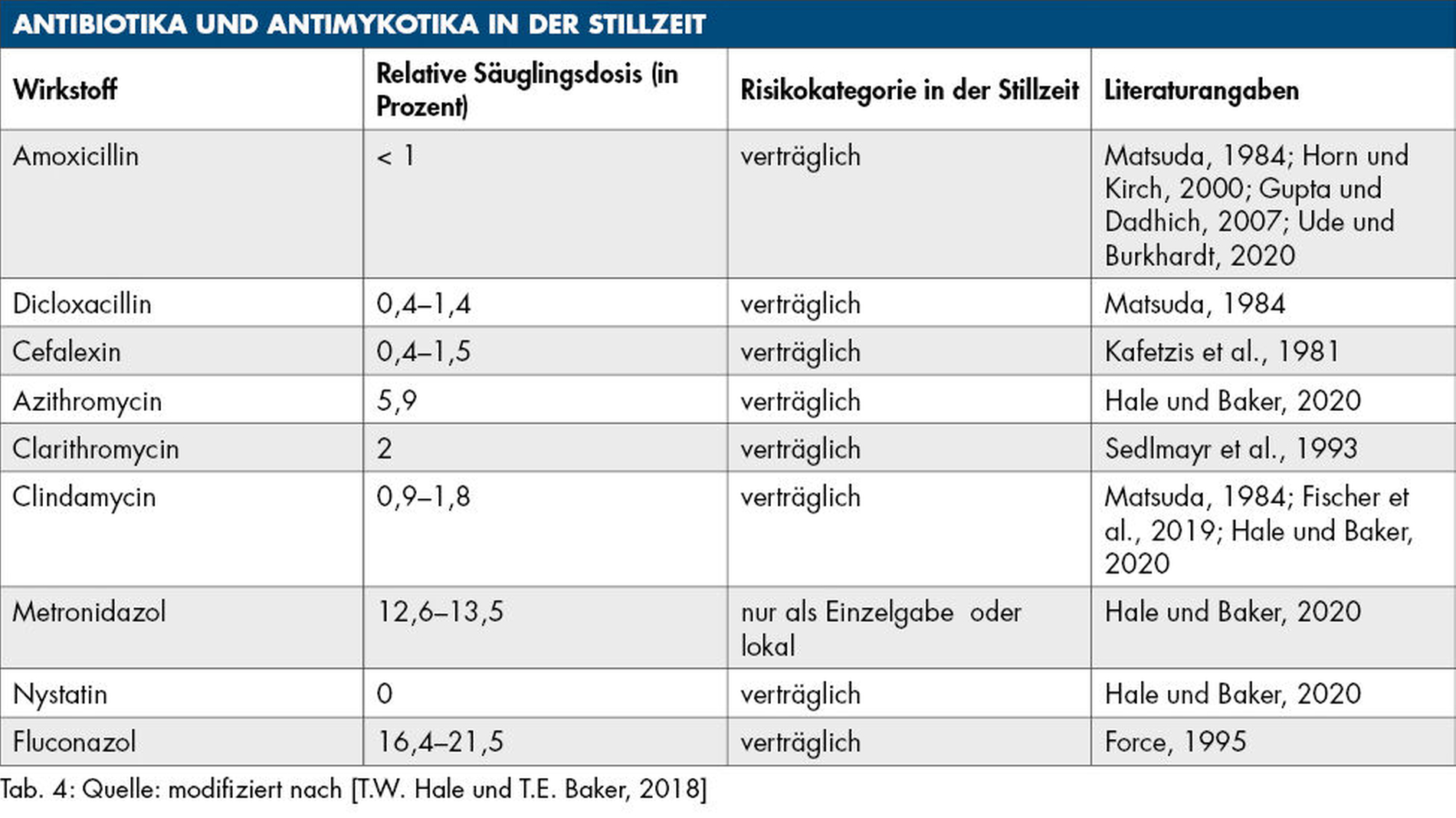
Antibiotika und Antimykotika
Alle in der Zahnmedizin gängigen Antibiotika wurden auch bei stillenden Müttern in ausreichendem Maße untersucht (Tabelle 4). Grundsätzlich können alle Antibiotika, die die Mutter in der Stillzeit einnimmt, bei ihr wie beim Säugling durch eine Beeinflussung der Darmflora zu unerwünschten Wirkungen wie Durchfällen und Pilzinfektionen führen [Schäfer und Koch, 1998; Horn und Kirch, 2000; Fischer et al., 2019; Ude und Burkhardt, 2020]. Nach einer Antibiotikagabe ist der Gehalt an Bifidobakterien in der Muttermilch vermindert, was wiederum die Zusammensetzung des kindlichen Darmmikrobioms beeinflusst [Lemas et al., 2016].
Die Penicillinderivate als gebräuchlichste Gruppe wie auch die Cephalosporine bleiben aufgrund ihrer hohen Polarität weitestgehend aus dem Milchkompartiment ausgeschlossen und die RID-Werte sind entsprechend niedrig (Tabelle 4) [Hale und Baker, 2020]. Mittel der zweiten Wahl sind Makrolide, die allerdings bei einem bestehenden Ikterus des Neugeborenen nicht angewendet werden sollten [Horn und Kirch, 2000; Ude und Burkhardt, 2020]. Clindamycin wird aufgrund der etwas höheren Wahrscheinlichkeit von kindlichen Stuhlveränderungen ebenfalls als Mittel der zweiten Wahl angesehen [Hale und Baker, 2020]. Laut Embryotox erfordern eine lokale Metronidazol-Therapie oder Einzelgaben keine Einschränkung des Stillens. Hale und Baker empfehlen hingegen, nach einer Einzelgabe die Milch für zwölf bis 24 Stunden zu verwerfen [Hale und Baker, 2020]. Die Indikation zur mehrtägigen oder intravenösen Therapie mit Metronidazol sollte in der Stillzeit kritisch gestellt werden.
Nystatin ist ein bewährtes Mittel zur lokalen Behandlung von oralen Candidainfektionen. Es wird kaum resorbiert und geht daher nicht in die Muttermilch über (Tabelle 4). Im Gegensatz dazu penetriert Fluconazol in relativ hohem Maß in die Muttermilch und wird deshalb auch stärker vom gestillten Säugling aufgenommen (Tabelle 4). Trotz der hohen RID, die deutlich über der nominalen Sicherheitsgrenze von zehn Prozent liegt [Force, 1995], bewegt sich die Konzentration für Säuglinge weit unter der klinischen Dosis, die Säuglingen direkt verabreicht wird [Hale und Baker, 2020].
Lokalanästhetika
Die lokale Verabreichung von Lokalanästhetika (LA) in der Stillzeit ist sicher, da diese große polarisierende Moleküle sind, die nur schwer in die Milchgänge diffundieren können [Dalal et al., 2014; Fischer et al., 2019]. Obwohl die Datenlage hier relativ dürftig ist, kann laut der Datenbank Embryotox davon ausgegangen werden, dass bei indikationsgerechter Anwendung im Rahmen der üblichen zahnärztlichen Behandlungen keine Probleme auftreten. Dies gilt gerade auch für die Kombinationen mit Adrenalin [Horn und Kirch, 2000], das die lokale Resorptionsgeschwindigkeit und Wirkstoffspitzen reduziert.
Die meisten Veröffentlichungen zur Stillzeit liegen für Lidocain und Bupivacain vor [Ortega et al., 1999; Guiliani et al. 2001]. Hier wurden keine negativen klinischen Effekte auf Mutter oder Kind beobachtet. Für Articain und Mepivacain liegen diesbezüglich keine Untersuchungen vor. Nach Angaben der Datenbank Embryotox geht man im Fall von Mepivacain aufgrund der strukturell starken Ähnlichkeit zu Bupivacain von ähnlich niedrigen Übergangsraten in die Muttermilch aus. Bei Articain stellen die hohe Plasmaproteinbindung von 94 Prozent in Kombination mit der sehr kurzen Eliminationshalbwertszeit von 20 Minuten [Daubländer und Kämmerer, 2011] wesentliche Sicherheitsfaktoren für einen geringen Wirkstofftransfer beim Stillen dar. Generell empfiehlt es sich, zahnärztliche Lokalanästhesien direkt nach der Stillmahlzeit vorzunehmen, um den physiologischen Abbau der Anästhetika im mütterlichen Plasma bis zum nächsten Stillen auszunutzen.
Fazit
Fast alle Arzneimittel, die in der Zahnmedizin angewendet werden, gehen zu einem gewissen Grad in die Muttermilch über, fast immer jedoch in einer subklinischen Dosis. Zu beachten ist, dass es bei Säuglingen große pharmakokinetische Unterschiede im Vergleich zu Erwachsenen gibt. Besonders empfindlich gegenüber Arzneimitteln in der Muttermilch sind Frühgeborene und schwache Säuglinge, während ältere Säuglinge weniger anfällig sind. Da die relative Säuglingsdosis (RID) der meisten Medikamente beim Säugling unter einem Wert von zehn Prozent liegt, ist es in der Regel nicht notwendig, dass die Mutter ihre Milch abpumpt und verwirft. Eine Arzneimittelexposition des Kindes lässt sich fast immer wirksam vermeiden, wenn die Mutter ein paar Stunden abwartet, bis der Wirkstoffspiegel im Plasma gesunken ist. Lediglich bei der Gabe von Metamizol, von ASS und von codeinhaltigen Analgetika sowie Metronidazol bestehen Risiken für den gestillten Säugling, die beachtet werden müssen.
Literaturliste
Anderson, G. D. (2006). Using pharmacokinetics to predict the effects of pregnancy and maternal-infant transfer of drugs during lactation. Expert Opin Drug Metab Toxicol 2(6): 947-960. Doi: 10.1517/17425255.2.6.947.
Bennett, P. N. Use of the Monographs on Drugs. In: Drugs and Human Lactation (Hrsg. P.N. Bennett). 2nd. Edition. Amsterdam, Elsevier, 1996.
Brettschneider, A. K., von der Lippe, E., et al. (2018). Stillverhalten in Deutschland – Neues aus KiGGS Welle 2. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 61(8): 920-925. Doi: 10.1007/s00103-018-2770-7.
Bundesinstitut für Risikobewertung (BfR) (2020) Empfehlungen zur Stilldauer - Einführung von Beikost. www.bfr.bund.de/de/empfehlungen_zur_stilldauer___einfuehrung_von_beikost-54044.html (Zugriff am 5.5.2023).
Dalal, P. G., Bosak, J. et al. (2014). Safety of the breast-feeding infant after maternal anesthesia. Paediatr Anaesth 24(4): 359–371. Doi:org/10.1111/pan.12331.
Daubländer, M. und P. W. Kämmerer. Lokalanästhesie in der Zahnmedizin. Berlin, Sanofi, 2011.
Fatori Popovic, S., Lübbers, H.T., et al. (2016). Schwangerschaft und Stillzeit: Welche Lokalanästhetika und Analgetika? Swiss Dent J 126(3): 260–261.
Fischer, A., Ortner, C., et al. (2019). Welche Medikamente sind in der Stillzeit erlaubt? Eine Übersicht für den Anästhesisten, Geburtshelfer und Kinderarzt. Wien Med Wochenschr 169(3-4): 45-55. Doi: 10.1007/s10354-018-0637-z.
Force, R. W. (1995). Fluconazole concentrations in breast milk. Pediatr Infect Dis J 14(3): 235-236. Doi: 10.1097/00006454-199503000-00012.
Giuliani, M., Grossi, G. B., et al. (2001) Could local anesthesia while breast-feeding be harmful to infants? J Pediatr Gastroenterol Nutr 32(2): 142-144. Doi: 10.1097/00005176-200102000-00009.
Gupta, A. und J. Dadhich (2007). Maternal Medication and Breastfeeding. Journal of Neonatology 21(1): 10-12. Doi:10.1177/0973217920070103.
Hale, T. W. und T. E. Baker (2018). Stillen und die Anwendung von Medikamenten. In Stillen und Muttermilch - Von den biochemischen Grundlagen bis zur gesellschaftlichen Bedeutung. The Global Health Network. Doi:org/10.21428/3d48c34a.387b8cc2. (Zugriff am 6.5.2023).
Hale, T. W., McDonald, R., et al. (2004). Transfer of celecoxib into human milk. J Hum Lact 20(4): 397-403. Doi: 10.1177/0890334404269875.
Horn, B. und W. Kirch (2000). Zahnärztlich relevante Medikamente in Schwangerschaft und Stillzeit. Zahnärztl Mitt 90(13): 1610–1614.
Horta, B. L. und C. G. Victora. Long-term effects of breastfeeding: a systematic review. World Health Organization (WHO), Geneva, 2013.
Hotham, N. und E. Hotham (2015). Drugs in breastfeeding. Aust Prescr 38(5):156-159. Doi: 10.18773/austprescr.2015.056.
Ilett, K. F., Kristensen, J. H., et al. (1997). Drug distribution in human milk. Aust Prescr 20: 35-40.
Kafetzis, D. A., Siafas, C. A., et al. (1981). Passage of cephalo-sporins and amoxicillin into the breast milk. Acta Paediatr Scand 70(3): 285-288. Doi: 10.1111/j.1651-2227.1981.tb16553.x.
Koletzko, B., Bauer C. P., et al. (2016). Ernährung und Bewegung von Säuglingen und stillenden Frauen. Aktualisierte Handlungsempfehlungen von „Gesund ins Leben – Netzwerk Junge Familie“, eine Initiative von IN FORM. Monatsschr Kinderheilkd 164(9): 765-789.
Koren, G., Cairns, J., et al. (2006). Pharmacogenetics of morphine poisoning in a breastfed neonate of a codeine-prescribed mother. Lancet 368(9536): 704.
Kuminek, F., Kiess, W., et al. (2021). Zusammenhang zwischen Stilldauer und early childhood caries. Oralprophylaxe Kinderzahnheilkd 43: 40–48.
Lam, J., Kelly, L., et al. (2012). Central nervous system depression of neonates breastfed by mothers receiving oxycodone for postpartum analgesia. J Pediatr 160(1): 33-37.e2. Doi: 10.1016/j.jpeds.2011.06.050.
Lemas, D. J., Yee, S., et al. (2016). Exploring the contribution of maternal antibiotics and breastfeeding to development of the infant microbiome and pediatric obesity. Semin Fetal Neonatal Med 21(6): 406–409. Doi: 10.1016/j.siny.2016.04.013.
Matsuda, S. (1984) Transfer of antibiotics into maternal milk. Biol Res Pregnancy Perinatol 5(2): 57-60.
Mitchell, J., Jones, W., et al. (2020). Guideline on anaesthesia and sedation in breastfeeding women 2020: Guideline from the Association of Anaesthetists. Anaesthesia 75(11): 1482-1493. Doi: 10.1111/anae.15179.
Mittelhammer, M. (2023). Stillen und Mundgesundheit. Zahnärztl Mitt 113(3): 106-108.
Nassen, C. A., Schaefer, C., et al. (2014). Anästhesie und Analgesie in der Stillperiode. Kriterien der Medikamentenauswahl. Anaesthesist 63(5): 415-421. Doi: 10.1007/s00101-014-2311-1.
Notarianni, L. J., Oldham, H. G., et al. (1987). Passage of paracetamol into breast milk and its subsequent metabolism by the neonate. Br J Clin Pharmacol 24(1): 63-67. Doi: 10.1111/j.1365-2125.1987.tb03137.x#.
Ortega, D., Viviand, X., et al. (1999). Excretion of lidocaine and bupivacaine in breast milk following epidural anesthesia for cesarean delivery. Acta Anaesthesiol Scand 43(4): 394-397. Doi: 10.1034/j.1399-6576.1999.430405.x.
Robert Koch-Institut (RKI) (2020). AdiMon-Themenblatt Stillen (Stand: 15. Juli 2020).
Sachs, H. C. (2013). Comittee on drugs. The transfer of drugs and therapeutics into human breastmilk: an update on selected topics. Pediatrics 132(3): e796-809. Doi: 10.1542/peds.2013-1985.
Schäfer, C. (2010). Stillen und Arzneimittel – geht das? Fortbildungstelegramm Pharmazie 4(3): 57-67.
Schäfer, C. und I. Koch (1998). Die Beratung der Schwangeren und Stillenden zum Medikamentenrisiko. Dtsch Arztebl 95(42): 2637-2642.
Sedlmayr, T., Peters, F., et al. (1993). Clarithromycin, ein neues Makrolid-Antibiotikum. Wirksamkeit bei puerperalen Infektionen und Übertritt in die Muttermilch. Geburtshilfe Frauenheilkd 53(7): 488-491.Doi: 10.1055/s-2007-1022919.
Ude, M. und M. Burkhardt. Beratung in der Stillzeit – Arzneimittel und Ernährung. Consilium Hebamme Heft 3, 2. Aufl. Heppenheim, Pädia GmbH, 2020.