Zerebraler Abszess nach odontogener Infektion bei vermeintlicher Penicillinallergie
Eine 72-jährige Patientin stellte sich mit einer paramandibulären Schwellung rechts vor. Anamnestisch bestand eine bekannte Penicillinallergie mit einem vor mehr als zehn Jahren aufgetretenem Exanthem im Rahmen der Antibiotikagabe. Die Patientin wies relevante Vorerkrankungen auf (chronisch obstruktive Lungenerkrankung, periphere arterielle Verschlusserkrankung, arterielle Hypertonie, mikrozytäre Anämie, Vorhofflimmern) und hatte eine ausgeprägte Raucheranamnese mit mehr als 50 Packyears.
Bereits im Jahr 2017 war bei ihr eine purulente Osteomyelitis des linken Unterkiefers aufgetreten, die stationär, mit mehrfachen operativen Revisionen in Intubationsnarkose, behandelt werden musste. Damals war in den intraoperativ durchgeführten mikrobiologischen Abstrichen ein Streptococcus intermedius nachgewiesen worden.
Die aktuelle Infektion im rechten Unterkiefer entwickelte sich nach alio loco erfolgter Extraktion des Zahnes 43. Aufgrund eines deutlich reduzierten Allgemeinzustands und auffälliger Laborwerte (C-reaktives Protein 22,4 mg/dl, Leukozyten 17,9 G/l, Hämoglobin 8,8 g/dl, Kalium 2,7 mmol/l) erfolgte die stationäre Aufnahme zur weiteren Behandlung. Initial wurde eine intraorale Inzision in Lokalanästhesie durchgeführt und eine intravenöse Antibiotikumtherapie mit Moxifloxacin bei anamnestischer Penicillinallergie eingeleitet.
Im Verlauf entwickelte sich eine progrediente Schwellung mit eingeschränkter Mundöffnung und dem klinischen Bild eines perimandibulären Abszesses. Die Abszesseröffnung erfolgte in Intubationsnarkose mit einer extraoralen Inzision, Drainage und intraoraler modellierender Osteotomie im vierten Quadranten. Der mikrobiologische Befund bestätigte erneut einen Clindamycin- und Makrolid-resistenten Streptococcus intermedius, histologisch bestand eine floride Osteomyelitis.
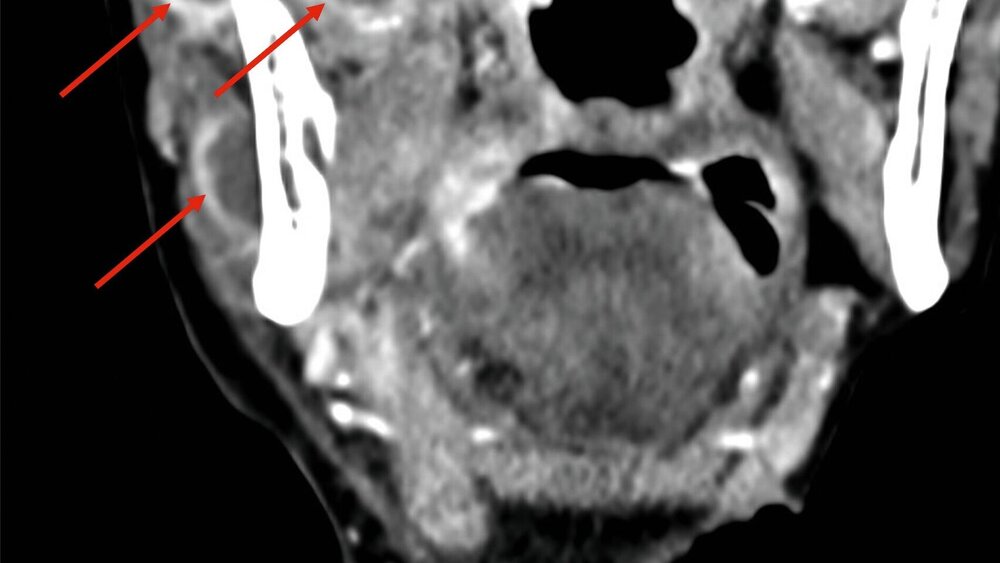
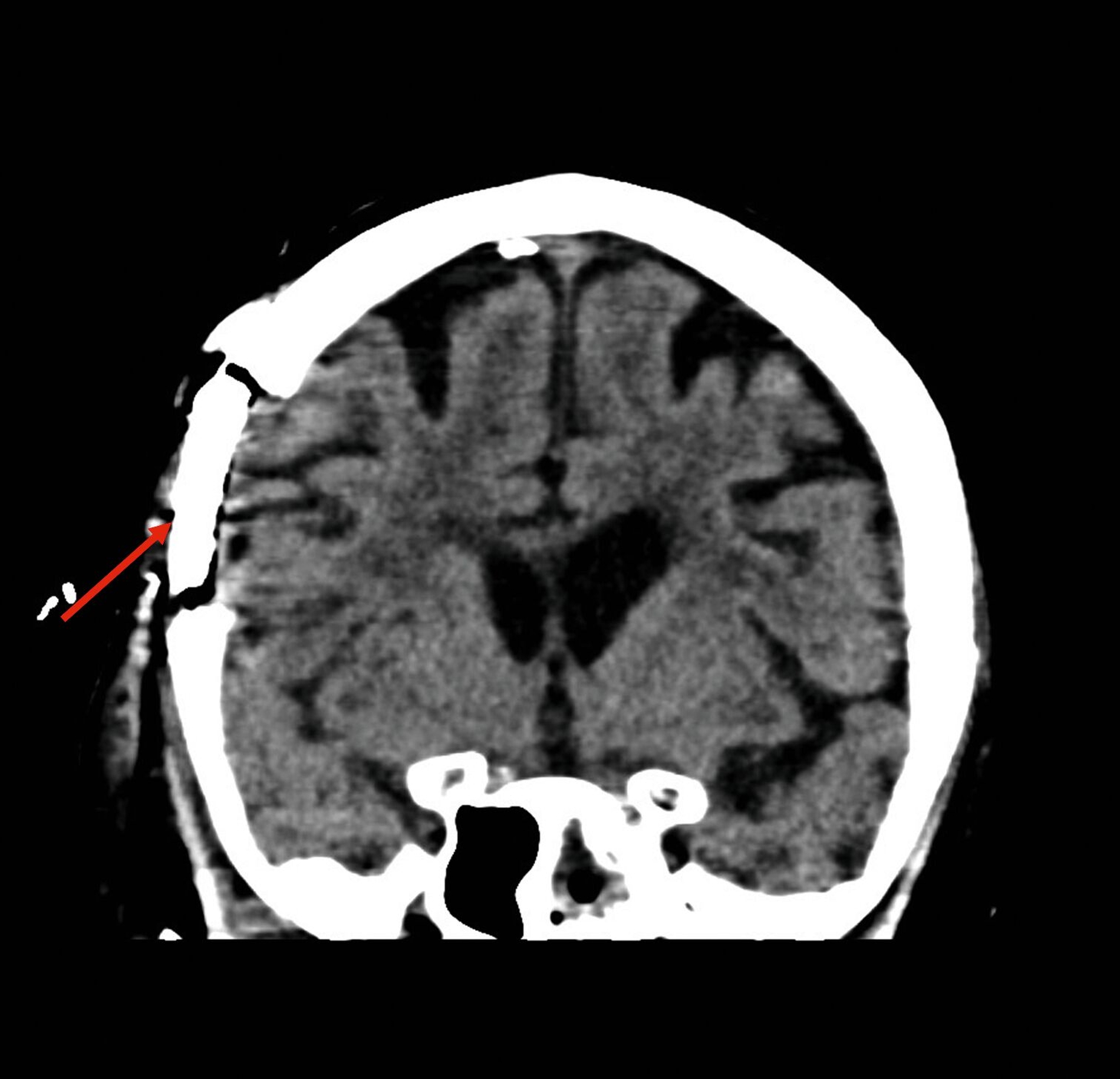
Eine im Verlauf angefertigte CT-Diagnostik zeigte trotz der initialen chirurgischen Eingriffe multiple Abszessformationen medial und lateral angrenzend an den Ramus mandibulae rechts sowie kaudal an die Lamina lateralis des Processus pterygoideus des Os sphenoidale (Abbildung 1).
Aufgrund der zwischenzeitlich deutlich gebesserten Klinik und einer ablehnenden Haltung der Patientin gegenüber einem weiteren operativen Eingriff wurde zunächst unter engmaschiger Kontrolle konservativ weiterbehandelt. Eine chirurgische Revision erfolgte zu diesem Zeitpunkt nicht.
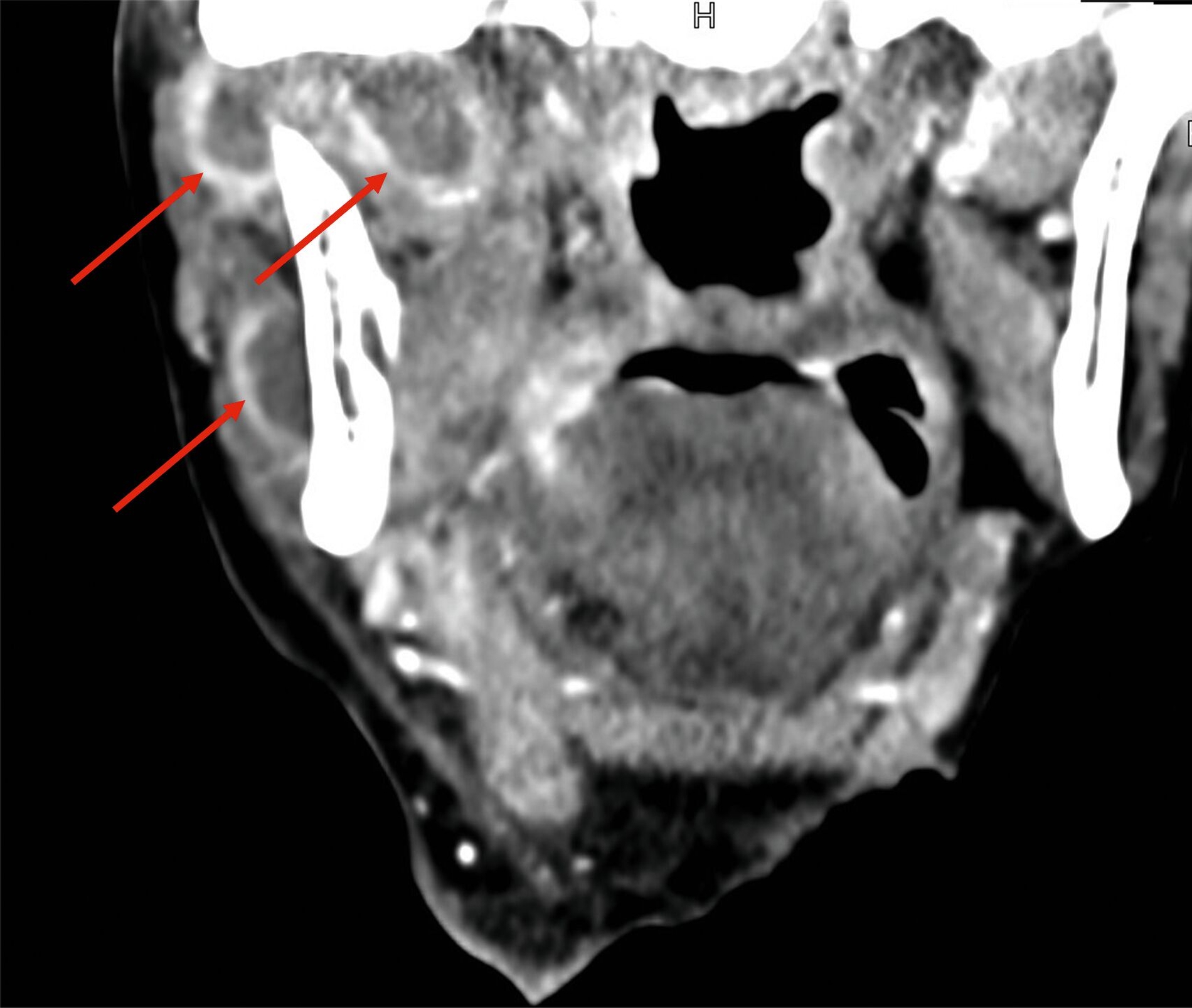
Etwa zwei Wochen nach der Entlassung wurde die Patientin mit ausgeprägter perimandibulärer Schwellung, eingeschränkter Mundöffnung, freiliegendem Knochen im rechten Unterkiefer sowie Allgemeinsymptomen wie Abgeschlagenheit und Fieber wieder stationär aufgenommen. Erneut erfolgte eine submandibuläre Inzision und Drainage in Intubationsnarkose. Die postoperative CT-Bildgebung zeigte nun eine weitgehend suffiziente Drainage der Abszesshöhlen (Abbildung 2). Mikrobiologisch zeigte sich erneut ein Streptococcus intermedius mit Clindamycin-Resistenz, ergänzt durch Enterococcus faecalis und eine anaerobe Mischflora.
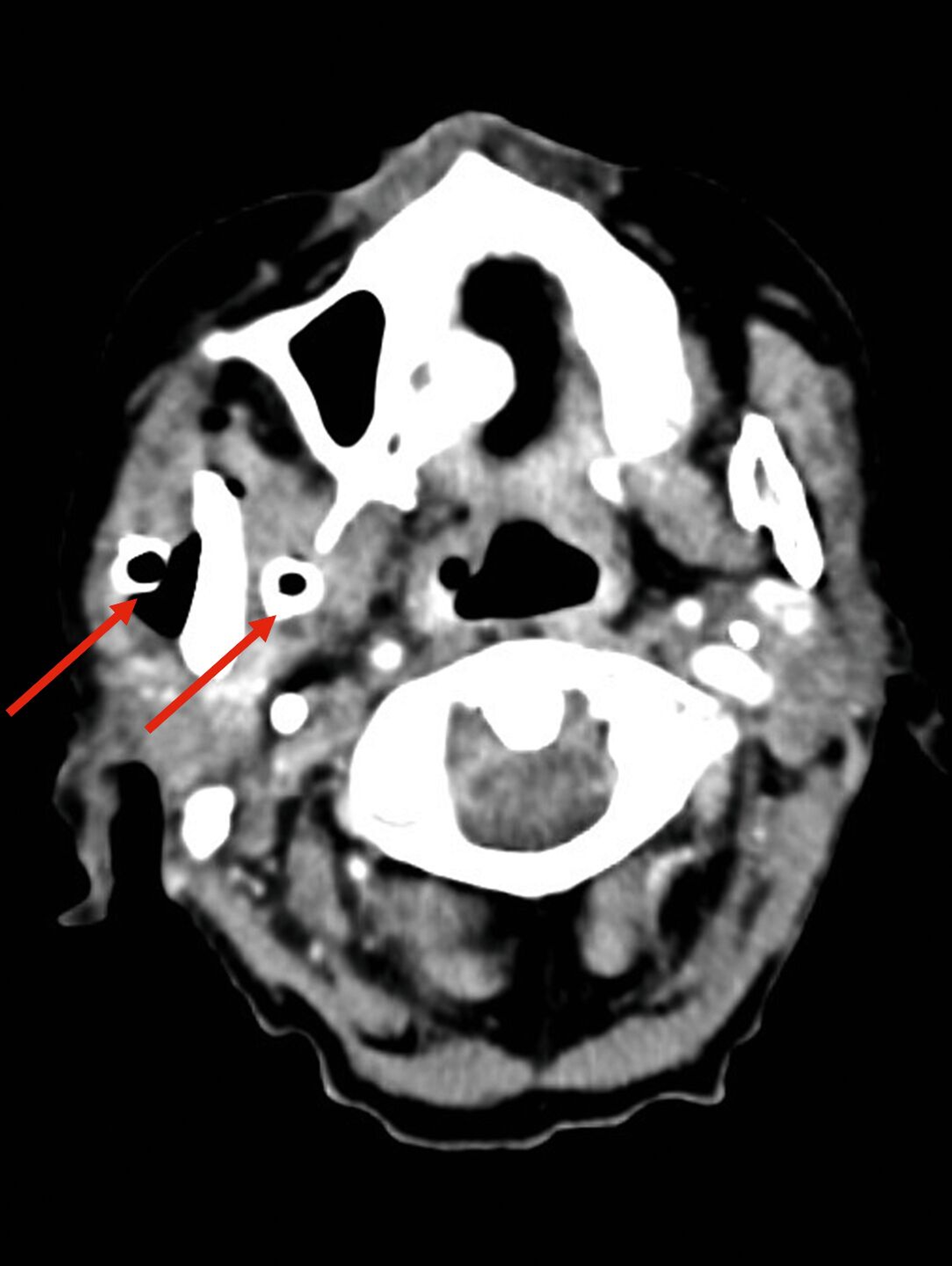
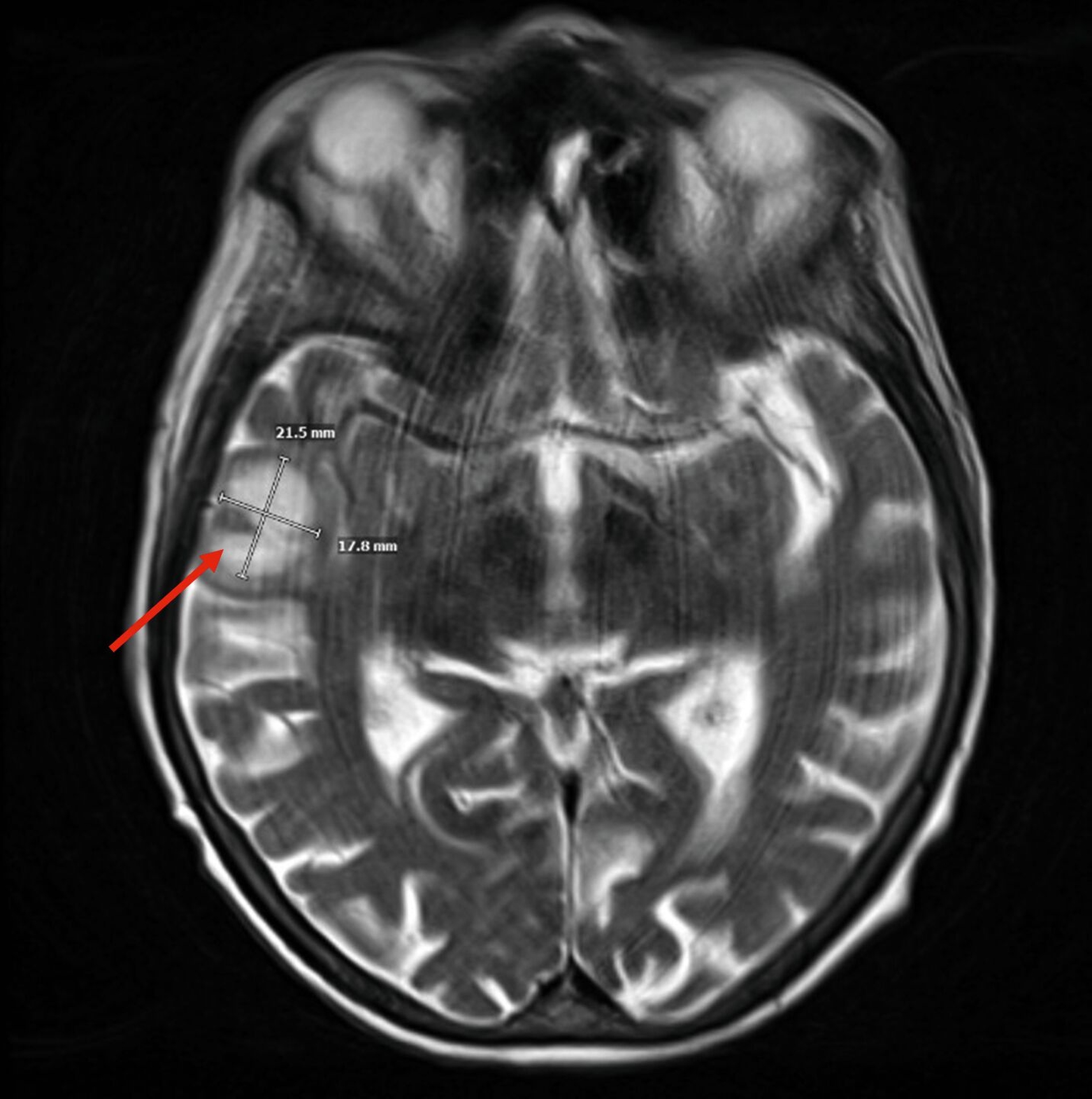
Im weiteren stationären Verlauf fiel am neunten postoperativen Tag eine zunehmende Somnolenz mit Wortfindungsstörungen und Wesensveränderung auf. Die zerebrale Schnittbildgebung zeigte eine hyperintense Läsion temporal rechts mit Verdacht auf einen zerebralen Abszess sowie eine Verschattung im Sinus sphenoidalis (Abbildung 3). Am selben Tag erfolgte durch die Kollegen der Neurochirurgie eine osteoplastische Kraniotomie mit Drainage des Hirnabszesses sowie eine Drainage des Keilbeinsinus durch die Kollegen der HNO (Abbildung 4). In beiden Lokalisationen wurde erneut Streptococcus intermedius als dominierende Bakterienspezies identifiziert – mit Resistenz gegenüber Clindamycin, jedoch guter Empfindlichkeit gegenüber Ampicillin.
Angesichts des klinischen Bildes und der Resistenzlage wurde nach PEN-FAST-orientierter Einschätzung eine stationäre Provokation mit Ampicillin durchgeführt, die komplikationslos verlief. Die Patientin konnte von der Penicillinallergie delabelt werden und erhielt im Anschluss eine gezielte antibiotische Therapie mit Ampicillin, unter der sich die dargestellte Infektsymptomatik deutlich zurückbildete.
Noch im Prämedikationsprotokoll war die Patientin mit „hackt zu Hause selbst Holz“ als aktiv beschrieben worden – der komplexe Verlauf während des stationären Aufenthalts führte jedoch zu einem deutlich ausgeprägten körperlichen Abbau. Durch diesen Mobilitätsverlust kam es im Verlauf zu einem Sturz mit pertrochantärer Femurfraktur, die osteosynthetisch versorgt wurde. Die Patientin befindet sich in neurologischer, unfallchirurgischer und MKG-chirurgischer Nachsorge; eine rehabilitative Weiterbehandlung zur Wiedererlangung der Mobilität und Selbstständigkeit ist angestrebt.
Diskussion
Dieser Fall zeigt exemplarisch, wie eine odontogene Infektion zu schwerwiegenden, interdisziplinär relevanten Komplikationen führen kann – insbesondere, wenn eine gezielte Antibiotikatherapie durch eine vermeintliche Penicillinallergie erschwert wird.
Die chirurgische Drainage stellt nach wie vor die zentrale Maßnahme in der Behandlung odontogener Abszesse dar [Dirks et al., 2004; Kumari et al., 2018; Böttger et al., 2020]. In der Praxis jedoch kann eine suffiziente chirurgische Sanierung vor allem bei ausgedehnten oder multiplen tief gelegenen Abszedierungen anatomisch anspruchsvoll sein. Bei komplexen Befundkonstellationen kann eine ergänzende CT-Diagnostik entscheidend zur Beurteilung der Ausdehnung und der Lokalisation beitragen – wobei der perimandibuläre Abszess in der MKG-Chirurgie in der Regel klinisch diagnostiziert wird [Gonzalez-Beicos et al., 2012; Wabik et al., 2014; Brucker et al., 2015].
Typische Zeichen für einen perimandibulären Abszess sind eine derbe, druckdolente Schwellung mit nicht mehr vollständig durchtastbarem Unterkieferrand, eine eingeschränkte Mundöffnung und Schluckbeschwerden. Darüber hinaus spielt die CT (beziehungsweise MRT) eine zentrale Rolle in der Ausbreitungsdiagnostik – etwa bei einer neu aufgetretenen Bewusstseinsveränderung, einer drohenden Atemwegseinengung oder klinischer Progredienz trotz Therapie [Dalla Torre et al., 2013; Rautaporras et al., 2023].
Gerade bei schweren Verläufen wie in diesem Fall ist eine enge interdisziplinäre Zusammenarbeit entscheidend. Neben der MKG-chirurgischen Versorgung waren hier sowohl die Neurochirurgie als auch die HNO, die Unfallchirurgie und die Mikrobiologie ins Behandlungskonzept eingebunden. Solche komplexen Verläufe zeigen, wie wichtig es ist, im richtigen Moment über den fachlichen Tellerrand hinauszuschauen und rechtzeitig spezialisierte Kolleginnen und Kollegen hinzuzuziehen – insbesondere bei unklaren Symptomen oder bei Anzeichen systemischer Ausbreitung.
Zerebrale Abszesse im Rahmen odontogener Infektionen sind selten, aber potenziell lebensbedrohlich. Wie häufig aus einer odontogenen Infektion tatsächlich ein Hirnabszess entsteht, ist aufgrund der begrenzten Datenlage derzeit nicht valide quantifizierbar. Die vorhandene Literatur besteht überwiegend aus Fallberichten und kleinen Fallserien. In einem systematischen Review mit 135 Fällen konnte in 17 Prozent der Fälle ein mikrobiologischer Zusammenhang zum oralen Fokus nachgewiesen werden; die Letalität lag bei 6,6 Prozent [Lisboa et al., 2022]. In einer retrospektiven Studie mit 87 Hirnabszess-Patienten war in elf Prozent der Fälle ein odontogener Fokus nachweisbar. Bei Fällen ohne identifizierbare Ursache fanden sich in rund zwei Dritteln vor allem oral vorkommende Bakterienspezies wie Streptococcus anginosus und Streptococcus intermedius, was auf eine möglicherweise unterschätzte Rolle oraler Infektionen hinweist [Roy et al., 2023].
Auch andere systemische Komplikationen wie cavernöse Sinusthrombose, Orbitaabszesse, Pleuraempyem, Pneumonie, Leberabszesse, Mediastinitis, Sepsis oder nekrotisierende Fasziitis sind im Zusammenhang mit odontogenen Infektionen beschrieben [Vijayan et al., 2012; Gunaratne et al., 2018; Schimmel et al., 2019; Weise et al., 2019; Caranfa et al., 2021; Escobedo et al., 2021].
Wenn eine systemische Antibiotikatherapie erforderlich ist und keine Kontraindikation besteht, gelten bei odontogenen Infektionen Aminopenicilline in Kombination mit einem Betalaktamaseinhibitor – wie Amoxicillin/Clavulansäure – weiterhin als Mittel der ersten Wahl [Heim et al., 2021].Im vorliegenden Fall wurde bei anamnestischer Penicillinallergie nicht die in der bisherigen S3-Leitlinie „Odontogene Infektionen“ empfohlene kalkulierte Initialtherapie mit Clindamycin gewählt, sondern eine empirische Behandlung mit dem Fluorchinolon-Antibiotikum Moxifloxacin durchgeführt.
Ausschlaggebend für diese individuelle Therapieentscheidung war die Kombination aus ausgeprägter, progredienter lokaler Entzündungsreaktion mit verschlechtertem Allgemeinzustand, fortgeschrittenem Lebensalter und mehreren relevanten Vorerkrankungen, die eine rasche und breit wirksame Therapie erforderlich machten. Moxifloxacin erschien unter diesen Umständen – auch aufgrund seiner guten Wirksamkeit im erwarteten Keimspektrum einschließlich anaerober Erreger – als eine sinnvolle therapeutische Option, die in dieser Konstellation gegenüber Clindamycin bevorzugt wurde [Sebastian et al., 2019; Wang et al., 2022]. Dabei wurden die möglichen Risiken von Fluorchinolonen – wie Tendopathien, neurologische Nebenwirkungen und eine QT-Zeit-Verlängerung – im Sinne einer individuellen Nutzen-Risiko-Abwägung berücksichtigt, wie sie auch im Zusammenhang mit den Rote-Hand-Briefen von 2019 und 2023 thematisiert wurden [BfARrM, 2019; BfArM, 2023].
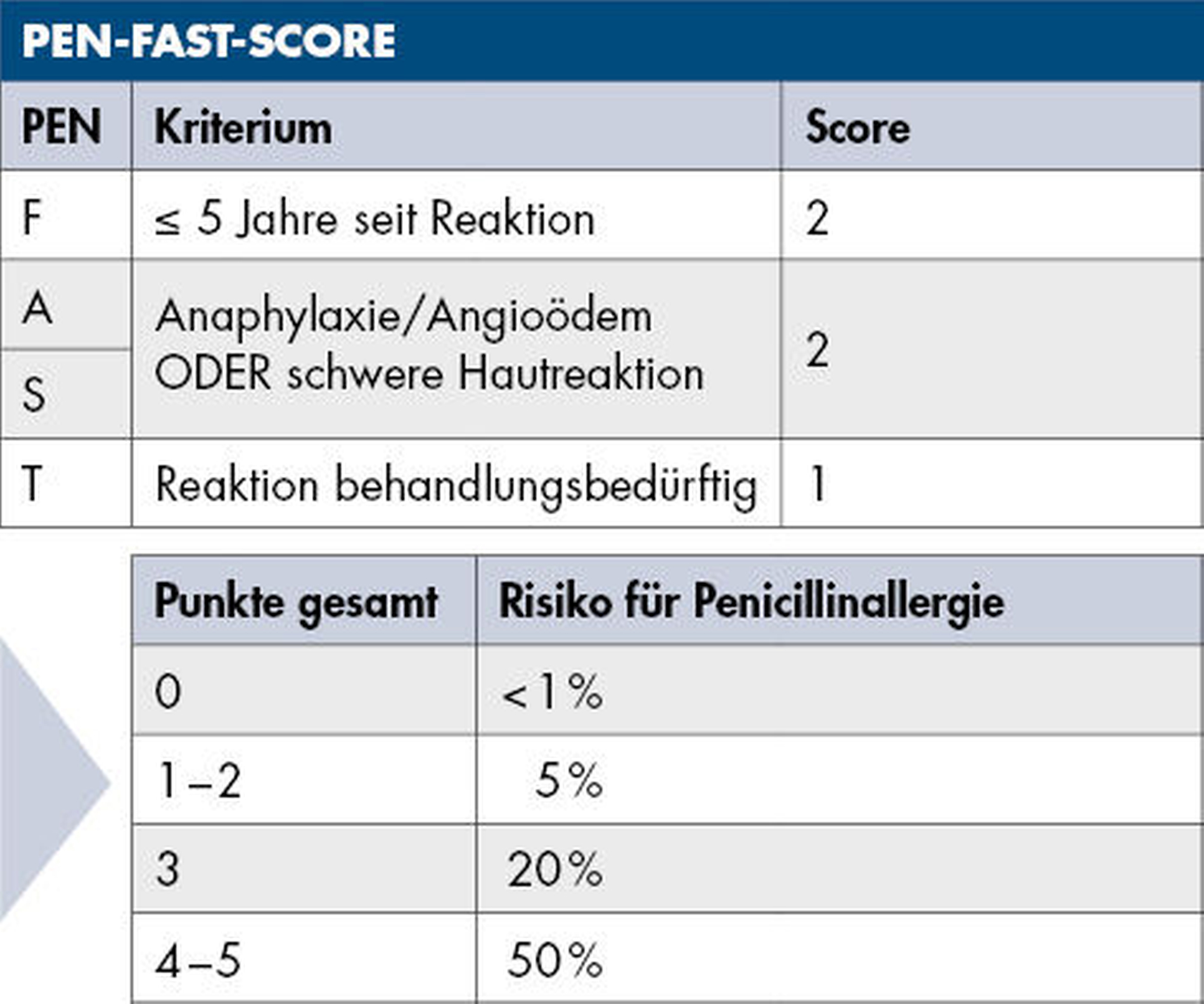
Vor dem Hintergrund der zunehmenden Resistenzentwicklung gegenüber Clindamycin und der Limitationen alternativer Therapieoptionen rückt die strukturierte Abklärung vermeintlicher Penicillinallergien zunehmend in den Fokus [Bigus et al., 2023; Chadha et al., 2023; Mahmoud et al., 2024]. In der aktuellen Literatur wird der Einsatz des PEN-FAST-Scores als effektives, klinisch praktikables Instrument zur Risikostratifizierung und zur Entscheidungsfindung hinsichtlich eines möglichen Delabelings empfohlen [Trubiano et al., 2020] (Abbildung 5). Auch Zahnärztinnen und Zahnärzten kann der PEN-FAST-Score als strukturierte Orientierung dienen, um bei anamnestischer Penicillinallergie das Risiko für eine echte Reaktion besser einzuschätzen. Clindamycin sollte dabei künftig restriktiv und ausschließlich bei begründetem klinischem Verdacht auf eine echte Penicillinallergie (zum Beispiel bei einem PEN-FAST-Score größer als 0) im Rahmen der kalkulierten Therapie odontogener Infektionen verordnet werden [Tran et al., 2025].
Fazit für die Praxis
Zerebrale Abszesse stellen eine seltene, aber potenziell lebensbedrohliche Komplikation odontogener Infektionen dar.
Eine suffiziente chirurgische Drainage bleibt zentral; ein CT beziehungsweise ein MRT sind bei komplexen Verläufen hilfreich.
Die strukturierte Risikobewertung einer anamnestischen Penicillinallergie mittels Scores wie PEN-FAST kann helfen, Patientinnen und Patienten sicher zu delabeln und eine leitliniengerechte Antibiotikatherapie zu ermöglichen.
Clindamycin sollte künftig nur noch bei einem begründeten Verdacht auf eine echte Penicillinallergie eingesetzt werden.
Die bevorstehende Aktualisierung der S3-Leitlinie „Odontogene Infektionen“ betont die Bedeutung einer resistenzgerechten Antibiotikatherapie und den kritischen Umgang mit Clindamycin.
Auch in der anstehenden Aktualisierung der S3-Leitlinie „Odontogene Infektionen“ wird der PEN-FAST-Score als klinisches Instrument zur Risikostratifizierung bei dokumentierter Penicillinallergie berücksichtigt. Die Leitlinienüberarbeitung legt dabei einen besonderen Schwerpunkt auf die zunehmende Resistenzlage, insbesondere gegenüber Clindamycin, sowie auf einen kritischeren und differenzierteren Umgang mit vermeintlichen Penicillinallergien, um eine adäquate kalkulierte Antibiotikatherapie sicherzustellen. Die anstehende Leitlinienaktualisierung setzt ein wichtiges Zeichen für einen differenzierten, resistenzbasierten und patientenorientierten Einsatz von Antibiotika – und fördert eine evidenzbasierte Versorgung in Zahnmedizin und Chirurgie.
Literaturliste
BfArM, Bundesinstitut für Arzneimittel und Medizinprodukte (2023). Rote-Hand-Brief zu systemisch und inhalativ angewendeten fluorchinolonhaltigen Antibiotika: Erinnerung an die Anwendungsbeschränkungen.
BfARrM, Bundesinstitut für Arzneimittel und Medizinprodukte (2019). Rote-Hand-Brief zu Fluorchinolon-Antibiotika: Schwerwiegende und anhaltende, die Lebensqualität beeinträchtigende und möglicherweise irreversible Nebenwirkungen.
Bigus, S., G. Russmüller, P. Starzengruber, H. Reitter and C. L. Sacher (2023). „Antibiotic resistance of the bacterial spectrum of deep space head and neck infections in oral and maxillofacial surgery - a retrospective study.“ Clin Oral Investig 27(8): 4687–4693.
Böttger, S., K. Lautenbacher, E. Domann, H. P. Howaldt, S. Attia, P. Streckbein and J. F. Wilbrand (2020). „Indication for an additional postoperative antibiotic treatment after surgical incision of serious odontogenic abscesses.“ J Craniomaxillofac Surg 48(3): 229–234.
Brucker, J. L. and L. R. Gentry (2015). „Imaging of head and neck emergencies.“ Radiol Clin North Am 53(1): 215–252.
Caranfa, J. T. and M. K. Yoon (2021). „Septic cavernous sinus thrombosis: A review.“ Surv Ophthalmol 66(6): 1021–1030.
Chadha, S., J. P. Troost and P. L. Shivers (2023). „Does thePenicillin Allergy Label Affect Outcomes of Complicated Odontogenic Infections?“ J Oral Maxillofac Surg 81(10): 1301–1310.
Dalla Torre, D., S. Brunold, I. Kisielewsky, F. R. Kloss and D. Burtscher (2013). „Life-threatening complications of deep neck space infections.“ Wien Klin Wochenschr 125(21-22): 680–686.
Dirks, S. J. and G. T. Terezhalmy (2004). „The patient with an odontogenic infection.“ Quintessence Int 35(6): 482–502.
Escobedo, M. F., L. M. Junquera, J. Megias, L. García-San Narciso, M. J. Fernández and S. Junquera (2021). „Mediastinitis of odontogenic origin. A serious complication with 80 years of history.“ Br J Oral Maxillofac Surg 59(6): 683–689.
Gonzalez-Beicos, A. and D. Nunez (2012). „Imaging of acute head and neck infections.“ Radiol Clin North Am 50(1): 73–83.
Gunaratne, D. A., E. A. Tseros, Z. Hasan, A. S. Kudpaje, A. Suruliraj, M. C. Smith, F. Riffat and C. E. Palme (2018). „Cervical necrotizing fasciitis: Systematic review and analysis of 1235 reported cases from the literature.“ Head Neck 40(9): 2094–2102.
Heim, N., B. Jürgensen, F. J. Kramer and V. Wiedemeyer (2021). „Mapping the microbiological diversity of odontogenic abscess: are we using the right drugs?“ Clin Oral Investig 25(1): 187–193.
Kumari, S., S. Mohanty, P. Sharma, J. Dabas, S. Kohli and C. Diana (2018). „Is the routine practice of antibiotic prescription and microbial culture and antibiotic sensitivity testing justified in primary maxillofacial space infection patients? A prospective, randomized clinical study.“ J Craniomaxillofac Surg 46(3): 446–452.
Lisboa, E. C. C., W. O. Silva, R. C. V. Rodrigues, S. C. Brum and F. R. F. Alves (2022). „The connection between brain abscess and odontogenic infections: A systematic review.“ Arch Oral Biol 135: 105360.
Mahmoud, R., S. Arbel, C. Ianculovici, O. Peleg, S. Kleinman and A. Shuster (2024). „Antimicrobial therapy in the management of odontogenic infections: the penicillin-allergic patient.“ Int J Oral Maxillofac Surg 53(3): 251–257.
Rautaporras, N., J. Uittamo, J. Furuholm, M. Marinescu Gava and J. Snäll (2023). „Deep odontogenic infections - Computed tomography imaging-based spreading routes and risk for airway obstruction.“ J Stomatol Oral Maxillofac Surg 124(4): 101424.
Roy, H., R. Bescos, E. McColl, U. Rehman, E. Cray, L. A. Belfield, K. D. Nweze, K. Tsang, W. Singleton, P. Whitfield and Z. Brookes (2023). „Oral microbes and the formation of cerebral abscesses: A single-centre retrospective study.“ J Dent 128: 104366.
Schimmel, T., H. Trawinski, T. Karlas, S. Wendt and C. Lübbert (2019). „[Polymicrobial liver abscesses and pleural empyema in a 40-year-old male after tooth extraction and closed periodontal treatment: A case report].“ Z Gastroenterol 57(5): 600–605.
Sebastian, A., P. G. Antony, M. Jose, A. Babu, J. Sebastian and A. Kunnilathu (2019). „Institutional microbial analysis of odontogenic infections and their empirical antibiotic sensitivity.“ J Oral Biol Craniofac Res 9(2): 133–138.
Tran, K., J. Lund, C. Sealy, D. Langley and J. Kisgen (2025). „PEN-FAST-ED: Utilizing the PEN-FAST decision tool to guide antibiotic prescribing in the emergency department.“ Am J Emerg Med 90: 124–128.
Trubiano, J. A., S. Vogrin, K. Y. L. Chua, J. Bourke, J. Yun, A. Douglas, C. A. Stone, R. Yu, L. Groenendijk, N. E. Holmes and E. J. Phillips (2020). „Development and Validation of a Penicillin Allergy Clinical Decision Rule.“ JAMA Intern Med 180(5): 745–752.
Vijayan, A., V. P. Sreejith, R. Surendran and G. Ahamed (2012). „Orbital abscess arising from an odontogenic infection.“ J Contemp Dent Pract 13(5): 740–743.
Wabik, A., B. K. Hendrich, J. Nienartowicz, M. Guziński and M. J. Sąsiadek (2014). „Odontogenic inflammatory processes of head and neck in computed tomography examinations.“ Pol J Radiol 79: 431–438.
Wang, P., Y. Huang and J. Long (2022). „A Five-Year Retrospective Study of 746 Cases with Maxillofacial Space Infection in Western China.“ Infect Drug Resist 15: 5099–5110.
Weise, H., A. Naros, C. Weise, S. Reinert and S. Hoefert (2019). „Severe odontogenic infections with septic progress - a constant and increasing challenge: a retrospective analysis.“ BMC Oral Health 19(1): 173.