Eine Pille gegen Schlafapnoe?
Unterkieferprotrusionsschienen (UPS) stellen neben der als Standardtherapie geltenden Behandlung mit Positivdruck (Continuous Positive Airway Pressure/CPAP) und neben weiteren Ansätzen wie Verhaltensmodifikation, myofunktioneller Therapie, chirurgischen Verfahren oder Stimulation des Nervus Hypoglossus eine bedeutende Säule in der Behandlung der Schlafapnoe dar [Veasey et al., 2019; Gottlieb et al., 2020].
Die meisten Patienten tolerieren UPS gut und bevorzugen sie gegenüber CPAP oder einem chirurgischen Verfahren. Es wird von Compliance-Raten zwischen 40 und 80 Prozent berichtet [Ferguson et al., 1997]. Die Therapie mit UPS wurde im Jahr 2021 in Deutschland in den Leistungskatalog der Gesetzlichen Krankenversicherung aufgenommen.
Zur OSA
Die obstruktive Schlafapnoe (OSA) ist eine weit verbreitete chronische schlafbezogene Atmungsstörung, die sich durch wiederholten Kollaps des oberen Atemwegs im Schlaf auszeichnet. Dies führt zu Schlafunterbrechungen, einer Entsättigung des Blutsauerstoffs und übermäßiger Tagesschläfrigkeit (Excessive Daytime Sleepiness, EDS), also ungewollter Einschlafneigung, gerade in monotonen Situationen, wie beispielsweise Sekundenschlaf am Steuer. Schlafapnoe geht außerdem mit einer erhöhten Mortalität [Balk et al., 2011] und Morbidität im Sinne von kardio- und cerebrovaskulären Erkrankungen, Diabetes und kognitiven Einschränkungen einher. Sie ist negativ mit der Lebensqualität und positiv mit Verletzungen im Straßenverkehr assoziiert [Jonas et al., 2017] und betrifft schätzungsweise eine Milliarde Menschen weltweit [Benjafiled et al., 2019].
Therapie ist Herausforderung für Patient und Zahnarzt
Wie bei der CPAP-Therapie bedeuten auch bei der UPS-Therapie die Langzeitadhärenz und der Umgang mit unerwünschten Nebenwirkungen eine große Herausforderung für die Patienten. Im Fall der UPS-Therapie stellt dies auch eine Herausforderung für den schlafmedizinisch tätigen Zahnarzt dar, der diese chronisch kranken Patienten in einer lebenslang konzipierten Therapiephase zahnärztlich begleitet [Patel et al., 2021; Saglam-Aydinatay et al., 2018; Sutherland et al., 2018].
Hinzu kommt, dass die Mainstream-Behandlungen mit CPAP oder UPS wegen medizinischer oder wirtschaftlicher Belange bei einem signifikanten Anteil der Patienten gar nicht durchführbar sind [Lee et al., 2023]. So sind UPS beispielsweise auf die Retention von Zähnen angewiesen, weshalb die Therapie stark von einem gesunden Zahnstatus abhängt [Marklund et al., 2019; McNicholas et al., 2022]. Neben den etablierten mechanischen Therapieinterventionen CPAP und UPS könnte deshalb die Pharmakotherapie eine einfach verfügbare und attraktive Alternative bei der OSA-Behandlung darstellen [Horner et al., 2017].
Die Pharmakotherapie der OSA galt jedoch lange Zeit als ein Tabu und wird bis heute in der AWMF-S3-Leitlinie „Nicht erholsamer Schlaf“ bis auf die beiden zentralnervösen Stimulantien Solriamfetol und Pitolisant nicht empfohlen.
Mit diesen Medikamenten stehen zwei wirksame und zugelassene Therapieverfahren lediglich für solche OSA-Patienten zur Verfügung, die trotz erfolgreich eingestellter mechanischer Therapie unter residualer Tagesschläfrigkeit (rEDS) leiden [Norden et al., 2022]. Die jüngere Forschung hat allerdings neues Licht in mögliche weitere pharmakotherapeutische Therapieansätze gebracht.
Exkurs in die Pathophysiologie
Um diese Therapieansätze zu verstehen, ist ein Exkurs in die Pathophysiologie der obstruktiven Schlafapnoe hilfreich. Hatte man früher geglaubt, die Schlafapnoe sei ein rein anatomisches Problem, ist heutzutage klar, dass auch nicht-anatomische Faktoren bei der Entwicklung der OSA eine Rolle spielen. Das erklärt, warum einige OSA-Patienten keine oder nur sehr moderate anatomische Einschränkungen zeigen [Eckert et al., 2018].
Muskeln: Kraft gegen Kollaps
Während die Pathophysiologie der OSA in all ihren Einzelheiten sehr komplex ist, besteht die grundlegende Abweichung zum Gesunden in der Unfähigkeit der Rachendilatatoren, dem negativen Druck im oberen Atemweg bei der Inspiration Widerstand zu leisten [McNicholas et al., 2022]. Normalerweise kontrahieren diese Muskeln in koordinierter Taktung mit der Inspiration. Faktoren, die den negativen Druck erhöhen oder umgekehrt die Effektivität der Muskeln verringern, stören diese Balance und prädisponieren für eine Obstruktion des oberen Atemwegs [Deegan & McNicholas, 1995].
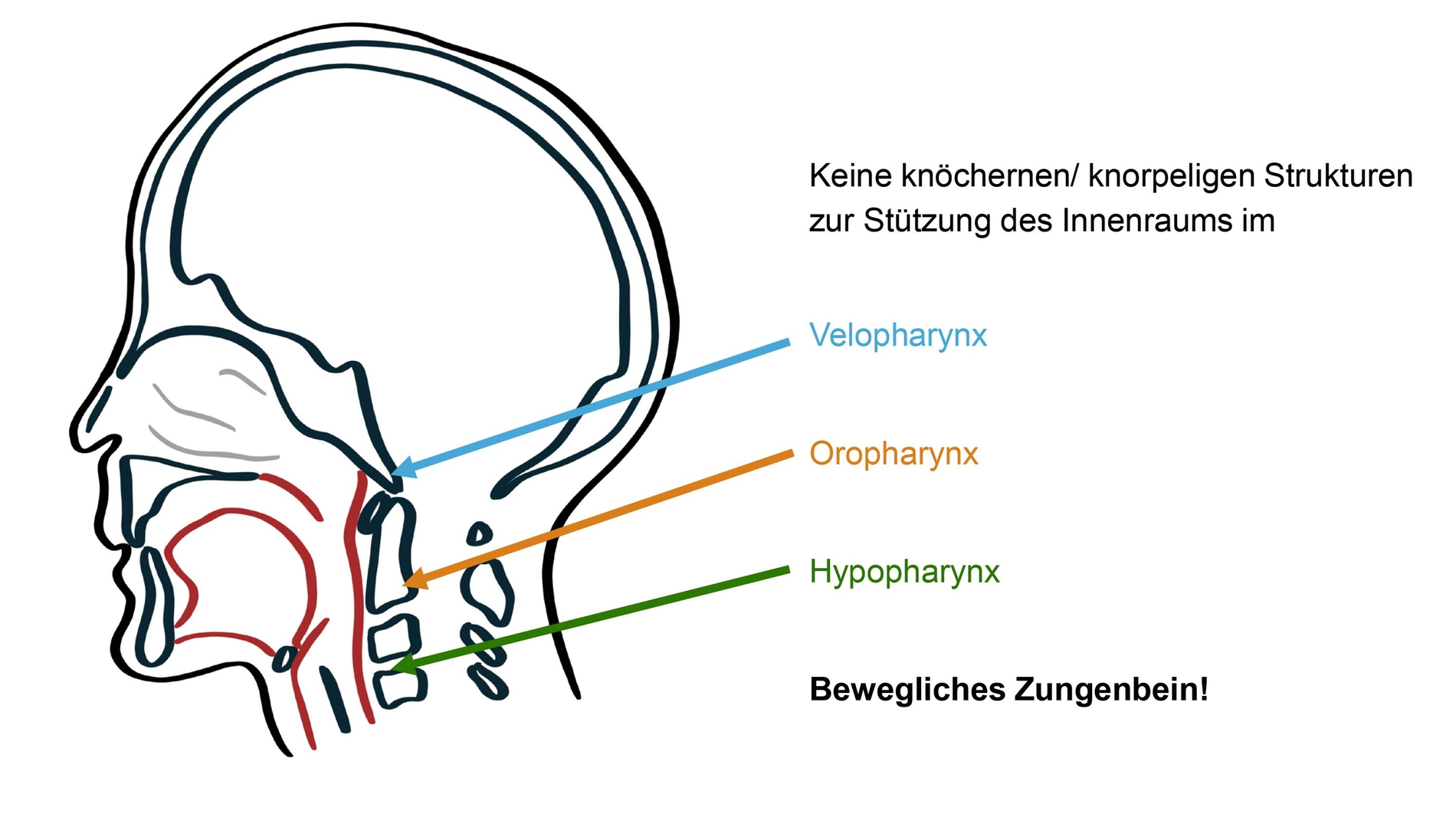
Der obere Atemweg besteht aus einer komplexen Anordnung von Skelettmuskeln und Weichgewebe, der anders als in den unteren Abschnitten des Atemwegs, also in der Luftröhre oder den Bronchien, nicht von stabileren knorpeligen Strukturen gestützt wird. Diese Eigenschaft macht den oberen Atemweg anfällig für Störungen oder gar einen Kollaps, obwohl er eigentlich beim Atmen in allen Körperpositionen offenbleiben muss, um ausreichende Lungenventilation und Gasaustausch zu ermöglichen.
Schlaf, insbesondere Rapid-Eye-Movement (REM)-Schlaf verursacht fundamentale Veränderungen im Muskeltonus der Rachenmuskulatur und in den Reflexantworten, erhöht den Atemwegswiderstand und ist Hauptverursacher von Hypoventilation und einem Anstieg des Kohlendioxidpartialdrucks bei gesunden schlafenden Menschen [Henke et al., 1992].
Individuen mit einem anatomisch ohnehin engen oberen Atemweg sind durch die Effekte des Schlafs auf den Muskeltonus für ein Absinken des Atemluftstroms (Hypopnoen) beziehungsweise für Atemstillstände (Apnoen) prädisponiert [Remmers et al., 1978]. Der Schlaf mit seinen spezifischen Mechanismen ist dabei eine „conditio sine qua non“ für diese Art von Atemstillständen [Andrisani et al., 2023].

Schlaf: aktiv und komplex
Schlaf ist ein komplexer physiologischer Vorgang, an dem zahlreiche Bestandteile des zentralen Nervensystems mit ihren jeweiligen Neurotransmittern beteiligt sind [Luppi et al., 2019]. Der Übergang von einem Schlafstadium zum nächsten für einen vollständigen Schlafzyklus, der vier bis fünfmal pro Nacht über einen Zeitraum von sieben bis acht Stunden erfolgt, erfordert eine komplexe neuronale Koordination verschiedener Gehirnabschnitte sowie funktionierende Signalwege über Neuronen und Neurotransmitter. Darüber hinaus benötigt die Kontrolle von Atmung und Atemwegsdurchlässigkeit eine enorme Koordinationsleistung zwischen Gehirn, Atemzentrum und peripheren neuromuskulären Strukturen [Toh et al., 2023].
Die für die Kontrolle von Schlaf und Aufwachen zuständigen neurologischen Mechanismen haben zahlreiche Projektionen in atmungssteuernde Motoneuronen (efferente Nervenzellen in der Muskulatur), einschließlich des motorischen Kerns des Nervus Hypoglossus [Horner et al., 2008].
Der Motoneuronen-Kern des Musculus hypoglossus innerviert sowohl die intrinsischen als auch die extrinsischen Zungenmuskeln. Die Co-Aktivierung dieser Muskeln trägt zur Erweiterung und Versteifung des oberen Atemwegs bei, um dem Kollaps beim Einatmen Widerstand zu leisten. [Horner et al., 1996; Fuller et al., 1999; Bailey et al., 2006]. Der Musculus Genioglossus spielt dabei im Schlaf eine kritische Rolle beim Offenhalten des oberen Atemwegs [Younes et al., 1985].
Aber auch eine reduzierte Muskelaktivität anderer Rachenmuskeln, wie die des vom Trigeminus innervierten Weichgaumens, trägt zu erhöhtem Atemwegswiderstand und einer Neigung zum Atemwegsverschluss bei [Tangel et al., 1991]. Eine wichtige Rolle für die Atemwegsdurchlässigkeit spielt hier im Schlaf der mesencephale trigeminale Nucleus (MTN), der die Aktivität der Kaumuskulatur modulieren kann und zum Beispiel für Schlafbruxismus mitverantwortlich ist [Giovanni et al., 2021].
Zähne für guten Schlaf: unterschätzt und untererforscht
Für uns Zahnärzte ist diese Information besonders interessant. Denn die Literatur legt nahe, dass Zähne in ihrem funktionellen Regelkreis mit Kau- und Gesichtsmuskeln eine wichtige Funktion für die Aktivierung des MTN und damit die funktionelle Steuerung des oberen Atemwegs haben [Andrisani et al., 2023].
So nimmt das Risiko für den mit Atemstillstand einhergehenden plötzlichen Kindstod mit dem Durchbruch der ersten Milchzähne deutlich ab [Andrisani et al., 2015]. Die Verwendung eines Schnullers mit seiner gesichts- und kaumuskelaktivierenden Funktion senkt das Risiko für solche Todesfälle [Moon et al., 2012]. Zahnlosigkeit ist beim Erwachsenen wiederum Risikofaktor für eine Schlafapnoe. Prothetische Rehabilitation mit und ohne Implantate scheint neben kaufunktionellen, phonetischen und psychologisch Gründen auch zur Senkung des Schlafapnoe-Risikos ratsam zu sein [Pachiou et al., 2025].
Trotz ihres Namens wird die obstruktive Schlafapnoe also zunächst nicht von einem Atemwegsverschluss verursacht. Zwar trägt die Obstruktion im Rachensegment zur Gesamtpathologie bei, der grundlegende Faktor in diesem Szenario ist jedoch eine Dysregulation von Neurotransmittern im Gehirn [Andrisani et al., 2023].
Dieses sowohl anatomische als auch funktionelle Verständnis der Pathophysiologie von OSA ermöglicht es, nachzuvollziehen, warum die Krankheit neben einer mechanischen Therapie, zum Beispiel mit einer UPS, oder einer anatomischen Korrektur, zum Beispiel mittels einer Dysgnathieoperation, auch einer zentral oder peripher ansetzenden Pharmakotherapie zugänglich sein kann.
Individuelle Pathomechanismen erkennen
OSA entsteht im Wechselspiel zentralnervöser und peripherer Pathomechanismen, die auch als OSA-Endotypen bezeichnet werden. Bekannt sind vier solcher Pathomechanismen:
der anatomisch für einen Kollaps anfällige obere Atemweg,
eine schwache Antwort der Rachendilatatoren,
eine starke Neigung zu einer kortikalen Weckreaktion bei Verengung des oberen Atemwegs (niedrige Weckschwelle) und
ein auf CO2-Schwankungen übermäßig reagierendes ventilatorisches Kontrollsystem [Eckert et al., 2013; 2018]. Letzteres wird auch mit dem Begriff eines hohen Loop Gain, zu deutsch einer starken negativen Rückkopplung, beschrieben.

Der Anteil der jeweiligen Pathomechanismen am Problem Schlafapnoe variiert erheblich zwischen den jeweiligen Patienten und kann am Ende über das individuelle Ansprechen auf eine Therapie, also über Erfolg oder Misserfolg entscheiden [Sands et al., 2018]. UPS sind zum Beispiel weniger effektiv bei Patienten mit einer starken Kollapsneigung des Rachensegments und bei Patienten mit einem hohen Loop Gain [Edwards et al., 2016; Sutherland et al., 2014].
KI für eine präzisere Therapieauswahl
Messtechnische Untersuchungen im Schlaflabor liefern eine Vielzahl von Daten, die in der Zukunft unter Nutzung von künstlicher Intelligenz (KI) helfen könnten, Patienten nach ihren spezifischen Endotypen, also nach ihren Pathomechanismen, einzuteilen [Toh et al., 2023].
UPS wirken dabei passiv anatomisch, haben aber keinen oder kaum Effekt auf andere Schlafapnoe-Pathomechanismen wie die Empfindlichkeit der ventilatorischen Kontrolle [Edwards et al., 2016]. Dies trägt zur Erklärung der hohen Varianz im Therapieansprechen auf eine UPS bei. Eine a priori bessere Einteilung der pathophysiologisch heterogenen OSA-Patienten könnte künftig dabei helfen, mögliche Kandidaten für eine UPS-Therapie vorhersagbarer auszuwählen.
Zusammenfassend ergeben sich für die UPS-Therapie Grenzen aus zahnmedizinischen Risiken, unerwünschten Nebenwirkungen, Problemen mit der Adhärenz sowie ihrer selektiven Wirkungsweise auf bestimmte, pathophysiologisch abgrenzbare OSA-Subgruppen.
Die Riege der personalisierten Medizin ruft auch deswegen auf zur Abkehr von der traditionellen Vorstellung einer OSA-Monotherapie zum Beispiel mit CPAP oder UPS hin zu einer multimodalen multipathomechanistisch-zielgerichteten Behandlung [Toh et al., 2023].
Der Wunder-Cocktail gegen Schlafapnoe?
Die schlafmedizinische Forschung sucht aktuell nach einem Medikament oder einer Medikamentenkombination, die nach Einnahme den oberen Atemweg stabil hält, ohne den Schlaf in all seinen wichtigen Funktionen zu beeinträchtigen. Dieses Wundermittel beziehungsweise dieser Cocktail neurotroper Medikamente soll im Idealfall über die gesamte Schlafdauer wirken und danach spurlos verschwinden, so dass die Tagesperformance des Patienten nicht gestört wird [Toh et al., 2023].
Muntermacher für die Rachenmuskeln
Der vielversprechendste pathomechanistische Therapieansatz beruht sowohl auf dem Verständnis von der Wirkung des endogenen Epinephrin-(Adrenalin)-Rückgangs auf den Tonus des Musculus Genioglossus im Non-REM-Schlaf als auch auf den inhibitorischen Effekten von Muscarin-Rezeptoren im REM-Schlaf [Grace et al., 2013; Lee et al., 2023].
Die Kombination von noradrenergen und antimuskarinergen Medikamenten wurde bereits in verschiedenen Studien erprobt. Atomoxetin plus Oxybutynin (AtoOxy) zeigte dabei eine signifikante Verbesserung des Apnoe-Hypnopnoe-Index (AHI), einem traditionellen Biomarker und Schweregrad-Indikator der OSA [Kinouchi et al., 2023; Taranto-Montemurro et al., 2019; 2020; Rosenberg et al., 2022; Schweitzer et al., 2023].
Der Effekt ist zwar statistisch positiv, aber klinisch bescheiden [Lee et al., 2023]. Gerade Nebenwirkungen wie Mundtrockenheit, Übelkeit, Müdigkeit, Appetitverlust, Erektionsstörungen und Harnverhalt können bei dieser Therapie die Adhärenz gefährden. Die Wirkung könnte sich langfristig außerdem abschwächen, Daten zur Langzeit-Wirkung fehlen bislang [Lee et al., 2023].
Hypnotika und Sedativa: (k)ein Widerspruch?
Historisch wurde die Anwendung von Hypnotika und Sedativa, welche die Weckschwelle erhöhen, als OSA-verschlechternd eingestuft. Man hatte vermutet, dass sie die Reaktion der Rachendilatatoren abschwächen und damit die Kollapsneigung des Rachens verstärken.
Tatsächlich zeigen jedoch die Sedativa Zolpidem, Eszopiclon und Zopiclon keine verschlechternde Wirkung auf OSA, in einigen Studien sogar eine Verbesserung. [Messineo et al., 2020; Carter et al., 2016; 2018; 2020]. Für das Sedativum Natriumoxybat und das Antidepressivum Tradozon konnte sogar eine Verbesserung des AHI nachgewiesen werden [George et al., 2010; 2011; Chen et al.; 2021; Arrendo et al., 2022].
Ein Ausflug in die Pathophysiologie bringt auch hier Licht in diese überraschenden Studienergebnisse. Man war nämlich lange Zeit davon ausgegangen, dass jedes Apnoe-Ereignis von einer Weckreaktion im Gehirn (Arousal) beendet werden muss [Eckert & Malhotra, 2008]. Jedoch haben jüngere Erkenntnisse zur Pathogenese der OSA gezeigt, dass ein bedeutender Anteil der respiratorischen Ereignisse gar nicht mit einer kortikalen Weckreaktion endet [Eckert et al., 2013].
Weckreaktionen stellen zwar einen lebenswichtigen Schutzmechanismus dar, die Weckreaktion kann nach heutigem Wissensstand aber auch zur Pathophysiologie der OSA beitragen, indem sie den Atemwegskollaps perpetuiert. Grund dafür sind die durch die Weckreaktion durcheinandergebrachten Blutgaspartialdrücke sowie eine Hyperventilation, die regelmäßig auf eine Apnoe folgt [Jordan et al., 2007; Eckert et al., 2013; McNicholas et al., 1998].
Der resultierende Abfall von Kohlendioxid im Blut verringert den Atemantrieb. Die Aktivität der Rachendilatatoren wird jedoch wesentlich von chemischen Stimuli und von vagalen Reizen gesteuert [Brouillette & Thach, 1980]. Kohlendioxid als chemischer und der Atemantrieb als neuronaler Stimulus fehlen damit nach einer Weckreaktion den Rachendilatatoren und schwächen ihre Effektivität.
Tatsächlich steigert sich das Elektromyogramm (EMG) während einer Apnoe, ihr Ende ist gefolgt von Hyperventilation für mehrere Atemzüge, nach denen das EMG sowohl des Zwerchfells wie auch des Musculus Genioglossus abfällt, was die nächste Obstruktion begünstigt [Dempsey et al., 2010].
Das erklärt, warum ein Anheben der Weckschwelle mittels Sedativa oder Hypnotika bei manchen OSA-Subgruppen Vorteile bieten könnte [Eckert et al., 2013]. Wegen fehlender randomisierter Studiendaten kann jedoch momentan noch keine Empfehlung ausgesprochen werden, welche OSA-Patienten von einer Medikation mit Hypnotika und Sedativa profitieren könnten [Carberry et al., 2018].
Wirken Medikamente für stabile Atmung gegen Schlafapnoe?
Ähnlich destabilisierend auf das ventilatorische System und die Reaktion der Rachendilatatoren wie eine niedrige Weckschwelle wirkt ein hoher Loop Gain. Er tritt dann auf, wenn die Atemantwort nach einer Apnoe deutlich gesteigert ist und sich die Wahrscheinlichkeit für das nächste Apnoe-Ereignis damit erhöht [Dempsey et al., 2010].
Auf den Loop Gain abzielend konnte für den Acetylcholinesterase-Hemmer Donezepil eine dosisabhängige Reduzierung des AHI um ein Drittel sowie eine Wirkung auf mehrere patientenrelevante Endpunkte nachgewiesen werden [Edwards et al., 2012; Fava Li et al., 2012; Sukys-Claudino et al., 2016]. Auch mit Cannabinoiden alleine und in Kombination mit Acetylcholinesterase-Hemmern oder Atomoxetin wurden über eine Absenkung des Loop Gain positive Effekte auf die Schlafapnoe festgestellt [Boylan et al., 2024; Thomson et al., 2025].
Es mangelt aktuell jedoch auch hier an Daten zu einer Langzeittherapie sowie an Untersuchungen zu Patienten-Subgruppen, die entlang ihrer Schlafapnoe-Pathophysiologie ausgewählt wurden. Typische Nebenwirkungen wie Parästhesien und Nykturie können wie die Notwendigkeit zur regelmäßigen Überwachung möglicher Wechselwirkungen mit Thiazid-Diuretika außerdem zum Problem dieser Pharmakotherapie werden [Schmickl et al., 2020].
Heilt die Spritze gegen Adipositas auch die Schlafapnoe?
Die Ansammlung von Körperfett ist ein wichtiger und unabhängiger Risikofaktor für OSA. [Messineo et al., 2022]. Fettpolster im oberen Atemweg oder der Zunge erhöhen den extraluminalen Druck und verstärken dadurch die Kollapsneigung [Li et al., 2012; Kim et al., 2024; Kirkness et al., 2008]. Incretin-Agonisten zur Behandlung der Adipositas haben deswegen jüngst das Interesse an einer Pharmakotherapie der OSA angeheizt. Es gibt substantielle initiale Evidenz, dass sie in der alltäglichen klinischen Routine einen Einfluss auf den OSA-Schweregrad haben.
Aber es gibt auch hier Schattenseiten: diese Medikamente müssen auf unbestimmte Zeit eingenommen werden, die Gewichtszunahme nach Absetzen der Medikation birgt die Gefahr eines höheren Fettanteils innerhalb der wiedergewonnenen Masse, die Dauermedikation könnte mit unerwünschten Nebenwirkungen zum Beispiel auf die Gallenblase und die Bauchspeicheldrüse einhergehen, und nicht zuletzt kann die Applikation mittels subkutaner Injektion eine Barriere für viele Patienten darstellen [Messineo et al., 2024].
Trotz der vorherrschenden Auffassung, dass Schlafapnoe und Adipositas ureigen miteinander verbunden sind, muss man mit gutem Grund kritisch reflektieren, dass Übergewicht nicht zwingend notwendig ist, um eine OSA zu entwickeln [Messineo et al., 2024]. Während die Adipositas zwar bedeutend zur Pathogenese der Schlafapnoe beiträgt, gibt es Evidenz für die entscheidende Rolle nichtanatomischer Faktoren, insbesondere bei Patienten ohne Adipositas.
Schlafapnoe kann sich außerdem auch bei Vorliegen anderer anatomischer Faktoren unabhängig von einer Adipositas entwickeln [Messineo et al., 2024], beispielsweise bei kraniofazialen knöchernen Anomalien, tonsillärer Hypertrophie oder unter Einfluss transienter Faktoren wie Flüssigkeitsansammlungen im Rachenbereich in liegender Körperposition [Nicholas et al., 2022].
Aus der Apotheke in die bessere Anatomie?
Entsprechend existieren neben den neuen Medikamenten gegen Adipositas weitere pharmakotherapeutische Ansätze, die an anderen anatomischen Ursachen für den Kollaps im Rachensegment ansetzen: Diuretika gegen Flüssigkeitsretention im Bereich des oberen Atemwegs sowie intranasale Steroide und abschwellendes Nasenspray gegen Nasenatmungsbehinderung [Taranto-Montemurro et al., 2019]. Die beiden Letzteren haben eine positive Tendenz hinsichtlich AHI-Absenkung gezeigt, jedoch ohne statistische Signifikanz [Kiely et al., 2004; Smith et al., 2019; Acar et al., 2013; An et al., 2018].
Zusammenfassung und Ausblick
Pharmakologische, nichtinvasive Therapien gegen OSA befinden sich derzeit im Aufwind und werden zukünftig mit hoher Wahrscheinlichkeit klinisch nutzbare Behandlungsoptionen hervorbringen[Arrendo et al., 2022; Toh et al., 2023]. Studien mit längeren Nachbeobachtungszeiträumen zur Bewertung der Sicherheit und Dauerhaftigkeit des Effekts dieser Therapien stehen jedoch noch aus [Nobre et al., 2024].
Auch wenn viele Studien zur Pharmakotherapie der OSA auf günstige Ergebnisse hindeuten, gelten diese oft nur für bestimmte OSA-Subgruppen oder sind klinisch nicht signifikant. Aktuell gibt es vor allem wegen fehlender Studien an sehr großen Patienten-Kohorten (Phase III-Studien), noch keine hinreichende Evidenz, um irgendeine Pharmakotherapie gegen die OSA zu empfehlen, einmal abgesehen von der gegen residuale Tagesschläfrigkeit (rEDS). Ausschließlich medikamentös wurde eine OSA bislang auch noch nicht erfolgreich behandelt.
Medikamente könnten jedoch künftig als alternative Behandlung zum Einsatz kommen bei Patienten, die etablierte Verfahren nicht tolerieren oder nicht akzeptieren, als ergänzende Therapie zusammen mit chirurgischen Verfahren im Bereich des oberen Atemwegs oder zusammen mit bariatrischer Chirurgie, als Rettungs-Therapie bei Patienten mit residualer OSA nach Chirurgie oder unter einer UPS-Therapie sowie als synergistische Behandlung mit myofunktioneller Therapie, genauso wie die anerkannte Kombination von Hypnotika mit kognitiv verhaltenstherapeutischer Intervention bei Insomnie[Lee et al., 2023; Toh et al., 2023].
Neben dem Off-Label-Gebrauch bereits etablierter Medikamente werden nicht zuletzt ständig neue Substanzen für die gezielte Anwendung bei OSA entwickelt. Derzeit behandeln aber in erster Linie mechanische Interventionen wie CPAP und UPS effektiv die OSA [Gaisl et al., 2019].
Im Orchester der OSA-Therapien wird die UPS also auch in Zukunft ein unverzichtbares, seit Jahrzehnten etabliertes, gut untersuchtes und sicheres Instrument auf höchstem Evidenzniveau bleiben. Künftig könnte eine bessere und gegebenenfalls KI-gestützte Auswertung von Daten aus dem Schlaflabor eine präzisere Diagnostik ermöglichen, die die Zuordnung zu einem OSA-Endotypen erlaubt und bereits vorab individuelle Prognosen über das Therapieansprechen des Patienten auf die therapeutischen Optionen zulässt.
Der komplexe Hintergrund und die zunehmende Bedeutung multimodaler Therapieansätze unterstreichen umso mehr die Notwendigkeit zu interdisziplinärer Vernetzung und zu spezifischer Fortbildung des im schlafmedizinischen Netzwerk eingebundenen Zahnarztes.
Literaturliste
Acar M, Cingi C, Sakallioglu O, San T, Fatih Yimenicioglu M, Bal C. The effects of mometasone furoate and desloratadine in obstructive sleep apnea syndrome patients with allergic rhinitis. Am J Rhinol Allergy. 2013 Jul-Aug;27(4):e113-6. doi: 10.2500/ajra.2013.27.3921. PMID: 23883803.
An Y, Li Y, Kang D, Sharama-Adhikari SK, Xu W, Li Y, Han D. The effects of nasal decongestion on obstructive sleep apnoea. Am J Otolaryngol. 2019 Jan-Feb;40(1):52-56. doi: 10.1016/j.amjoto.2018.08.003. Epub 2018 Aug 23. PMID: 30243839.
Andrisani G, Andrisani G. The mesencephalic nucleus of the trigeminal nerve and the SIDS. Med Hypotheses. 2015 Jan;84(1):8-10. doi: 10.1016/j.mehy.2014.11.005. Epub 2014 Dec 2. PMID: 25486983.
Andrisani G, Andrisani G. Sleep apnea pathophysiology. Sleep Breath. 2023 Dec;27(6):2111-2122. doi: 10.1007/s11325-023-02783-7. Epub 2023 Mar 28. PMID: 36976413; PMCID: PMC10656321.
Arredondo E, DeLeon M, Masozera I, Panahi L, Udeani G, Tran N, Nguyen CK, Atphaisit C, de la Sota B, Gonzalez G Jr, Liou E, Mayo Z, Nwosu J, Shiver TL. Overview of the Role of Pharmacological Management of Obstructive Sleep Apnea. Medicina (Kaunas). 2022 Feb 2;58(2):225. doi: 10.3390/medicina58020225. PMID: 35208549; PMCID: PMC8874508.
Arredondo E, DeLeon M, Masozera I, Panahi L, Udeani G, Tran N, Nguyen CK, Atphaisit C, de la Sota B, Gonzalez G Jr, Liou E, Mayo Z, Nwosu J, Shiver TL. Overview of the Role of Pharmacological Management of Obstructive Sleep Apnea. Medicina (Kaunas). 2022 Feb 2;58(2):225. doi: 10.3390/medicina58020225. PMID: 35208549.
Attali V, Chaumereuil C, Arnulf I, Golmard JL, Tordjman F, Morin L, Goudot P, Similowski T, Collet JM. Predictors of long-term effectiveness to mandibular repositioning device treatment in obstructive sleep apnea patients after 1000 days. Sleep Med. 2016 Nov-Dec;27-28:107-114. doi: 10.1016/j.sleep.2016.10.004. Epub 2016 Oct 27. PMID: 27938910.
Bailey, E.F., Huang, Y.H., Fregosi, R.F., 2006. Anatomic consequences of intrinsic tongue muscle activation. Journal of Applied Physiology 101, 1377–1385.
Balk EM, Moorthy D, Obadan NO, Patel K, Ip S, Chung M, et al. Diagnosis and treatment of obstructive sleep apnea in adults: Comparative effectiveness review No. 32. Rockville, MD: Agency for Healthcare Research and Quality, 2011.
Benjafield AV, Ayas NT, Eastwood PR, Heinzer R,Ip MSM,Morrell MJ,et al.Estima-tion of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. LancetRespirMed 2019;7(8):687–98.
Boylan PM, Santibañez M, Thomas J, Weeda E, Noel ZR, Caballero J. Cannabinoids for obstructive sleep apnea: A systematic review. Pharmacotherapy. 2024 Nov; 44(11):880-891. doi: 10.1002/phar.4622. Epub 2024 Nov 5. PMID: 39498540.
Brouillette, R. T., & Thach, B. T. (1980). Control of genioglossus muscle inspiratory activity. Journal of Applied Physiology: Respiratory, Environ mental and Exercise Physiology, 49(5), 801–808. doi.org/101152/jappl.1980.49.5.801.
Carberry JC, Amatoury J, Eckert DJ. Personalized Management Approach for OSA. Chest. 2018 Mar;153(3):744-755. doi: 10.1016/j.chest.2017.06.011. Epub 2017 Jun 16. PMID: 28629917.
Carter SG, Berger MS, Carberry JC, Bilston LE, Butler JE,Tong BKY, et al. Zopiclone increases the arousal threshold without impairing genioglossus activity in obstructive sleep apnea. Sleep. 2016;39(4):757–66. 32.
Carter SG, Carberry JC, Cho G, FisherLP, Rollo CM,Stevens DJ,et al.Effect of 1 month of zopiclone on obstructive sleep apnoea severity and symptoms: a randomised controlled trial. EurRespirJ 2018; 52(1):1800149. 33.
Carter SG, Carberry JC, Grunstein RR, Eckert DJ. Randomized trial on the effects of high-dose zopiclone on OSA severity, upper airway physiology, and alertness. Chest 2020;158(1):374–85.
Chen CY, ChenCL Yu CC. Trazodone improves obstructive sleep apnea after ischemic stroke:a randomized,double-blind,placebo controlled, crossover pilot study. JNeu-rol 2021; 268(8):2951–60. 37.
Clarenbach CF, Kohler M, Senn O, Thurnheer R, Bloch KE. Does nasal decongestion improve obstructive sleep apnea? J Sleep Res. 2008 Dec;17(4):444-9. doi: 10.1111/j.1365-2869.2008.00667.x. Epub 2008 Aug 15. PMID: 18710420.
Dempsey, J. A., Veasey, S. C., Morgan, B. J., & O'Donnell, C. P. (2010). Pathophysiology of sleep apnea. Physiological Reviews, 90(1), 47–112. doi.org/10.1152/physrev.00043.2008
Doi A, Ramirez JM. State-dependent interactions between excitatory neuromodulators in the neuronal control of breathing. J Neurosci. 2010 Jun 16;30(24):8251-62. doi: 10.1523/JNEUROSCI.5361-09.2010. PMID: 20554877; PMCID: PMC3606074.
Eckert, D. J., & Malhotra, A. (2008). Pathophysiology of adult obstructive sleep apnea. Proceedings of the American Thoracic Society, 5(2), 144–153. doi.org/10.1513/pats.200707-114MG.
Eckert DJ, Owens RL, Kehlmann GB,Wellman A, Rahangdale S, Yim-Yeh S,et al.Eszopiclone increases the respiratory arousal threshold and lowers the apnoea/hypopnoea index in obstructive sleep apnoea patients witha low arousal threshold.ClinSci (Lond)2011;120(12):505–14. 29.
Eckert DJ, White DP, Jordan AS, Malhotra A, Wellman A. Defining phenotypic causes of obstructive sleep apnea. Identification of novel therapeutic targets. Am J Respir Crit Care Med. 2013 Oct 15;188(8):996-1004. doi: 10.1164/rccm.201303-0448OC. PMID: 23721582; PMCID: PMC3826282.
Eckert DJ. Phenotypic approaches to obstructive sleep apnoea - New pathways for targeted therapy. Sleep Med Rev. 2018 Feb;37:45-59. doi: 10.1016/j.smrv.2016.12.003. Epub 2016 Dec 18. PMID: 28110857.
Edwards BA, Sands SA, Eckert DJ, White DP, Butler JP, Owens RL, Malhotra A, Wellman A. Acetazolamide improves loop gain but not the other physiological traits causing obstructive sleep apnoea. J Physiol. 2012 Mar 1;590(5):1199-211. doi: 10.1113/jphysiol.2011.223925. Epub 2012 Jan 4. PMID: 22219335; PMCID: PMC3381825.
Edwards BA, Andara C, Landry S, Sands SA, Joosten SA, Owens RL, et al. Upper-airway collapsibility and loop gain predict the response to oral appliance therapy in patients with obstructive sleep apnea. Am J Respir Crit Care Med. 2016;194:1413–1422. doi: 10.1164/rccm.201601-0099OC.
Fava C., Dorigoni S., Dalle Vedove F. Effect of CPAP on blood pressure in patients with OSA/hypopnea a systematic review and meta-analysis. Chest. 2014;145(4):762–771. doi: 10.1378/chest.13-1115. [DOI] [PubMed] [Google Scholar].
Ferguson KA, Ono T, Lowe AA, al-Majed S, Love LL, Fleetham JA. A short-term controlled trial of an adjustable oral appliance for the treatment of mild to moderate obstructive sleep apnoea. Thorax. 1997;52:362–368.
Fuller, D.D., Williams, J.S., Janssen, P.L., Fregosi, R.F., 1999. Effect of co-activation of tongue protrudor and retractor muscles on tongue movements and pharyngeal airflow mechanics in the rat. Journal of Physiology 519, 601–613.
Gaisl T, Haile SR, Thiel S, Osswald M, Kohler M. Efficacy of pharmacotherapy for OSA in adults: A systematic review and network meta-analysis. Sleep Med Rev. 2019 Aug;46:74-86. doi: 10.1016/j.smrv.2019.04.009. Epub 2019 Apr 19. PMID: 31075665.
George CF, Feldman N, Inhaber N, Steininger TL, Grzeschik SM, Lai C,et al. A safety trial of sodium oxybate in patients with obstructive sleep apnea: acute effects on sleep-disordered breathing. SleepMed 2010; 11(1):38–42. 35.
George CF, Feldman N, Zheng Y, Steininger TL, Grzeschik SM, Lai C, et al. A2-week, polysomnographic,safety study of sodium oxybate in obstructive sleep apneasyndrome. SleepBreath 2011; 15(1):13–20.36.
Giovanni A, Giorgia A. The neurophysiological basis of bruxism. Heliyon. 2021 Jul 3;7(7):e07477. doi: 10.1016/j.heliyon.2021.e07477. PMID: 34286138; PMCID: PMC8273205.
Gottlieb DJ, Punjabi NM.Diagnosis and management of obstructive sleep apnea: a review.JAMA2020;323(14):1389–400.
Grace KP, Hughes SW, Horner RL. Identification of the mechanism mediating genioglossus muscle suppression in REM sleep. Am J Respir Crit Care Med 2013; 187:311–9.
Horner, R.L., 1996. Motor control of the pharyngeal musculature and implications. for the pathogenesis of obstructive sleep apnea. Sleep 19, 827–853.
Horner RL, Grace KP, Wellman A. A resource of potential drug targets and strategic decision-making for obstructive sleep apnoea pharmacotherapy. Respirology 2017;22(5):861e73.
Jonas DE, Amick HR, Feltner C, Weber RP, Arvanitis M, Stine A, et al. Screening for obstructive sleep apnea in adults: An evidence review for the US Preventive Services Task Force: Evidence synthesis No. 146. Rockville, MD: Agency for Healthcare Research and Quality, 2017.
Jordan, A. S., Wellman, A., Heinzer, R. C., Lo, Y. L., Schory, K., Dover, L., Gautam, S., Malhotra, A., & White, D. P. (2007). Mechanisms used to restore ventilation after partial upper airway collapse during sleep in humans. Thorax, 62(10), 861–867. doi.org/10.1136/thx.2006. 070300.
Jordan AS, McSharry DG, Malhotra A. Adult obstructive sleep apnoea. Lancet 2014;383:736–747.
Keenan, B.T.; Kim, J.; Singh, B.; Bittencourt, L.; Chen, N.-H.; Cistulli, P.A.; Magalang, U.; McArdle, N.; Mindel, J.W.; Benediktsdottir,B. Recognizable clinical subtypes of OSA across a worldwide sleep center population: A cluster analysis. Sleep 2018, 41, zsx214.
Kiely JL, Nolan P, McNicholas WT. Intranasal corticosteroid therapy for obstructive sleep apnoea in patients with co-existing rhinitis. Thorax. 2004 Jan;59(1):50-5. PMID: 14694248; PMCID: PMC1758841.
Kim AM, Keenan BT, Jackson N, Chan EL, Staley B, Poptani H, et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep 2014 Oct 1;37(10):1639–48. PubMed PMID: 25197815. PMCID: PMC4173920. Epub 2014/09/10.
KinouchiT, TeradaJ,SakaoS,KoshikawaK,SasakiT,SugiyamaA,etal.Effects of the Combination of atomoxetine and oxybutynin in Japanese patients with obstructive sleep apnoea: a randomized controlled crossover trial.Respirology2023;28(3):273– 80.18.
Kirkness JP, Schwartz AR, Schneider H, Punjabi NM, Maly JJ, Laffan AM, et al. Contribution of male sex, age, and obesity to mechanical instability of the upper airway during sleep. J Appl Physiol 2008 Jun;104(6):1618–24. PubMed PMID: 18420722. PMCID: PMC2474771. Epub 2008/04/19.
Lee YC, Lu CT, Chuang LP, Lee LA, Fang TJ, Cheng WN, Li HY. Pharmacotherapy for obstructive sleep apnea - A systematic review and meta-analysis of randomized controlled trials. Sleep Med Rev. 2023 Aug;70:101809. doi: 10.1016/j.smrv.2023.101809. Epub 2023 Jun 17. PMID: 37423095.
Lettieri CJ, Quast TN, Eliasson AH, Andrada T. Eszopiclone improves overnight polysomnography and continuous positive airway pressure titration: a prospective, randomized, placebo-controlledtrial.Sleep2008;31(9):1310–6.28.
Li Y, Lin N, Ye J, Chang Q, Han D, Sperry A. Upper airway fat tissue distribution in subjects with obstructive sleep apnea and its effect on retropalatal mechanical loads. Respir Care 2012 Jul;57(7):1098–105. PubMed PMID: 22273428. Epub 2012/01/26.
Li Y, Owens RL, Sands S, Orr J, Moraes W, De Young P, et al. The effect of donepezil on Arousal threshold and apnea- hypopnea index .A randomized, double-blind,cross-over study. AnnAmThoracSoc 2016; 13(11):2012–8. 39.
Luppi PH, Fort P. Neuroanatomical and Neurochemical Bases of Vigilance States. Handb Exp Pharmacol. 2019;253:35-58. doi: 10.1007/164_2017_84. PMID: 29476336.
Marklund M, Braem MJA, Verbraecken J. Update on oral appliance therapy. Eur Respir Rev. 2019 Sep 25;28(153):190083. doi: 10.1183/16000617.0083-2019. PMID: 31554705; PMCID: PMC9488498.
McNicholas, W. T. (1998). Arousal in the sleep apnoea syndrome: A mixed blessing? Eur Resp J, 12(6), 1239–1241 Retrieved from erj. ersjournals.com.
McNicholas WT, Pevernagie D. Obstructive sleep apnea: transition from pathophysiology to an integrative disease model. J Sleep Res. 2022 Aug;31(4):e13616. doi: 10.1111/jsr.13616. Epub 2022 May 24. PMID: 35609941; PMCID: PMC9539471.
Messineo L, Eckert DJ, Lim R ,Chiang A, Azarbarzin A, Carter SG, et al.: Zolpidem increases sleep efficiency and the respiratory arousal threshold without changing slee papnoea severity and pharyngea lmuscle activity. JPhysio l 2020;598 (20):4681–92. 31.
Messineo L, Eckert DJ. Obstructive sleep apnea phenotyping to understand pathophysiology and improve treatment and outcomes. In: Encyclopedia of respiratory medicine. second ed.: Elsevier; 2022. p. 22–33.
Messineo L, Bakker JP, Cronin J, Yee J, White DP. Obstructive sleep apnea and obesity: A review of epidemiology, pathophysiology and the effect of weight-loss treatments. Sleep Med Rev. 2024 Dec;78:101996. doi: 10.1016/j.smrv.2024.101996. Epub 2024 Aug 30. PMID: 39244884.
Moon RY, Tanabe KO, Yang DC, Young HA, Hauck FR. Pacifier use and SIDS: evidence for a consistently reduced risk. Matern Child Health J. 2012 Apr;16(3):609-14. doi: 10.1007/s10995-011-0793-x. PMID: 21505778.
Moraes W, Poyares D, Sukys-Claudino L, Guilleminault C, Tufik S. Donepezil improves obstructive sleep apnea in Alzheimer disease: a double-blind, placebo-controlled study. Chest2008;133(3):677–83.
Nobre ML, Sarmento ACA, de Oliveira PF, Wanderley FF, Diniz Júnior J, Gonçalves AK. Pharmacological treatment for obstructive sleep apnea: A systematic review and meta-analysis. Clinics (Sao Paulo). 2024 Feb 10;79:100330. doi: 10.1016/j.clinsp.2024.100330. PMID: 38341903; PMCID: PMC10869242.
Norden, D., Herkenrath, S. Aktuelle Entwicklungen in der Schlafforschung und Schlafmedizin – eine Einschätzung der AG „Apnoe“. Somnologie 26, 144–148 (2022). doi.org/10.1007/s11818-022-00376-2.
Pachiou A, Roulias P, Steiropoulos P, Halazonetis DJ, Kourtis S. Association of edentulism and obstructive sleep apnea: A systematic review. J Prosthodont. 2025 Apr;34(S1):90-99. doi: 10.1111/jopr.13981. Epub 2024 Nov 13. PMID: 39539112; PMCID: PMC12000637.
Patel SR, Bakker JP, Stitt CJ, Aloia MS, Nouraie SM. Age and sex disparities in adherence to CPAP. Chest 2021;159:382e9.
Ramar K, Dort LC, Katz SG, Lettieri CJ, Harrod CG, Thomas SM, et al. Clinical practice guideline for the treatment of obstructive sleep apnea and snoring with Oral Appliance Therapy: An update for 2015. J Clin Sleep Med. 2015;11:773–827.
Rosenberg R, Roach JM, Scharf M, Amato DA. A pilot study evaluating acute use of eszopiclone in patients with mild to moderate obstructive sleepapnea syndrome. SleepMed 2007;8(5):464–70. 30.
Rosenberg R, Abaluck B, Thein S.: Combination of atomoxetine with the novel anti-Muscarinica roxybutynin improves mild tomoderate OSA. JClinSleepMed 2022;18 (12):2837–44. 21.
Saglam-Aydinatay B, Taner T. Oral appliance therapy in obstructive sleep apnea: Long-term adherence and patients experiences. Med Oral Patol Oral Cir Bucal. 2018 Jan.
Sands SA, Edwards BA, Terrill PI, Taranto-Montemurro L, Azarbarzin A, Marques M, Hess LB, White DP, Wellman A. Phenotyping Pharyngeal Pathophysiology using Polysomnography in Patients with Obstructive Sleep Apnea. Am J Respir Crit Care Med. 2018 May 1;197(9):1187-1197. doi: 10.1164/rccm.201707-1435OC. PMID: 29327943; PMCID: PMC6019932.
Schwab RJ. Properties of tissues surrounding the upper airway. Sleep 1996 Dec; 19(10 Suppl):S170–4. PubMed PMID: 9085502. Epub 1996/12/01.
Smales ET, Edwards BA, Deyoung PN, Mc Sharry DG, Wellman A, Velasquez A, et al. Trazodone effects on obstructive sleep apnea and non-REM arousal threshold. Ann AmThoracSoc 2015; 12(5):758–64.
Schmickl CN, Owens RL, Edwards BA, Malhotra A. OSA endotypes: what are they and what are their potential clinical implications? Curr Sleep Med Rep 2018;4:231–242.
Schmickl CN, Landry SA, Orr JE, Chin K, Murase K, Verbraecken J, Javaheri S, Edwards BA, Owens RL, Malhotra A. Acetazolamide for OSA and Central Sleep Apnea: A Comprehensive Systematic Review and Meta-Analysis. Chest. 2020 Dec;158(6):2632-2645. doi: 10.1016/j.chest.2020.06.078. Epub 2020 Aug 5. PMID: 32768459; PMCID: PMC7768933.
Schweitzer PK, Maynard JP, Wylie PE, Emsellem HA, SandsSA, et al.Efficacy of atomoxetine plus oxybutynin in the treatment of obstructive sleep apnea with moderate pharyngeal collapsibility.SleepBreath2023;27(2):495–503.
Smith DF, Sarber KM, Spiceland CP, Ishman SL, Augelli DM, Romaker AM. Effects of Medical Therapy on Mild Obstructive Sleep Apnea in Adult Patients. J Clin Sleep Med. 2019 Jul 15;15(7):979-983. doi: 10.5664/jcsm.7876. PMID: 31383235; PMCID: PMC6622504.
Sukys-Claudino L, Moraes W, Guilleminault C, Tufik S, Poyares D. Beneficial effect of donepezil on obstructive sleep apnea: a double-blind,placebo-controlled clinical trial. SleepMed 2012; 13(3):290–6. 4.
Sutherland K, Phillips CL, Davies A, Srinivasan VK, Dalci O, Yee BJ, et al. CPAP pressure for prediction of oral appliance treatment response in obstructive sleep apnea. J Clin Sleep Med. 2014;10:943–949. doi: 10.5664/jcsm.4020.
Sutherland K, Almeida FR, Kim T, Brown EC, Knapman F, Ngiam J, Yang J, Bilston LE, Cistulli PA. Treatment usage patterns of oral appliances for obstructive sleep apnea over the first 60 days: a cluster analysis. J Clin Sleep Med. 2021.
Tangel, D.J., Mezzanotte,W.S., White, D.P., 1991. Influence of sleep on tensor palatini EMG and upper airway resistance in normal men. Journal of Applied Physiology 70, 2574–2581.
Taranto-Montemurro L, Messineo L, Wellman A. Targeting Endotypic Traits with Medications for the Pharmacological Treatment of Obstructive Sleep Apnea. A Review of the Current Literature. J Clin Med. 2019 Nov 2;8(11):1846. doi: 10.3390/jcm8111846. PMID: 31684047; PMCID: PMC6912255.
Taranto-Montemurro L,Messineo L,SandsSA,AzarbarzinA, Marques M, Edwards BA, et al. The combination of atomoxetine and oxybutynin greatly reduces obstructive Sleep apnea severity. A randomized,placebo-controlled, double-blind crossover trial. AmJRespirCritCareMed2019;199(10):1267–76. 20.
Taranto-Montemurro L, Messineo L, Azarbarzin A, Vena D,Hess LB,Calianese NA,et al.Effects of the combination of atomoxetine and oxybutynin on OSA endotypic traits. Chest 2020;157(6):1626–36.19.
Thomson LDJ, Landry SA, Maddison K, Walsh R, Bleackley MR, Hamilton GS, Joosten SA, Walsh J, Edwards BA. The impact of acetazolamide and dronabinol on the physiological endotypes responsible for obstructive sleep apnea. Sleep Med. 2025 Aug;132:106542. doi: 10.1016/j.sleep.2025.106542. Epub 2025 Apr 28. PMID: 40328187.
Toh ST. Pharmacotherapy for obstructive sleep apnea: Reality or Pipe Dream? Sleep Med Rev. 2023 Aug;70:101817. doi: 10.1016/j.smrv.2023.101817. Epub 2023 Jul 11. PMID: 37480826.
Veasey SC, Rosen IM. Obstructive sleep apnea in adults. N Engl J Med 2019;380:1442e9.
Wang T., Eskandari D., Zou D., Grote L., Hedner J. Increased carbonic anhydrase activity is associated with sleep apnea severity and related hypoxemia. Sleep. 2015;38(7):1067–1073. doi: 10.5665/sleep.4814.
Ye, L.; Pien, G.W.; Ratcliffe, S.J.; Björnsdottir, E.; Arnardottir, E.S.; Pack, A.I.; Benediktsdottir, B.; Gislason, T. The different clinical faces of obstructive sleep apnoea: A cluster analysis. Eur. Respir. J. 2014, 44, 1600–1607.
Younes M, Loewen AH, Ostrowski M, Laprairie J, Maturino F, Hanly PJ. Genioglossus activity available via non-arousal mechanisms vs. that required for opening the airway in obstructive apnea patients. J Appl Physiol 2012;112(2):249e58. 1985.
Zinchuk AV, Gentry MJ, Concato J, Yaggi HK. Phenotypes in obstructive sleep apnea: A definition, examples and evolution of approaches. Sleep Med Rev. 2017;35:113–123.