Leukoplakie – ein praxisorientierter Leitfaden für einfache bis komplexe Fälle
Potenzielle Vorläuferläsionen maligner Veränderungen der Mundschleimhaut stellen im zahnärztlichen Alltag eine bedeutende Herausforderung dar. Sie können symptomlos oder unspezifisch erscheinen und sind klinisch häufig nur schwer von harmlosen Schleimhautveränderungen abgrenzbar. Dabei bergen sie ein relevantes Entartungsrisiko und müssen daher sorgfältig diagnostiziert und überwacht werden. Die Gruppe der sogenannten potenziell malignen Veränderungen (PMV) umfasst eine Vielzahl an Läsionen, darunter vor allem die Leukoplakie und den oralen Lichen planus – in Mitteleuropa die beiden häufigsten Erscheinungsformen.
Dr. med. dent. Josephine Ionfrida
2013–2018: Studium der Zahnmedizin an der Johannes Gutenberg-Universität, Mainz
2018–2024: Studium der Humanmedizin an der Ludwig Maximilian-Universität, München, sowie der Johannes Gutenberg-Universität, Mainz
seit 2023: Assistenzärztin in der Abteilung für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz
Univ.-Prof. Dr. Dr. Peer W. Kämmerer, MA, FEBOMFS
2001–2007: Studium der Medizin an der Johannes-Gutenberg-Universität, Mainz, sowie an der Universität Zürich
2004–2010: Studium der Zahnmedizin an der Johann Wolfgang Goethe-Universität, Frankfurt, sowie an der Johannes-Gutenberg-Universität, Mainz
2007–2013: Assistenzarzt an der Klinik für Mund-, Kiefer- und Gesichtschirurgie an der Universitätsmedizin Mainz
2012/2013: Gastprofessor der Harvard Medical School, Boston, MA, USA
2014–2018: Oberarzt und später Stellvertretender Klinikdirektor der Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie der Universitätsmedizin Rostock
2018–jetzt: Ernennung zum Leitenden Oberarzt / Stellvertretenden Klinikdirektor der Klinik und Poliklinik für Mund-, Kiefer- und plastische Gesichtschirurgie der Universitätsmedizin Mainz
Januar 2021: Ruf auf die W2-Professur für das Fach „Plastisch rekonstruktive Mund-, Kiefer- und Gesichtschirurgie“ an der Johannes Gutenberg-Universität Mainz
seit 2022 Wissenschaftlicher Beirat bei den Zahnärztlichen Mitteilungen
Die klinische Erkennung, Abgrenzung und Einstufung solcher Läsionen erfordert nicht nur eine systematische Untersuchung der gesamten Mundhöhle, sondern auch ein differenziertes Verständnis für die Risikofaktoren, Verlaufsformen und Transformationspotenziale. Die aktuelle WHO-Klassifikation der potenziell malignen oralen Erkrankungen ist in Tabelle 1 aufgeführt [Baumhoer und Reichert, 2024].
Die Anwendung des Konzepts „Simple – Advanced – Complex“ erlaubt eine Strukturierung des diagnostischen und therapeutischen Vorgehens bei PMV. Diese Einteilung unterstützt eine risikoadaptierte Patientenführung in der zahnärztlichen Primärversorgung.
Orale Leukoplakie
Im Mittelpunkt dieses Beitrags steht die Leukoplakie. Mit einer globalen Prävalenz von einem bis fünf Prozent ist sie die häufigste potenziell maligne Veränderung der Mundschleimhaut und ist definiert als „eine weiße Plaque mit fraglichem Krebsrisiko, die nur diagnostiziert werden kann, nachdem andere spezifische Erkrankungen ausgeschlossen wurden“ [Mello et al., 2018; Reibel et al., 2017]. Damit handelt es sich um eine Ausschlussdiagnose, die auch vom Pathologen nur unter Berücksichtigung des klinischen Befunds und durch den Ausschluss anderer Erkrankungen bestätigt werden kann. Dennoch ist eine Biopsie unerlässlich, um eine mögliche Malignität oder eine Schleimhautdysplasie sicher auszuschließen.
Typischerweise tritt die Leukoplakie bei Erwachsenen über 40 Jahren auf, häufiger bei Männern [Stolte und Dommisch, 2023]. Der wichtigste Risikofaktor ist der Tabakkonsum, sowohl Rauchen als auch Kautabak, gefolgt von regelmäßigem Alkoholkonsum, schlechter Mundhygiene und chronischen mechanischen Reizungen, beispielsweise durch scharfe Zahnkanten oder schlecht sitzende Prothesen. Auch Infektionen mit humanen Papillomaviren können eine Rolle spielen und sind derzeit Gegenstand der Forschung [Mello et al., 2018; Mishra et al., 2005; Feller und Lemmer, 2012]. Einige Leukoplakien treten auch bei lebenslangen Nichtrauchern ohne erkennbare Ursache auf; in solchen Fällen spricht man von einer idiopathischen Leukoplakie. Bei diesen Personen wird ein erhöhtes Risiko für die Entstehung oraler Plattenepithelkarzinome vermutet [Stolte und Dommisch, 2023; Napier und Speight, 2008]. Zu den wichtigsten Differenzialdiagnosen zählen die orale Haarleukoplakie, der orale Lichen planus, Candidiasis und Morsicatio buccarum [Kämmerer et al., 2017].
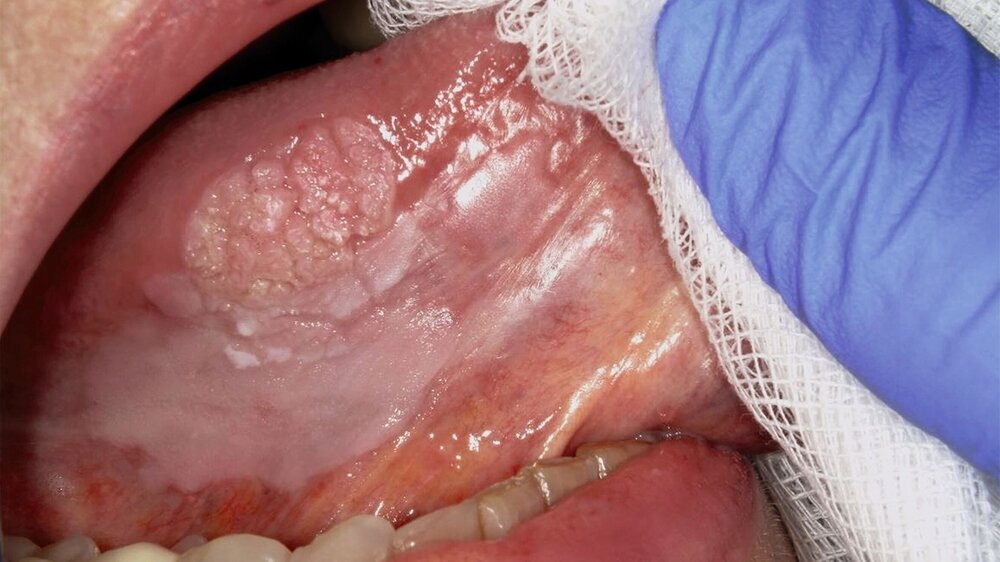
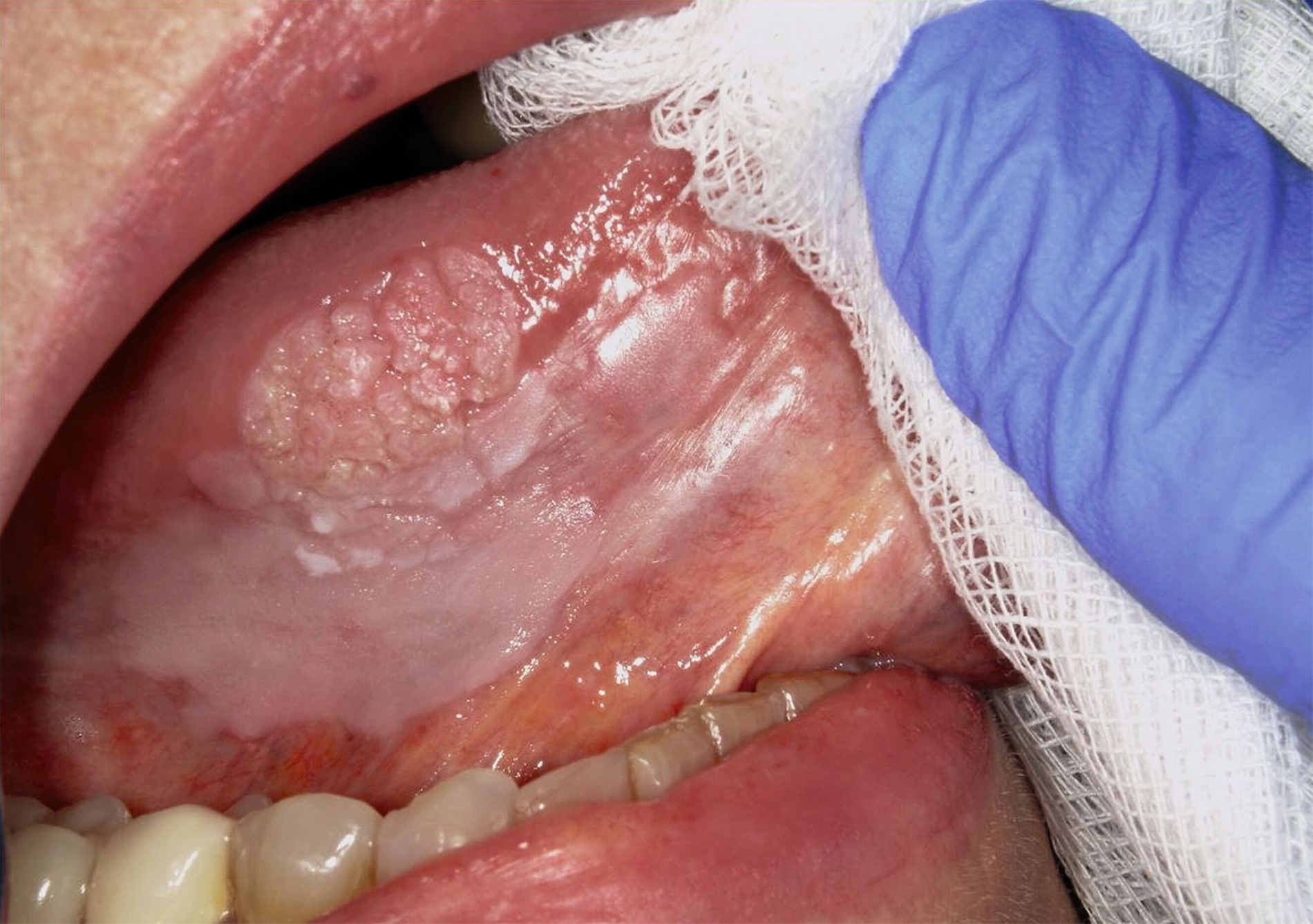
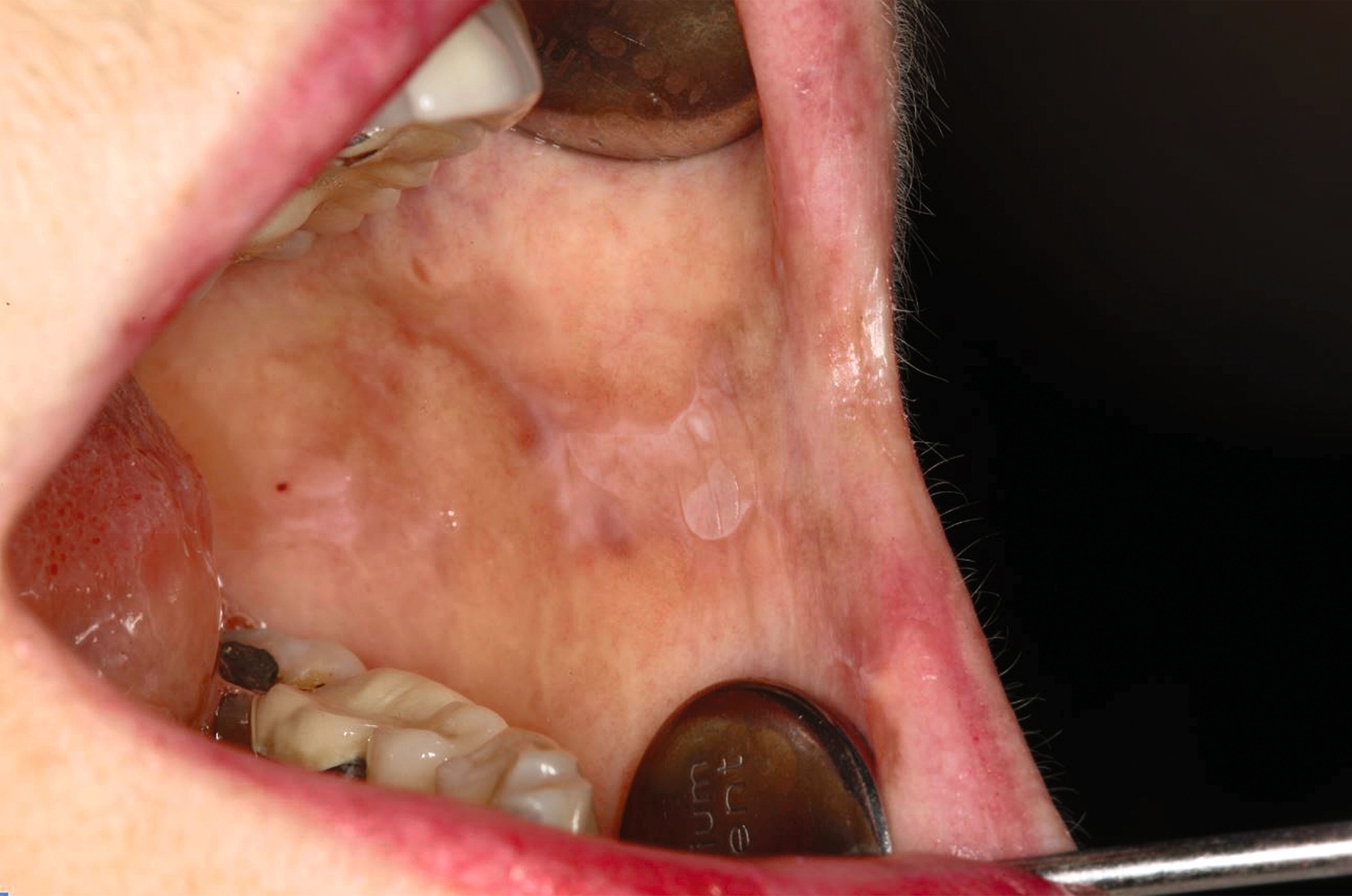
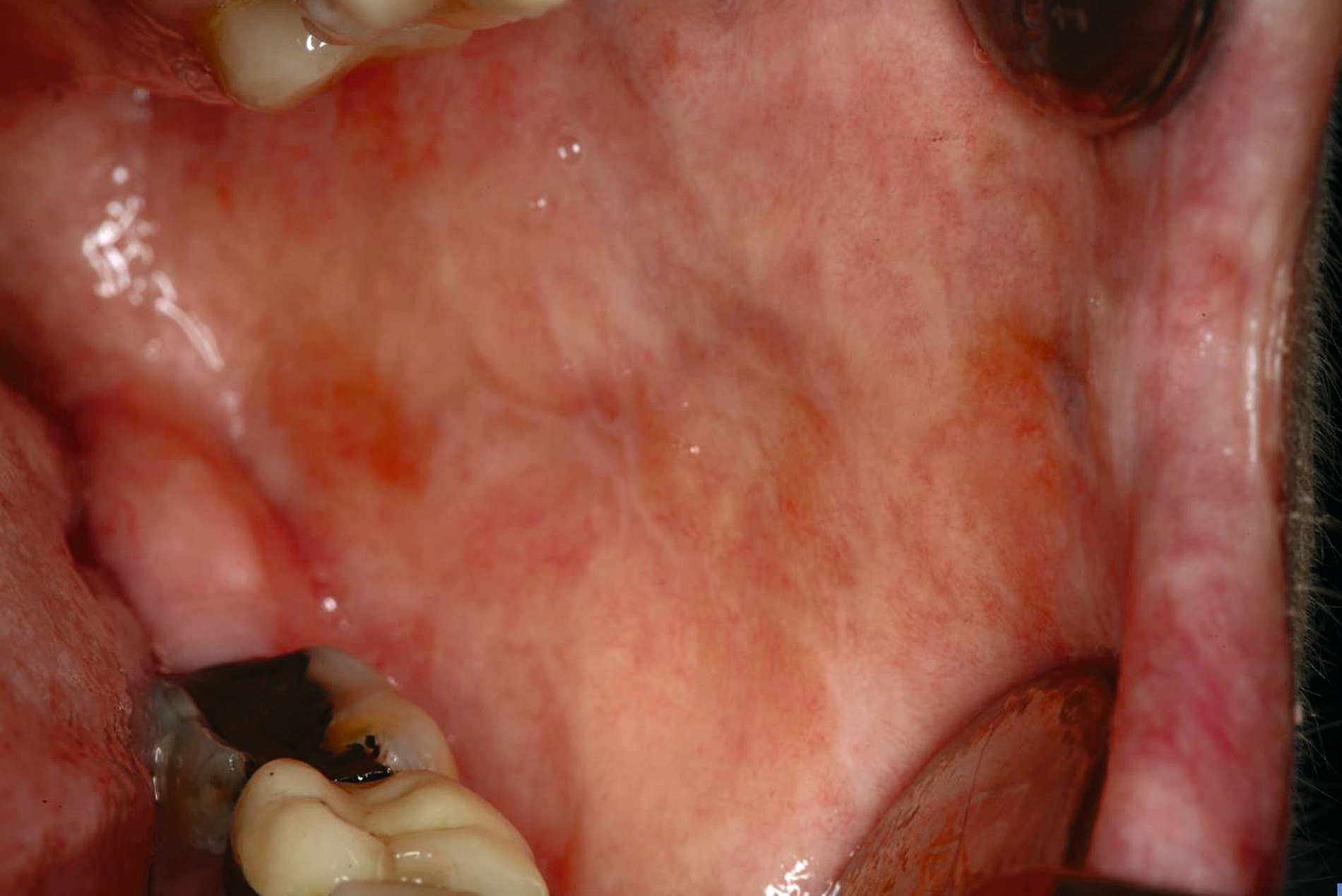
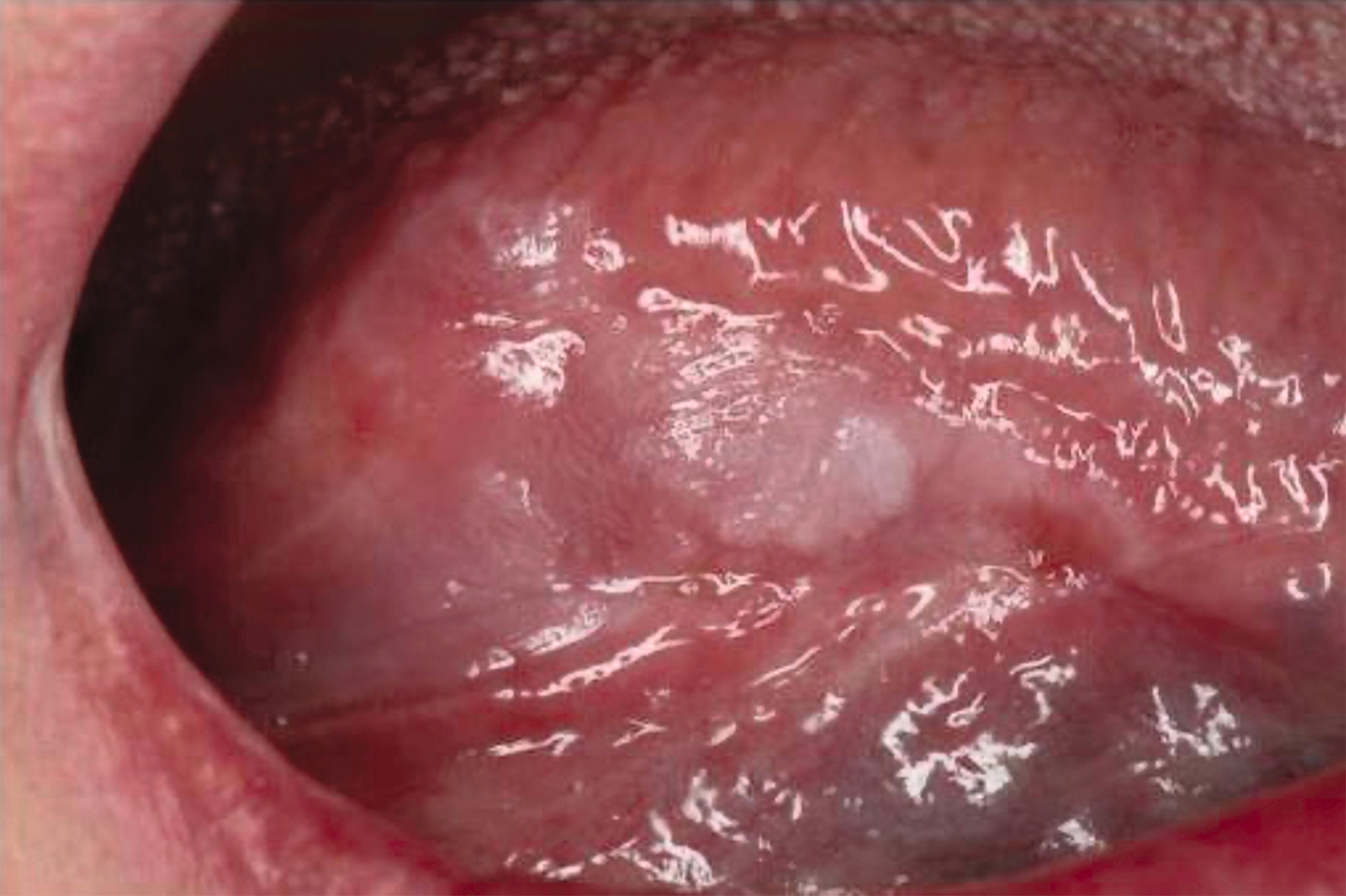
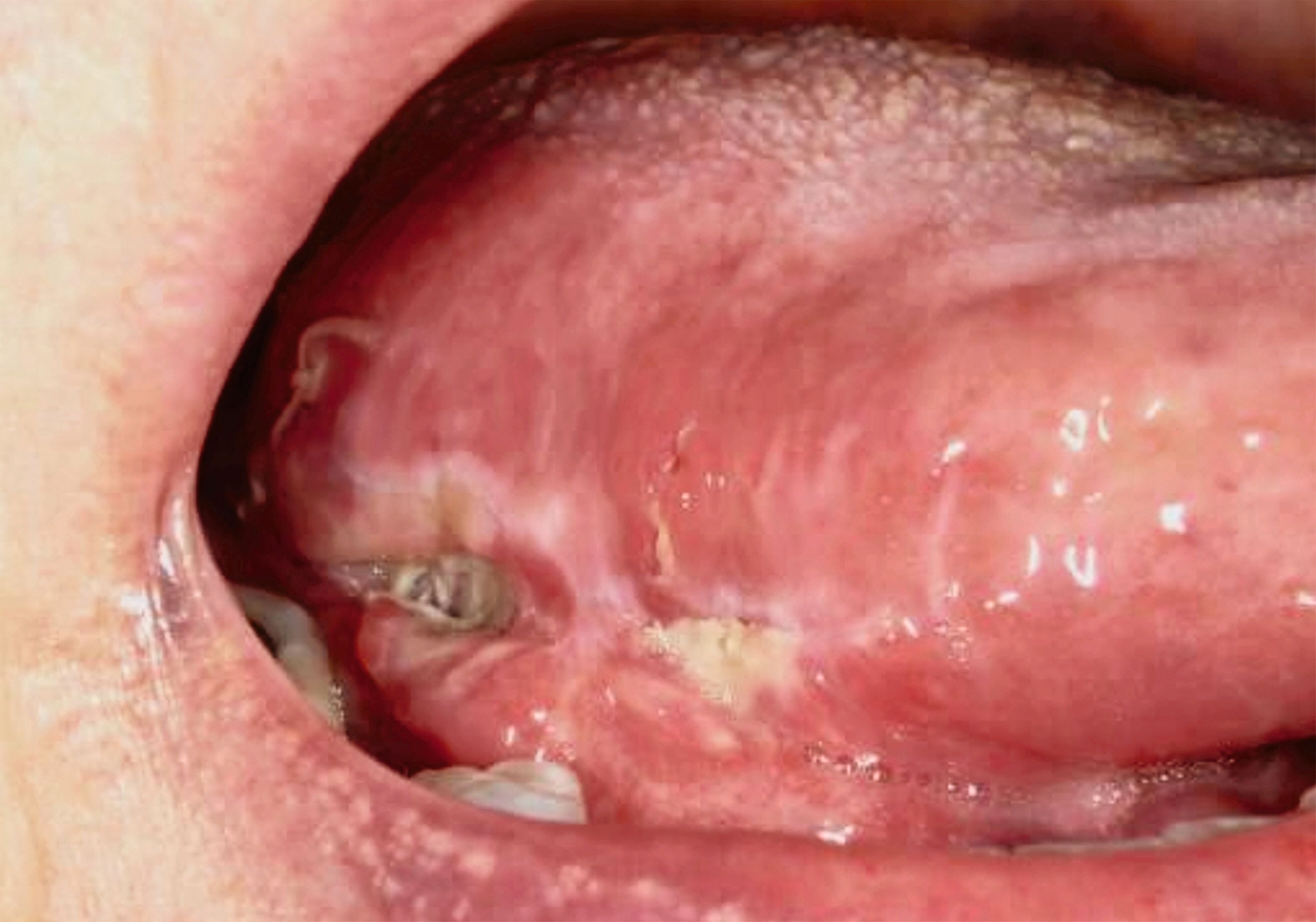
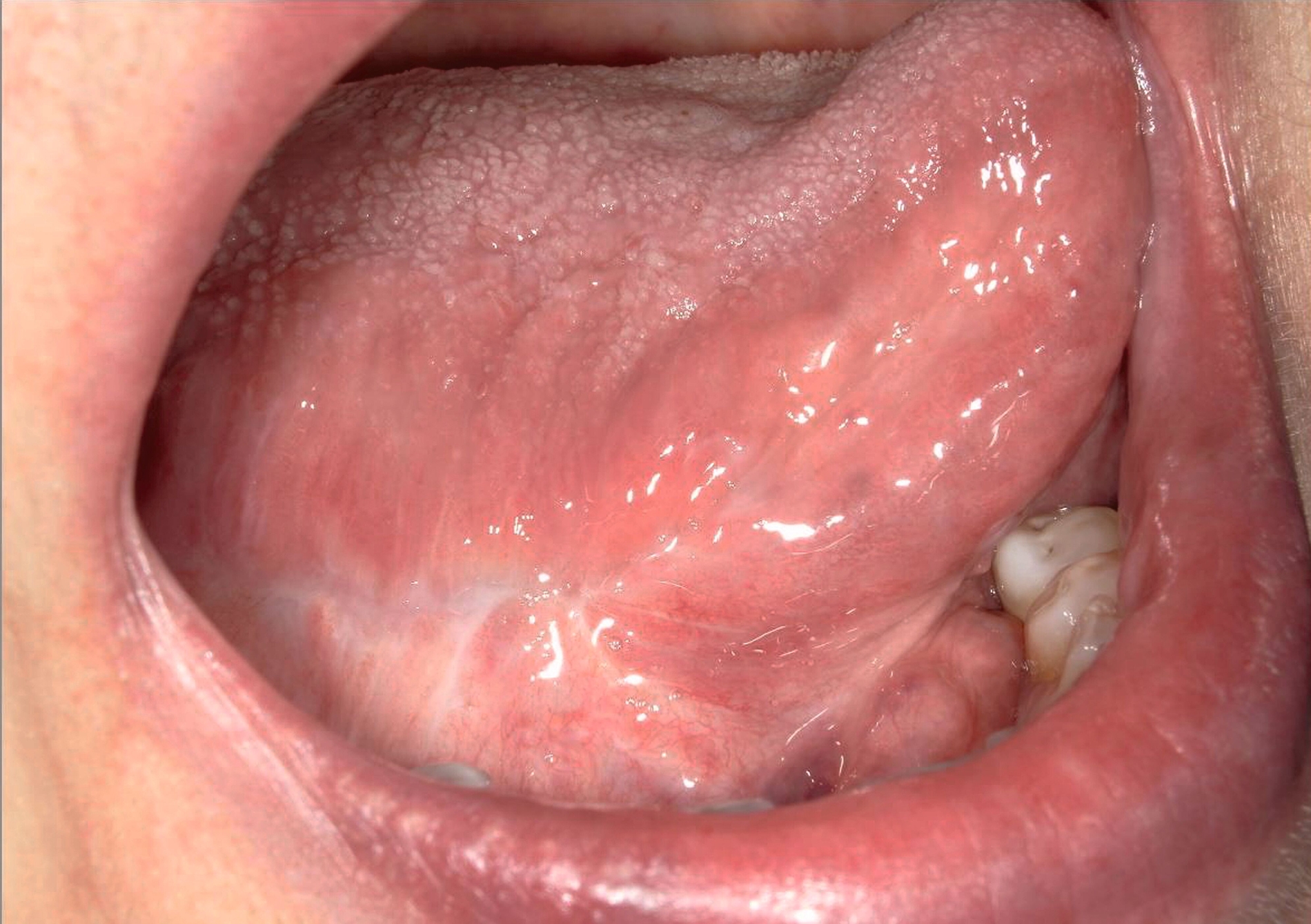
Die Leukoplakie äußert sich in Form von weißlichen Flecken oder Plaques auf der Mundschleimhaut, die nicht abgewischt werden können. Sie sind in der Regel schmerzlos, können aber durch ihre Beschaffenheit – meist rau oder leicht erhaben – auffallen. Am häufigsten sind sie an der Wangeninnenseite, am Alveolarfortsatz, an der Zunge, am Mundboden oder an den Lippen zu finden [Kämmerer et al., 2017; Speight et al., 2018]. Je nach Aussehen und histologischer Beurteilung unterscheidet man die homogene Leukoplakie von der inhomogenen Leukoplakie. Die homogene Leukoplakie zeigt sich als gleichmäßig weißer, glatter oder leicht rauer Fleck (Abbildung 1). Ihr Risiko, bösartig zu entarten, gilt als gering. Inhomogene Leukoplakien haben im Gegensatz dazu ein erhöhtes Entartungsrisiko und lassen sich in weitere Formen unterteilen: die gesprenkelte Form, auch als Erythroplakie bezeichnet (eine Mischung aus weißen und roten Arealen, wobei der weiße Anteil überwiegt), die noduläre Form (kleine, polypenartige Vorwölbungen mit rundlichen, roten oder weißen Erhebungen) und die verruköse Form (gekennzeichnet durch eine gefurchte oder warzenartige Oberfläche) (Abbildungen 2 und 3) [Kämmerer et al., 2017; Warnakulasuriya et al., 2016].
Der Anteil maligner Transformationen variiert in der Literatur erheblich und liegt je nach Studie zwischen 0,13 Prozent und 34 Prozent, wobei das Vorliegen einer Epitheldysplasie als der wichtigste Hinweis auf ein mögliches Entartungsrisiko gilt [Warnakulasuriya und Ariyawardana, 2016; Aguirre-Urizar et al., 2021; van der Waal, 2010]. Die anerkannten Risikofaktoren, die statistisch gesehen mit einem erhöhten Risiko für die Transformation in ein orales Plattenepithelkarzinom einhergehen sind in Tabelle 2 aufgelistet [Warnakulasuriya und Ariyawardana, 2016; van der Waal, 2010].
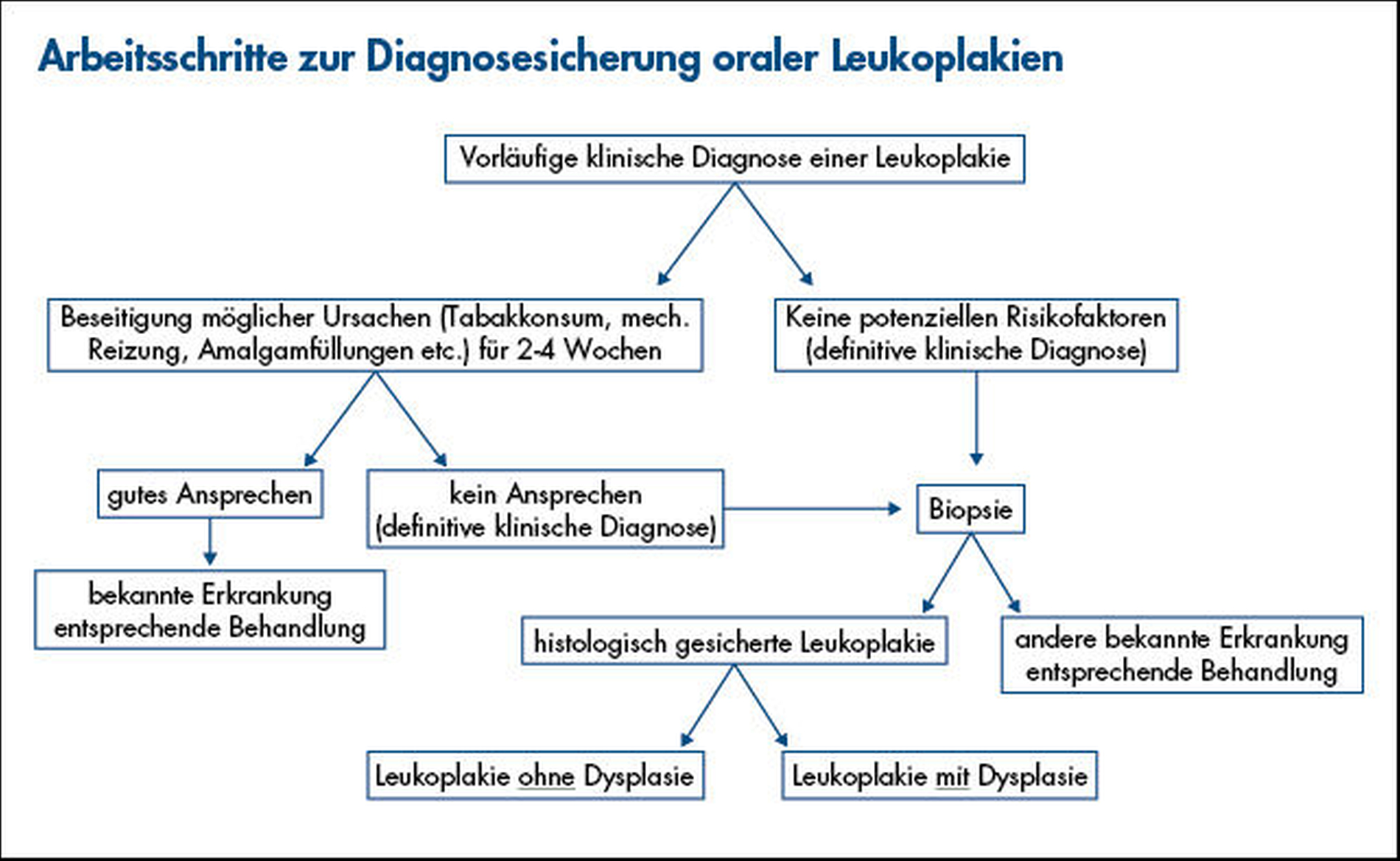
Eine Verdachtsdiagnose auf Leukoplakie wird gestellt, wenn eine überwiegend weiße Läsion bei der klinischen Untersuchung nicht eindeutig einer anderen Erkrankung der Mundschleimhaut zugeordnet werden kann. Obwohl viele Leukoplakien nicht maligne entarten und sich nach dem Verzicht auf auslösende Noxen (insbesondere Tabakrauch und Alkoholkonsum) zurückbilden können, ist eine Biopsie in jedem Fall unerlässlich. Sie dient dem Nachweis oder Ausschluss einer Schleimhautdysplasie, die wiederum entscheidend für die Einschätzung des Entartungsrisikos ist. Eine gesicherte Diagnose liegt dann vor, wenn keine andere spezifische Erkrankung histopathologisch nachgewiesen werden kann und andere Ursachen ausgeschlossen wurden [Warnakulasuriya et al., 2007]. Abbildung 4 zeigt eine schematische Darstellung der Schritte zur Diagnose oraler Leukoplakien [van der Waal, 2010].
Bei asymptomatischen Läsionen und Risikofaktoren wie Tabakkonsum oder mechanischen Reizungen scheint ein Beobachtungszeitraum von zwei bis vier Wochen akzeptabel, um eine klinische Regression des Befunds nach Beseitigung der Ursachen zu beobachten [van der Waal, 2009; Kunkel et al., 2011]. Zu den bekannten reversiblen weißlichen Mundschleimhautveränderungen zählen unter anderem die friktionsbedingte Hyperkeratose oder die Leukokeratosis nicotinica palati. Um jedoch eine dysplastische Leukoplakie oder sogar ein bereits vorhandenes Plattenepithelkarzinom nicht zu übersehen, sollte bei Vorliegen von Symptomen wie Schmerzen oder Brennen eine Biopsie nicht aufgeschoben und bereits vor Beseitigung der möglichen Auslöser gewonnen werden [van der Waal, 2015].
Einfache Fälle („Simple“)
Homogene Leukoplakien treten meist an weniger gefährdeten Lokalisationen wie der bukkalen Schleimhaut auf und präsentieren sich als flache, gleichmäßig weißliche Läsionen ohne strukturelle Auffälligkeiten oder subjektive Beschwerden. Sie sind in der Regel asymptomatisch und werden meist zufällig im Rahmen einer Routineuntersuchung entdeckt. Die initiale Diagnostik umfasst die ausführliche Anamnese des Patienten, die systematische Inspektion und Palpation der gesamten Mundhöhle sowie eine sorgfältige Dokumentation der Läsion hinsichtlich Lokalisation, Ausdehnung und Morphologie – idealerweise ergänzt durch eine Fotodokumentation. Zur minimalinvasiven Abklärung eignet sich in diesen Fällen besonders die Bürstenbiopsie, eventuell mit ergänzender bildzytometrischer DNA-Analyse, die eine erste Einschätzung hinsichtlich zellulärer Atypien erlaubt, ohne dass eine chirurgische Intervention notwendig ist [Kunkel et al., 2011]. Da die Qualität des Abstrichs nicht umgehend kontrolliert werden kann, erscheint es sinnvoll, mehrere Bürsten zu nehmen [Kämmerer et al., 2017]. Vorteile dieses Verfahrens sind die Minimalinvasivität, die geringen Kosten und die breite Verfügbarkeit.
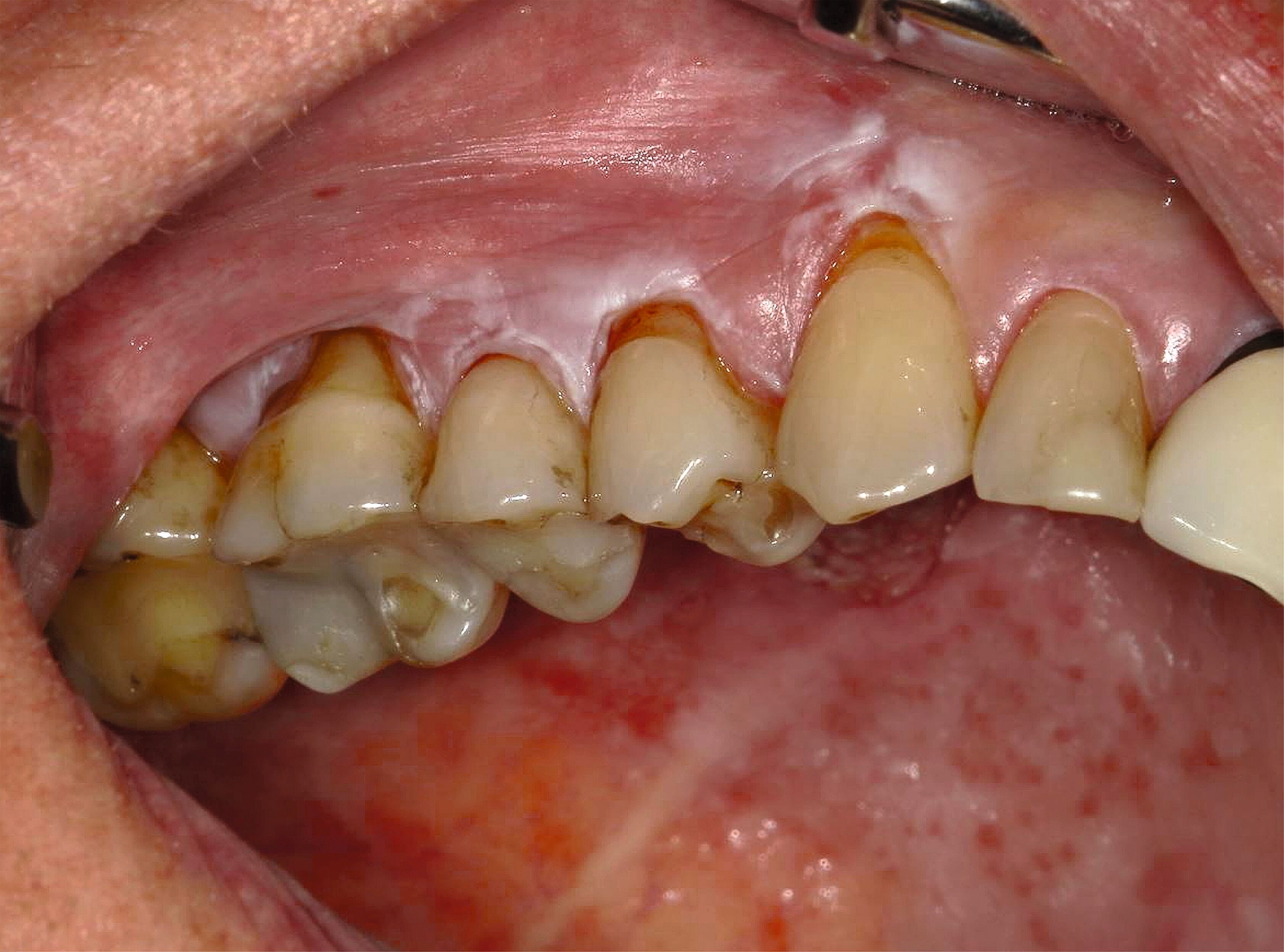
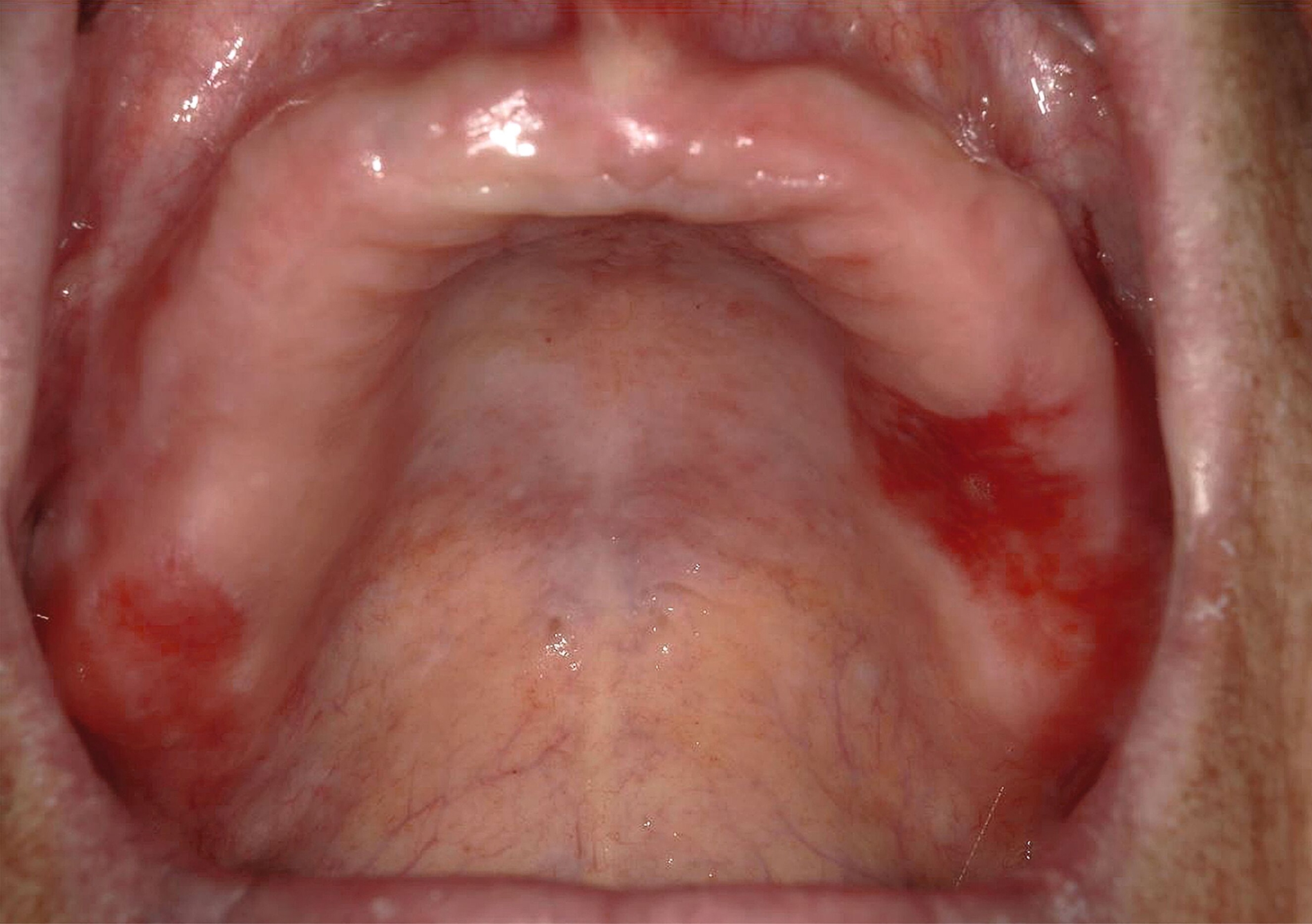
Therapeutisch steht, wie bereits erwähnt, die konsequente Beseitigung potenzieller Noxen im Vordergrund – insbesondere die Einstellung des Tabakkonsums sowie gegebenenfalls die Anpassung schlechtsitzender Prothesen oder scharfer Zahnkanten. Bei unauffälligem zytologischem Befund und fehlender Symptomatik ist ein konservatives Vorgehen mit regelmäßiger klinischer Kontrolle gerechtfertigt, wobei ein Intervall von sechs Monaten ausreichend erscheint [van der Wahl, 2009; Kunkel et al., 2011]. Eine chirurgische Therapie ist in diesen Fällen in der Regel nicht erforderlich. Ebenfalls kann auf eine Biopsie verzichtet werden, wenn nach Ausschalten der Risikofaktoren ein Rückgang der Läsion erkennbar wird (Abbildungen 5 und 6) [Kunkel et al., 2011].
Inhomogene oder symptomatische Leukoplakien („Advanced“)
Zeigen sich bei der Erstdiagnose bereits subjektive Symptome oder präsentiert sich das klinische Bild einer inhomogenen Leukoplakie, sollte nicht mit einer Biopsie gewartet werden. Studien haben gezeigt, dass ein Abwarten von mehr als vier Wochen einen signifikant negativen Effekt auf die Prognose haben kann [Allison et al., 1998; Kowalski und Carvalho, 2001]. Den Goldstandard bildet die vollschichtige Biopsie. Entscheidend hierbei ist die Durchführung einer gezielten Entnahme an den klinisch auffälligsten Arealen der Läsion. Laut Studienlage liegt das Risiko, ein orales Karzinom durch die Inzisionsbiopsie zu übersehen bei sieben bis zehn Prozent, weshalb stets eine Exzisionsbiopsie – sofern durchführbar – anzustreben ist [Kämmerer et al., 2017; Chiesa et al., 1986; Holmstrup et al., 2007]. Aufgrund der häufig komplexen anatomischen Verhältnisse oder sogar multilokulär auftretenden Befunde empfiehlt sich bei fortgeschrittenen Läsionen häufig eine interdisziplinäre Zusammenarbeit mit spezialisierten Einrichtungen wie der Mund-, Kiefer- und Gesichtschirurgie oder der Dermatologie.
Die histopathologische Untersuchung dient der Beurteilung des Dysplasiegrades und ist essenziell für die weitere Therapieplanung. Während leichte bis mäßige Dysplasien zunächst einer engmaschigen klinischen Kontrolle von drei Monaten unterzogen werden können, sollte bei hochgradigen Dysplasien eine Exzision in toto durchgeführt werden [Kunkel et al., 2015]. Bei einer enoralen Exzisionsbiopsie wird unter örtlicher Betäubung eine auffällige Schleimhautveränderung in der Mundhöhle vollständig entfernt. Dabei erfolgt die Umschneidung der Läsion mit einem Sicherheitsabstand, meist mit einem Skalpell oder alternativ mit Elektrochirurgie oder Laser. Das entnommene Gewebe wird zur histologischen Untersuchung in Formalin fixiert und gegebenenfalls an den Schnitträndern markiert. Die entstandene Wunde wird in der Regel spannungsfrei vernäht, kleinere Defekte können auch offen heilen.
Die Frage nach dem angemessenen klinischen Sicherheitsabstand bei der Exzisionsbiopsie ist bislang unzureichend beantwortet. Anzunehmen ist, dass in der Praxis häufig ein Abstand von wenigen Millimetern angestrebt wird, um unnötig große Resektionen zu vermeiden. Dabei ist es denkbar und mittlerweile belegt, dass nukleäre Atypien im Epithel weit über die optisch erkennbare Leukoplakie hinausreichen können. Dieses Phänomen könnte das Risiko für Lokalrezidive sowie einer Entstehung de novo erklären. Die beschriebenen Rezidivraten variieren erheblich und reichen von nahezu null bis 30 Prozent [van der Waal, 2009].
Ebenso essenziell ist eine ausführliche Aufklärung der Patienten über den Befund, das persönliche Risiko, mögliche lokale Therapieoptionen sowie Maßnahmen zur Verbesserung der Mundhygiene. Unabhängig von der gewählten Therapie wird eine langfristige Nachsorge empfohlen, um ein mögliches Rezidiv oder eine maligne Transformation frühzeitig erkennen zu können. Zu den lokalen Therapieoptionen zählen unter anderem die Lasertherapie, die Kryotherapie und die lokale Retinoidtherapie [van der Waal, 2009; Chandu und Smith, 2005; Chiesa et al., 2005]. Eine engmaschige Kontrolle der Patienten ist notwendig, um etwaige Nebenwirkungen der angewandten Therapie frühzeitig zu erkennen und zu behandeln.
Komplexe Fälle
Trotz sorgfältiger Probebiopsie kann es in komplexen Fällen zu einer Diskrepanz zwischen dem histopathologischen Ergebnis und dem klinischen Befund kommen. Die S2k-Leitlinie „Diagnostik und Management von Vorläuferläsionen des oralen Plattenepithelkarzinoms in der Zahn-, Mund- und Kieferheilkunde“ empfiehlt in solchen Fällen eine erneute histologische Überprüfung oder eine Überweisung in eine entsprechende Fachklinik [van der Waal, 2009] Die Abbildungen 7 bis 9 zeigen die Entwicklung einer Leukoplakie der Zunge (Abbildung 7), ihre Transformation in ein orales Plattenepithelkarzinom (Abbildung 8) sowie den klinischen Situs nach chirurgischer Therapie (Abbildung 9).
Bei Patienten mit Komorbiditäten, die mit einem hohen perioperativen Risiko verbunden sind (zum Beispiel hohe Nachblutungsgefahr bei Einnahme von Antikoagulantien oder eingeschränkte Wundheilung bei schlecht eingestelltem Diabetes), oder beim Vorliegen großer oder multifokaler Läsionen, die keine vollständige Exzision erlauben, können Therapien mit Vitaminen (A, C und K), Bleomycin oder Fenritinid erfolgen [Chiesa et al., 2005; Kumar et al., 2013]. Bei diesen Patienten sind eine strenge, engmaschige lebenslange Kontrolle sowie eine histopathologische Verlaufsdiagnostik unumgänglich [Villa und Woo, 2017].
Im Fall einer malignen Transformation ist eine Anbindung an ein onkologisches Fachzentrum notwendig. Dort kann eine weiterführende Diagnostik im Sinne eines Tumorstagings erfolgen und im Rahmen eines interdisziplinären Tumorboards eine zielgerichtete und patientenspezifische Therapie festgelegt werden.
Fazit für die Praxis
Die frühe Erkennung einer Leukoplakie und die systematische Untersuchung der gesamten Mundhöhle sind entscheidend.
Primär sollte die Eliminierung von Risikofaktoren (Alkohol, Rauchen, mechanische Reize) angestrebt werden.
Bei inhomogenen, symptomatischen oder persistierenden Läsionen sollte eine Biopsie erfolgen.
Bei komplexen oder therapierefraktären Fällen sollte frühzeitig eine interdisziplinäre Zusammenarbeit eingeleitet werden.
Ein engmaschiger Recall (alle drei bis sechs Monate) ist anzustreben, auch nach erfolgreicher Therapie zur Rezidiv-Erkennung.
Die Patienten sollten über den Befund, das individuelle Risiko und die notwendigen Kontrollintervalle aufgeklärt werden.
Alternative Therapieverfahren (Lasertherapie, Vitaminpräparate) können bei speziellen Konstellationen in Betracht gezogen werden.
Diskussion
Die orale Leukoplakie stellt aufgrund ihres variablen Verlaufs und ihres Entartungspotenzials bis heute eine Herausforderung für die alltägliche Praxis dar. Die sichere Differenzierung zwischen harmlosen und risikobehafteten Läsionen erfordert Erfahrung und eine systematische Diagnostik. Besonders bedeutsam ist dabei die Durchführung einer vollwertigen Exzisionsbiopsie.
Während sich homogene Befunde ohne chirurgische Therapie zurückbilden können, verlangen inhomogene und therapierefraktäre Befunde ein intensives Management. Eine regelmäßige, langfristige Nachsorge ist essenziell, um Rezidive oder maligne Transformationen rechtzeitig zu erkennen. Entscheidend bleibt die umfassende Patientenaufklärung und die konsequente Einbindung spezialisierter Zentren bei Verdachtsfällen.
Literaturliste
Aguirre-Urizar, J.M., I. Lafuente-Ibáñez de Mendoza, and S. Warnakulasuriya, Malignant transformation of oral leukoplakia: Systematic review and meta-analysis of the last 5 years. Oral Diseases, 2021. 27(8): p. 1881-1895.
Allison, P., et al., The role of professional diagnostic delays in the prognosis of upper aerodigestive tract carcinoma. Oral Oncol, 1998. 34(2): p. 147-53.
Baumhoer, D. and T.E. Reichert, Aktuelle WHO-Klassifikation der oralen potenziell malignen Erkrankungen (OPMD). Die MKG-Chirurgie, 2024. 17(2): p. 72-81.
Chandu, A. and A.C. Smith, The use of CO2 laser in the treatment of oral white patches: outcomes and factors affecting recurrence. International journal of oral and maxillofacial surgery, 2005. 34(4): p. 396-400.
Chiesa, F., et al., Excision of oral leukoplakias by CO2 laser on an out-patient basis: a useful procedure for prevention and early detection of oral carcinomas. Tumori Journal, 1986. 72(3): p. 307-312.
Chiesa, F., et al., Randomized trial of fenretinide (4‐HPR) to prevent recurrences, new localizations and carcinomas in patients operated on for oral leukoplakia: long‐term results. International journal of cancer, 2005. 115(4): p. 625-629.
Feller, L. and J. Lemmer, Oral leukoplakia as it relates to HPV infection: a review. International journal of dentistry, 2012. 2012(1): p. 540561.
Holmstrup, P., et al., Oral premalignant lesions: is a biopsy reliable? Journal of oral pathology & medicine, 2007. 36(5): p. 262-266.
Kämmerer, P., et al., Diagnostik potenziell maligner Mundschleimhautveränderungen in der Zahnarztpraxis. wissen kompakt, 2017. 11: p. 105-120.
Kowalski, L. and A. Carvalho, Influence of time delay and clinical upstaging in the prognosis of head and neck cancer. Oral oncology, 2001. 37(1): p. 94-98.
Kumar, A., et al., How should we manage oral leukoplakia? British Journal of Oral and Maxillofacial Surgery, 2013. 51(5): p. 377-383.
Kunkel, M., et al., S2k-Leitlinie: Diagnostik und Management von Vorläuferläsionen des oralen Plattenepithelkarzinoms in der Zahn-, Mund-und Kieferheilkunde. Der MKG-Chirurg, 2011. 4(3): p. 206-212.
Mello, F.W., et al., Prevalence of oral potentially malignant disorders: a systematic review and meta‐analysis. Journal of Oral Pathology & Medicine, 2018. 47(7): p. 633-640.
Mishra, M., et al., Epidemiological and clinicopathological study of oral leukoplakia. Indian Journal of Dermatology, Venereology & Leprology, 2005. 71(3).
Napier, S.S. and P.M. Speight, Natural history of potentially malignant oral lesions and conditions: an overview of the literature. Journal of Oral Pathology & Medicine, 2008. 37(1): p. 1-10.
Reibel, J., et al., Oral potentially malignant disorders and oral epithelial dysplasia. WHO classification of head and neck tumours, 2017. 9: p. 112.
Speight, P.M., S.A. Khurram, and O. Kujan, Oral potentially malignant disorders: risk of progression to malignancy. Oral surgery, oral medicine, oral pathology and oral radiology, 2018. 125(6): p. 612-627.
Stolte, K.N. and H. Dommisch, Potenziell maligne Veränderungen der Mundschleimhaut. Zahnmedizin up2date, 2023. 17(05): p. 369-380.
van der Waal, I., Oral leukoplakia, the ongoing discussion on definition and terminology. Med Oral Patol Oral Cir Bucal, 2015. 20(6): p. e685-92.
van der Waal, I., Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncology, 2010. 46(6): p. 423-425.
van der Waal, I., Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncology, 2009. 45(4): p. 317-323.
Villa, A. and S.B. Woo, Leukoplakia—A Diagnostic and Management Algorithm. Journal of Oral and Maxillofacial Surgery, 2017. 75(4): p. 723-734.
Warnakulasuriya, S. and A. Ariyawardana, Malignant transformation of oral leukoplakia: a systematic review of observational studies. Journal of Oral Pathology & Medicine, 2016. 45(3): p. 155-166.
Warnakulasuriya, S., N.W. Johnson, and I. Van Der Waal, Nomenclature and classification of potentially malignant disorders of the oral mucosa. Journal of Oral Pathology & Medicine, 2007. 36(10): p. 575-580.