MIH – Klinisches Erscheinungsbild, Diagnostik und Ätiologie
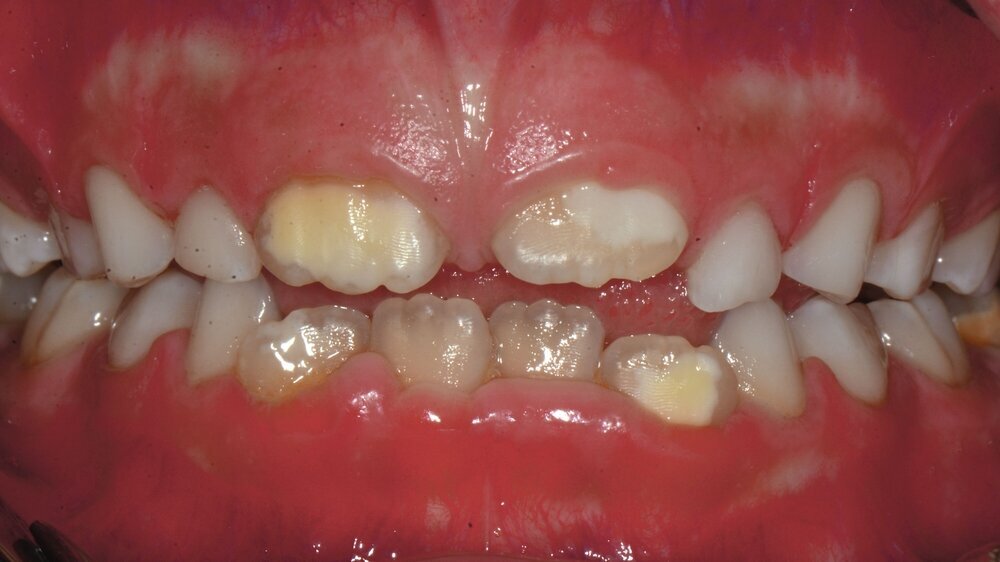
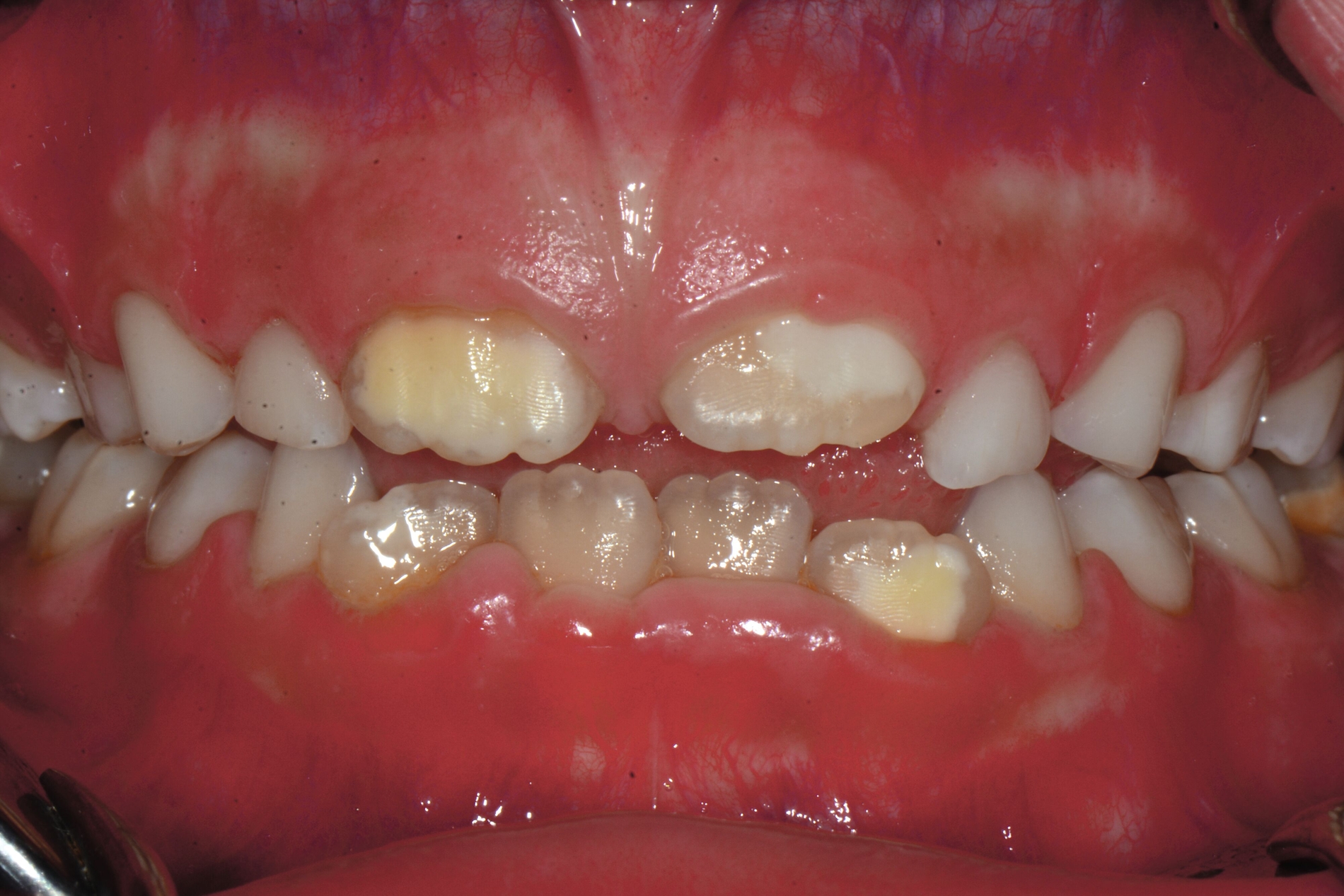
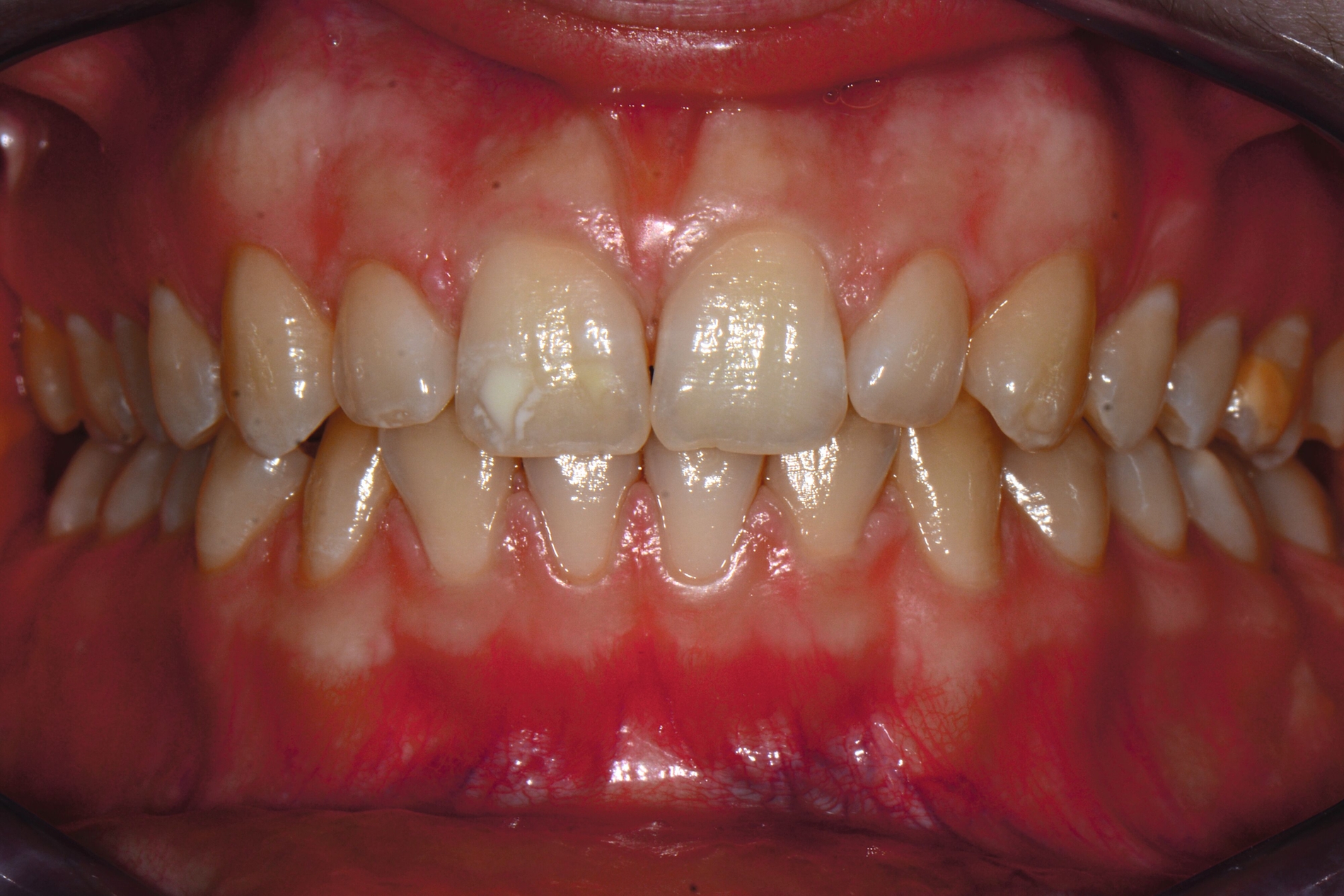
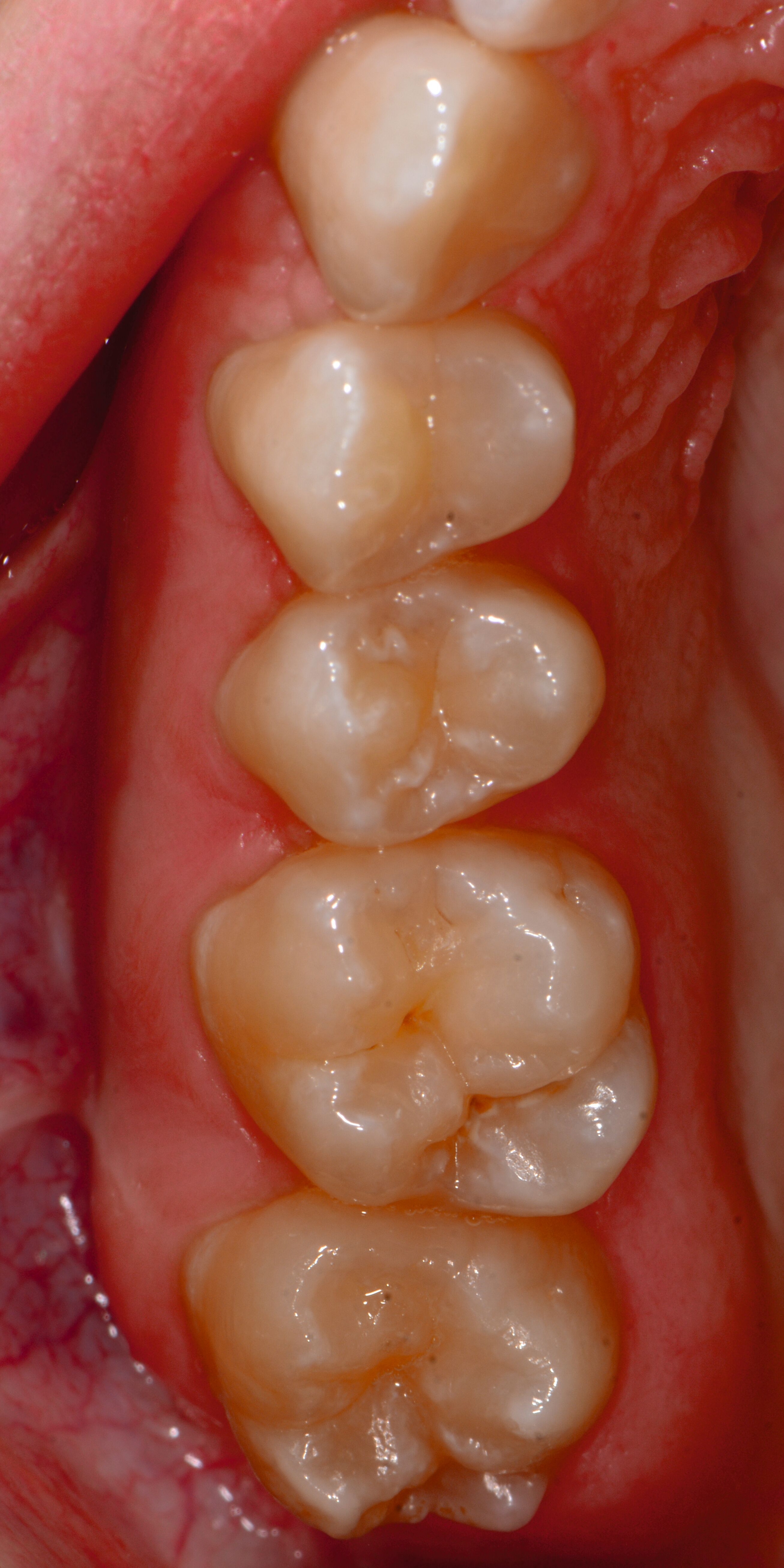
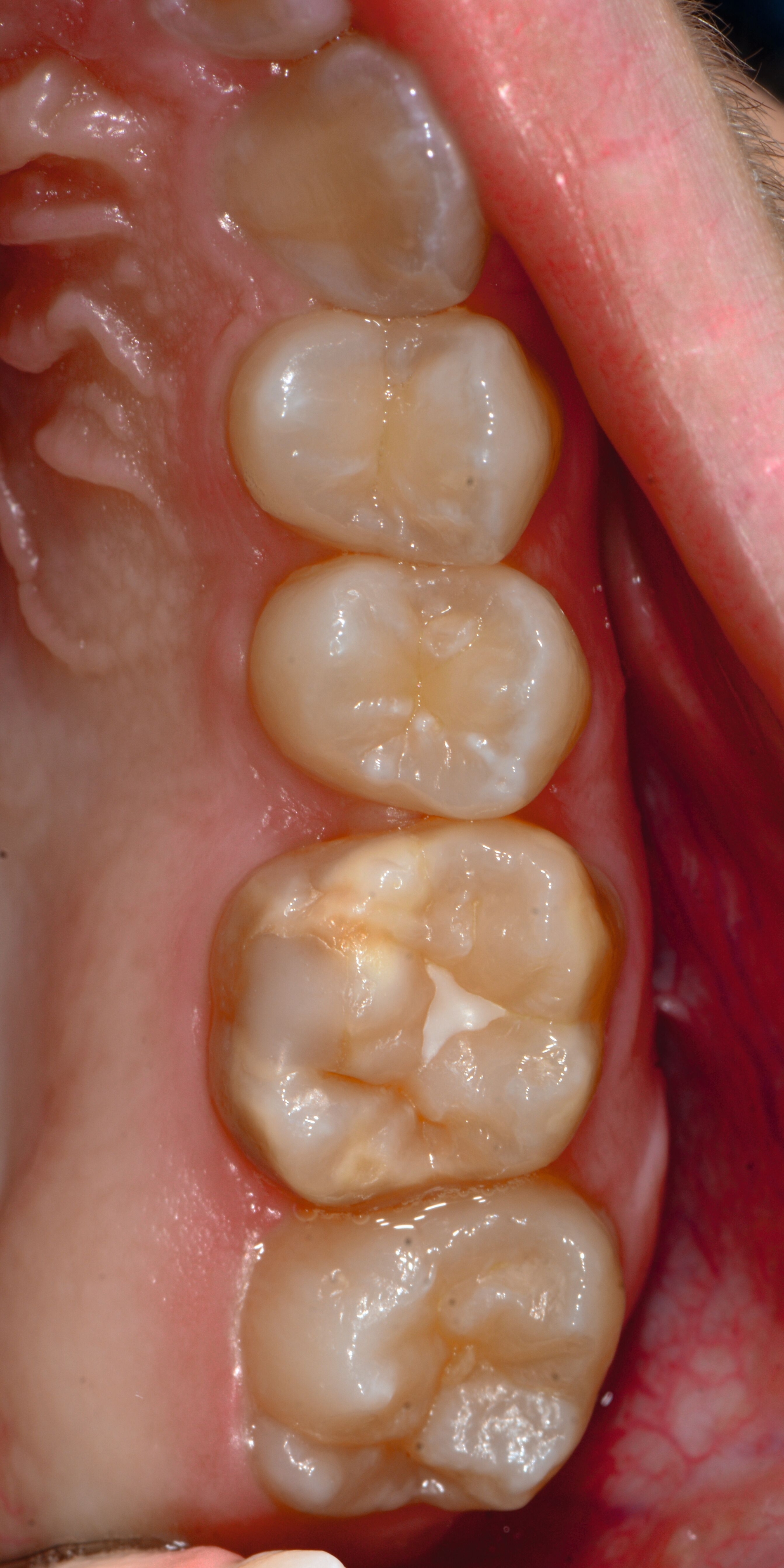
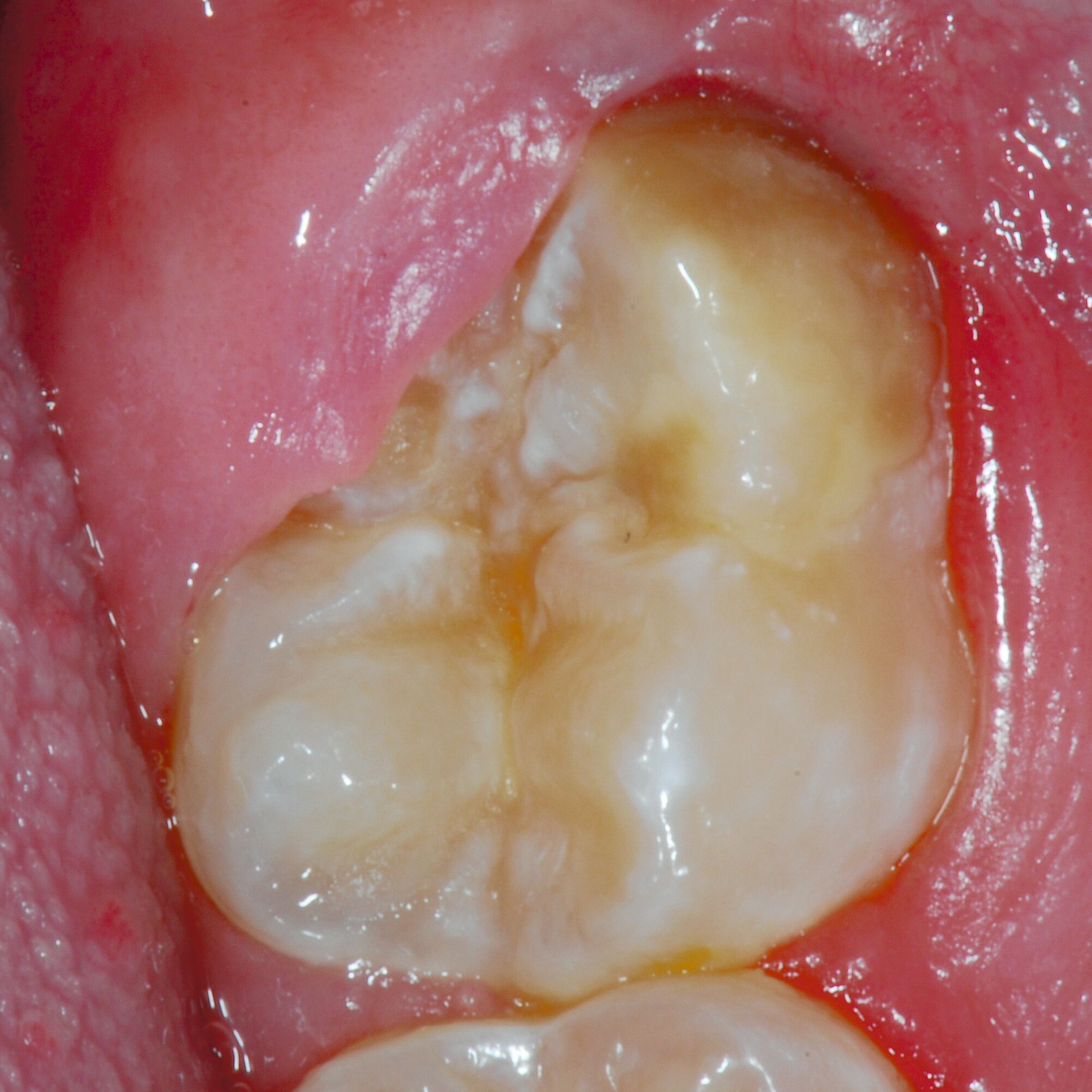
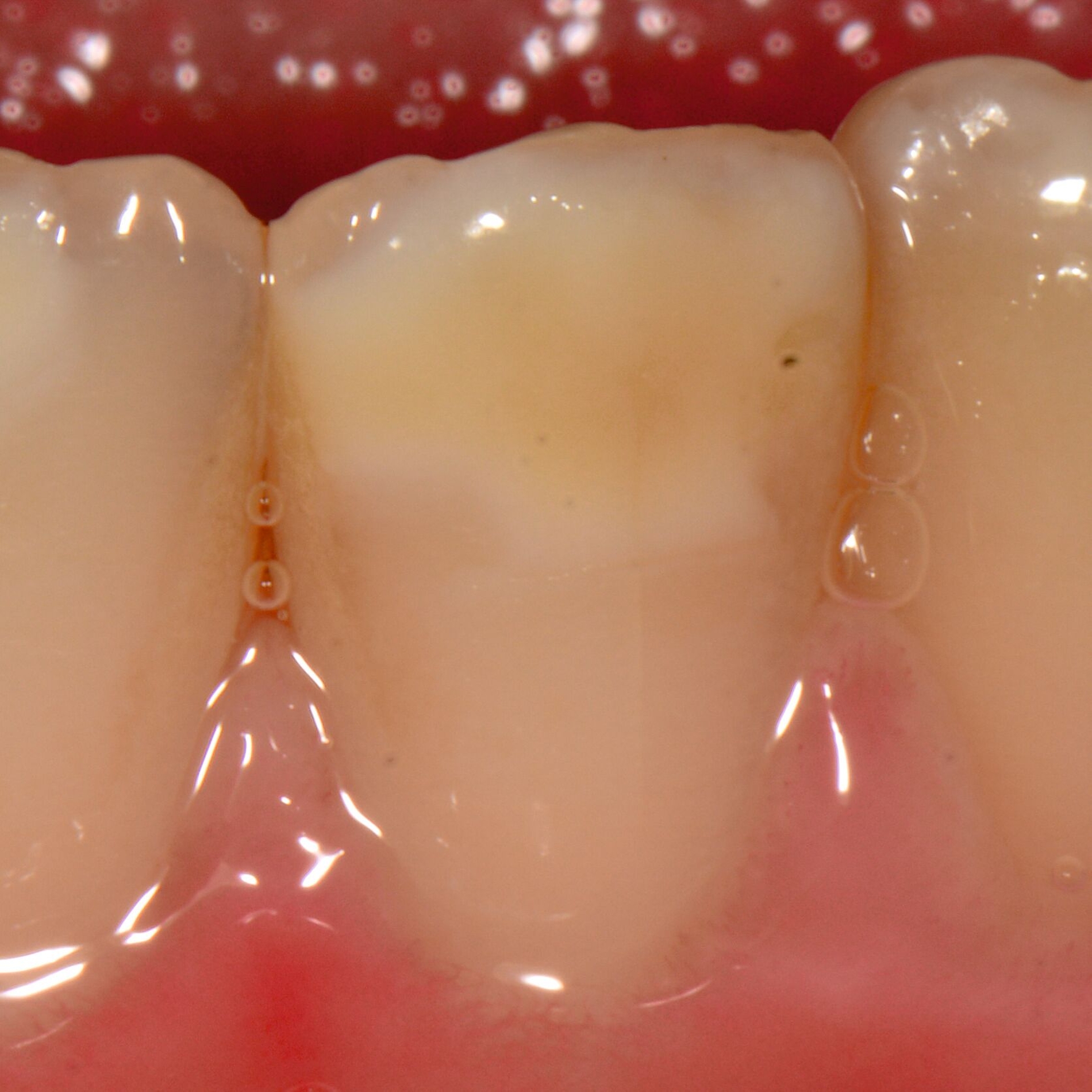
Die MIH (Abbildungen 1 und 2) stellt eine Strukturstörung der Zähne dar, die sich während der Zahnentwicklung manifestiert und daher bereits vor dem Durchbruch des Zahns in die Mundhöhle vorhanden ist. Obwohl der Name suggeriert, dass die ersten bleibenden Molaren und bleibenden Inzisiven die bevorzugten Indexzähne beziehungsweise Zahngruppen in der bleibenden Dentition sind, nutzt die Definition der European Academy of Paediatric Dentistry (EAPD) ausschließlich die ersten bleibenden Molaren zur Diagnosestellung. Entsprechend dieser Vorgabe muss zumindest ein erster bleibender Molar Zeichen einer MIH-bedingten Strukturstörung aufweisen [Lygidakis et al., 2010, 2022], damit die Diagnose einer MIH gestellt werden kann.
Werden die verfügbaren Daten aus aktuellen epidemiologischen Erhebungen unter Berücksichtigung der EAPD-Definition betrachtet, sind etwa 15 Prozent der Heranwachsenden in Deutschland von einer MIH betroffen [Bekes et al., 2025; Fresen et al., 2024]. Darüber hinaus wurden in der Vergangenheit regionale Unterschiede beschrieben [Petrou et al., 2014], die eine mögliche Ungleichverteilung signalisieren. Die Daten aus Deutschland ordnen sich in die weltweit verfügbaren Häufigkeitsangaben weitgehend nahtlos ein.
Systematisch recherchierte Meta-Analysen ergeben dafür mittlere Häufigkeiten zwischen 12.8 Prozent (Konfidenzintervall 11.5–14.1) bis 15.5 Prozent (14.4–16.6) [Hernandez et al., 2016; Zhao et al., 2021; Lopes et al., 2021; Sluka et al., 2024; Schwendicke et al., 2018; Ammar et al., 2025]. Diese Größenordnungen zeigen, dass es sich bei der MIH um ein prävalentes Zustandsbild handelt, mit dem der Zahnarzt vertraut sein muss.
Prof. Dr. med. dent. Jan Kühnisch
1991 – 1996: Studium der Zahnmedizin an der Universität Leipzig und Friedrich-Schiller-Universität Jena/ Bereich Erfurt
1998 – 1999: Assistenzzeit in zahnärztlicher Praxis
1999: Dissertation mit dem Prädikat „summa cum laude“
2000: Wissenschaftlicher Assistent an der Poliklinik für Präventive Zahnheilkunde der FSU Jena
2003: Spezialisierung im Fachbereich “Kinder- und Jugendzahnheilkunde”
seit 2004: Zahnarzt und wissenschaftlicher Mitarbeiter an der Poliklinik für Zahnerhaltung und Parodontologie der Ludwig-Maximilians-Universität München
2006: Ernennung zum Oberarzt im Funktionsbereich Kinder- und Jugendzahnheilkunde an der Poliklinik für Zahnerhaltung und Parodontolgie der LMU München
2008/2009: Habilitation und Ernennung zum Privatdozenten
2015: Ernennung zum APL-Professor
Klinisches Erscheinungsbild
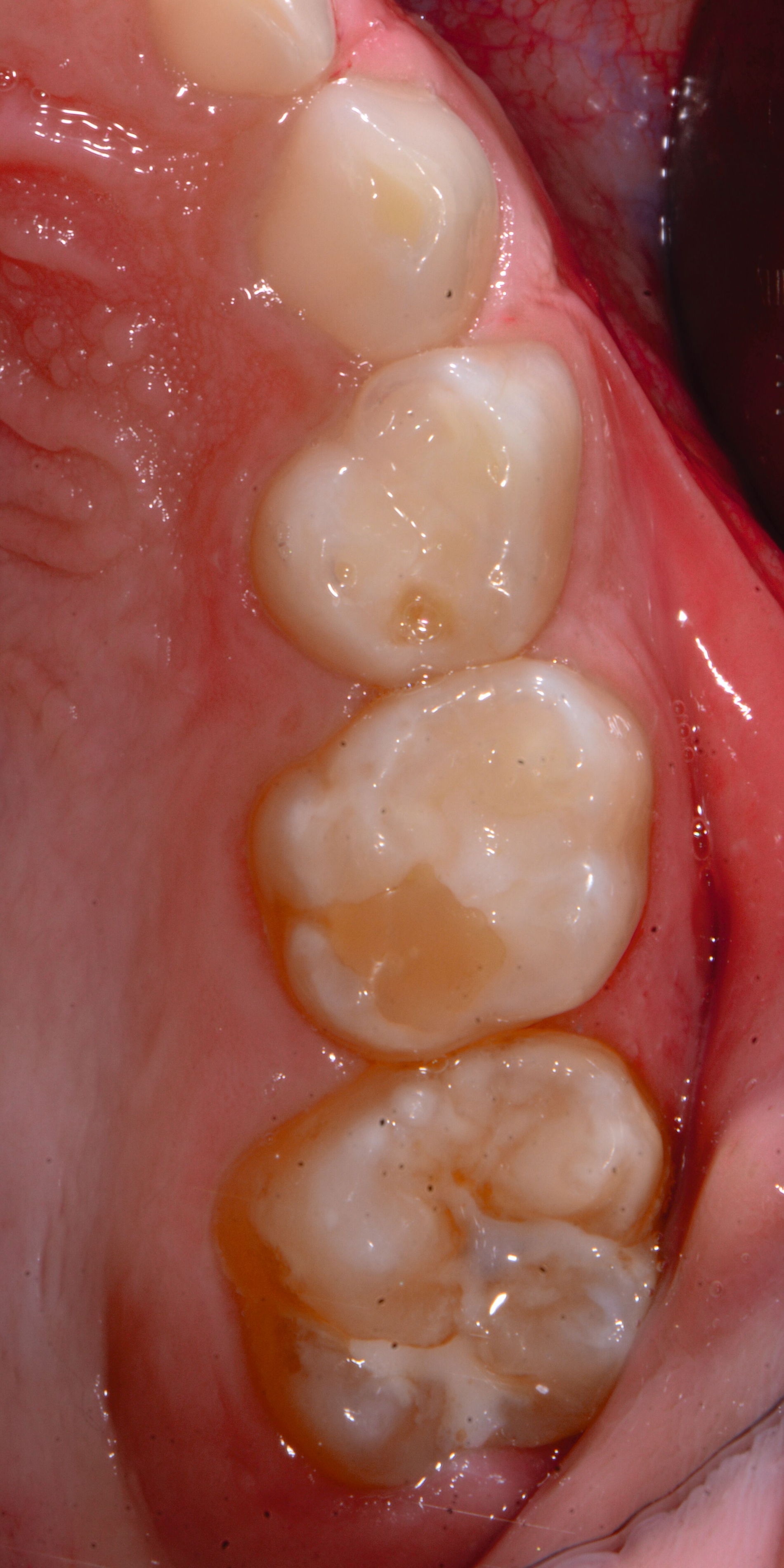
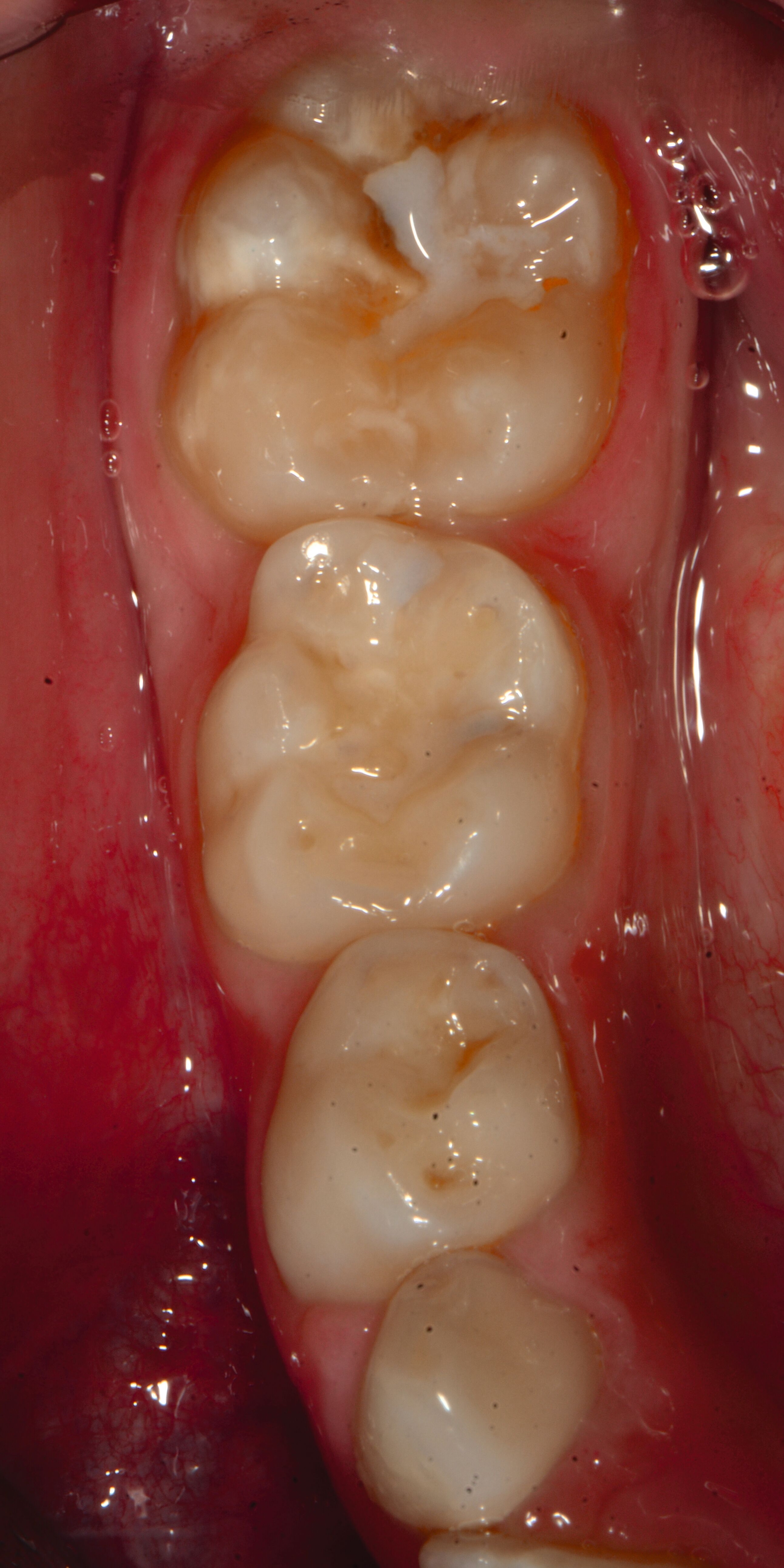
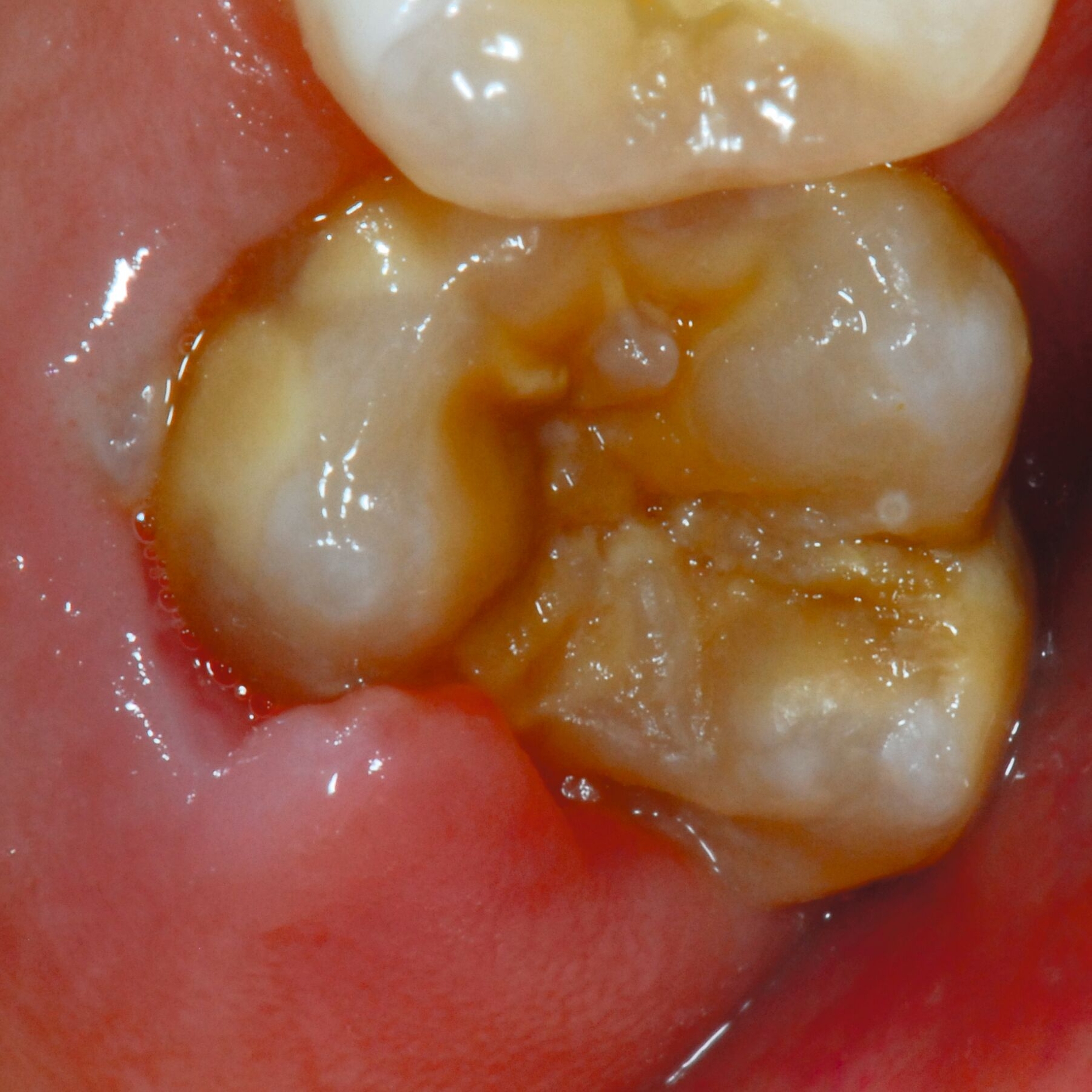
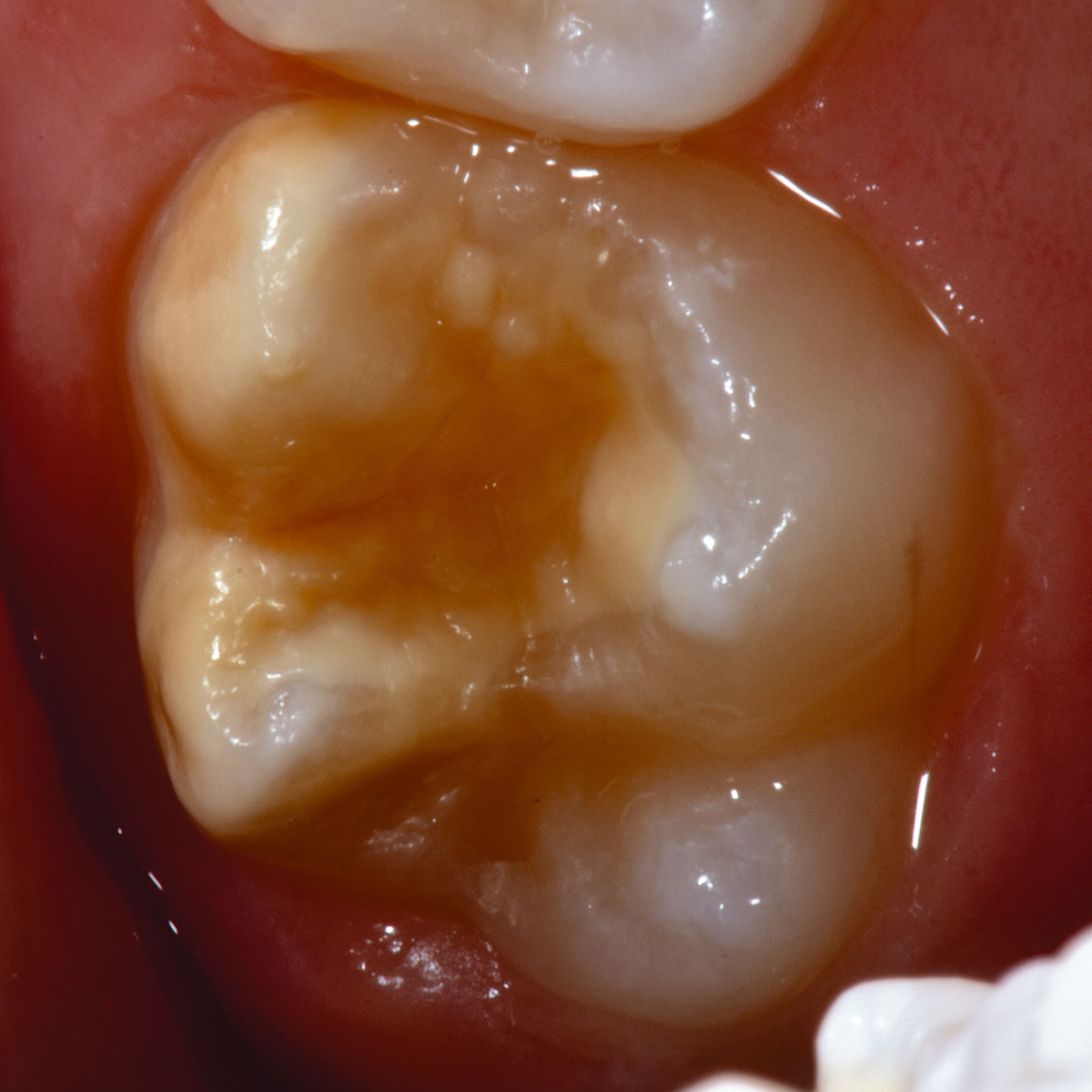
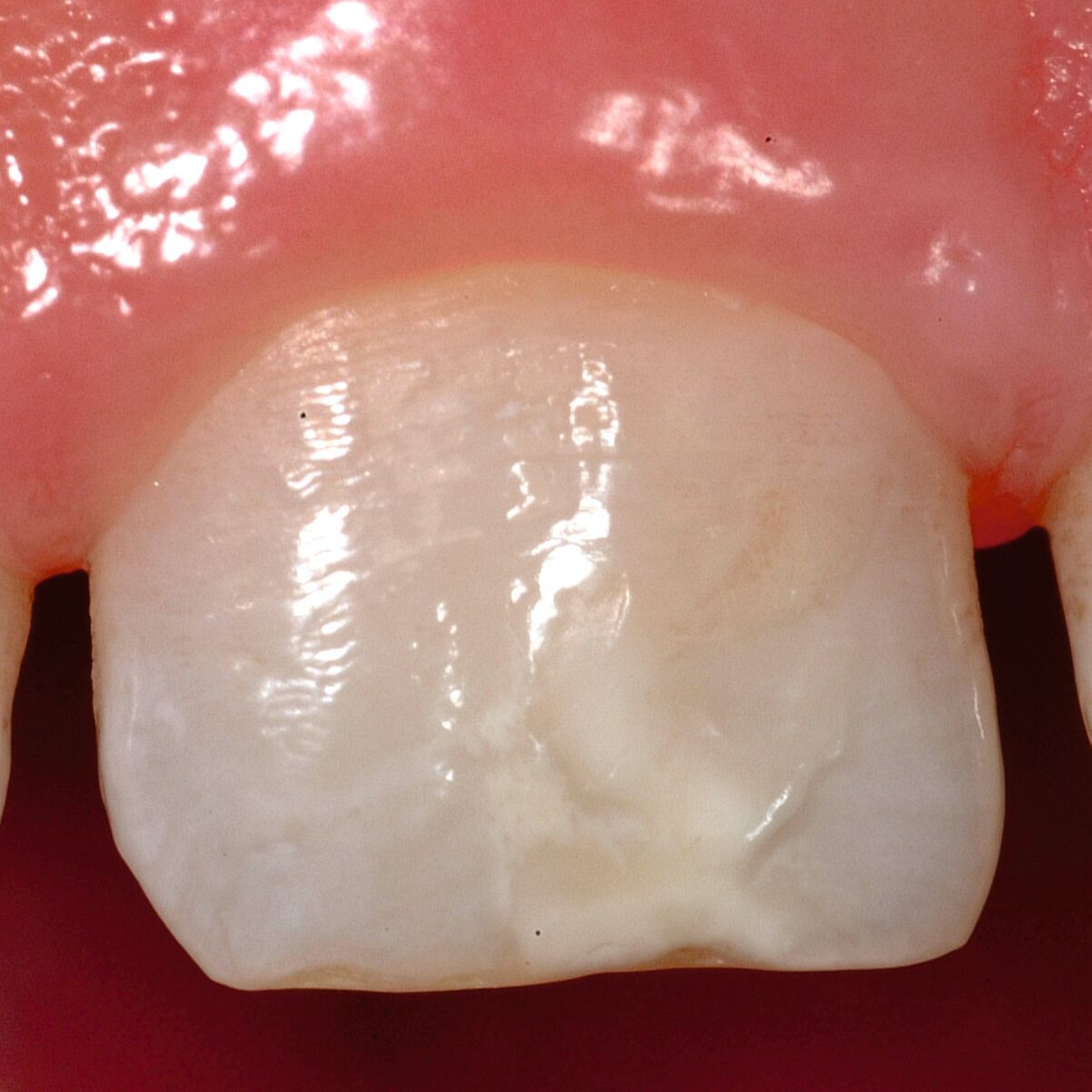
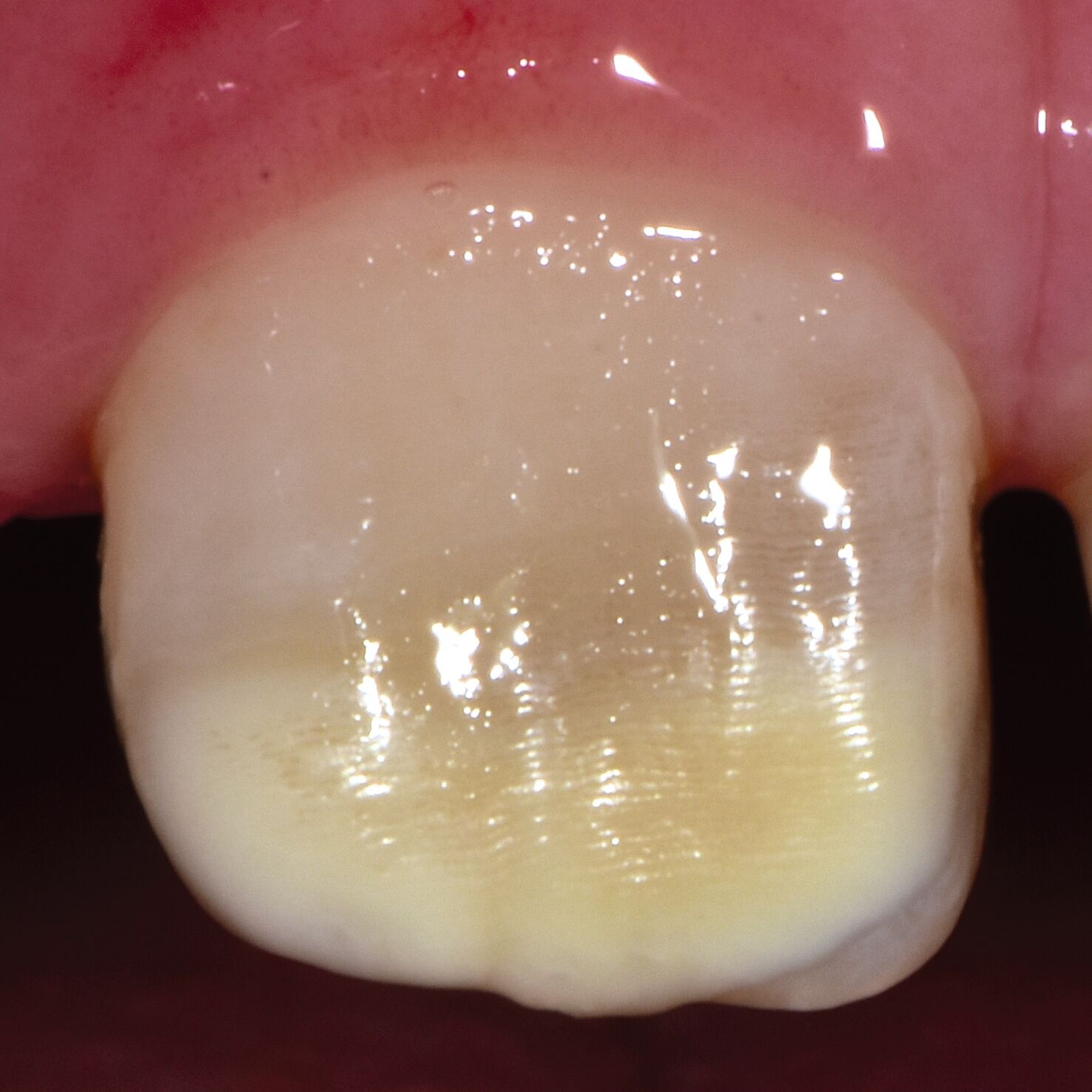
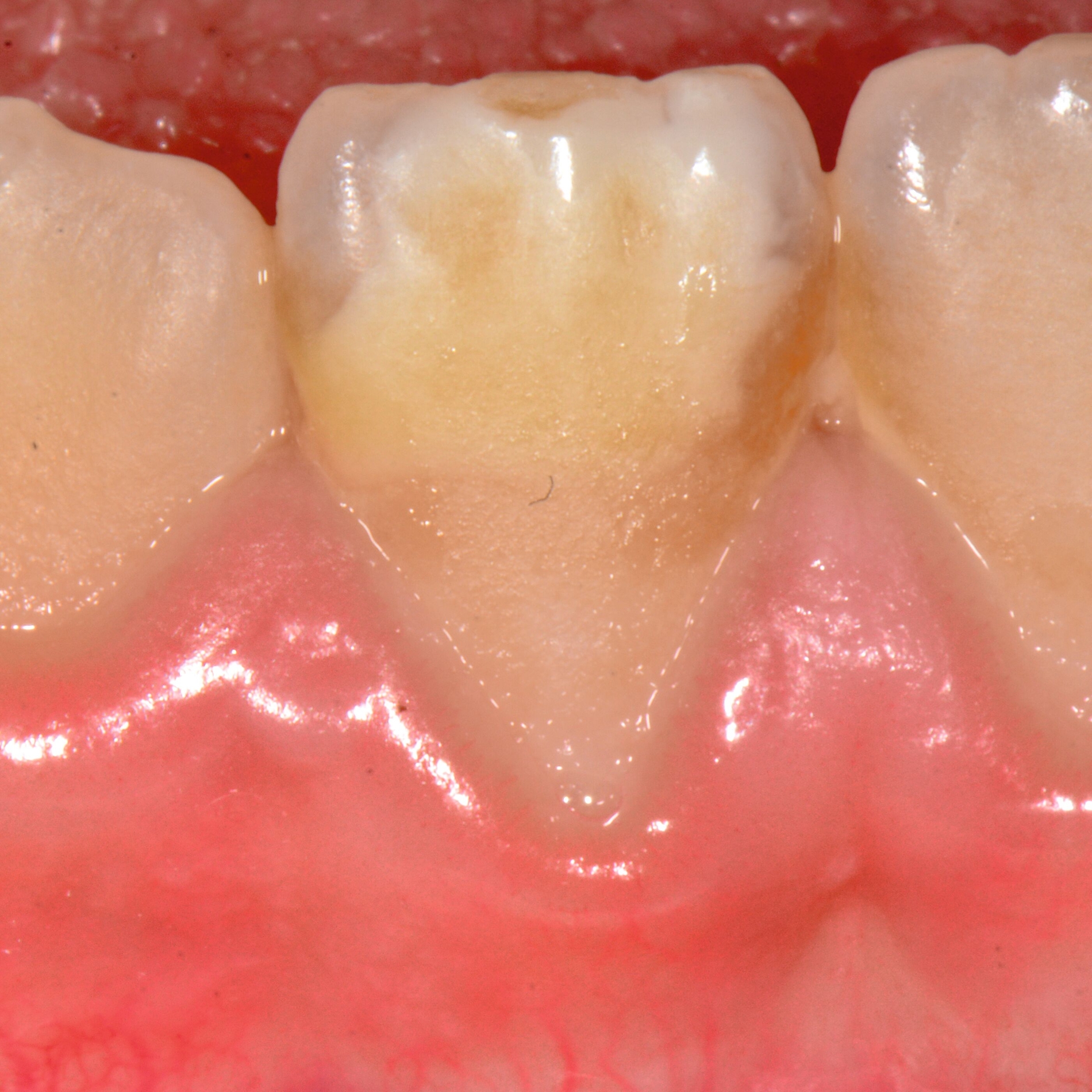
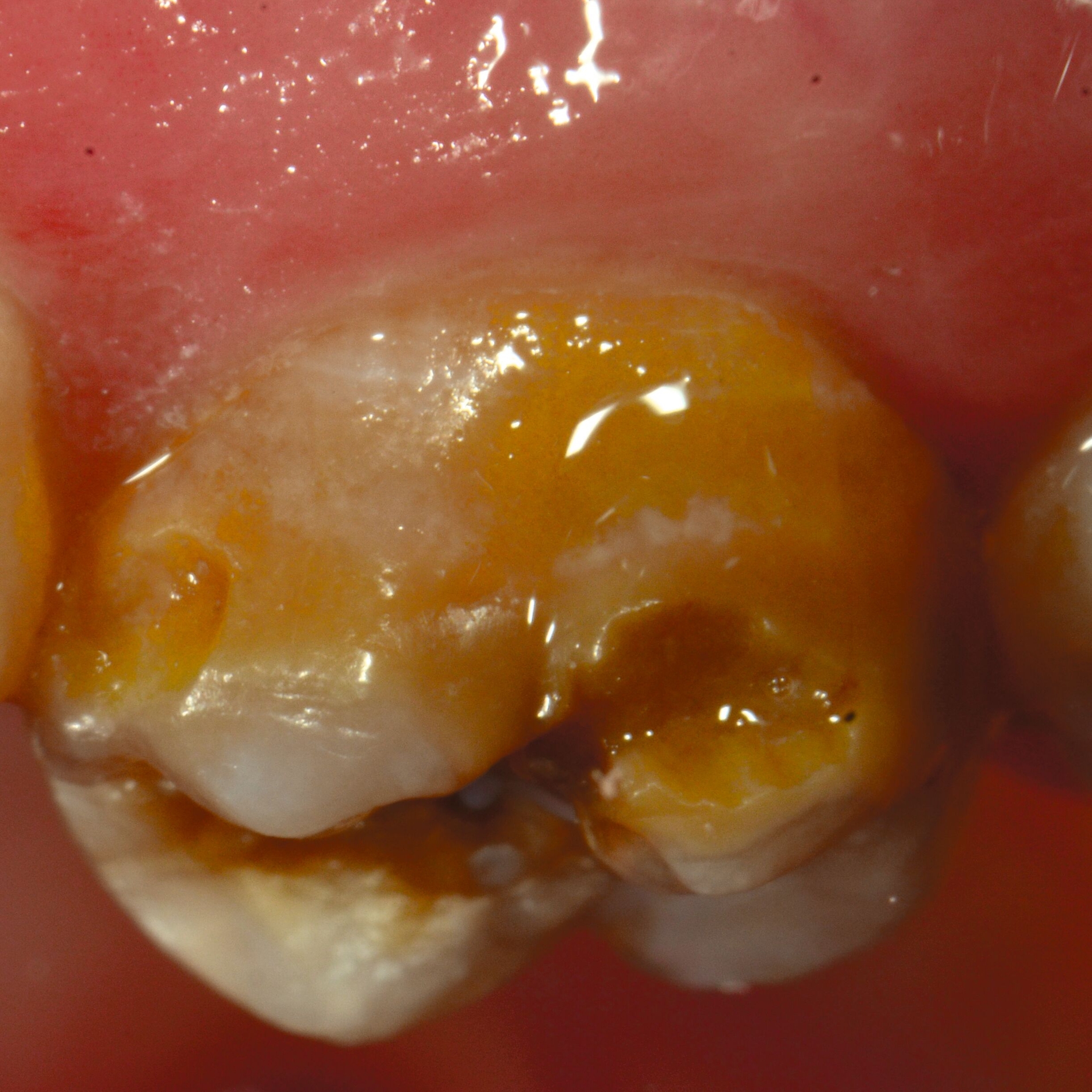
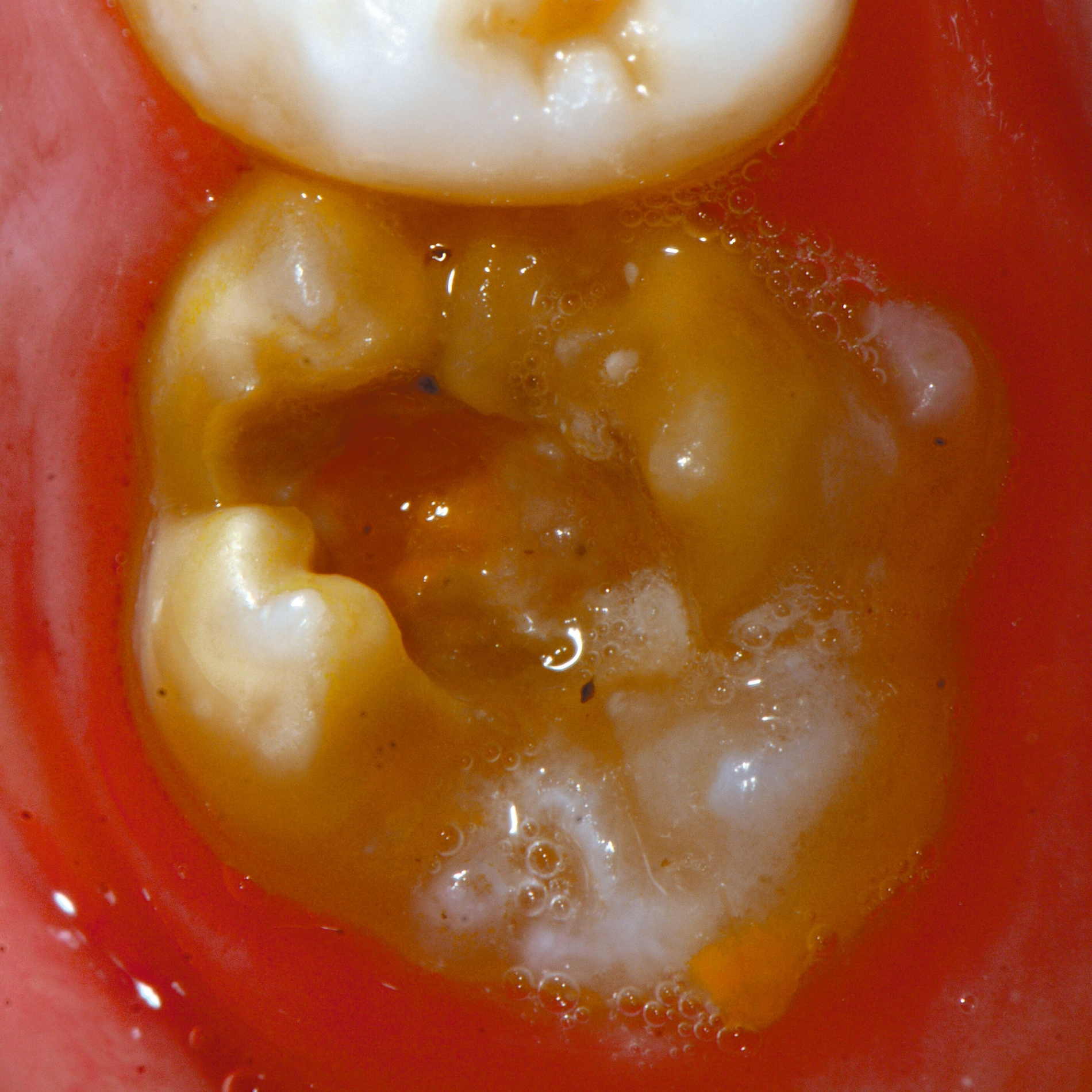
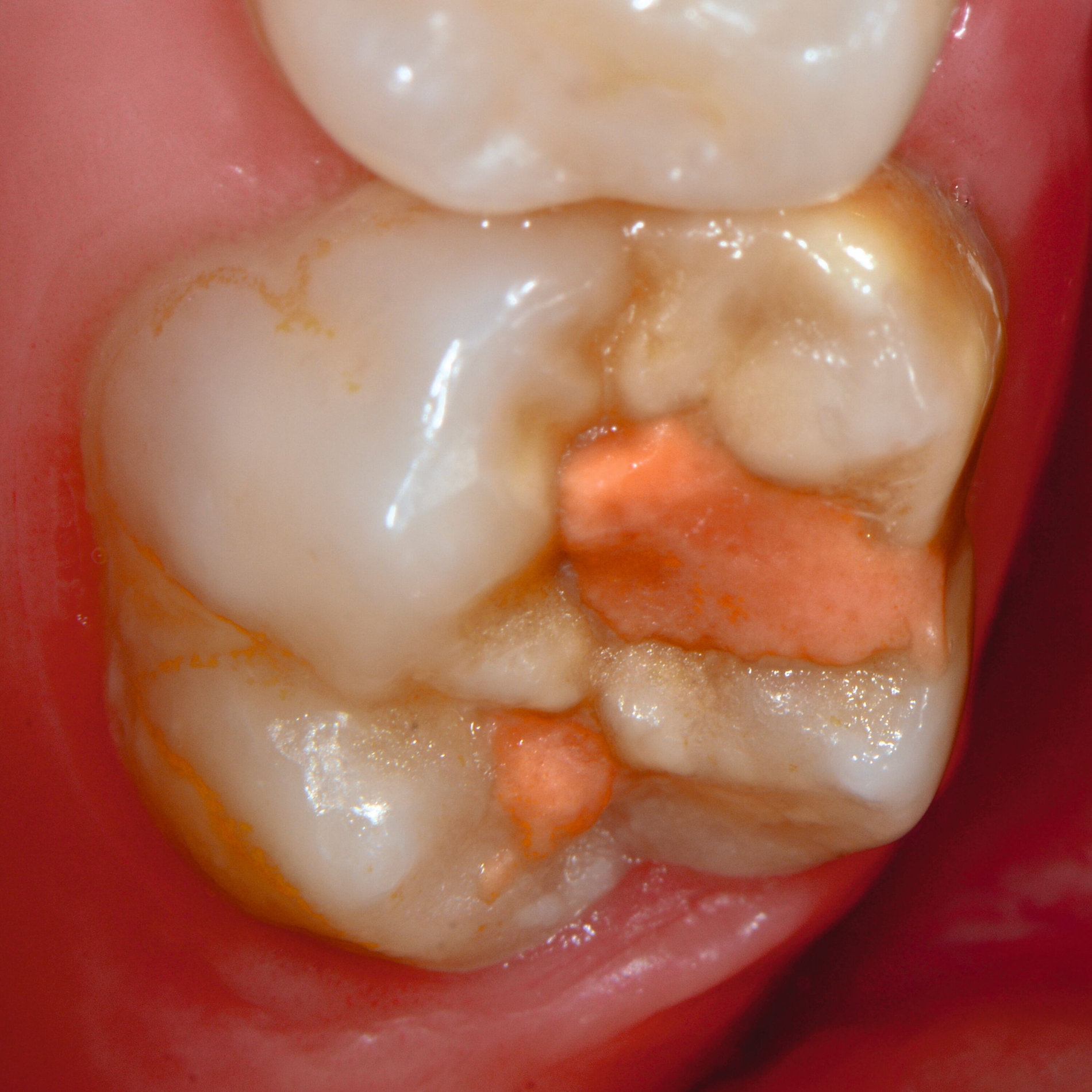
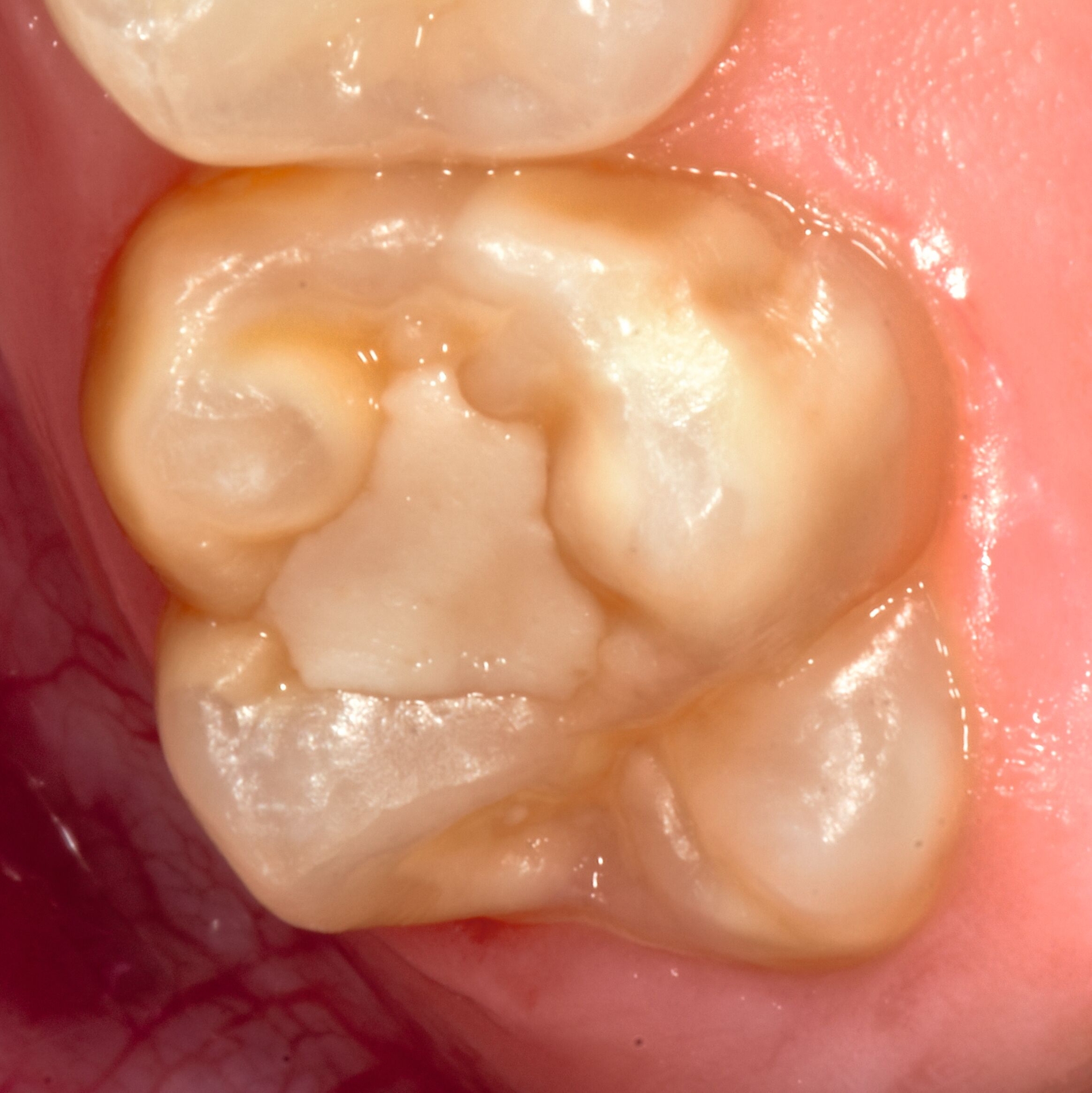
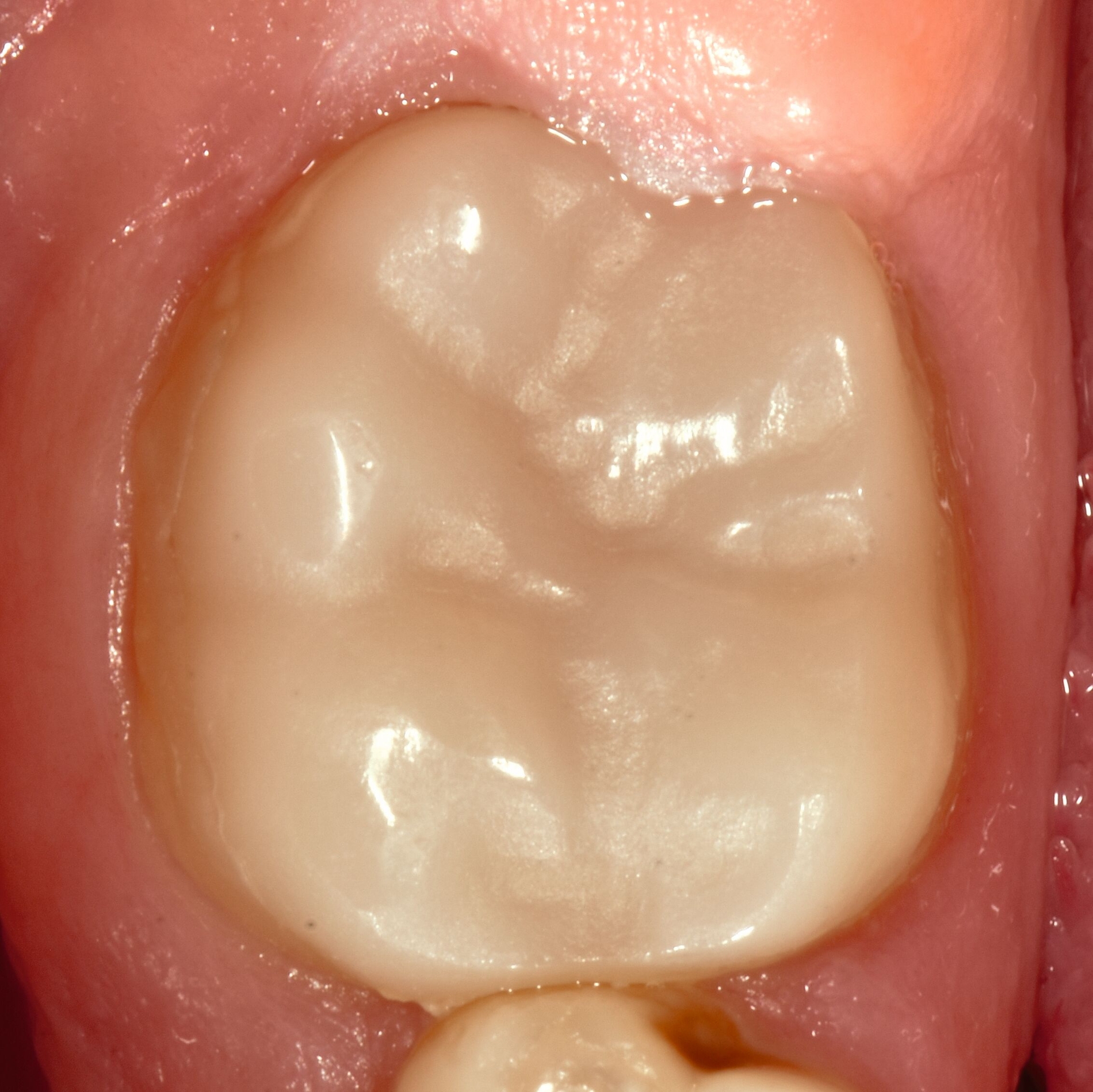
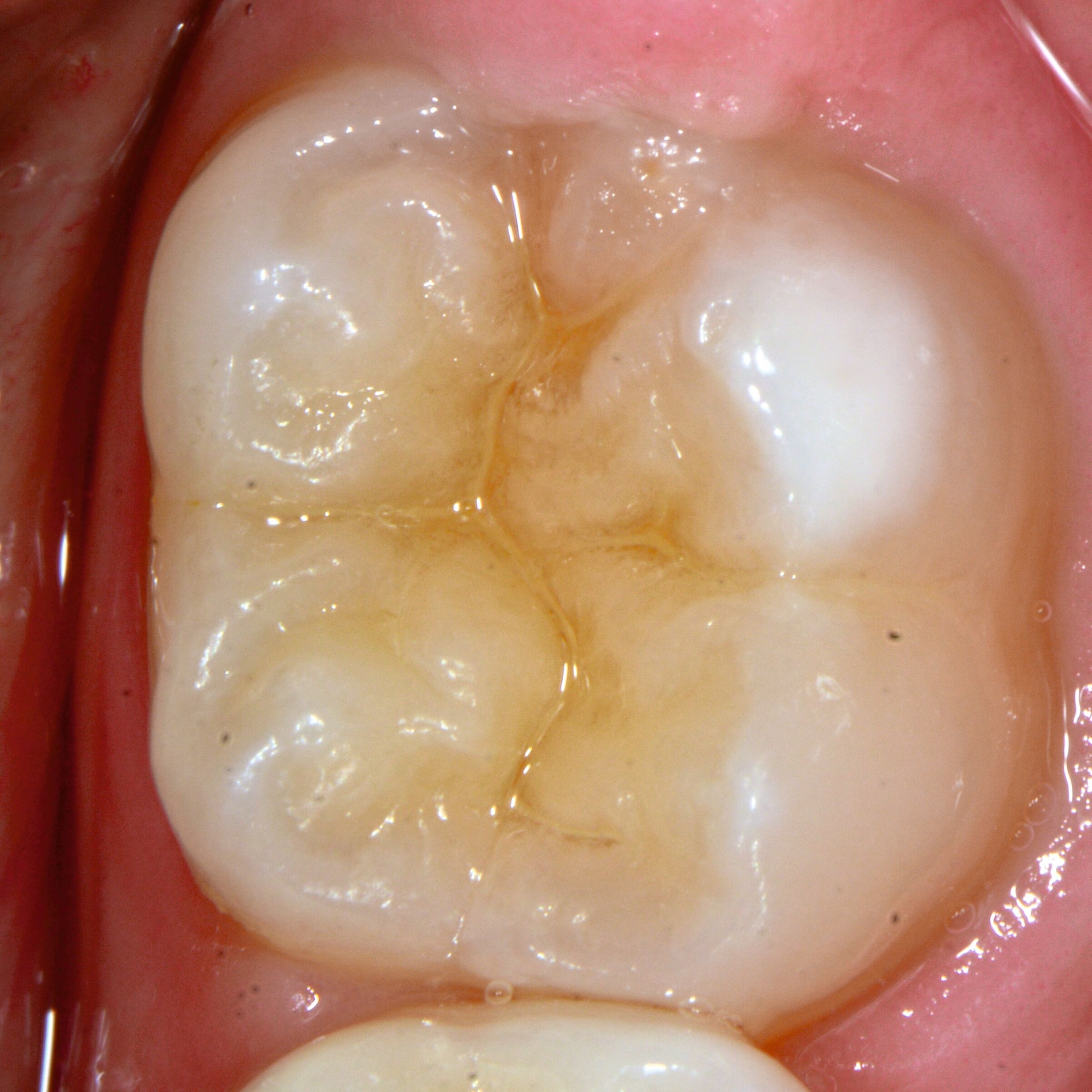
Das klinische Erscheinungsbild an bleibenden Zähnen zeigt typischerweise weißlich-gelbe bis gelblich-braune Opazitäten, die zumindest in einigen Bereichen durch eine scharfe Abgrenzung (engl.:„demarcated opacities“) zum gesunden Zahnschmelz charakterisiert sind (Abbildungen 3 und 4). Die abgegrenzten Hypomineralisationen befinden sich mehrheitlich im Bereich der inzisalen Kronenhälfte unabhängig von dem Auftreten an Front- oder Seitenzähnen. Die Ausprägung am Zahn kann dabei auf einzelne Areale oder Höcker begrenzt sein.
Bei einer schwerwiegenderen Ausprägung sind Zahnflächen vollständig betroffen, mitunter alle Zahnflächen an einem Zahn. Die Verteilung in der Dentition beziehungsweise an den Indexzähnen ist gleichermaßen variabel und betrifft nicht nur die Defektgröße, sondern auch die Farbe und Festigkeit. Was die Festigkeit betrifft, gilt als die Faustregel: Je dunkler die Farbe des Schmelzes, umso weicher beziehungsweise poröser und damit minderwertiger wird dessen Qualität sein. Damit reduziert sich seine kaufunktionelle Belastungsfähigkeit, was insbesondere an ersten bleibenden Molaren von klinischer Relevanz ist.
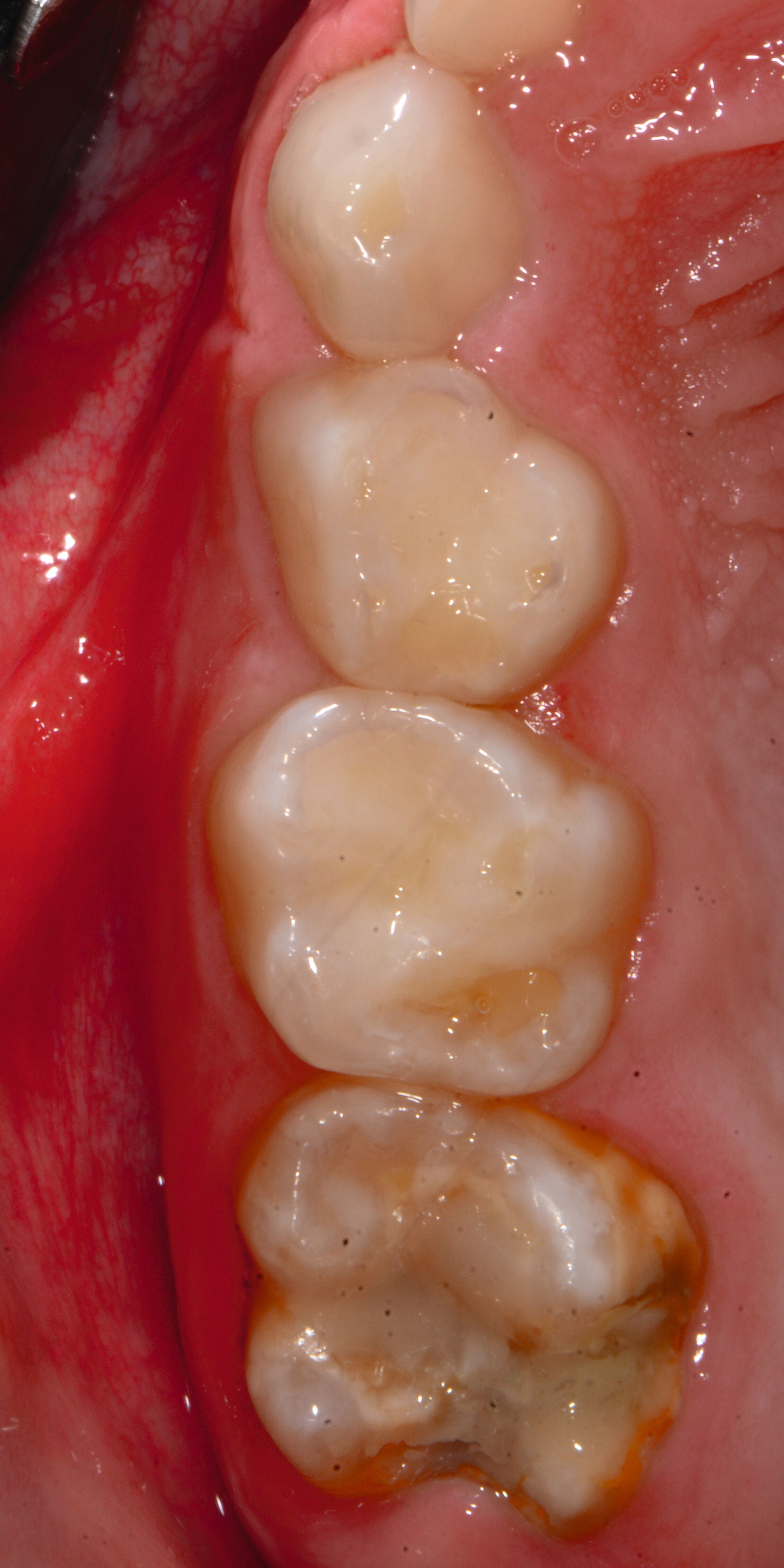
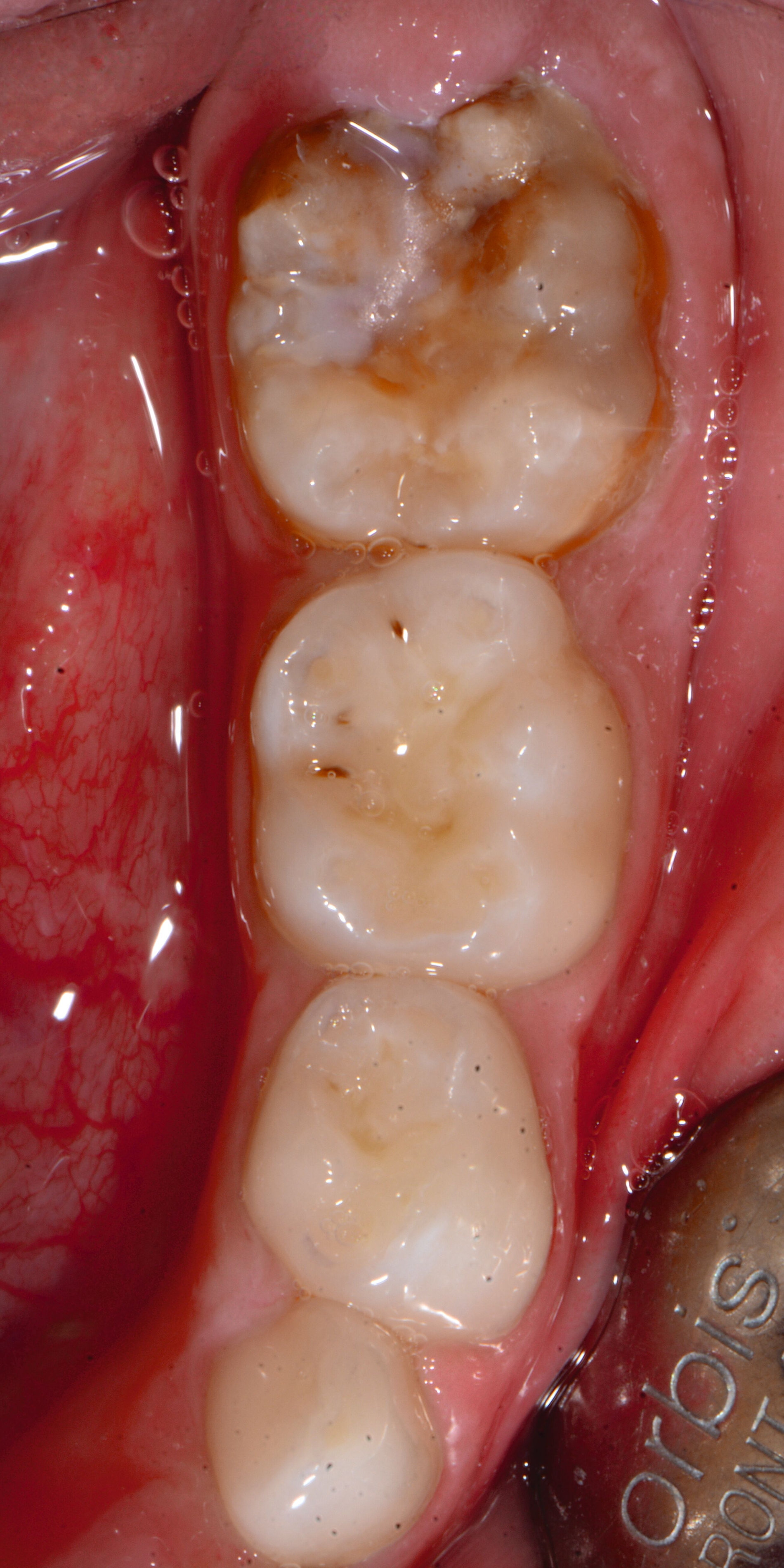
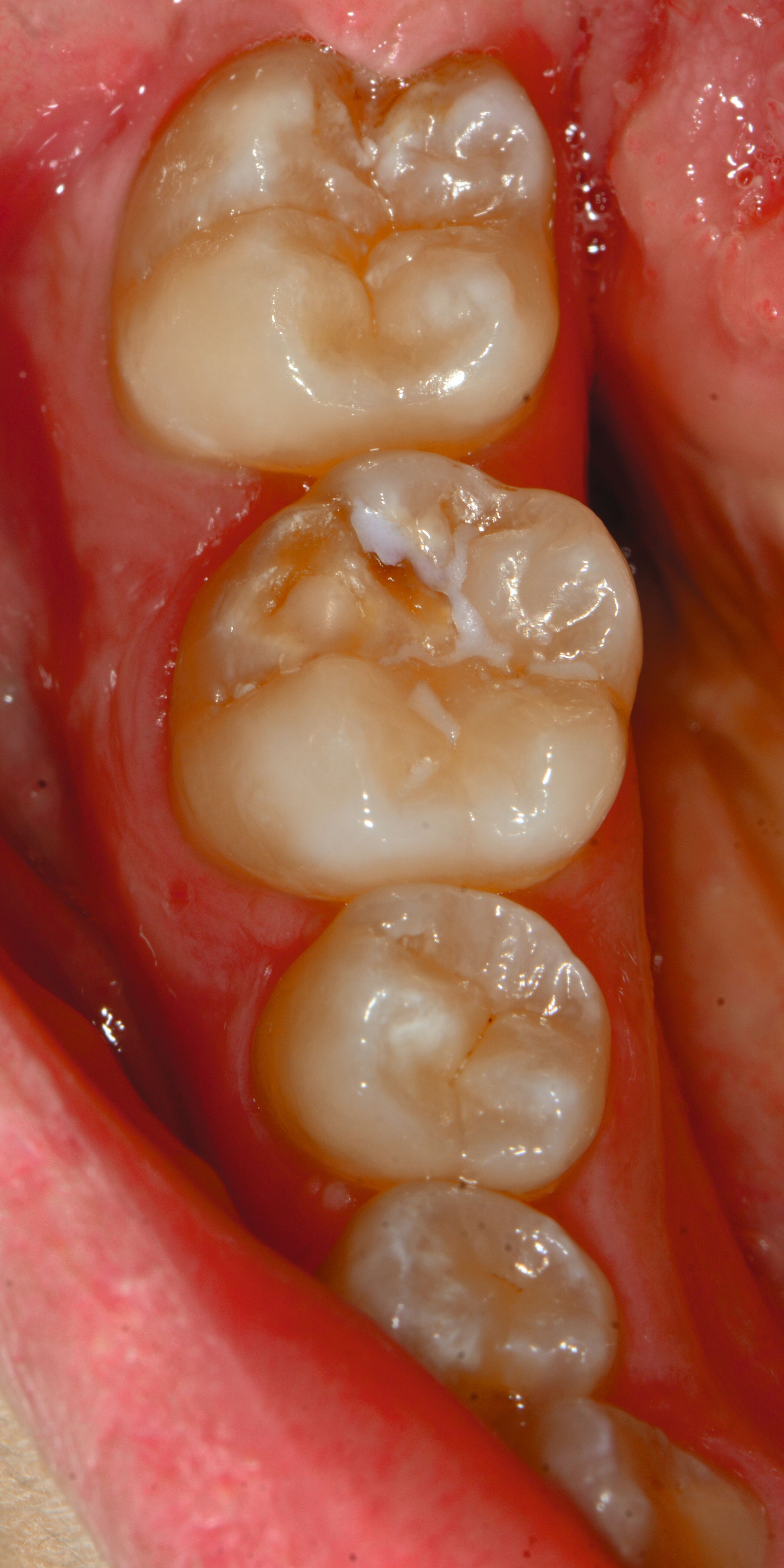
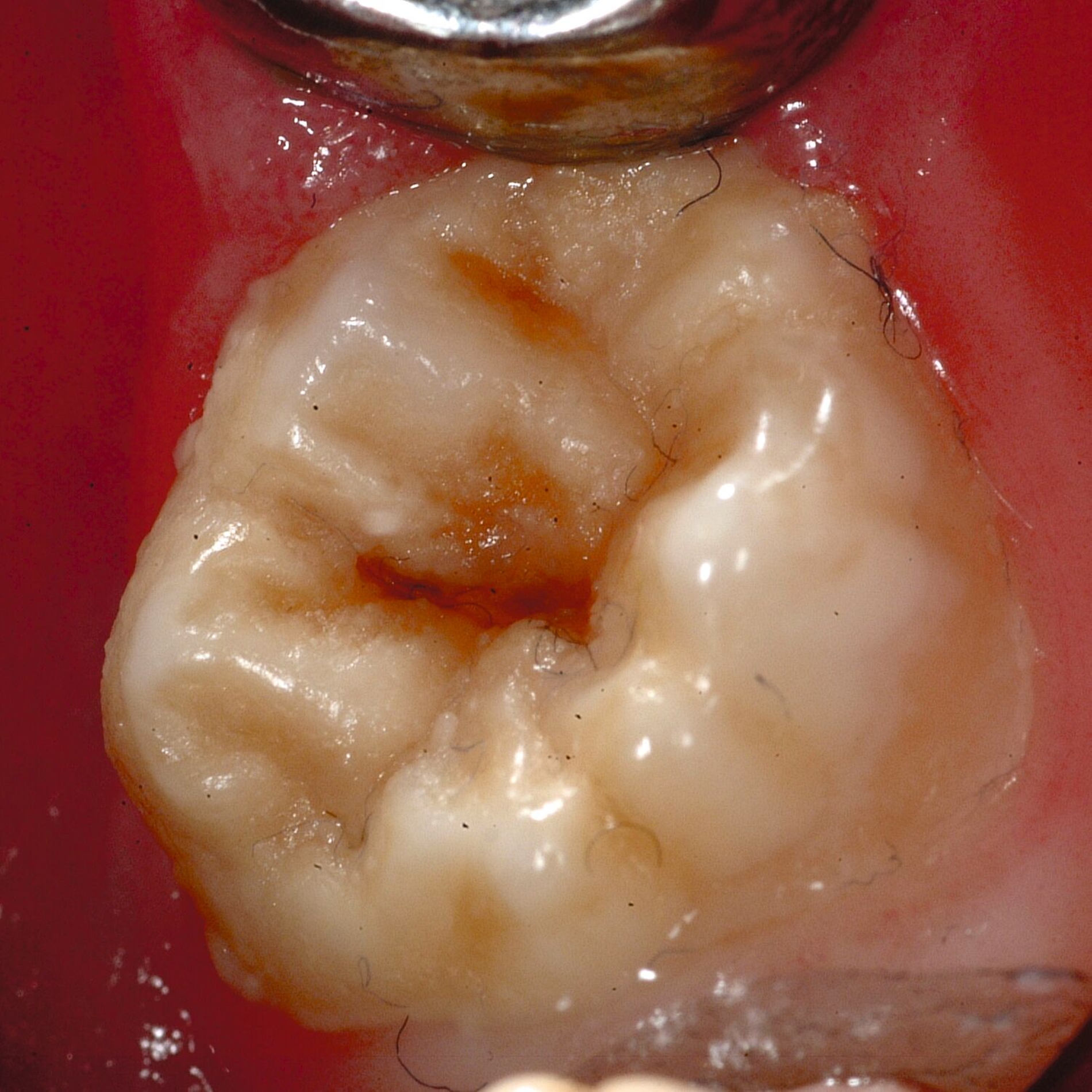
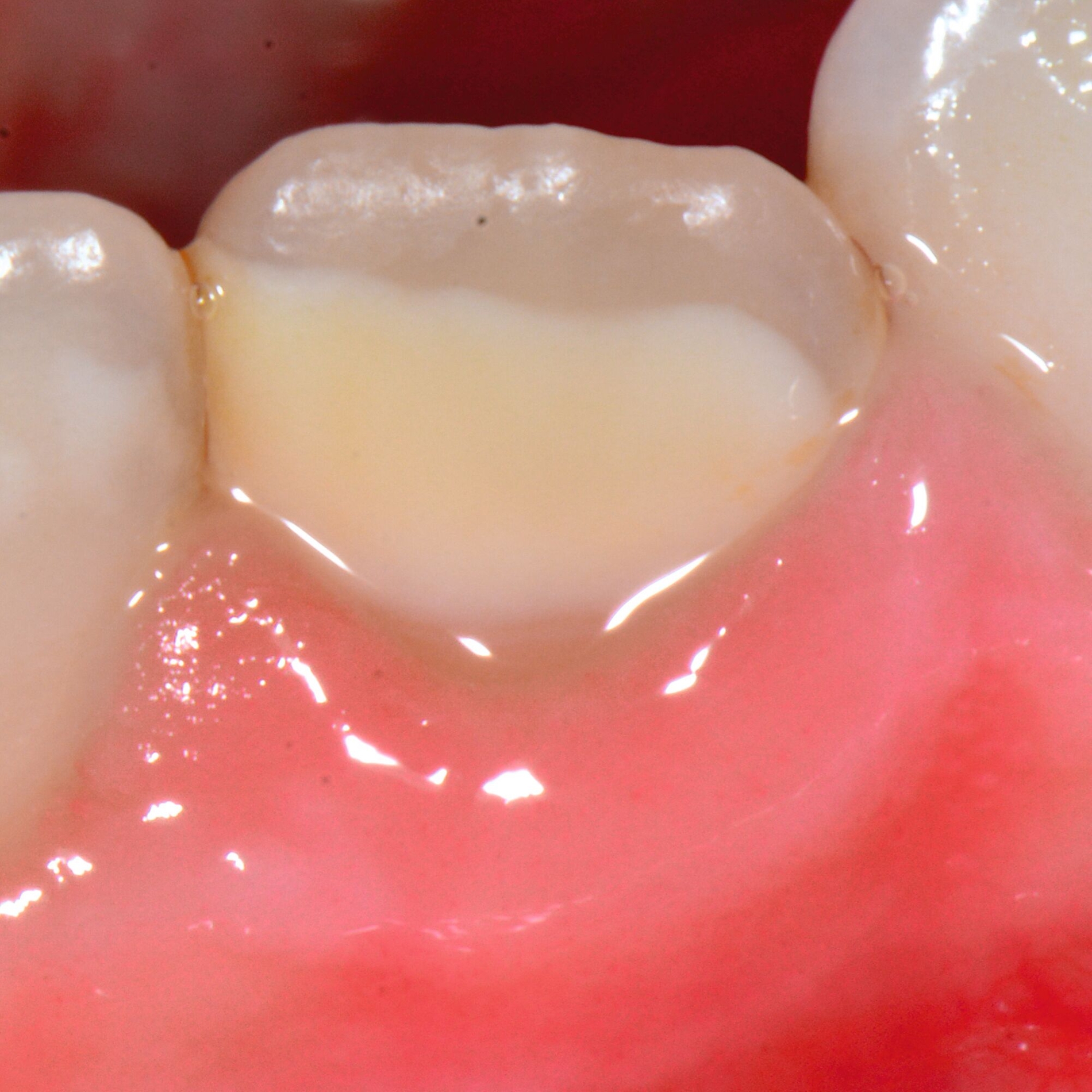
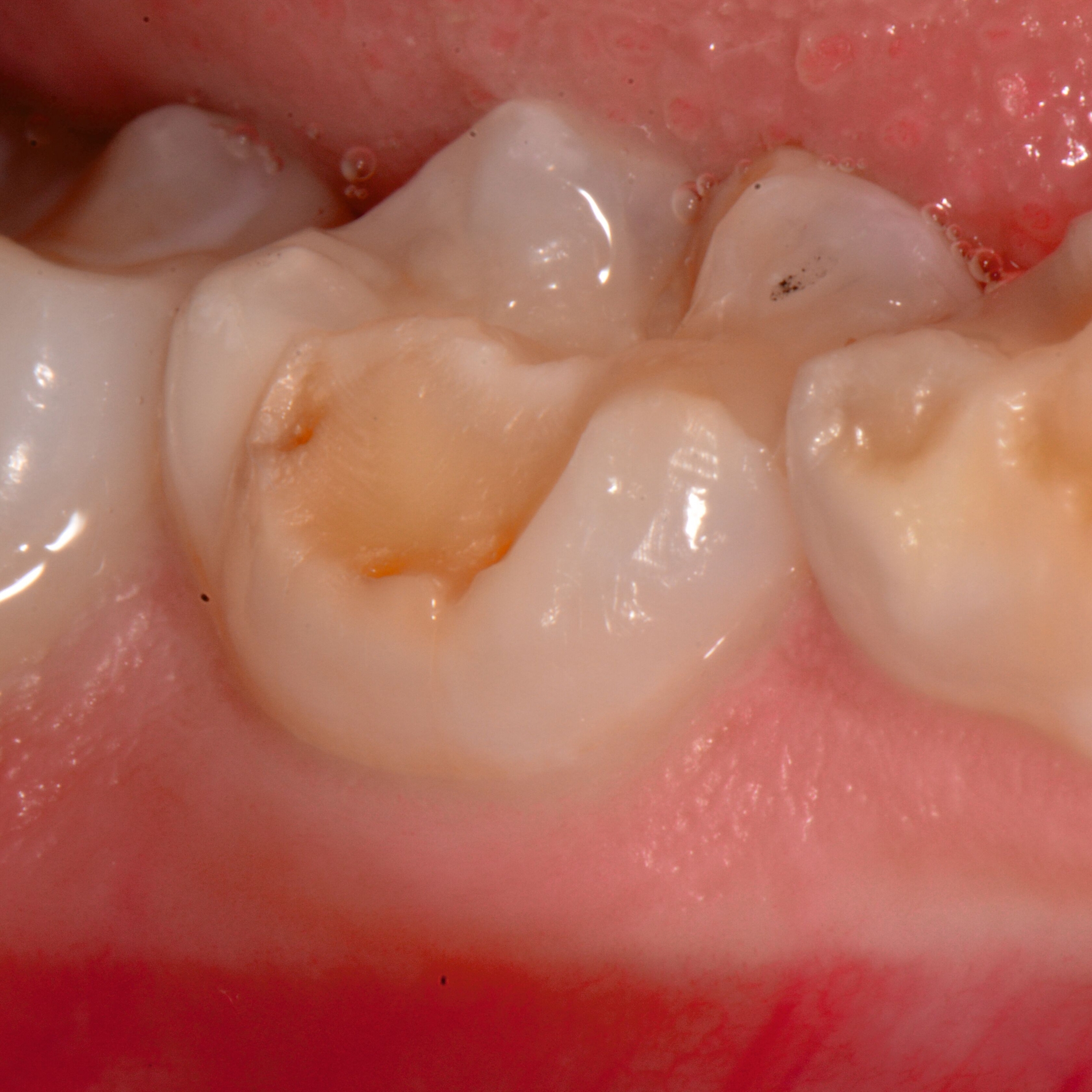
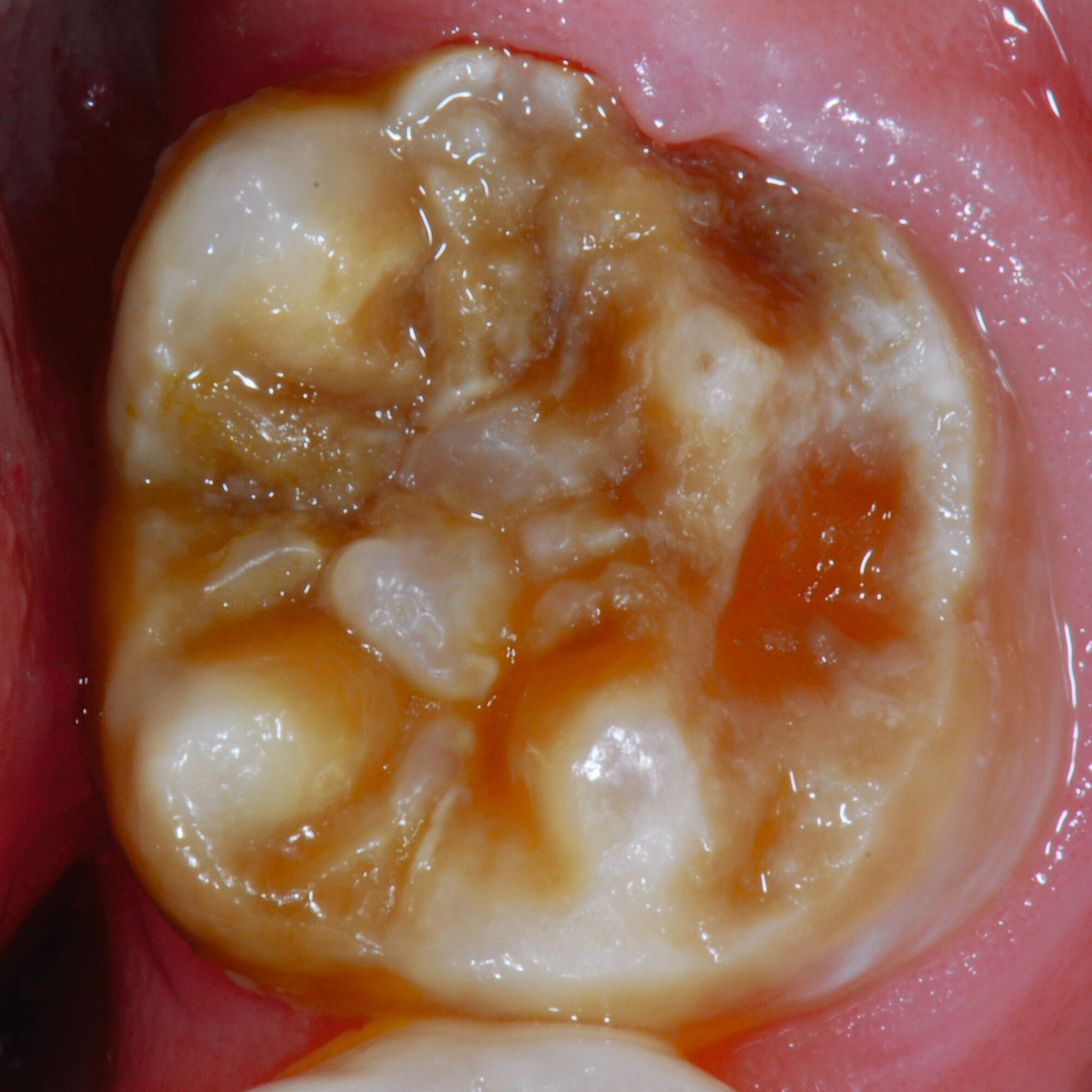
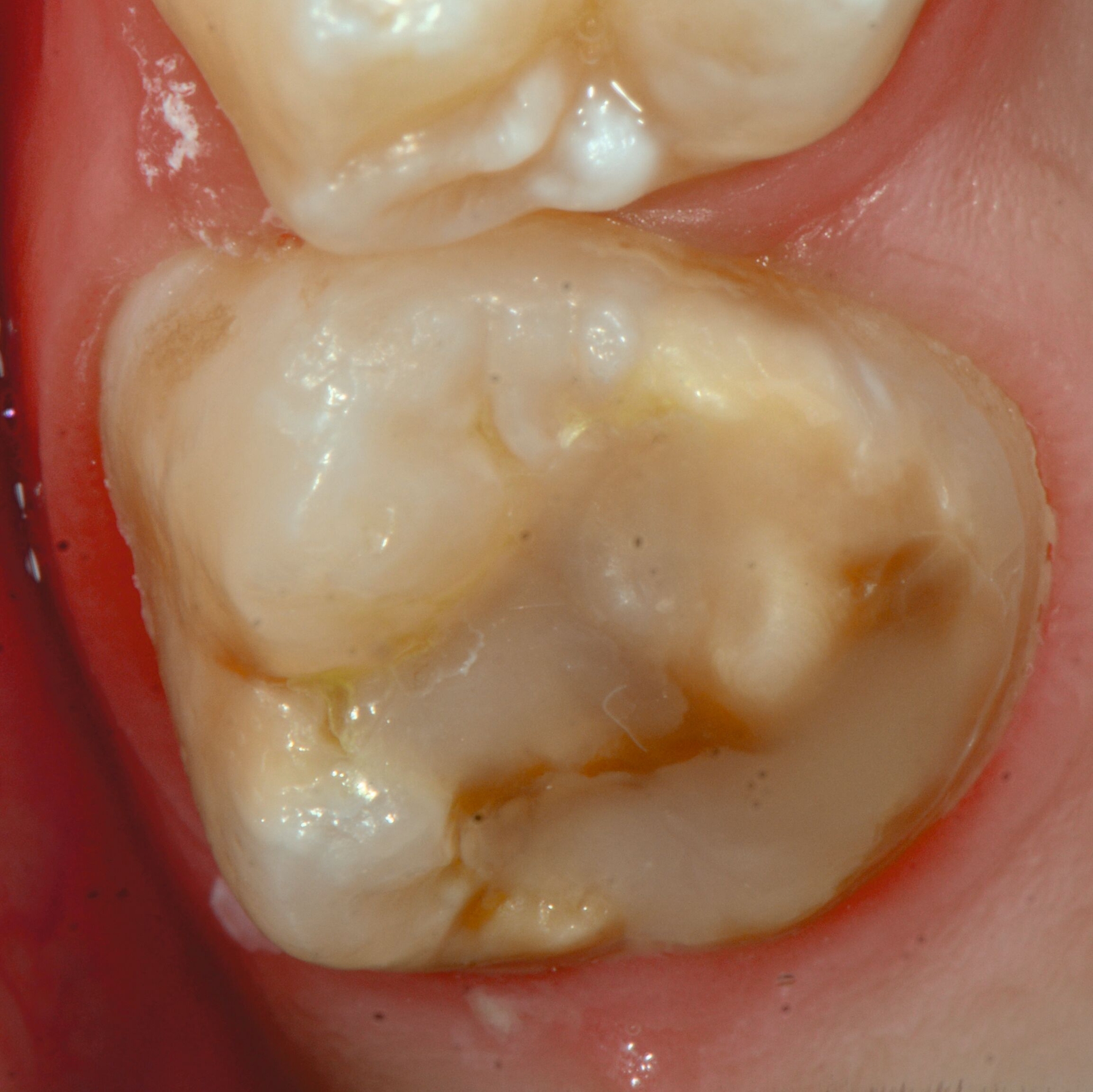
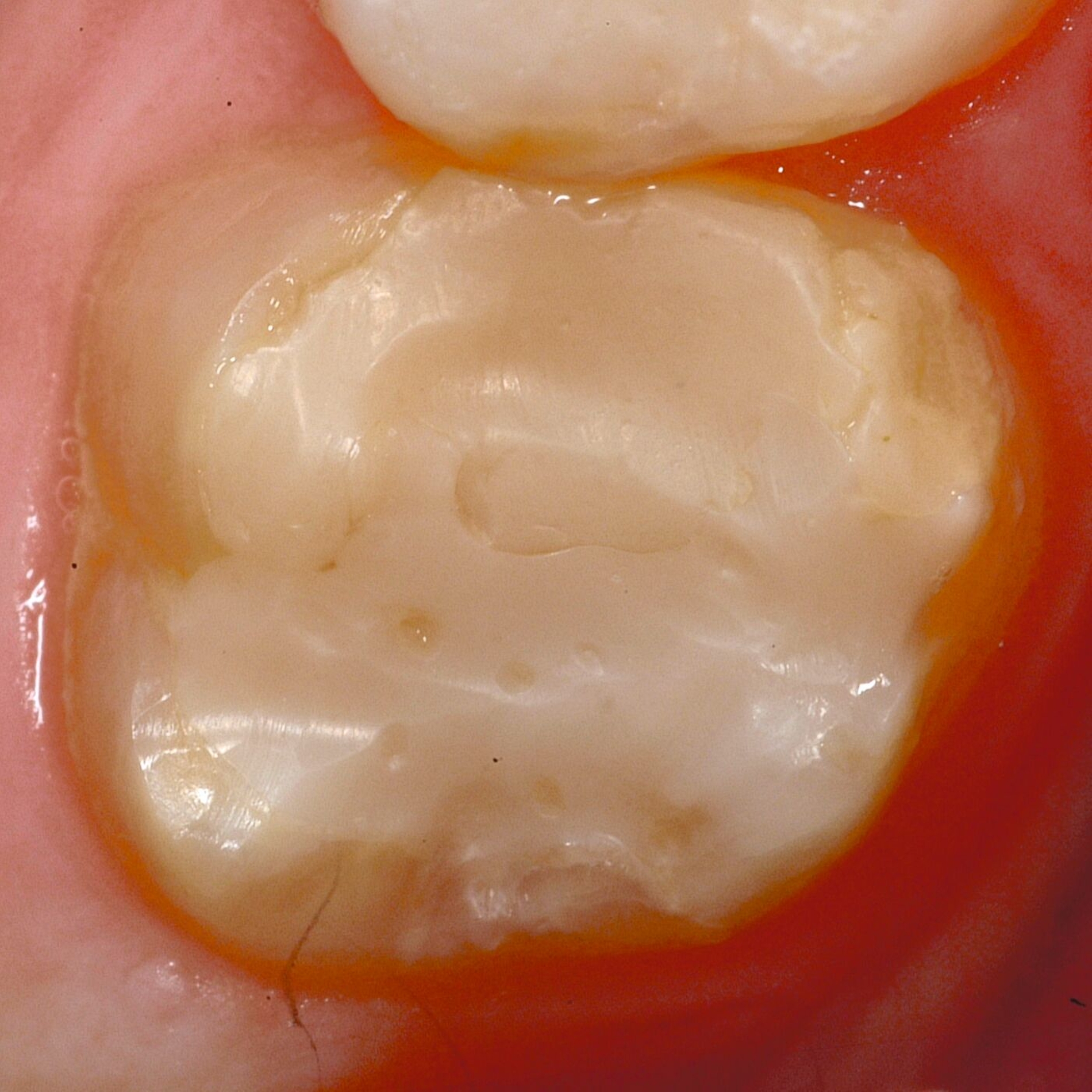
An umfangreich hypomineralisierten Zähnen können Schmelzeinbrüche (engl.: „enamel breakdown“ oder „enamel desintegration“, Abbildung 5) auftreten [Lygidakis et al., 2010; 2022]. Da diese oftmals die Folge einer fehlenden Belastungsfähigkeit des Zahnschmelzes sind und erst nach der Einstellung der Zähne in die Okklusion auftreten, werden sie auch als posteruptive Schmelzeinbrüche bezeichnet. Sie sind häufig im Bereich der Kauflächen beziehungsweise Höcker der Molaren zu finden, führen zur Dentinexposition und damit einhergehend zu ausgeprägten Hypersensitiven insbesondere bei Kindern, deren Zähne gerade erst durchgebrochen sind [Linner et al., 2021].
Frontzähne sind seltener von MIH-bedingten Schmelzeinbrüchen und Hypersensitivitäten betroffen. Von den posteruptiven Oberflächeneinbrüchen sind präeruptive Defekte abzugrenzen. Diese Zähne brechen bereits mit einem vorhandenen Oberflächendefekt in die Mundhöhle durch.
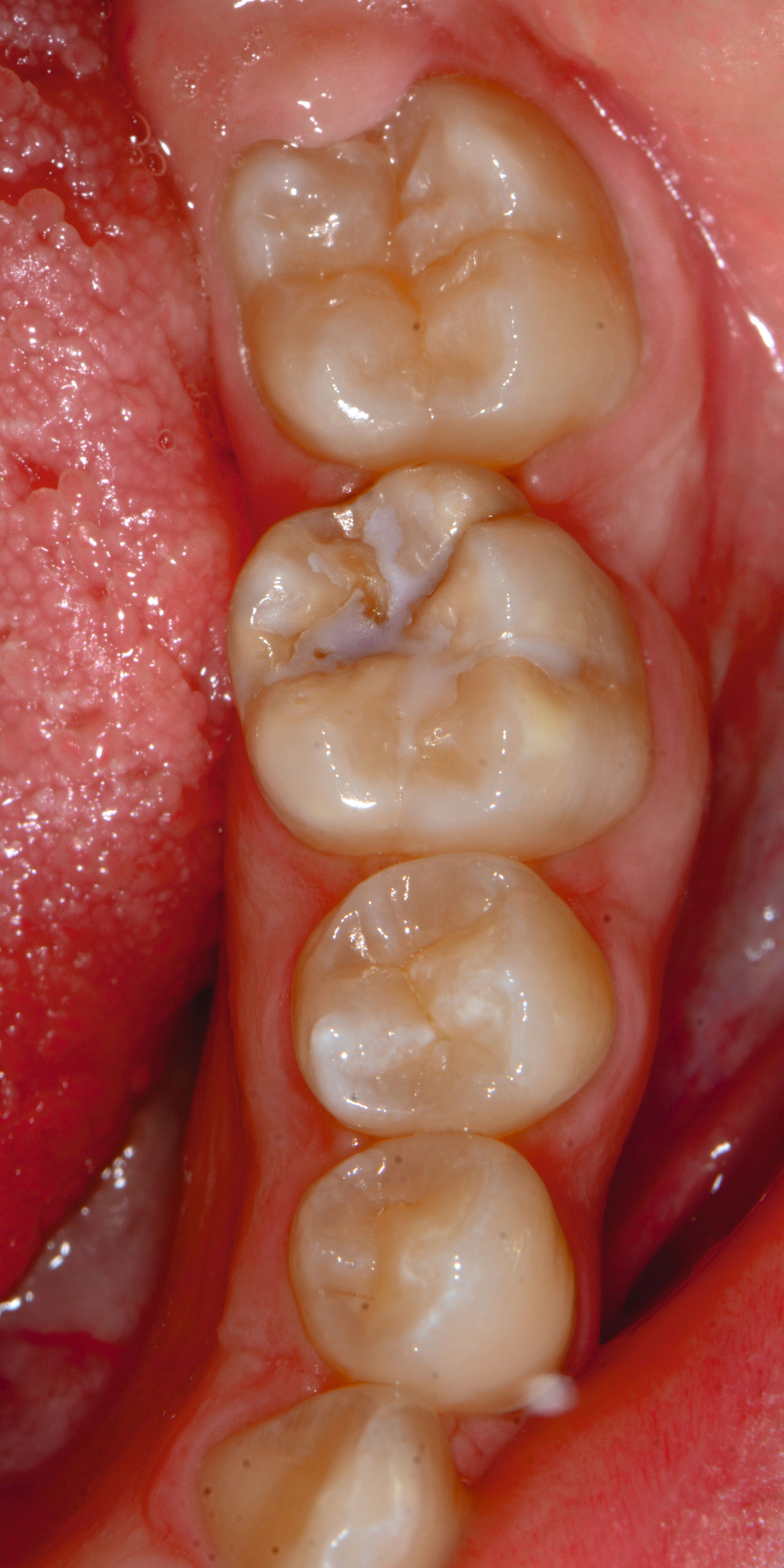
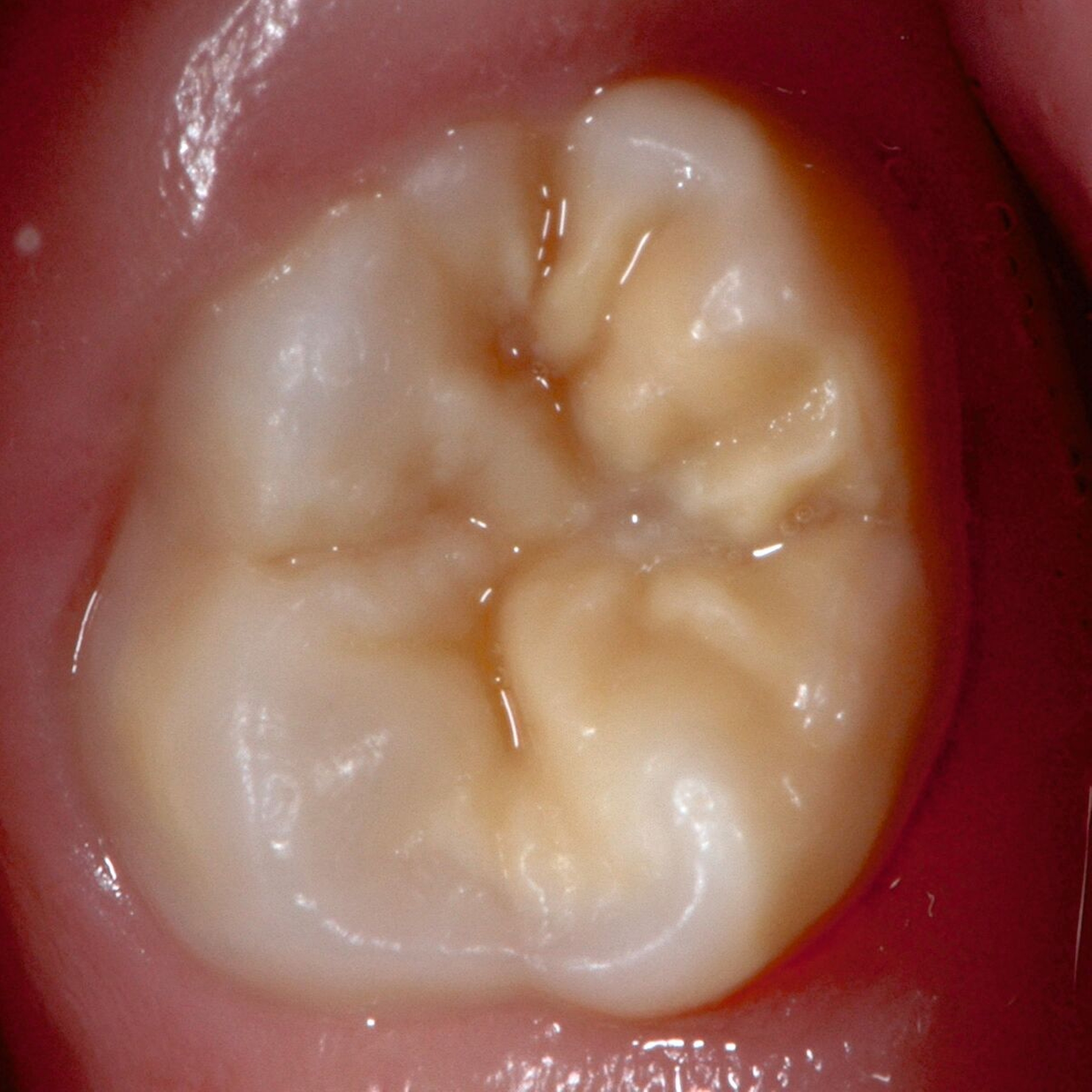
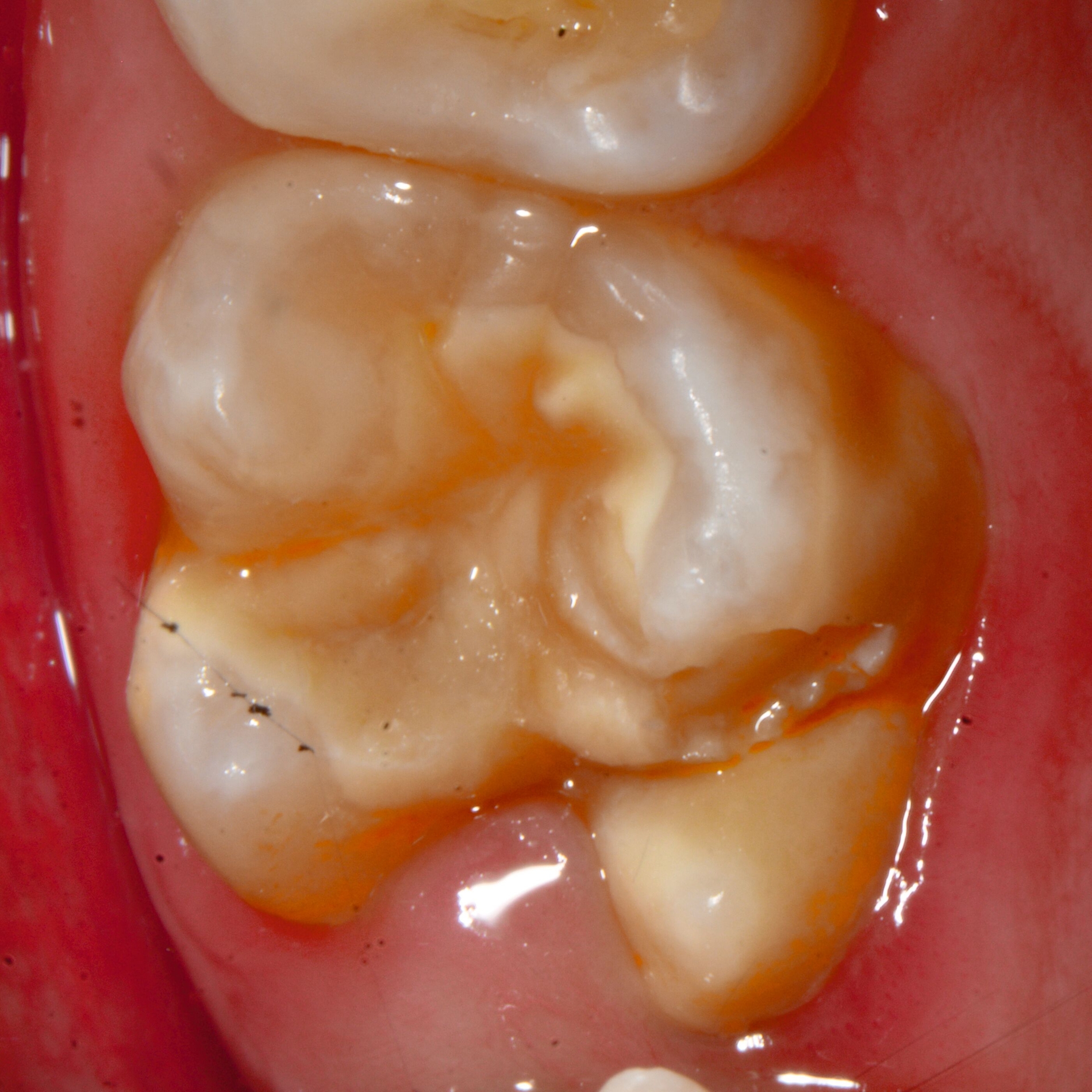
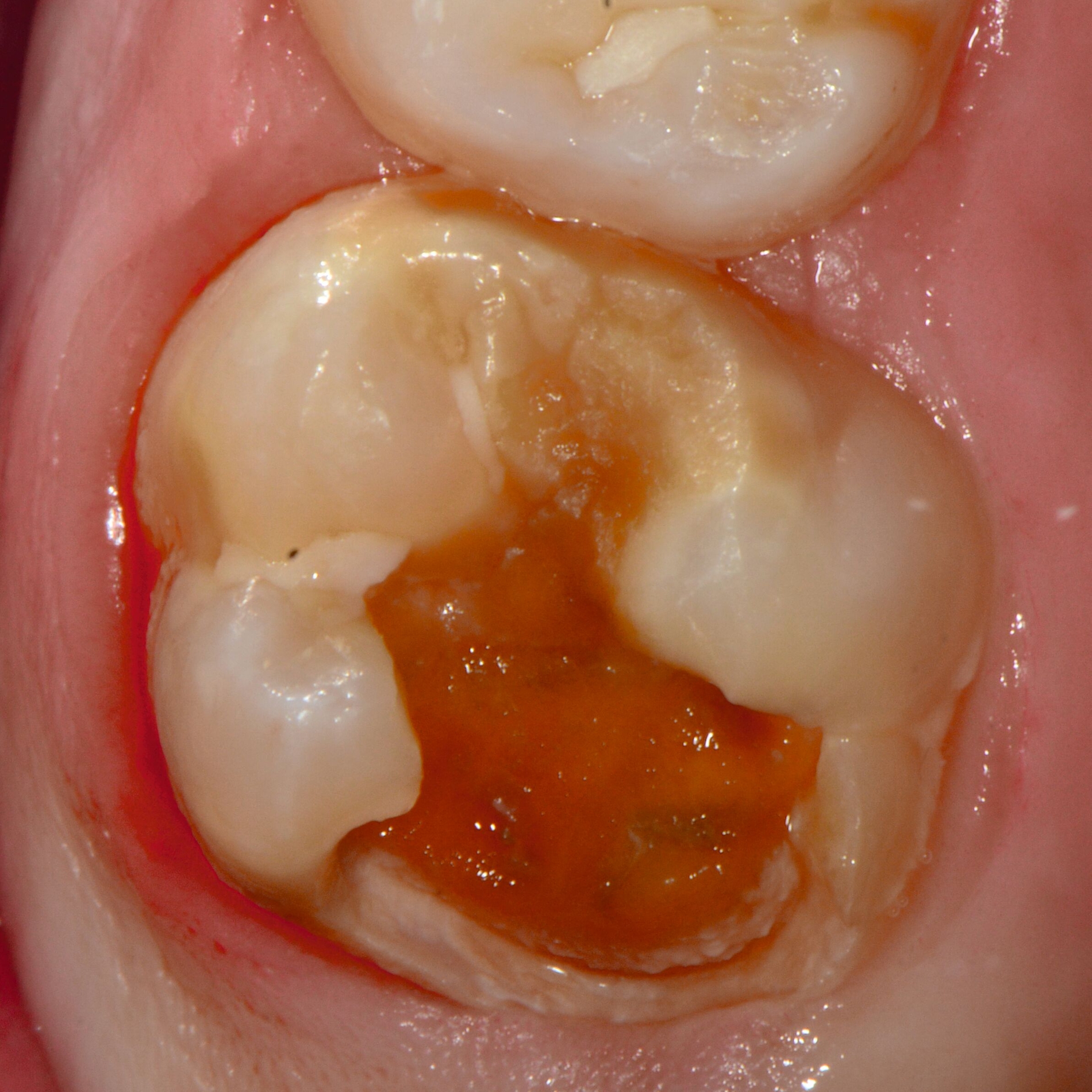
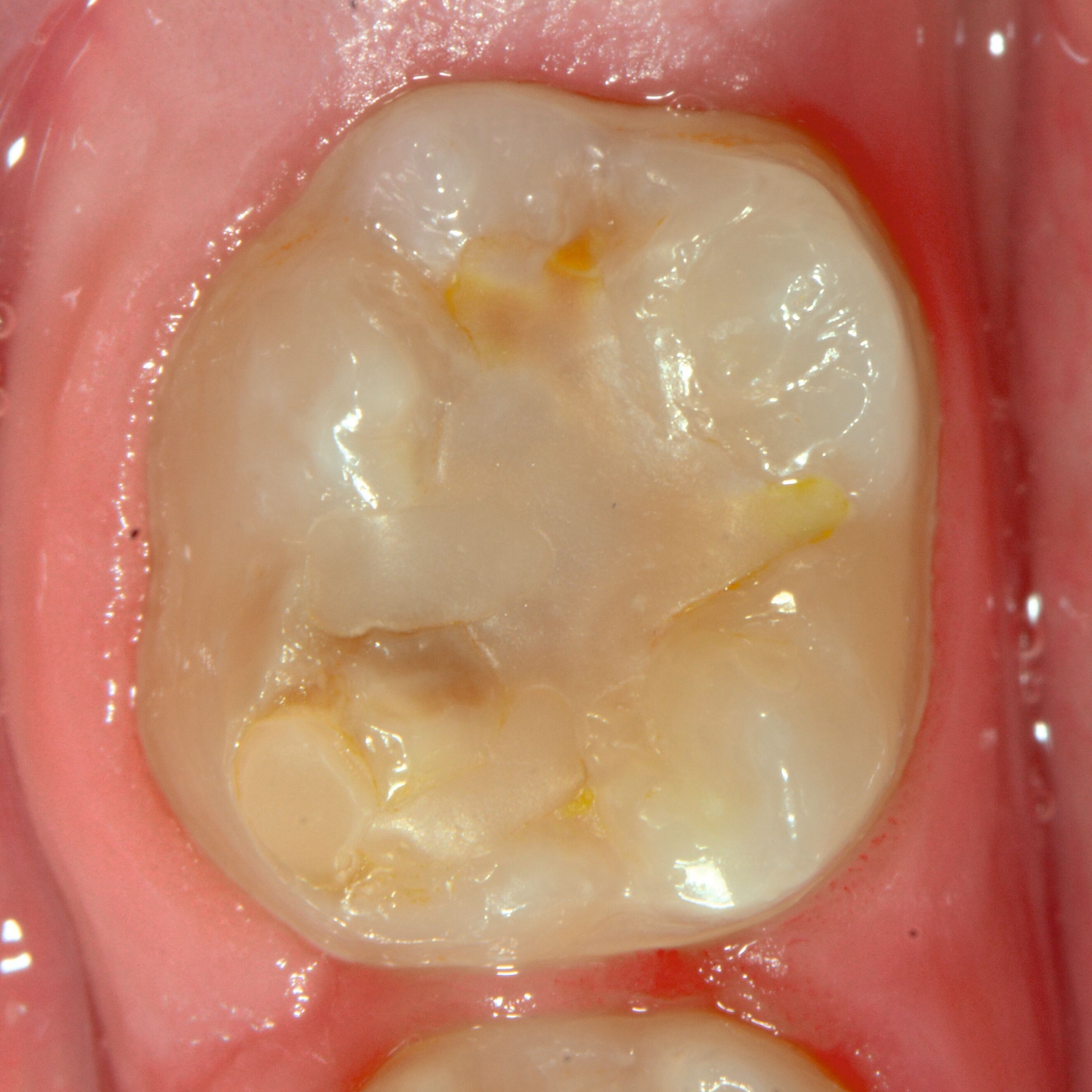
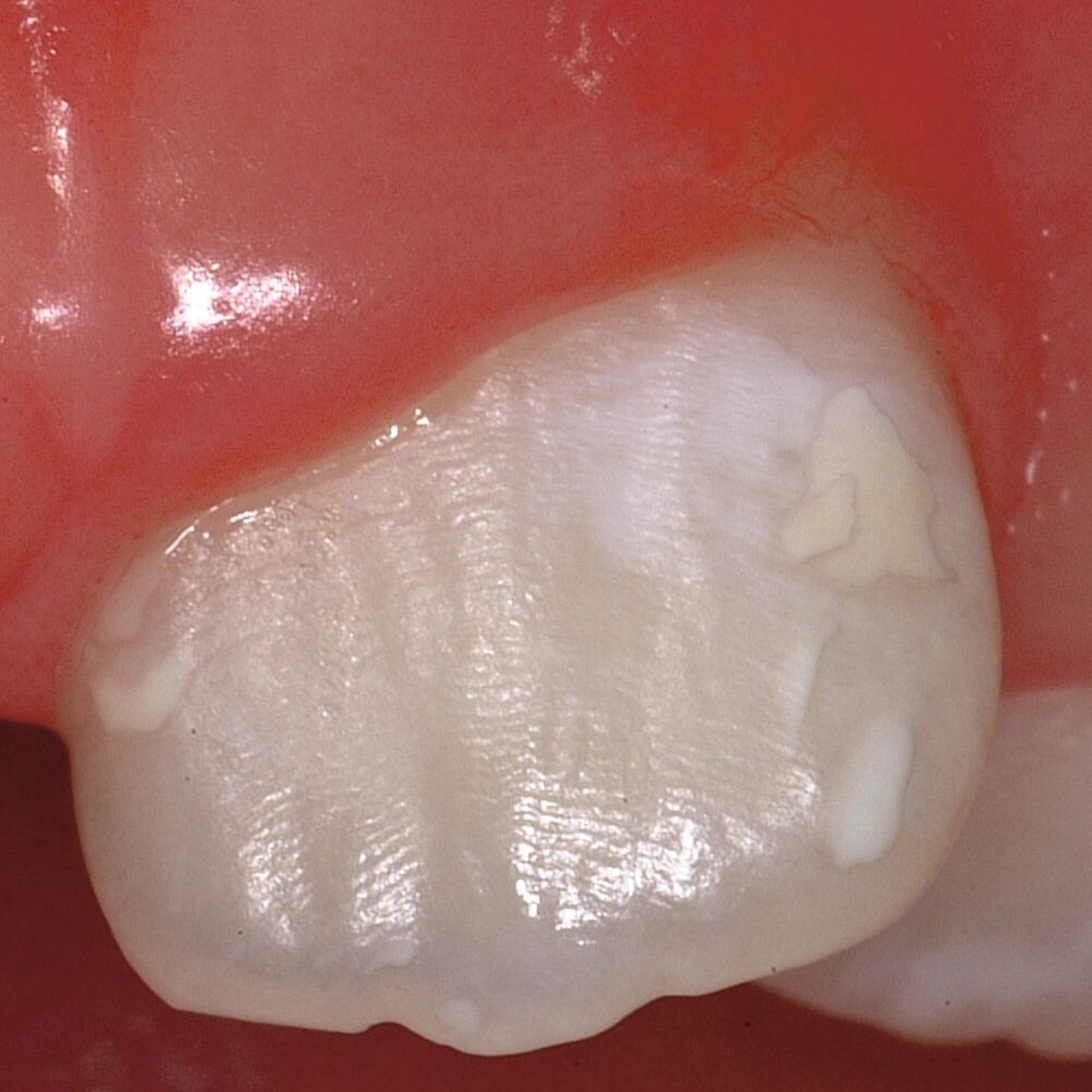
Bei post- beziehungsweise präeruptiven Oberflächendefekten ergibt sich in einigen Fällen die Indikation zur Restauration dieser MIH-Zähne. Unter Verweis auf die Lokalisation von MIH-bedingten Hypomineralisationen außerhalb der typischen Kariesprädilektionsstellen – zum Beispiel okklusale Fissuren und Grübchen oder Approximalflächen – werden diese als „atypische Restaurationen“ (engl.: „atypical restoration“, Abbildung 6) klassifiziert. Als ein weiteres Erkennungsmerkmal gilt die Präsenz von Hypomineralisationen im Bereich der Restaurationsränder. MIH- und kariesbedingte Restaurationen können und sollten sicher voneinander abgegrenzt werden.
Neben dem skizzierten klinischen Erscheinungsbild, bestehend aus abgegrenzten Opazitäten, Schmelzeinbrüchen und atypischen Restaurationen, ist das Vorliegen von Hypersensibilitäten charakteristisch für eine MIH. Diese treten mit dem Zahndurchbruch auf und verhindern mitunter eine reguläre Nutzung der Zähne und schränken die Lebensqualität ein [Linner et al., 2021].
Ursächlich ist die qualitativ veränderte Schmelzstruktur mit erhöhter Porosität. Dadurch ist das sensible Dentin nicht ausreichend vor thermischen oder chemischen Reizen geschützt, was häufig zu Einschränkungen bei der Getränke- und Nahrungsaufnahme sowie zu einer eingeschränkten Mundhygiene insbesondere im Seitenzahnbereich führt. Dadurch ist auch die immer wieder dokumentierte Kariesanfälligkeit von MIH-Zähnen begründet [Americano et al., 2017; Ben Salem et al., 2023; Mazur et al., 2023; Villani et al., 2023].
MIH-typische Befunde finden sich aber nicht nur an ersten bleibenden Molaren oder bleibenden Frontzähnen, sondern prinzipiell an allen Zähnen im bleibenden Gebiss als auch in der Milchzahndentition. Da Hypomineralisationen im Milchgebiss vornehmlich an den zweiten Milchmolaren festzustellen sind, werden diese als Milchmolaren-Hypomineralisation (MMH), Decidous-Molar-Hypomineralisation (DMH) oder Second-Primary-Molar-Hypomineralisation (SPMH) bezeichnet. Obwohl die Namenswahl darauf hindeutet, dass es sich um eine eigene Erkrankungsgruppe handelt, ist davon auszugehen, dass diese Krankheitsbilder zum Formenkreis der MIH gehören.
Diagnostik und Klassifikation
Für die Dokumentation und Klassifikation der MIH wurden verschiedene Systeme vorgeschlagen. Als historisch und veraltet gilt der (modifizierte) DDE-Index. Demgegenüber haben die Kriterien der EAPD – abgegrenzte Opazitäten (Abbildung 3 und 4), Schmelzeinbrüche (Abbildung 5), atypische Restaurationen (Abbildung 6) – mittlerweile die weiteste Verbreitung gefunden. Diese wurden 2003 erstmals zur Beschreibung der MIH auf empirischer Basis publiziert [Weerheijm et al., 2003] und den Jahren 2010 und 2022 im Rahmen der damaligen MIH-Workshops bestätigt [Lygidakis et al., 2010; 2022].
Mit dem Ziel, MIH-bedingte Zustandsbilder und Hypersensitivitäten mit etwaigen Therapiemaßnahmen zu verknüpfen, haben Steffen et al. [2017] das Würzburger Konzept entwickelt und publiziert. Ein Update wurde von Bekes et al. [2023] veröffentlicht. Der vorgeschlagene MIH-Treatment-Need-Index (MIH-TNI) berücksichtigt dabei die Hypersensitivität der Zähne und kombiniert diese mit dem Vorhandensein eines Zahnhartsubstanzdefekts (Tabelle 1). Der MIH-TNI kann im Milch- und bleibenden Gebiss verwendet werden und ist nicht auf Indexzähne beschränkt.
Die Anwendung des MIH-TNI erfordert in der Praxis sowohl die Objektivierung von Hypersensitivitäten als auch die metrische Einschätzung der Defektausdehnung, was in der intendierten Präzision möglicherweise nicht immer exakt gelingt. Die auf dem MIH-TNI basierenden Therapieempfehlungen ermöglichen dem Praktiker eine Orientierung zur Versorgung der MIH-Zähne [Bekes et al., 2023]. Allerdings wird die Kooperationsbereitschaft der Betroffenen nicht berücksichtigt, so dass im Einzelfall individuelle Behandlungskonzepte konsentiert werden müssen.
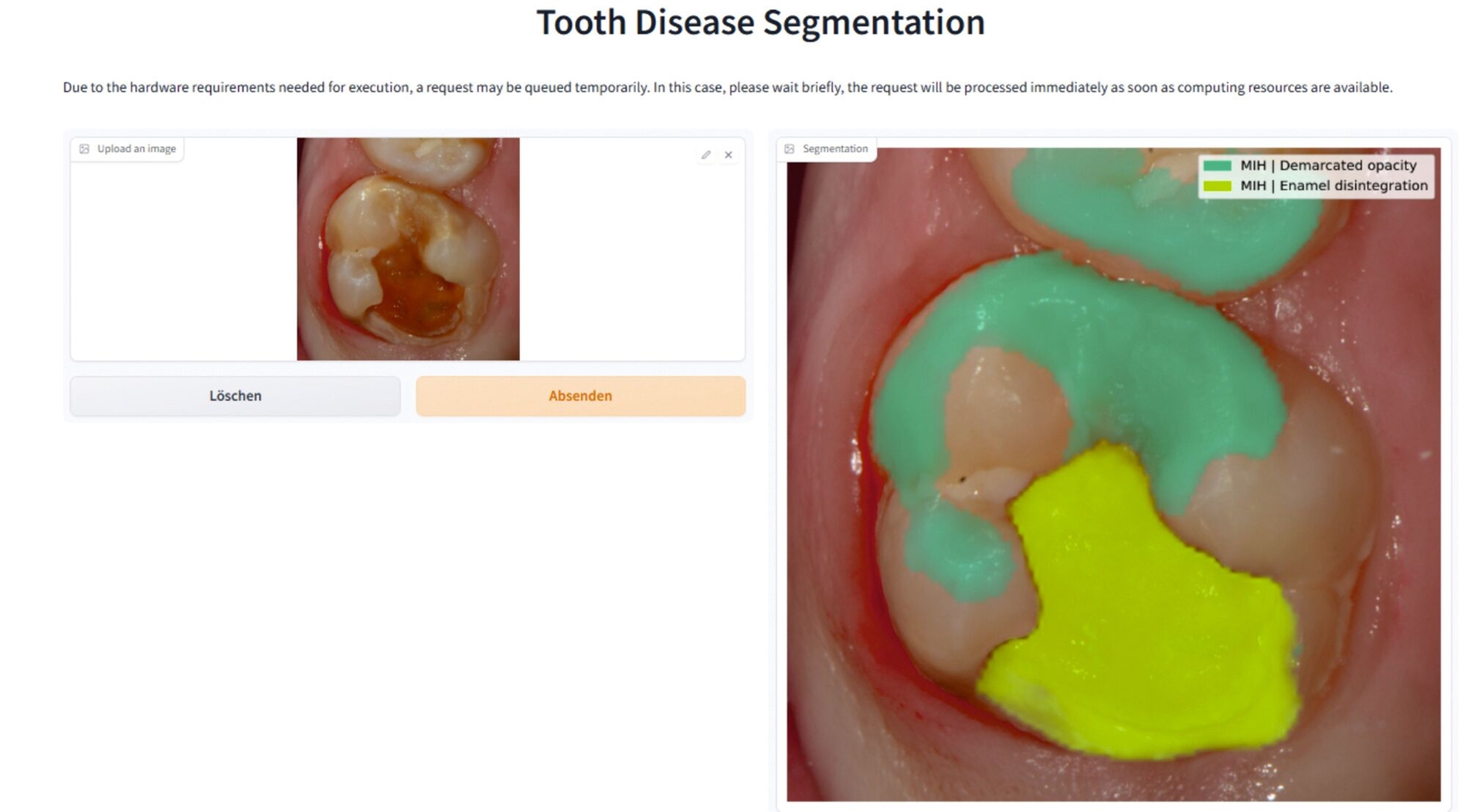
Obwohl die Diagnostik mit den verfügbaren klinischen Systemen in der Regel gut gelingt, werden im Praxisalltag immer wieder diagnostische Unsicherheiten bei der Erkennung und Klassifikation von MIH-bedingten Hypomineralisationen beobachtet. Zur Diagnoseunterstützung ist seit Kurzem ein auf künstlicher Intelligenz (KI) beruhendes Diagnostik-Tool verfügbar, das MIH-bedingte Hypomineralisationen und Oberflächeneinbrüche neben Karies automatisiert auf intraoralen Fotografien erkennen und kategorisieren kann [Felsch et al., 2023]. Auf der Webseite (https://demo.dental-ai.de, Abbildung 7), können selbst erstellte Bilddateien dem KI-basierten Algorithmus vorgelegt werden. Im Anschluss an die Bildanalyse gibt der Algorithmus das Evaluierungsergebnis dem Nutzer zurück.
Differenzialdiagnostik
Obwohl das klinische Erscheinungsbild der MIH in vielen Fällen typische Merkmale aufweist, kann die Differenzialdiagnostik und Abgrenzung zu anderen Strukturstörungen der Zahnhartsubstanzen für den Zahnarzt herausfordernd sein. Obwohl die MIH heute als die häufigste Strukturstörung an Zähnen einzuordnen ist, gibt es eine Reihe weiterer Zustandsbilder, die dazu abzugrenzen sind. Hier können das klinische Erscheinungsbild, die Lokalisation, sowie die Anzahl und das Verteilungsmuster der betroffenen Zähne wertvolle Hinweise liefern, ob ein erworbener Zahnhartsubstanzdefekt, wie Karies, oder eine entwicklungsbedingte Strukturstörung vorliegt.
Die häufigste und relevanteste Differenzialdiagnose sind kariöse Läsionen. Dies trifft vor allem für kariesaktive Patienten zu, die multiple und ausgedehnte (initial)kariöse Läsionen aufweisen können. Die Differenzialdiagnostik gelingt hier auf Grundlage einer sorgfältigen klinischen Untersuchung, wobei die Lokalisation und Konfiguration wichtige diagnostische Hinweise geben. Kariöse Läsionen sind dabei typischerweise im Bereich von Plaqueretentionsstellen, zum Beispiel Gingivarand und Approximalflächen, detektierbar. Demgegenüber befinden sich Hypomineralisationen mehrheitlich im Bereich der inzisalen Kronenhälfte und damit außerhalb der Kariesprädilektionsstellen.
Eine weitere Strukturstörung ist die Dentalfluorose. Das klinische Erscheinungsbild von Fluorosen unterscheidet sich durch diffuse Opazitäten grundlegend im Vergleich zu den scharf begrenzten Opazitäten der MIH-Zähne. Fluorosen treten symmetrisch und möglicherweise an allen Zähnen infolge einer langfristigen Fluoridüberdosierung auf. Genetisch bedingte Erkrankungen der Zähne, wie Amelogenesis imperfecta und Dentinogenesis imperfecta, werden durch spezifische Genmutationen verursacht und sind dadurch gekennzeichnet, dass alle Zähne beider Dentitionen gleichermaßen betroffen sind [Kühnisch et al., 2025; DGKIZ et al., 2024]. Im Gegensatz dazu sind MIH-Defekte mehrheitlich an den sogenannten Indexzähnen zu finden. Zudem ist oftmals ein symmetrisches Auftreten zu beobachten.
Die ungeklärte Ätiologie
Es besteht ein grundsätzlicher Konsens, dass eine systemisch bedingte, funktionelle Schädigung der Ameloblasten während der Schmelzentwicklung vorliegen muss, um eine MIH zu verursachen [Vieira und Manton, 2019]. Dazu wurden vielfältigste Hypothesen aufgestellt und in unterschiedlichen Studien betrachtet. Unter Verweis auf den mehrjährigen Verzug zwischen dem Zeitpunkt der etwaigen Initiation der Strukturstörung am Zahnschmelz im Säuglings- beziehungsweise Kleinkindalter und dem Zeitpunkt der MIH-Erkennung jenseits des sechsten bis achten Lebensjahres wird deutlich, dass es im Idealfall prospektiv angelegter, longitudinaler Beobachtungsstudien mit einem Geburtskohorten-Design bedarf. Dieses Studiendesign konnte jedoch nur in einer Handvoll Studien genutzt werden.
Die überwiegende Mehrzahl der verfügbaren Ätiologiestudien kombiniert die klinische Untersuchung in einer mehr oder weniger repräsentativ gezogenen Stichprobe in einer ebenfalls mehr oder weniger homogenen Gruppe von Kindern beziehungsweise Jugendlichen (Querschnitts-Studie) und nutzt wiederum mehr oder weniger validierte Instrumente, um Informationen zu etwaigen ätiologischen Faktoren zu erhalten.
Dies ist ein fundamentaler methodischer Nachteil bei der Suche nach den Ursachen der MIH. Da die verfügbaren Studien möglicherweise nicht frei von Verzerrungen sind, sollten sie daher zurückhaltend interpretiert werden. Dies trifft gleichermaßen für die systematischen Übersichtsarbeiten und Meta-Analysen zur MIH-Ätiologie zu, welche jedoch hervorragende Zusammenfassungen darstellen [Crombie et al., 2009; Alaluusua, 2010; Silva et al., 2016; Fatturi et al., 2019; Garot et al., 2023].
Umwelttoxine
Seit Beginn der Suche nach MIH-Ursachen werden Umweltfaktoren als potenzielle Einflussvariablen untersucht und diskutiert. Als umwelttoxikologische Agenzien wurden bereits in den 1990er Jahren Dioxine oder Bisphenol-A (BPA) identifiziert [Alaluusua et al., 1996; 1999]. Die finnische Arbeitsgruppe um Prof. Alaluusua konnte damals bei Kindern mit Hypomineralisationen der Zähne eine erhöhte Dioxinkonzentration als verursachend ausweisen und zusätzlich einen positiven Zusammenhang zwischen längerem Stillen und Schmelzdefekten erkennen. Dieser Effekt war allerdings in anderen Untersuchungen nicht erkennbar [Jälevik et al., 2001; Whatling et al., 2008]. Das finnische Team veröffentlichte später Studienergebnisse, die signalisierten, dass es keinen signifikanten Zusammenhang zwischen einer mütterlichen Dioxinexposition und einer MIH gibt [Laisi et al., 2008].
Jüngere, tierexperimentelle Untersuchungen dokumentierten strukturelle Veränderungen in der Zahnhartsubstanz nach einer BPA-Exposition an Ratten [Jedeon et al., 2013]. In der viel zitierten Tierversuchsstudie, in der trächtige Ratten definierte BPA-Mengen mit der Nahrung aufnahmen, entwickelten die Jungtiere der MIH ähnliche Hypomineralisationen. Darüber hinaus untersuchte die französische Forschungsgruppe den Einfluss endokriner Disruptoren auf die Ameloblastenproliferation sowie endokrine Signalwege [Houari et al. 2016]. Unabhängig von der nachgewiesenen Anfälligkeit der Ameloblasten gegenüber Umwelttoxinen erscheinen hierzu weitere Untersuchungen erforderlich. Insbesondere müssen mögliche BPA-Quellen, Expositionswege und potenziell schädliche Aufnahmemengen abgeschätzt werden.
Frühkindliche Erkrankungen
In der Diskussion spielen auch Erkrankungen im Kindesalter eine wichtige Rolle. Deren Einfluss auf eine mögliche MIH-Entwicklung in den ersten Lebensjahren wurde vielfach untersucht. Dennoch lieferten die verfügbaren Studien keine eindeutigen Ergebnisse[Crombie et al., 2009; Alaluusua, 2010; Silva et al., 2016; Fatturi et al., 2019; Garot et al., 2023]. Aus dem Kreis der frühkindlichen Erkrankungen wurden erhöhte MIH-Häufigkeiten beispielsweise für Atemwegserkrankungen, Mittelohrentzündungen und Fieber dokumentiert.
Den Übersichtsarbeiten zufolge gibt es jedoch eine Vielzahl weiterer Erkrankungen, die für eine MIH verantwortlich sein könnten. Hierzu zählen zum Beispiel Windpocken, Masern und Röteln, gastrointestinale Erkrankungen, Allergien, Herz- und Nierenerkrankungen, Lymphome, Zöliakie, Mukoviszidose, HIV, Lippen-Kiefer-Gaumen-Spalten und verschiedene Syndrome. Allerdings deuten die aktuellen Daten eher auf eine Negativ-Assoziation hin. Die kontroversen Studienergebnisse legen indes auch nahe, dass weitere Untersuchungen erforderlich sind und Erkrankungen des Kindesalters in zukünftigen Studien möglichst detailreich registriert werden sollten. Die Mehrzahl der zuvor genannten Erkrankungen beziehungsweise Infektionen können medikamentös therapiert werden. Daher ist neben der Erkrankung selbst auch deren Therapie als potenziell MIH-verursachend zu betrachten. Im Fall von Infektionen sind daher Wechselwirkungen zwischen einer Antibiotikaeinnahme und dem MIH-Auftreten zu erörtern.
Antibiotika
Antibakterielle Wirkstoffe kommen seit mehr als einem halben Jahrhundert auch in der Pädiatrie zum Einsatz und sind daher als potenziell MIH-verursachend zu sehen, da diese sich bei der systemischen Einnahme im gesamten Körper verteilen. Zudem haben Studien eine Positiv-Assoziation sowohl im Tierversuch als auch in kindlichen Kohortenstudiendokumentiert [Laisi et al., 2009; Wuollet et al., 2016]. Im Tierversuch griffen Antibiotika in den Ameloblasten-Stoffwechsel dahingehend ein, dass ein beschleunigtes Prismenwachstum vonstatten ging, ohne dass parallel dazu offensichtlich eine reguläre Kristallisation stattfand.
Im Ergebnis lag eine qualitativ minderwertige Schmelzbildung vor [Laisi et al., 2009]. Zudem scheinen neben der Antibiotikagruppe auch der Zeitpunkt und die Häufigkeit der Einnahme relevant zu sein. Eine höhere Anzahl von Antibiotika-Zyklen in den ersten Lebensjahren erhöhte die Wahrscheinlichkeit für das Auftreten einer MIH. Nach Ghanim et al. [2013] ist das MIH-Risiko durch eine Antibiotika-Einnahme im ersten Lebensjahr sogar um mehr als das Dreifache erhöht.
Vitamin-D-Einfluss
In den vergangenen Jahren initiierten verschiedene Arbeitsgruppen Untersuchungen zum Einfluss des Vitamin-D-Stoffwechsels auf die Ausbildung von Hypomineralisationen. Während die Ergebnisse zum Zusammenhang zwischen dem Serum-Vitamin-D-Spiegel und dem klinischen Auftreten einer MIH heterogen sind [Kühnisch et al., 2015; van der Tas et al., 2029] zeigte eine randomisierte Interventionsstudie, dass die vorgeburtliche, hochdosierte Vitamin-D-Gabe mit einer signifikant niedrigeren Häufigkeitsrate von MIH im Alter von sechs Jahren einherging [Nørrisgaard et al., 2019]. Dies deutet auf einen möglichen präventiven Effekt der Vitamin-D-Gabe in dieser Entwicklungsphase hin.
Geburtliche Faktoren
Mit Blick auf die Vielzahl von Einflüssen, denen ein Säugling bei der Geburt ausgesetzt ist und dem Mineralisationsbeginn der bleibenden Zähne um den Zeitpunkt der Geburt,wird offensichtlich, dass perinatale Faktoren möglicherweise zur Entstehung einer MIH beitragen könnten. Ereignisse um den Zeitpunkt der Geburt werden in etlichen Studien betrachtet.
Allerdings lassen sich diese perinatalen Faktoren nicht immer klar voneinander trennen. So hat beispielsweise ein Frühgeborenes natürlicherweise ein geringeres Geburtsgewicht und potenziell unausgereifte Organe. Dies verkompliziert die Analyse geburtlicher Variablen. Grundsätzlich deuten die verfügbaren Ergebnisse aus Studien unter Einbeziehung geburtlicher Variablen darauf hin, dass deren Einfluss auf die MIH-Entstehung begrenzt ist. Allerdings muss man auch an dieser Stelle auf die Notwendigkeit eines weiterführenden Forschungsbedarfs verweisen.
Zusammenfassung
Wir haben das klinische Erscheinungsbild, die Diagnostik und die Ätiologie zu MIH erläutert. Leider liegt noch keine stichhaltige Ätiologiekette vor. Deshalb geht man nach heutigem Forschungsstand von einem multifaktoriellen Geschehen aus [Vieira und Manton, 2019], und es gibt gegenwärtig auch keine wirksame Präventionsstrategie. Dies ist unbefriedigend und unterstreicht die Notwendigkeit weiterer Anstrengungen, um die Ursache(n) der MIH zu identifizieren.
Literaturliste
Alaluusua S, Lukinmaa PL, Torppa J, Tuomisto J, Vartiainen T: Developing teeth as biomarker of dioxin exposure. Lancet 353 (1999) 206.
Alaluusua S, Lukinmaa PL, Vartiainen T, Partanen M, Torppa J, Tuomisto J: Polychlorinated dibenzo-p-dioxins and dibenzofurans via mother's milk may cause developmental defects in the child's teeth. Environ Toxicol Pharmacol 15 (1996) 193-197.
Alaluusua S: Aetiology of Molar-Incisor Hypomineralisation: A systematic review. Eur Arch Paediatr Dent 11 (2010) 53-58.
Americano GC, Jacobsen PE, Soviero VM, Haubek D: A systematic review on the association between molar incisor hypomineralization and dental caries. Int J Paediatr Dent 27 (2017) 11-21.
Ammar N, Fresen K-F, Schwendicke F, Kühnisch J: Epidemiological trends in Molar-Incisor Hypomineralization and enamel hypomineralization: A systematic review and meta-analysis of cross-sectional studies from year 2000 until 2020. Clin Oral Investig 29 (2025) 327.
Bekes K, Meyer-Lueckel H, Jordan AR, Kuhr K, Schiffner U: Molar incisor hypomineralization: results of the 6th German Oral Health Study (DMS • 6). Quintessence Int. 56 (2025) S70-S74.
Bekes K, Steffen R, Krämer N: Update of the molar incisor hypomineralization: Würzburg concept. Eur Arch Paediatr Dent 24 (2023) 807-813.
Ben Salem M, Chouchene F, Masmoudi F, Baaziz A, Maatouk F, Ghedira H: Are Molar-Incisor Hypomineralization and Hypomineralized Second Primary Molars Predictive of Dental Caries? A Systematic Review. Eur J Dent 17 (2023) 7-15.
Crombie F, Manton D, Kilpatrick N: Aetiology of molar-incisor hypomineralization: a critical review. Int J Paediatr Dent 19 (2009) 73-83.
DGKiZ, DGPro, DGCZ, GfH, DGZMK: S3-Leitlinie „Versorgung seltener, genetisch bedingter Erkrankungen der Zähne“, Langfassung, Version 1.0, 2024, AWMF-Registriernummer: 083-048, www.awmf.org/leitlinien/detail/ll/083-048.html, (Zugriff am: 17.09.2025).
Fatturi AL, Wambier LM, Chibinski AC, Assunção LRDS, Brancher JA, Reis A, Souza JF: A systematic review and meta-analysis of systemic exposure associated with molar incisor hypomineralization. Community Dent Oral Epidemiol 47 (2019) 407-415.
Felsch M, Meyer O, Schlickenrieder A, Engels P, Schönewolf J, Zöllner F, Heinrich-Weltzien R, Hesenius M, Hickel R, Gruhn V, Kühnisch J: Detection and localization of caries and hypomineralization on dental photographs with a vision transformer model. npj Digit Med 6 (2023) 198.
Fresen K-F, Gaballah R, Schill H, Amend S, Sapari K, Pitchika V, Krämer N, Kühnisch J: Prevalence and association of caries and enamel hypomineralisation/ molar-incisor hypomineralisation in 8- to 10-year-old children from Bavaria, Germany. Caries Res 59 (2025) 87-97.
Ghanim A, Manton DJ, Bailey D, Mariño R, Morgan M: Risk factors in the occurrence of molar-incisor hypomineralization amongst a group of Iraqi children. Int J Paediatr Dent 23 (2013) 197–206.
Garot E, Rouas P, Somani C, Taylor GD, Wong F, Lygidakis NA: An update of the aetiological factors involved in molar incisor hypomineralisation (MIH): a systematic review and meta-analysis. Eur Arch Paediatr Dent 23 (2022) 23-38.
Hernandez M, Boj JR, Espasa E: Do we really know the prevalence of MIH? Journal of Clinical Pediatric Dentistry 40 (2016) 259–263.
Houari S, Loiodice S, Jedeon K, Berdal A, Babajko S: Expression of Steroid Receptors in Ameloblasts during Amelogenesis in Rat Incisors. Frontiers in Physiology 7 (2016) 503.
Jälevik B, Norén JG, Klingberg G, Barregård L: Etiologic factors influencing the prevalence of demarcated opacities in permanent first molars in a group of Swedish children. Eur J Oral Sci 19 (2001) 230-234.
Jedeon K, de la Dure-Molla M, Brookes SJ, Loiodice S, Marciano C, Kirkham J, Canivenc-Lavier MC, Boudalia S, Bergès R, Harada H, Berdal A, Babajko S: Enamel defects reflect perinatal exposure to bisphenol A. Am J Pathol 183 (2013) 108-118.
Kühnisch J, Bücher K, Schüler I-M, Schmidt P, Hertel S, Timpel J, Jablonski-Momeni A, Schilke R, Kapferer-Seebacher I, Zschocke J, Liebermann A, Güth JF, Edelhoff D, Heinrich-Weltzien R, Dujic H: S3-Leitlinie „Seltene Erkrankungen der Zähne“ – Zusammenfassung aller Empfehlungen zur Diagnostik und Therapie. Oralprophylaxe & Kinderzahnmedizin 47 (2025) 184–193.
Kühnisch J, Thiering E, Kratzsch J, Heinrich-Weltzien R, Hickel R, Heinrich J for the GINI-10 plus study group and LISA-10 plus study group: Elevated serum 25(OH)-vitamin D levels are negatively correlated with MIH. J Dent Res 94 (2015) 381-387.
Laisi S, Ess A, Sahlberg C, Arvio P, Lukinmaa PL, Alaluusua S: Amoxicillin may cause molar incisor hypomineralization. J Dent Res 88 (2009) 132-136.
Laisi S, Kiviranta H, Lukinmaa PL, Vartiainen T, Alaluusua S: Molar-incisor-hypomineralisation and dioxins: new findings. Eur Arch Paediatr Dent 9 (2008) 224–227.
Linner T, Khazaei Y, Bücher K, Pfisterer J, Hickel R, Kühnisch J: Hypersensitivity in teeth affected by Molar-Incisor Hypomineralisation (MIH). Sci Reports 11 (2021) 17922.
Lopes LB, Machado V, Mascarenhas P, Mende JJ, Botelho J: The prevalence of molar-incisor hypomineralization: a systematic review and meta-analysis. Scientific Reports 11 (2021) 22405.
Lygidakis NA, Garot E, Somani C, Taylor GD, Rouas P, Wong FSL: Best clinical practice guidance for clinicians dealing with children presenting with molar-incisor-hypomineralisation (MIH): an updated European Academy of Paediatric Dentistry policy document. Eur Arch Paediatr Dent 23 (2022) 3–21.
Lygidakis NA, Wong F, Jälevik B, Vierrou AM, Alaluusua S, Espelid I. Best Clinical Practice Guidance for clinicians dealing with children presenting with Molar-Incisor-Hypomineralisation (MIH): An EAPD Policy Document. Eur Arch Paediatr Dent 11 (2010) 75-81.
Mazur M, Corridore D, Ndokaj A, Ardan R, Vozza I, Babajko S, Jedeon K: MIH and Dental Caries in Children: A Systematic Review and Meta-Analysis. Healthcare (Basel) 11 (2023) 1795.
Nørrisgaard PE, Haubek D, Kühnisch J, Chawes B.L, Stokholm J, Bønnelykke K, Bisgaard H: Association of high-dose Vitamin D supplementation during pregnancy with the risk of enamel defects in offspring. A 6-Year Follow-up of a Randomized Clinical Trial. JAMA Pediatrics 173 (2019) 924-930.
Petrou MA, Giraki M, Bissar AR, Basner R, Wempe C, Altarabulsi MB, Schäfer M, Schiffner U, Beikler T, Schulte AG, Splieth CH: Prevalence of Molar-Incisor-Hypomineralisation among school children in four German cities. Int J Paediatr Dent 24 (2014) 434–440.
Schwendicke F, Elhennawy K, Reda S, Bekes K, Manton DJ, Krois J: Global burden of molar incisor hypomineralization. J Dent 68 (2018) 10–18.
Silva MJ, Scurrah KJ, Craig JM, Manton DJ, Kilpatrick N: Etiology of molar incisor hypomineralization - A systematic review. Community Dent Oral Epidemiol 44 (2016) 342-353.
Sluka B, Held U, Wegehaupt F, Neuhaus KW, Attin T, Sahrmann P: Is there a rise of prevalence for Molar Incisor Hypomineralization? A meta-analysis of published data. BMC Oral Health 24 (2024) 127.
Steffen R, Krämer N, Bekes K: The Würzburg MIH concept: the MIH treatment need index (MIH TNI) : A new index to assess and plan treatment in patients with molar incisior hypomineralisation (MIH). Eur Arch Paediatr Dent 18 (2017) 355-361.
van der Tas JT, Elfrink MEC, Heijboer AC, Rivadeneira F, Jaddoe VWV, Tiemeier H, Schoufour JD, Moll HA, Ongkosuwito EM, Wolvius EB, Voortman T: Foetal, neonatal and child vitamin D status and enamel hypomineralization. Community Dent Oral Epidemiol 46 (2018) 343-351.
Vieira AR, Manton DJ: On the Variable Clinical Presentation of Molar-Incisor Hypomineralization. Caries Res 53 (2019) 482-488.
Villani FA, Aiuto R, Dioguardi M, Paglia L, Caruso S, Gatto R, Re D, Garcovich D: Caries prevalence and molar incisor hypomineralisation (MIH) in children. Is there an association? A systematic review. Eur J Paediatr Dent 24 (2023) 312-320.
Weerheijm KL, Duggal M, Mejare I, Papagiannoulis L, Koch G, Martens LC, Hallonsten AL: Judgement criteria for molar incisor hypomineralisation (MIH) in epidemiologic studies: a summary of the European meeting on MIH held in Athens, 2003. Eur J Paediatr Dent 4 (2003) 110-113.
Whatling R, Fearne JM: Molar incisor hypomineralization: a study of aetiological factors in a group of UK children. Int J Paediatr Dent 18 (2008) 155–162.
Wuollet E, Laisi S, Salmela E, Ess A, Alaluusua S: Molar-incisor hypomineralization and the association with childhood illnesses and antibiotics in a group of Finnish children. Acta Odontol Scand 74 (2016) 416-422.
Zhao D, Dong B, Yu D, Ren Q, Sun Y: The prevalence of molar incisor hypomineralization: evidence from 70 studies. Int J Paediatr Dent 28 (2018) 170–179.