Zyste oder Ameloblastom? Entscheidend ist die histopathologische Aufarbeitung
Im Mai 2023 stellte sich nach Überweisung durch den Hauszahnarzt ein 31-jähriger Mann in unserer Ambulanz vor. Klinisch zeigte sich links eine diskrete paramandibuläre Schwellung. In der Anamnese wurde eine Colitis ulcerosa festgestellt, weitere Vorerkrankungen oder Dauermedikationen wurden verneint. Der Patient berichtete von einer langsamen, kontinuierlichen Größenzunahme ohne Schmerzen. Eine Malokklusion, Zahnlockerungen oder Sensibilitätsstörungen lagen nicht vor.
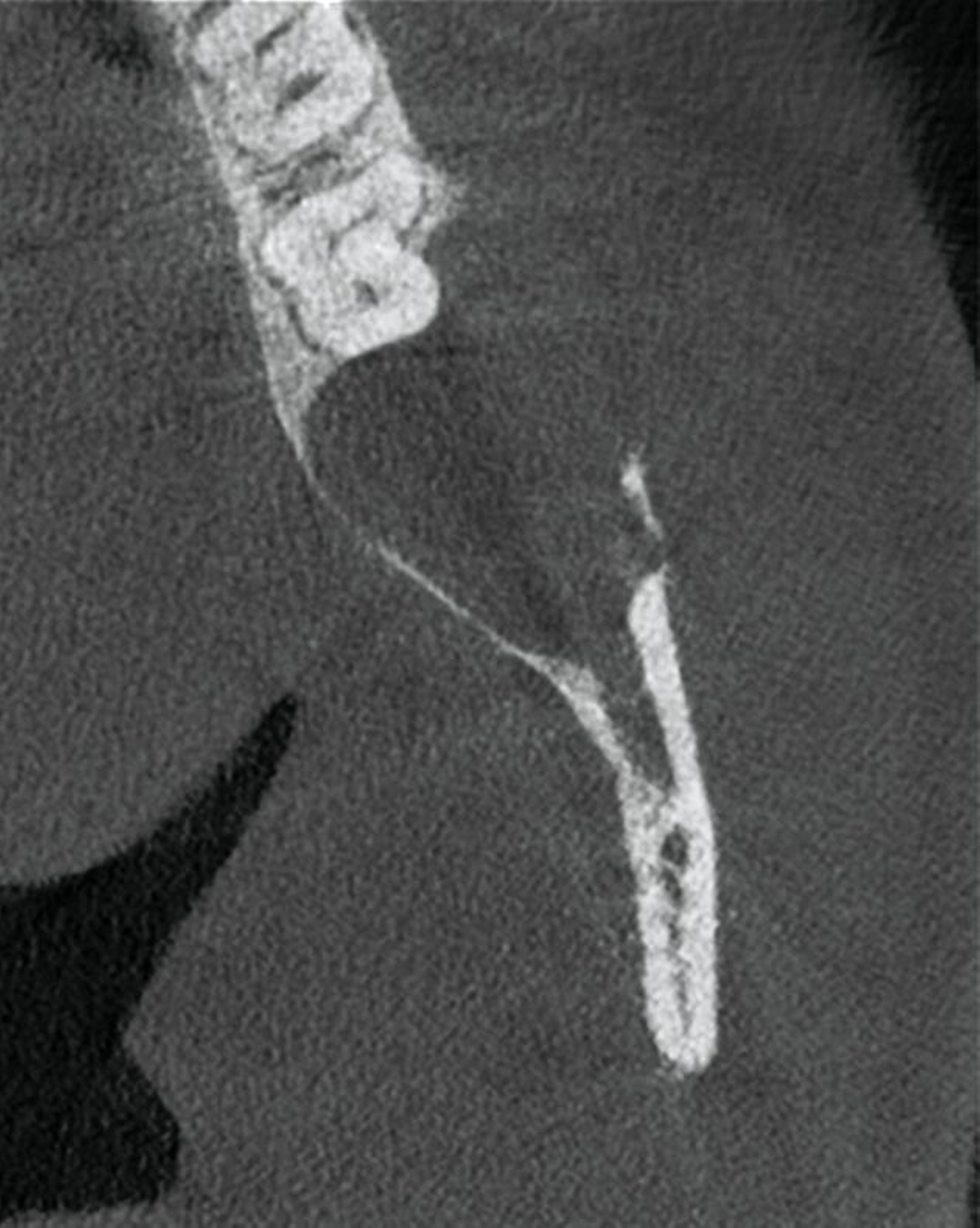
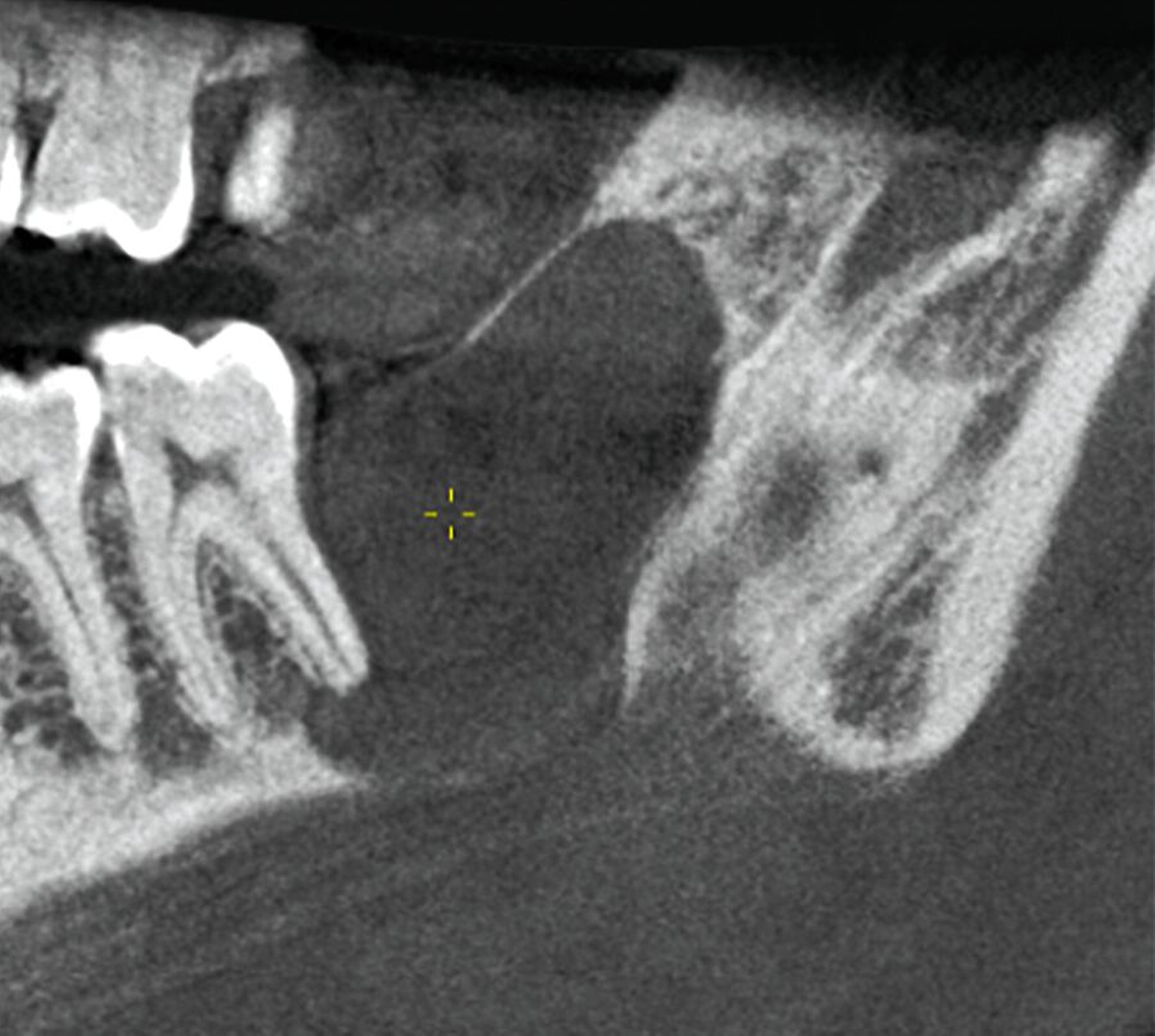
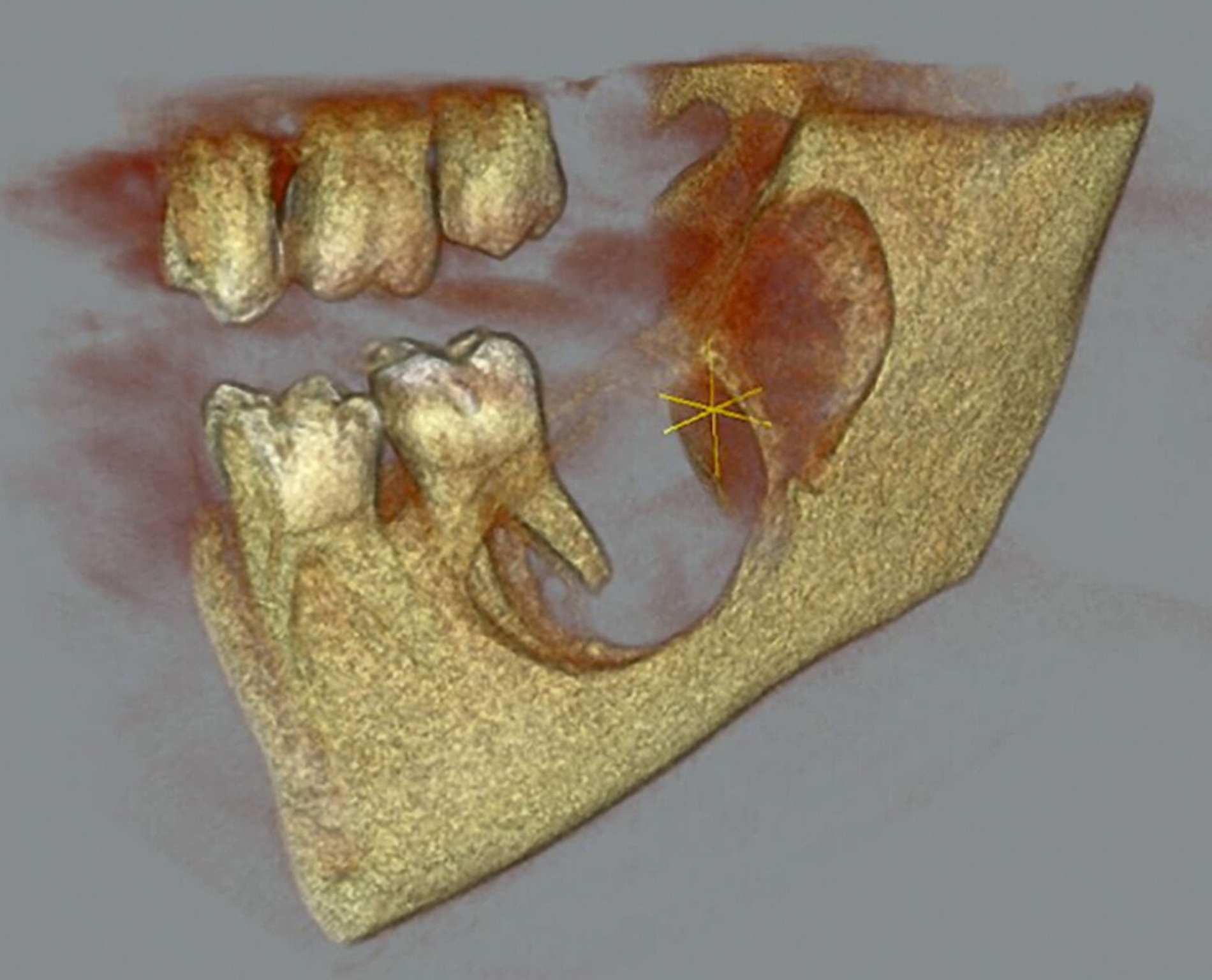
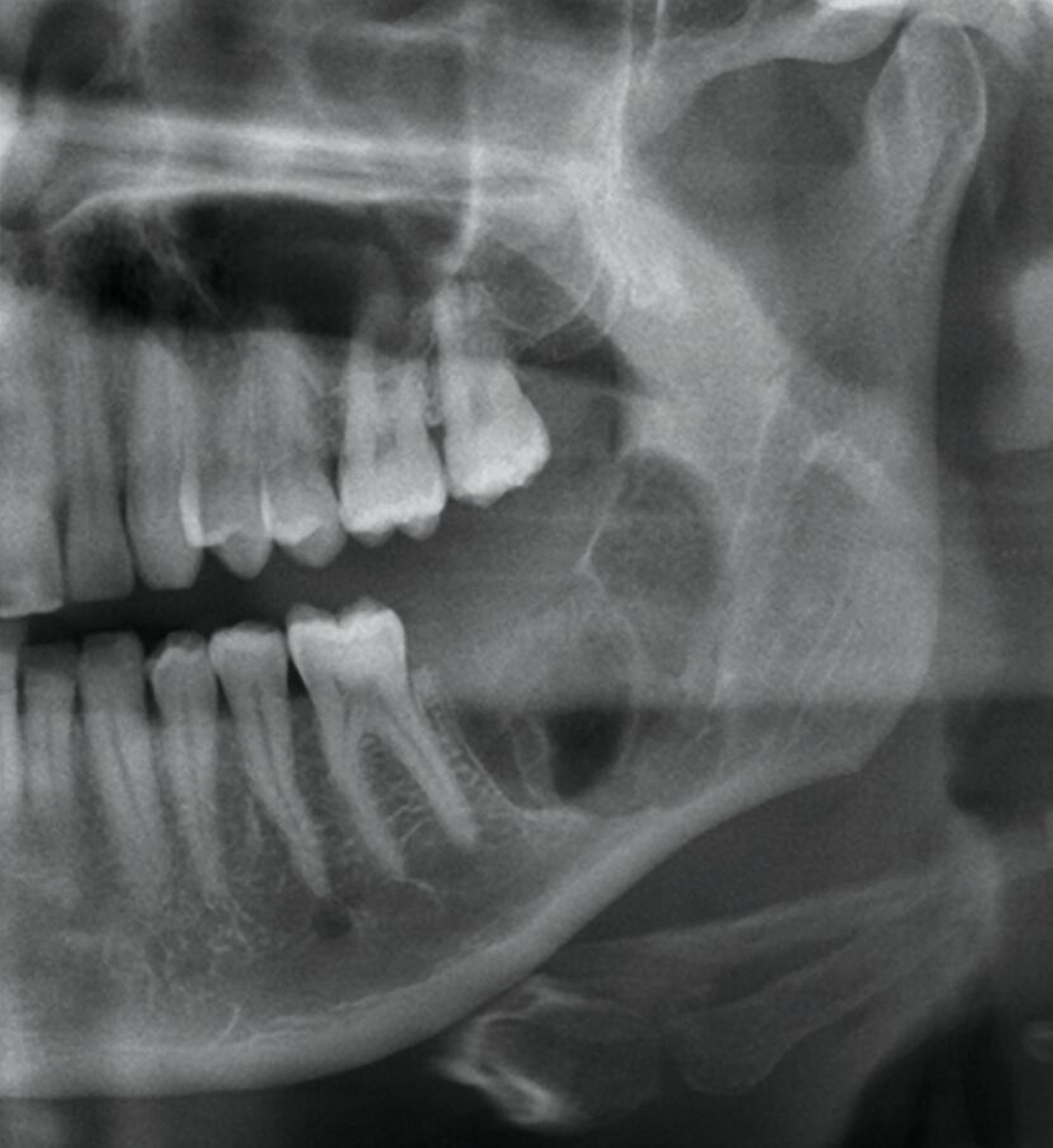
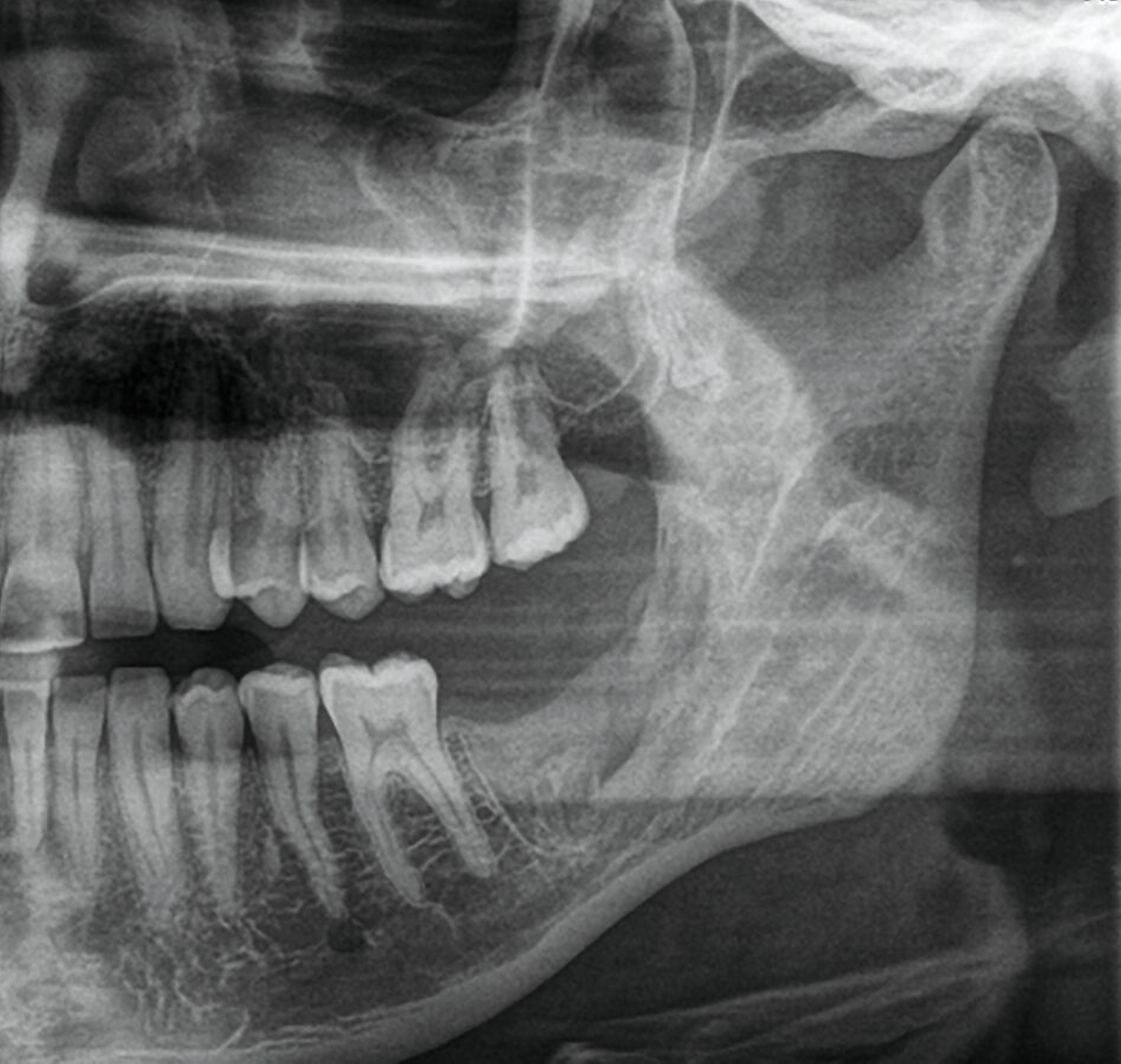
Die digitale Volumentomografie (DVT) ergab eine mehrkammerige, radioluzente Raumforderung, die sich bei erhaltener Kortikalis von der mesialen Wurzel des Zahnes 37 bis in den aufsteigenden Ast des Ramus mandibulae erstreckte (Abbildungen 1 und 2). Aufgrund der Morphologie bestand der Verdacht auf einen keratozystischen odontogenen Tumor, differenzialdiagnostisch auf andere odontogene Tumoren. Nach Aufklärung wurden die Extraktion des nicht erhaltungswürdigen Zahnes 37 sowie die Zystektomie geplant und zwei Wochen später in Intubationsnarkose durchgeführt.
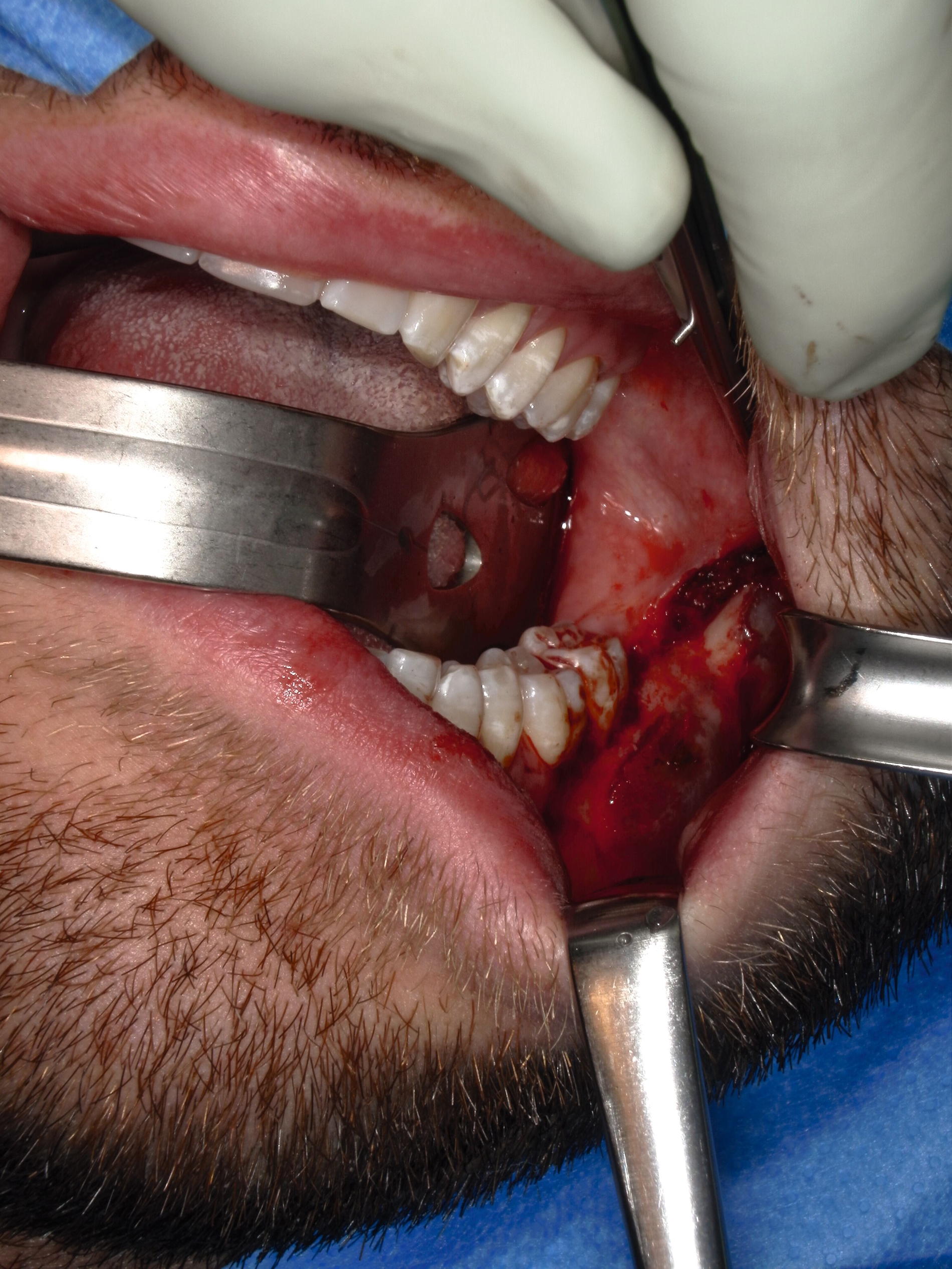
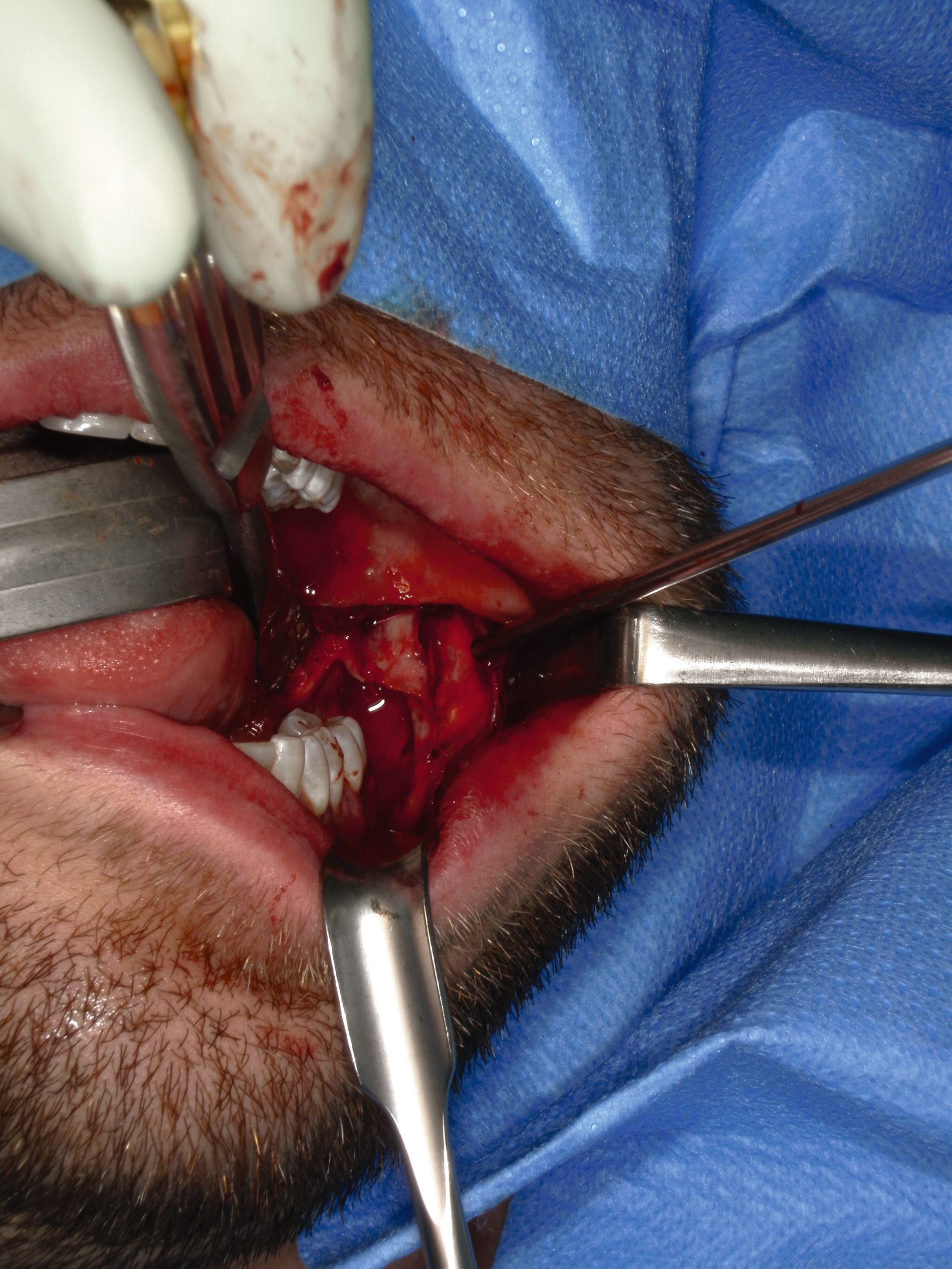
Operativ erfolgte eine krestale Inzision mit marginaler Fortführung und vestibulärer Entlastung. Vestibulär fand sich eine papierdünne Knochenlamelle, die den zystischen Hohlraum noch bedeckte (Abbildung 3a). Der Zahn 37 wurde gemeinsam mit dem Zystenbalg en bloc entfernt. Anschließend wurden die Zystenwände unter Schonung des N. alveolaris inferior im Sinne einer erweiterten Zystektomie ausgefräst (Abbildung 3b).
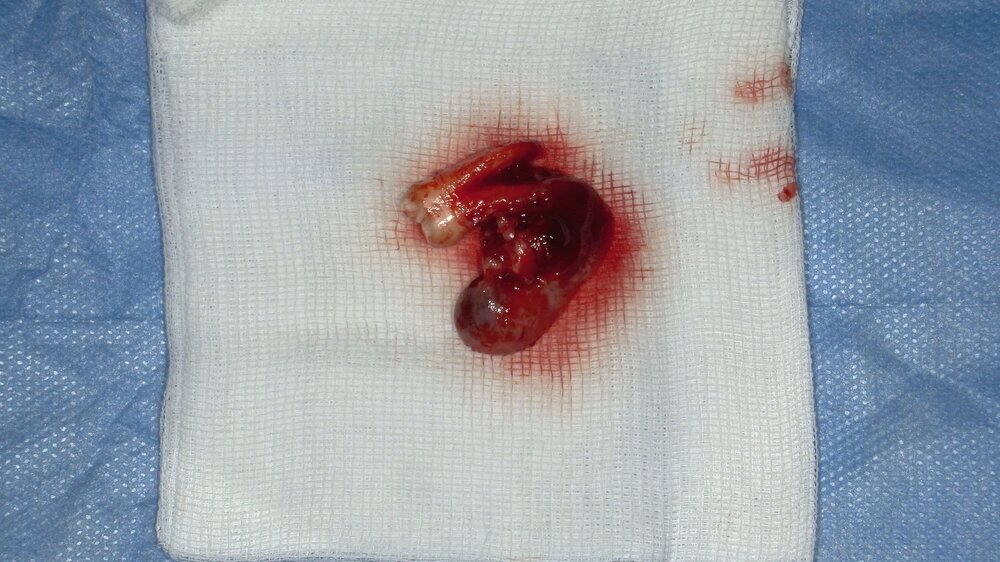
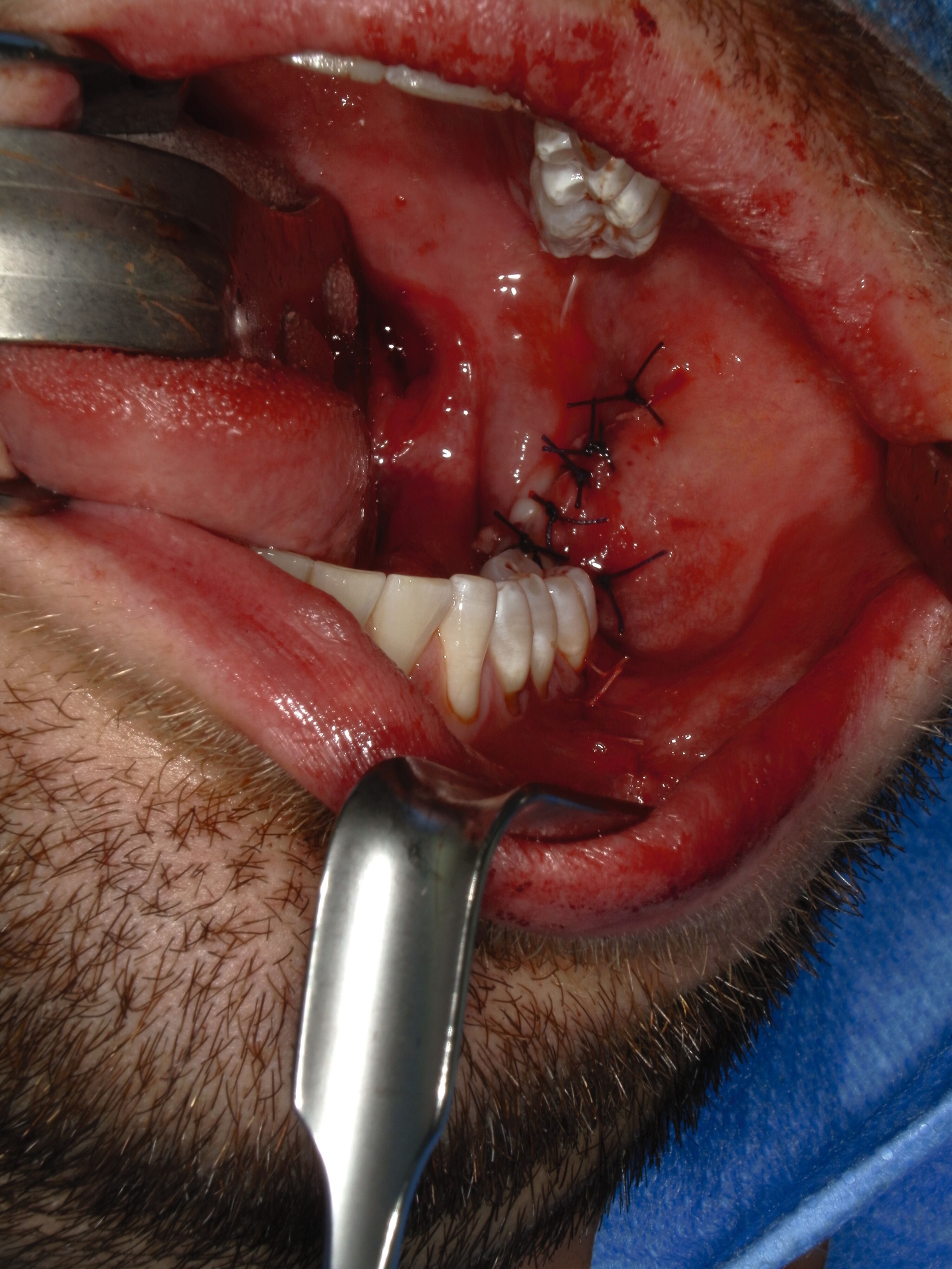
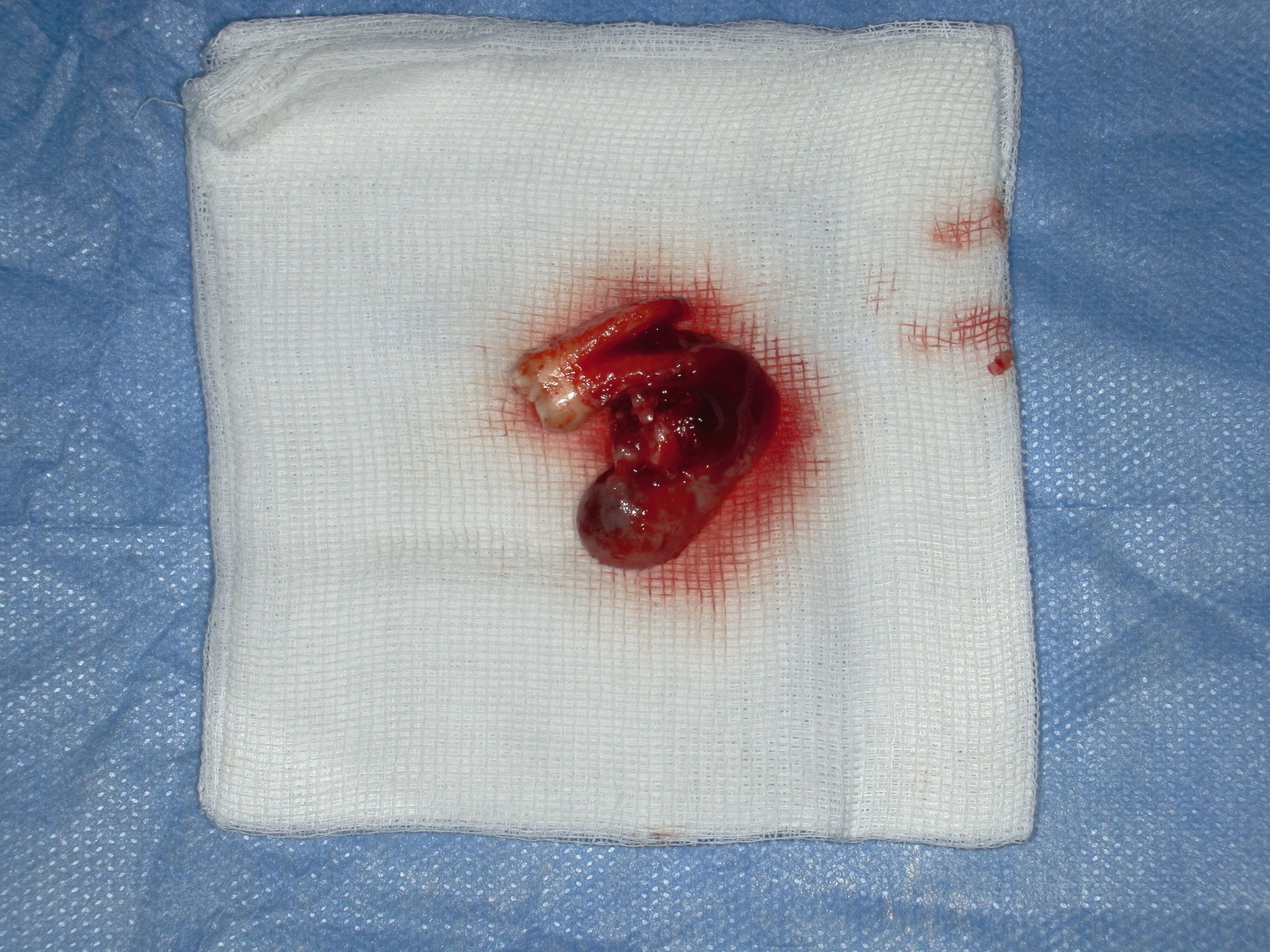
Der Wundverschluss erfolgte spannungsfrei (Abbildung 3c). Das Präparat mit dem extrahierten Zahn 37 und anhaftendem Zystenbalg ist in Abbildung 4 dokumentiert. Die Histopathologie ergab ein bis 1,8 cm messendes Ameloblastom; molekularpathologisch wurde eine BRAF-V600E-Mutation nachgewiesen.
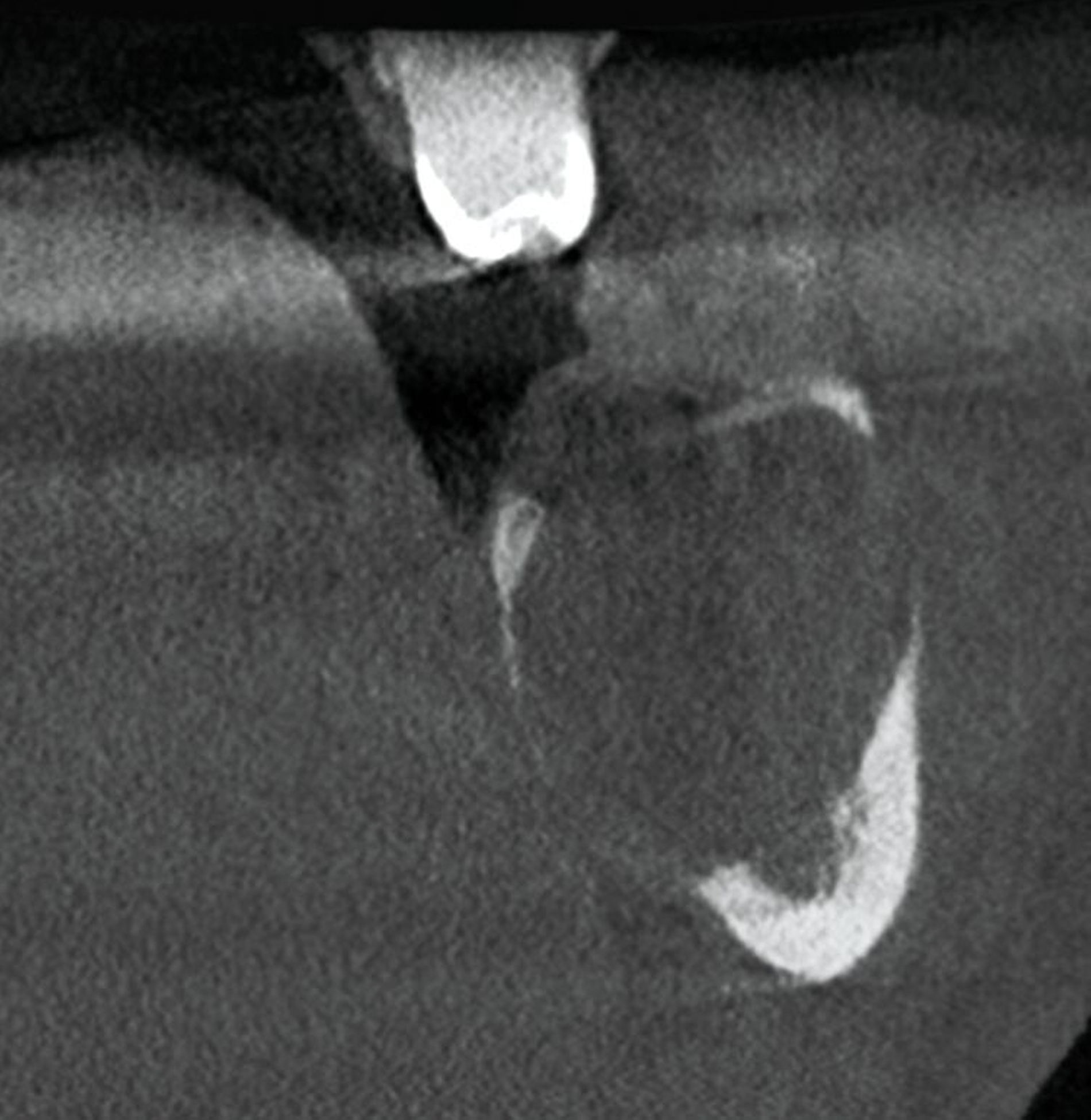
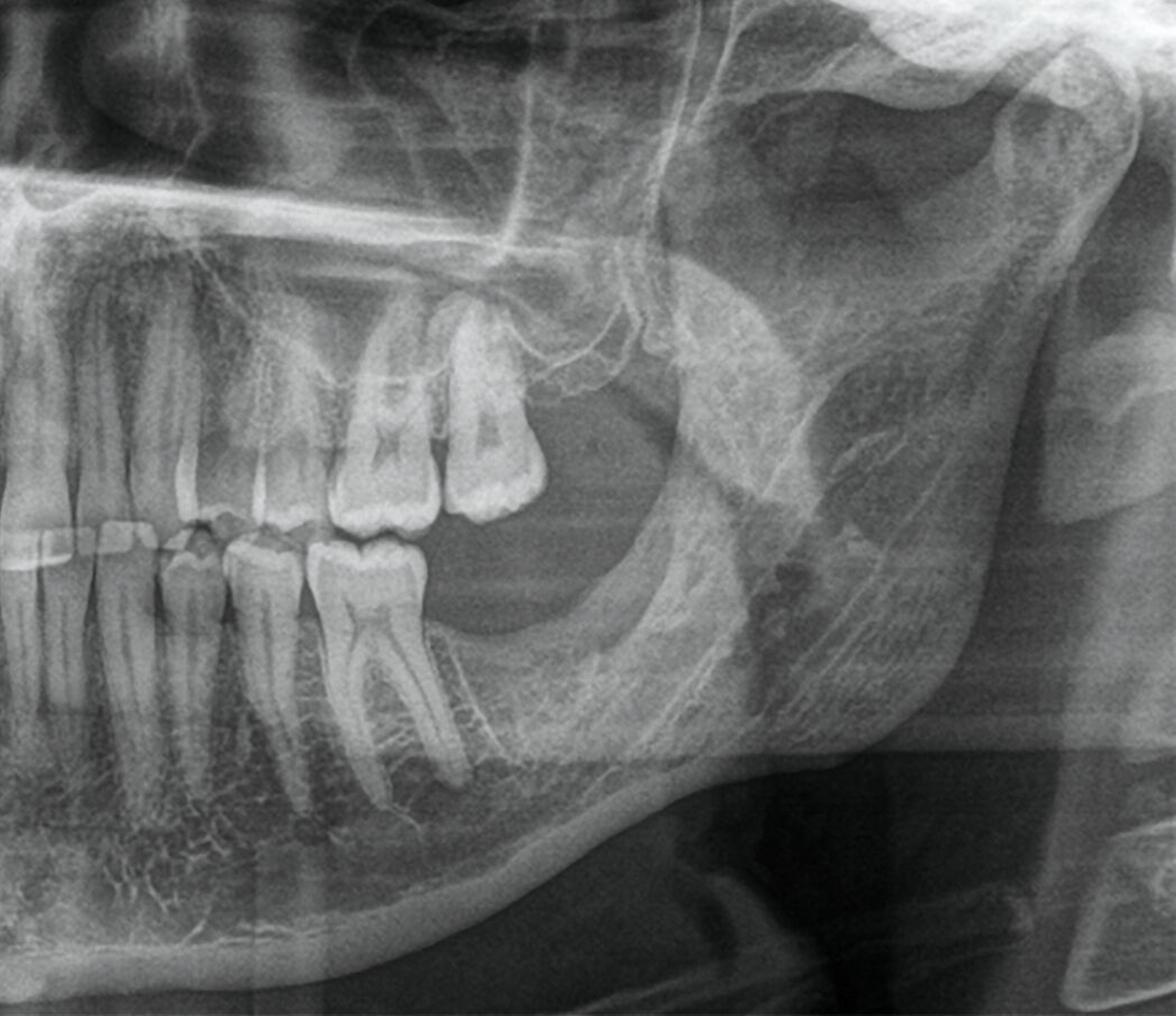
Die seitdem halbjährlich durchgeführten Nachkontrollen zeigen klinisch reizlose Verhältnisse und einen beschwerdefreien Patienten. Radiologisch fand sich eine fortschreitende knöcherne Ausheilung ohne Rezidivhinweise, wie in den Verlaufskontrollen unmittelbar postoperativ, nach einem Jahr und nach zwei Jahren dargestellt (Abbildung 5). Angesichts möglicher Spätrezidive wird die langfristige Nachsorge fortgeführt.
Diskussion
Trotz ihrer histologisch benignen Klassifikation zählen Ameloblastome zu den klinisch relevantesten odontogenen Tumoren, da sie lokal aggressiv wachsen und eine relevante Rezidivneigung zeigen. Nach dem Odontom sind sie die zweithäufigste Entität [Palanisamy und Jenzer, 2019]. Bevorzugt betroffen ist die Mandibula, insbesondere die Molaren-Ramus-Region.
Klinisch dominieren schmerzlose Kieferauftreibungen, gelegentlich mit Gesichtsasymmetrie, Malokklusion, Zahnlockerung oder Wurzelresorption [Ghai, 2022; Esser et al., 2015]; Sensibilitätsstörungen können auf eine perineurale Ausbreitung hinweisen [Soluk-Tekkeşin und Wright, McClary et al., 2016].
Radiologisch zeigen Ameloblastome meist eine multilokuläre Seifenblasen-ähnliche Osteolyse mit charakteristischer Radioluzenz [Gasparro et al., 2024]. In seltenen Fällen kann auch ein unilokuläres Muster beobachtet werden [Rayamajhi et al., 2022]. Das klinische Erscheinungsbild ist heterogen. Man unterscheidet das konventionelle, das unizystische und das periphere Ameloblastom, wobei die konventionelle Form am häufigsten ist und verschiedene histopathologische Muster aufweisen kann (follikulär, plexiform, akanthomatös oder desmoplastisch) [Haefliger und Baumhoer, 2023].
Obwohl Ameloblastome histologisch als benigne Neoplasien klassifiziert werden, zeigen sie in vielen Fällen ein lokal aggressives und destruierendes Wachstumsmuster. Dieses Verhalten ist insbesondere durch die Infiltration der kortikalen Begrenzungen und die Ausdehnung in benachbarte Strukturen wie Kieferhöhle, Weichgewebe oder Nervgewebe charakterisiert [Fehrenz et al., 2021]. Aufgrund dieser Invasivität stellt die chirurgische Sanierung eine therapeutische Herausforderung dar.
In der Literatur werden je nach Operationsmethode deutliche Unterschiede in den Rezidivraten beschrieben: Während nach radikaler Resektion mit Sicherheitsabstand Werte zwischen acht und 15 Prozent berichtet werden, steigen die Rezidivraten nach konservativen Verfahren wie Enukleation (im vorgestellten Fall eine erweiterte Enukleation) oder Kürettage auf bis zu 40 Prozent [Gasparro et al., 2024; Carlson und Marx, 2006].
Die Entscheidung zwischen einem funktionserhaltenden Eingriff und einer radikalen Therapie muss daher patientenindividuell unter Berücksichtigung von Alter, Tumorausdehnung und potenziellen funktionellen Einschränkungen erfolgen.
In sehr seltenen Fällen kann ein Ameloblastom eine maligne Transformation durchlaufen. Diese sogenannte Entartung führt zum Auftreten eines ameloblastischen Karzinoms, das sowohl durch histologische Atypien als auch durch die Fähigkeit zur Metastasierung gekennzeichnet ist [Speight und Takata, 2018]. Die Häufigkeit wird in der Literatur mit unter zwei Prozent angegeben.
Metastasen treten überwiegend pulmonal auf, wenngleich auch Lymphknoten- oder Fernmetastasen beschrieben wurden [Akrish et al., 2007]. Daneben existieren Fälle, in denen ein ameloblastisches Karzinom de novo entsteht, ohne dass zuvor ein benignes Ameloblastom nachweisbar war. Prognostisch sind diese Karzinome ungünstig, da sie häufig eine hohe Rezidivneigung, eine schnelle Progression und eine deutlich reduzierte Überlebenszeit aufweisen [McClary et al., 2016].
Besondere Relevanz erlangte im vorliegenden Fall die molekularpathologische Analyse, die im Tumorgewebe des Patienten eine BRAF-V600E-Mutation nachwies. Diese Mutation gilt als Schlüsselfaktor in der Pathogenese von Ameloblastomen und führt zu einer konstitutiven Aktivierung der MAPK-Signalkaskade. Mehrere Studien beschreiben eine Assoziation mit aggressiverem klinischem Verhalten [Zhang et al., 2024].
Aktuelle systematische Übersichtsarbeiten und Metaanalysen zeigen, dass die BRAF-V600E-Mutation zwar in rund zwei Dritteln der Fälle nachweisbar ist, jedoch keinen signifikanten Einfluss auf die Rezidivrate im Vergleich zu Wildtyp-Tumoren hat [Martins-de-Barros et al., 2023]. Damit besitzt die Mutation vor allem pathogenetische und potenziell therapeutische Relevanz, etwa durch den Einsatz spezifischer BRAF-Inhibitoren wie Vemurafenib oder Dabrafenib in inoperablen oder rezidivierenden Fällen, nicht jedoch prognostische Bedeutung im Hinblick auf das Wiederauftreten [Malakar et al., 2023].
Fazit für die Praxis
Auch langsam progrediente, schmerzlose Kieferschwellungen erfordern eine differenzialdiagnostische Abklärung.
Radiologische Überlappungen mit anderen odontogenen Läsionen machen die Histopathologie essenziell.
BRAF-V600E ist pathogenetisch und therapeutisch relevant; in ausgewählten Situationen kann eine zielgerichtete Therapie erwogen werden.
Aufgrund möglicher Spätrezidive ist eine langfristige, strukturierte Nachsorge erforderlich.
Ein interdisziplinäres Vorgehen mit Pathologie und Molekularpathologie optimiert Diagnostik und Therapieplanung.
Aufgrund möglicher Spätrezidive, teils mehr als ein Jahrzehnt nach Primärtherapie, ist eine langfristige, strukturierte Nachsorge erforderlich. Wir empfehlen in den ersten zwei Jahren klinische Kontrollen alle drei bis sechs Monate, jeweils mit adäquater Bildgebung abhängig vom OP-Ausmaß, in den Jahren drei bis fünf alle sechs bis zwölf Monate und in den Jahren sechs bis zehn jährlich. Ab dem zehnten Jahr erfolgen Kontrollen in größeren Abständen.
In Risikokonstellationen, wie bei einem konservativen Vorgehen oder fraglichen Resektionsrändern, sollte eine jährliche Kontrolle durchgeführt werden. In der Regel genügt eine Panoramaaufnahme beziehungsweise eine DVT, eine CT bleibt speziellen Fragestellungen vorbehalten.
Literaturliste
Akrish, S., A. Buchner, Y. Shoshani, M. Vered, and D. Dayan, Ameloblastic carcinoma: report of a new case, literature review, and comparison to ameloblastoma. Journal of oral and maxillofacial surgery, 2007. 65(4): p. 777-783.
Carlson, E.R. and R.E. Marx, The ameloblastoma: primary, curative surgical management. Journal of oral and maxillofacial surgery, 2006. 64(3): p. 484-494.
Esser, M., M. Horger, S. Ioanovicu, and H. Bösmüller. Imaging Diagnosis of Ameloblastoma–Bildgebung bei Ameloblastomen. in RöFo-Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. 2015. Georg Thieme Verlag KG.
Fehrenz, M., K. Freier, and D. Horn, Das Ameloblastom. Der MKG-Chirurg, 2021. 14(1): p. 55-62.
Gasparro, R., F. Giordano, M.D. Campana, A. Aliberti, E. Landolfo, P. Dolce, G. Sammartino, and A.E. di Lauro, The effect of conservative vs. radical treatment of ameloblastoma on recurrence rate and quality of life: an umbrella review. Journal of Clinical Medicine, 2024. 13(17): p. 5339.
Ghai, S., Ameloblastoma: An Updated Narrative Review of an Enigmatic Tumor. Cureus, 2022. 14(8): p. e27734.
Haefliger, S. and D. Baumhoer, [The new WHO classification of jaw tumours]. Pathologie (Heidelb), 2023. 44(4): p. 240-249.
Malakar, A., V.R. Kumar, P. Yadav, V. Bhardwaj, C.G. Barua, and G. Bhardwaj, The Role of BRAF Inhibitors in the Management of Ameloblastoma: A Literature Review. Cureus, 2023. 15(10): p. e47682.
Martins-de-Barros, A.V., C.C.G. Silva, K.K.N. Gonçalves, R. de Albuquerque Cavalcanti Almeida, E.S.E.D. de Oliveira, F.A. da Costa Araújo, L. Robinson, W.F.P. van Heerden, and M. de Vasconcelos Carvalho, Does BRAF V600E mutation affect recurrence rate of ameloblastomas? Systematic review and meta-analysis. J Oral Pathol Med, 2023. 52(8): p. 701-709.
McClary, A.C., R.B. West, A.C. McClary, J.R. Pollack, N.J. Fischbein, C.F. Holsinger, J. Sunwoo, A.D. Colevas, and D. Sirjani, Ameloblastoma: a clinical review and trends in management. Eur Arch Otorhinolaryngol, 2016. 273(7): p. 1649-61.
Palanisamy, J.C. and A.C. Jenzer, Ameloblastoma. 2019.
Rayamajhi, S., S. Shrestha, S. Shakya, S. Bhandari, A.R. Twayana, and K. Shahi, Unicystic Ameloblastoma of Mandible: A Case Report. JNMA J Nepal Med Assoc, 2022. 60(251): p. 657-660.
Soluk-Tekkeşin, M. and J.M. Wright, The World Health Organization classification of odontogenic lesions: a summary of the changes of the 2017 (4th) edition. Turk Patoloji Derg, 2018. 34(1): p. 1-18.
Speight, P.M. and T. Takata, New tumour entities in the 4th edition of the World Health Organization Classification of Head and Neck tumours: odontogenic and maxillofacial bone tumours. Virchows Archiv, 2018. 472(3): p. 331-339.
Zhang, C.X., L.Z. Zhang, H. Lin, Q.W. Man, and B. Liu, BRAF V600E mutation mediates invasive and growth features in ameloblastoma. Oral Diseases, 2024. 30(7): p. 4426-4439.