ECC-Plaque: So arbeiten Bakterien und Pilze zusammen
Forscher der zahnmedizinischen Fakultät der Universität Pennsylvania haben herausgefunden, dass Early Childhood Caries (ECC) in vielen Fällen durch Plaque verursacht wird, die sowohl Bakterien als auch Pilze zusammenhält - mit der Folge, dass der Biofilm auf den Zähnen pathogener und schwerer zu entfernen ist.
Die Wissenschaftler beobachteten, wie die Mikroorganismen synergetisch wirken, um die Arzneimittelresistenz zu erhöhen. Die Pilzzellen werden in der Folge nicht durch antimykotische Therapien getötet.
ECC-Biofilm - ein Mix aus Bakterien- und Pilzspezies
"Die aktuellen antimikrobiellen Modalitäten zur Behandlung von ECC sind nur begrenzt wirksam", sagt Hyun (Michel) Koo, Professor für Kieferorthopädie und Kinderzahnmedizin an der Penn's School of Dental Medicine. "Verfügbare Beweise zeigen, dass Biofilm-assoziierte Krankheiten polymikrobieller Natur sind, einschließlich einer Mischung aus Bakterien- und Pilzspezies. Daher ist eine Behandlung, die nur auf eine Art von Mikroorganismen gerichtet ist, möglicherweise nicht wirksam."
Zucker schafft die Voraussetzungen
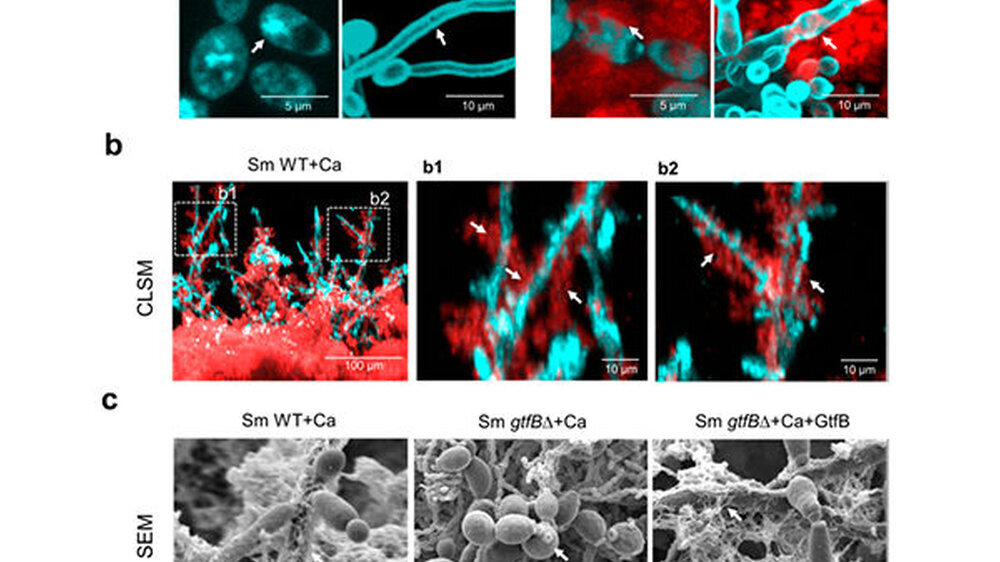
Während der letzten Jahre beobachteten die Forscher, dass der Zahnbelag bei Kindern mit Karies in der frühen Kindheit neben Streptococcus mutans oft die Pilzart Candida albicans enthielt, die normalerweise Schleimhautoberflächen besiedelt.
Die Arbeit im Labor zeigte, dass ein von den Bakterien hergestelltes Enzym (GtfB) an Candida binden kann und wenn Zucker vorhanden ist, bildet sich auf seiner Zelloberfläche eine klebrige polymere Matrix, die es dem Pilz ermöglicht, sich mit bakteriellen Gegenstücken an die Zähne zu binden. Einmal verbunden arbeiten diese Organismen zusammen, um die Schwere der Karies zu erhöhen.
Die Forscher wollten daher herausfinden, ob man mit einem zweigleisigen Ansatz die synergistische Assoziation aufbrechen und den Biofilm effektiv behandeln könnte. "Zu Beginn haben wir uns für Therapien entschieden, die in der Zahnmedizin klinisch eingesetzt werden, um Pilz- oder bakterielle Infektionen anzugreifen oder zu verhindern", sagt Koo. Dabei kamen Fluconazol und Povidon-Jodid zum Einsatz, die Präparate wirkten jedoch nur mäßig, was bestätige, dass die Monotherapie nicht gut gegen polymikrobielle Biofilme funktioniert.
Monotherapien helfen nicht, Kombi-Therapien wirken eindrucksvoll
In Kombination waren die Ergebnisse hingegen viel eindrucksvoller. "Wir haben die Pilzinfektion vollständig beseitigt, sowohl in den im Labor gewachsenen Biofilmen als auch in denen, die in vivo unter Verwendung eines Tiermodells gebildet wurden", bemerkt Koo.
Um zu verstehen, warum der Kombinationsansatz selbst gegen Candida albicans so effektiv war, ohne viele weitere Bakterien zu töten, untersuchten die Forscher hochauflösende mikroskopische Bilder der Biofilme mit den verschiedenen Behandlungskombinationen.
Sie beobachteten, dass der Pilz in unbehandelten Biofilmen und solchen, die nur mit Fluconazol behandelt wurden, mit einer reichlich vorhandenen klebrigen Matrix überzogen war, die als Schutzschild gegen die antimykotische Verbindung zu dienen schien. Aber auch in Biofilmen, die mit Povidoniodid behandelt wurden, wurde die Matrix wesentlich reduziert, wodurch der Pilz dem Fluconazol ausgesetzt wurde.
Die Forscher entdeckten, dass iodidhaltige Medikamente die Aktivität von GtfB hemmen können. In einer Reihe von Experimenten fanden sie heraus, dass Povidon-Iodid als ein starker Inhibitor der Produktion der klebrigen Matrix wirkt. Das Mittel war fast 100-fach stärker als ein Inhibitor der Matrix.
Povidon-Jod durchbricht das Schutzschild
Dies führte sie zu der Hypothese, dass die Matrix als "arzneimittelabfangender Schild" diente, was verhinderte, dass Fluconazol auf die Pilzzellen zugreifen und diese abtöten konnte. Um zu sehen, ob das Aufbrechen der Matrix das Eindringen von Fluconazol in den Pilz ermöglicht, verfolgten sie mit den Wissenschaftlern der Universität Tel Aviv fluoreszenzmarkiertes Fluconazol in Echtzeit zu verfolgen, während es sich durch einen Biofilm bewegte.
Unter Verwendung von zeitverzögerten Bildern fanden sie heraus, dass das Fluconazol in der Matrix gefangen war und es größtenteils nicht gelang, die Pilzzellen zu erreichen, was auch durch direkte Messung von in der Matrix absorbiertem radioaktiv markiertem Fluconazol bestätigt wurde. Im Unterschied dazu bewegte sich Fluconazol leicht in die Pilzzellen, wenn sie in Biofilmen lokalisiert waren, deren Matrix durch Povidon-Jod unterbrochen war.
Mit Blick auf die Zukunft hoffen die Forscher, dass ihre Ergebnisse zu neuen Strategien für die Behandlung von bakteriellen Pilzinfektionen führen, die mit Karies der frühen Kindheit und möglicherweise mit anderen polymikrobiellen Erkrankungen verbunden sind. So könnte künftig Nanotechnologie zum Einsatz kommen, um gezielte Ansätze zu entwickeln, die genau auf die Matrix und die Pilz- und Bakterienbestandteile des oralen Biofilms abzielen.
Dongyeop Kim et al., "Bacterial-derived exopolysaccharides enhance antifungal drug tolerance in a cross-kingdom oral biofilm", The ISME Journal (2018),https://www.nature.com/articles/s41396-018-0113-1#Sec1,doi:10.1038/s41396-018-0113-1