Die Phagentherapie – ein Ausweg aus der Antibiotika-Krise?
Derzeit sterben laut einer aktuellen Studie in Europa rund 30.000 Menschen jährlich an Infektionen, die durch antibiotikaresistente Bakterien verursacht werden. Werden nicht in naher Zukunft neue Therapieoptionen geschaffen, wird diese Zahl in den kommenden Jahren stark ansteigen [Cassini, 2019]. Unabhängig von der bedrohlichen Lage der Resistenzentwicklung gibt es jedoch auch Infektionen, die durch Antibiotika schwer zu behandeln sind. Sind Biofilme in die Infektion involviert, kann die Wirksamkeit von Antibiotika stark reduziert sein [Zimmerli, 2004]. Auch nimmt die Anwendung von Antibiotika einen großen Einfluss auf die Zusammensetzung des Mikrobioms, wodurch sich wiederum andere unerwünschte Bakterien etablieren können [Nylund, 2011]. Ergänzungen und Alternativen zur Behandlung von bakteriellen Infektionen werden dementsprechend dringend benötigt.
Entdeckung der Phagen und erste Anwendungen
In der mikrobiologischen Lebenswelt gibt es ein bemerkenswertes Phänomen: Eine Kultur von Bakterien kann scheinbar aus den Nichts heraus zerstört werden, wenn diese mit einer Probe gemischt wird, die einen entscheidenden Bestandteil enthält – Phagen, die mittels der sogenannten Lyse (Lyse = Auflösen) Bakterien zerstören können. Dieses lytische Phänomen auf bakterielle Kulturen ist schon lange bekannt, auch wenn zunächst über die genaue Ursache nur spekuliert werden konnte. Unabhängig voneinander wurden Phagen von dem Engländer Frederick William Twort und dem Frankokanadier Felix d´Hérelle vor gut 100 Jahren entdeckt. Als Direktor der Drown Animal Sanatory Institution in London forschte der Bakteriologe Twort an Infektionskrankheiten beim Nutztier. 1915 beobachtete er in einem Ausstrich Staphylokokkenkolonien mit ungewöhnlichem Aussehen. Unter dem Lichtmikroskop waren nur zerstörte Bakterienzellen zu erkennen. Nach einer Filtration dieser Proben konnte er das zufällig entdeckte lytische Phänomen auf neue Kulturen übertragen [Duckworth, 1976].
Der Mikrobiologe d´Hérelle entdeckte 1910 bei der Kultivierung von Enterobacter cloacae „Löcher“ im Bakterienrasen, deren mikroskopische Untersuchung keine Klärung des Phänomens lieferte. Auch d’Hérelle war sich der Übertragbarkeit des lytischen Prinzips auf neue Kulturen bewusst, jedoch veröffentlichte er seine Ergebnisse zu diesem Zeitpunkt nicht, da er keine Erklärung dafür hatte und diese teilweise schlecht reproduzierbar waren.
Während des Ersten Weltkriegs forschte d´Hérelle am Institut Pasteur in Paris an Patienten mit bakterieller Dysenterie (Darmentzündung/Durchfallerkrankung – „Ruhr“, Erreger: Shigella dysenteriae). Er nahm Stuhlproben und filtrierte sie. Anschließend gab er diese zu Shigella-dysenteriae-Kulturen und beobachtete das Wachstum der Bakterien. Während der ersten Krankheitsphase wuchsen die Bakterien unverändert gut. Erst bei Eintreten der Genesung der Patienten konnten die Bakterien nicht mehr kultiviert werden. Irgendein unbekannter, „lytischer“ Prozess hatte zwischenzeitlich die Bakterien zerstört. In seiner ersten Publikation (1917) schuf er deshalb den Begriff „Bakteriophage“. Bakteriophage bedeutet wörtlich übersetzt „Bakterienfresser“ und setzt sich zusammen aus den griechischen Worten „Bakterium“ und „phagein“ (= fressen). Er konnte nicht beobachten, dass sich die vermuteten Phagen von selbst im Medium vermehren. Dies erfolgt erst, wie man heute weiß, wenn spezifische Bakterien als Wirt hinzugeben werden [Duckworth, 1976; d´Herelle, 1917].
Die Anwendung von Phagen wurde von d´Hérelle zuerst erfolgreich veterinärmedizinisch untersucht. Danach verabreichte er bereits 1919 oral Phagenlysate an vier totgeglaubte Kinder mit bakterieller Dysenterie, die lediglich filtriert waren – die Kinder überlebten. Weitere erfolgreiche Behandlungen mit der neuen Phagentherapie bei Pest und Cholera folgten und lösten kurzfristig eine Euphorie aus, da damit anscheinend eine wirksame Therapieoption für die Behandlung von Infektionskrankheiten gefunden war. Unternehmen und Pharmafirmen stiegen in die Produktion und Vermarktung von Phagen ein.
Umstritten war nur, was genau die Bakteriophagen waren – ein Enzym oder doch ein Lebewesen? Erst der Mediziner Helmut Ruska konnte 1939 diese Frage klären, als er mit einem Elektronenmikroskop den ersten Bakteriophagen sichtbar machte [Ruska, 1939]. Leider war nicht allen Forschenden die Spezifität der Phagen bewusst, was zu einer Inkonsistenz der Heilungsversuche führte. Denn Phagen sind meist spezifisch für bestimmte Stämme einer Spezies. Außerdem warf der Vermehrungszyklus Fragen auf, denn nicht alle Phagen lysieren die Bakterien. Temperente Phagen, die meist in inaktiver Form integriert ins bakterielle Genom vorliegen (Abbildung 2), wurden deshalb oft als wirkungslos angesehen. Die Produktion der Phagen bereitete ebenfalls Probleme. Eine Reihe weiterer ungeklärter Fragen (optimale Dosis, Stabilität, prozessbedingte Verunreinigungen) und schließlich die Entdeckung der Antibiotika als berechenbarere Therapiealternative ließ die bislang favorisierten Phagen in den Hintergrund treten [Häusler, 2003].
Zu Beginn des Zweiten Weltkriegs erlebte die Phagentherapie allerdings noch einen Aufschwung. Dysenterie-Polyfagin® gegen Shigellen-Infektionen wurde 1939 von den Behringwerken bei Marburg/Lahn als erstes Phagenpräparat auf dem Markt gebracht. Ein weiteres Präparat Typhus-Polyfagin® wurde für die Behandlung von Abdominaltyphus (Salmonella-Infektion) hergestellt. Um die Phagen bei oraler Einnahme zu stabilisieren und die Magensäure zu neutralisieren, wurde gleichzeitig Natriumbicarbonat eingenommen. Viele Soldaten wurden mit den neuen Präparaten behandelt, so dass sowohl Erfolge als auch Misserfolge (aufgrund der vorher genannten Probleme) berichtet werden konnten. Die ambivalenten Erfahrungen veranlassten die American Medical Association 1934 und 1941 dazu, ein vernichtendes Urteil über die Phagentherapie zu veröffentlichen [Eaton, 1934; Krueger, 1941]. Die Gutachten bezeichneten die Effekte der Phagentherapie als äußerst widersprüchlich, so dass Ärzte und Wissenschaftler gleichermaßen verunsichert waren. Die Effizienz einer neuen Medikamentenklasse – der Antibiotika – verdrängte die Phagentherapie in der westlichen Welt. Viele Bakterien konnten nun durch Penicilline, Sulfonamide oder andere neue Antibiotika behandelt werden, so dass die unberechenbare Phagentherapie nicht weiter angewendet wurde [Häusler, 2003].
Überdauert hat die Phagentherapie vor allem in Ländern der ehemaligen UdSSR. Der georgische Wissenschaftler Georgi Eliava, Direktor des bakteriologischen Laboratoriums in Tiflis, brachte durch seinen Aufenthalt 1918 am Institut Pasteur das nötige technische und wissenschaftliche Wissen mit in seine Heimat. Nach seiner Rückkehr nach Tiflis baute er sein Institut zu einer Hochburg der Phagentherapie aus. Er behandelte Patienten jedoch nicht mit einem einzigen Phagen, sondern mit einer Mischung aus Phagen (Cocktail), um die Probleme der Spezifität und Resistenzentwicklung zu umgehen. Heute heißt das Institut in seinem Gedenken Georgi-Eliava-Institut für Bakteriophagenforschung.
In Georgien überlebte die Phagentherapie durch staatliche Förderung und in Ermangelung von Alternativen, da dort vor dem Zweiten Weltkrieg noch keine Antibiotika verfügbar waren. So stellte das Institut Phagen teils im großen Stil her: Gegen Cholera wurden beispielsweise über eine Million Phagendosen pro Jahr produziert. Gerade die Sammlung von aufkommenden antibiotikaresistenten Bakterien machten die Georgier berühmt. Sie suchen noch heute kontinuierlich Phagen gegen neu auftretende endemische Bakterienstämme und passen ihre Cocktails regelmäßig an.
In der westlichen Welt hat sich der Einsatz von Phagen im Pflanzenschutz und in der Lebensmittelindustrie etabliert. So ließ die US-amerikanische Food and Drug Administration (FDA) bereits Phagenprodukte zu. Beispielsweise produziert die Firma Omnilytics unter dem Namen Agriphage® Phagen gegen Feuerbrand (Einsatz in Obstplantagen, Erreger: Erwinia amylovora). Gegen Listerien auf Fleisch und anderen Lebensmitteln kommt das Produkt ListShield® der Firma Intralytix zum Einsatz [Zündorf, 2021].
Was sind Phagen?
Phagen sind Viren und in nahezu jedem Winkel der Erde zu finden, wodurch wir ihnen täglich ausgesetzt sind. Es gibt schätzungsweise 1031 Phagen auf der Welt [Hendrix, 2003]. Da sie wie alle Viren für die Vermehrung auf eine passende Wirtszelle angewiesen sind, sind sie vor allem dort zu finden, wo sich auch die passenden Bakterien wohlfühlen. Dabei sind sie hochspezialisiert und können meist nur einzelne Stämme innerhalb einer Bakterienspezies lysieren. Durch bestimmte Enzyme besitzen einige Phagen zudem die Fähigkeit Biofilme aufzulösen, wodurch sie Zugang zu den dort lebenden Bakterien erhalten. Besonders Abwässer, Böden und Kläranlagen, aber auch Menschen und Tiere sind reich an Mikroorganismen, so dass eine Isolation von Phagen aus Proben dieser Quellen möglich ist.
Phagen sind mit rund 50 bis 200 Nanometer um ein Vielfaches kleiner als ein Bakterium und relativ einfach aufgebaut. Die meisten bekannten Phagen gehören zur Ordnung Caudovirales und besitzen eine sogenannte Kopf-Schwanz-Struktur. Aufgrund der – elektronenmikroskopisch sichtbaren – Morphologie erfolgt die klassische Einteilung in drei Gruppen (Abbildung 1a). Die Myoviren besitzen einen kontraktilen, langen Schwanz, die Siphoviren einen nicht-kontraktilen, langen Schwanz und die Podoviren einen nicht-kontraktilen, kurzen Schwanz. Der Kopf dient zur Lagerung der DNA, während der Schwanz für die spezifische Erkennung des bakteriellen Rezeptors notwendig ist. Es gibt aber auch diverse andere Formen von Phagen, die einzelsträngige DNA oder RNA zur Speicherung der Erbinformationen nutzen. Die Größe des Genoms ist circa zehn- bis tausendfach kleiner als das von Bakterien.
Doch nicht nur im Hinblick auf ihren Aufbau sind Phagen sehr divers. Taxonomisch werden durch das International Committee on Taxonomy of Viruses (ICTV) mehr als 1.000 Spezies unterschieden [Krupovic, 2021]. Auch auf einer Agarplatte (Abbildung 1c) zeigen die Phagen in Form von Plaques („Löcher“ im Bakterienrasen) verschiedene Größen und Ausprägungen. Die Größe der Phagen, aber auch andere Wachstumsparameter, spielen bei der Plaquebildung eine Rolle. Trübe Ringe um eine klare Plaque herum – sogenannte Halos – entstehen beispielsweise, wenn Phagen Enzyme (Depolymerasen) produzieren, die die umliegenden Bakterien ebenfalls reduzieren können.
Wirkungsweise von Phagen
Phagen sind nicht in der Lage, sich selbst zu replizieren, sondern benötigen eine passende bakterielle Wirtszelle. Sie erkennen und binden bestimmte Strukturen auf der Oberfläche der Bakterien (Rezeptoren) und injizieren anschließend ihre genetische Information aus dem Kopf ins Zytoplasma der Bakterienzelle. Nach der Infektion nutzt der Phage die Maschinerie der Bakterienzelle zu seinen Gunsten zur Vervielfältigung des Genoms. Es werden Phagenproteine wie beispielsweise Hüllproteine und Schwänze synthetisiert, die anschließend zu intakten Phagen assemblieren. Im letzten Schritt wird die Bakterienzelle lysiert. Die neu produzierten Phagen werden in die Umgebung freigesetzt. Umliegende Bakterien können nun von den neuen Phagen infiziert werden und der Prozess beginnt von Neuem. Phagen, die sich ausschließlich auf diese Weise vermehren, folgen dem lytischen Zyklus (Abbildung 2). Beim therapeutischen Einsatz profitiert man demnach von dem natürlichen Bestreben der Phagen, sich zu vervielfältigen. Bakteriophagen sind der einzige Wirkstoff, der sich am Infektionsherd „selbstständig“ vermehrt und zwar theoretisch so lange, bis keine Wirte mehr vorhanden sind (auto-dosing effect).
Im Unterschied dazu findet bei temperenten Phagen (lysogener Zyklus) nach der Infektion ein Einbau der genetischen Information ins Genom der Bakterienzelle statt (= Prophage). Die Phagen-DNA wird mit der des Bakteriums vervielfältigt. Eine Lyse der Zelle findet nicht statt (Abbildung 2). Durch exogene Stressoren wie Antibiotika, UV-Licht, pH-Änderung, toxische Substanzen, kann es zur Freisetzung (Induktion) der Prophagen kommen. Die Phagen-DNA wird aus dem bakteriellen Genom ausgeschnitten und der lytische Zyklus weiterverfolgt. Temperente Phagen sind für die Phagentherapie aus zwei Gründen wenig geeignet. Zum einen können sie die Bakterien nicht effektiv zerstören, zum anderen besteht bei der Induktion die Gefahr, dass versehentlich unerwünschte genetische Informationen des Wirtes mit ausgeschnitten und nachfolgend auf andere Bakterien übertragen werden (Transduktion / Horizontaler Gentransfer) [Zinder, 1952].
Aber nicht nur replizierende Phagen haben die Fähigkeit Bakterien zu zerstören. Auch bestimmte Phagenenzyme stellen interessante „antibiotische“ Wirkstoffkandidaten dar. Die sogenannten Endolysine können Teile der bakteriellen Zellwand abbauen und diese damit destabilisieren. Sie werden am Ende des Produktionszyklus des Phagen gebildet und wirken von innen heraus [Mirski, 2019]. Besonders gut funktioniert dies aufgrund des einfacheren Zellwandaufbaus bei grampositiven Bakterien. Für den Einsatz von Endolysinen gegen gramnegative Bakterien müssen zusätzliche Peptide mit den Endolysinen fusioniert werden, damit die äußere Zellmembran ebenfalls destabilisiert werden kann [Zündorf, 2021].
Phagen für den therapeutischen Einsatz
Für eine erfolgreiche Therapie mit Phagen ist einerseits die lytische Effizienz ausschlaggebend. Nur wenn die Vermehrung der Phagen das Wachstum des Wirtes übersteigt, tritt eine Reduzierung der Zellzahl ein. Die lytische Effizienz ist von verschiedenen Faktoren abhängig. Einerseits von der Adsorption, andererseits von der Latenzzeit (Zeit, die ein Phage von der Infektion bis zur Lyse benötigt) und der Burst Size (Anzahl an neuen Phagen, die pro Replikationszyklus freigesetzt werden). Die lytische Effizienz ist aber ebenfalls abhängig vom verwendeten Wirt. Es ist nicht nur der Zustand der Kultur entscheidend, sondern auch die Verfügbarkeit von Nährstoffen, Temperatur und Sauerstoffeintrag. Zudem sollten die Phagen einen breiten Wirtsbereich aufweisen. Dies ist eine Voraussetzung dafür, dass später eine hohe Wahrscheinlichkeit dafür besteht, dass ein Patientenisolat sensitiv gegenüber dem Phagen ist. Außerdem sollten Phagen keine Gene enthalten, die für Antibiotikaresistenzen, Lysogenie oder Virulenzfaktoren kodieren [Philispon, 2018].
Für eine individuelle Phagentherapie muss zuerst der richtige Phage gefunden werden. In der Diagnostik wird dafür ein Phagogramm, das klassisch auf der Double-Agar-Overlay-Methode beruht, durchgeführt (Abbildung 4). Dabei wird eine Petrischale mit zwei Schichten Agar befüllt, wobei die obere eine niedrigere Konzentration besitzt (Topagar). Der Topagar enthält zusätzlich Bakterienkultur des Patientenstamms und verschiedene Verdünnungen des auf Eignung zu testenden Phagen. Nach der Inkubation werden Plaques bei Sensitivität des Bakteriums gegenüber dem Phagen auf einer sonst durchgängig bewachsenen Agarplatte als „Löcher“ sichtbar. Die Morphologie dieser durchsichtigen Plaques sieht je nach Phage-Wirt-Kombination deutlich unterschiedlich aus (Abbildung 1c).
Phagen und Antibiotika
Gegenüber Antibiotika haben Phagen einige Vorteile. Phagen greifen spezifisch nur ein Zielbakterium an, so dass das normale Mikrobiom unangetastet bleibt. Sie sind gut verträglich und haben keinerlei ernste Nebenwirkungen. Doch die gleichzeitige Behandlung von Infektionen mit Phagen und Antibiotika gemeinsam kann weitere Vorteile bringen. Die reine Präsenz von Phagen kann beispielsweise die Sensitivität resistenter Bakterien wiederherstellen, so dass Antibiotika wieder wirksam werden [Gu Liu, 2020]. Eine synergistische Wirkung ist vielfach beschrieben. Wie bei dem Antibiotikaeinsatz kann es bei der Einzelanwendung von Phagen zu einer Resistenzentwicklung kommen. Um dies zu verhindern, werden Kombinationen verschiedener Phagen zusammengestellt. Während die Akkumulation von Antibiotikaresistenzen für die Bakterien einen Überlebensvorteil darstellt, führt die Akkumulation von Resistenzen gegen Phagen zu Viabilitäts- und Virulenzverlusten der Bakterien. Es gibt aber auch antagonistische Effekte, bei denen ein Phage einem zweiten Phagen entgegenwirkt. Eine Herausforderung für den therapeutischen Einsatz ist daher die Wahl der richtigen Kombination aus Phagen.
Entwicklung der therapie in der westlichen Welt
Obwohl die Phagentherapie seit Langem in Georgien eine etablierte Behandlungsmethode darstellt und vermehrt erfolgreiche Einzelfallbehandlungen publiziert werden [Fish, 2018; Mulzer, 2020; Onsea, 2020; Schooley, 2017], kann in Europa und in den USA bisher noch kein zugelassenes Phagen-basiertes Arzneimittel angewendet werden. Im Gegensatz zu Georgien sind in Europa und den USA für die Zulassung von Phagen als Arzneimittel klinische Studien notwendig, wobei der Nachweis der Sicherheit und der Wirksamkeit der Phagentherapie nach geltenden westlichen Standards der evidenzbasierten Medizin erbracht werden muss. In einer sehr überschaubaren Anzahl von klinischen Studien konnte zwar gezeigt werden, dass die Phagentherapie ohne beziehungsweise mit wenigen Nebenwirkungen verläuft, jedoch konnte die Wirksamkeit aus verschiedenen Gründen noch nicht eindeutig belegt werden.
Entweder wurden die Studien schlicht nur als Phase I aufgesetzt, wobei die Phagen erstmalig an gesunden Probanden hinsichtlich Verträglichkeit und Sicherheit untersucht wurden [Wright, 2009; Rhoads, 2009], oder das Studiendesign ist von falschen Voraussetzungen ausgegangen. So wurde beispielsweise im Fall einer randomisierten, kontrollierten Studie im Nachhinein klar, dass unter dem Einsatz von E.-coli-Phagen gegen ETEC-Diarrhö gar nicht die zentralen Erreger der Erkrankung behandelt wurden [Sarker, 2016]. Bei der prominenten Studie PhagoBurn scheiterte die Rekrutierung von Studienteilnehmern, weil die Verbrennungswunden der Patienten nicht ausreichend Monoinfektionen (E. coli beziehungsweise P. aeruginosa) aufwiesen. Darüber hinaus war dort die eingesetzte Phagendosis aufgrund der Inaktivierung der Phagen geringer als geplant [Jault, 2019]. In einer kürzlich veröffentlichten Studie von Leitner und Kollegen konnte bei der Therapie von Harnwegsinfektionen weder die Unterlegenheit der Phagenbehandlung zum SOC (standard of care) noch die Überlegenheit zum Placebo gezeigt werden. In diesem Fall führte vermutlich bereits die vorgeschaltete intravesikale Spülung der Blase zur entscheidenden Erregereradikation [Leitner, 2021].
In Deutschland ist die Phagentherapie derzeit nur im Rahmen von individuellen Heilversuchen (copassionate use) bei austherapierten Patienten möglich, die an lebensbedrohlichen Infektionen leiden. Da aber erkannt wurde, dass die Entwicklung von alternativen und ergänzenden Therapiemöglichkeiten bei der Behandlung von Infektionen dringend benötigt wird, ist in diesem Zusammenhang 2017 die erste wissenschaftliche Studie zur Behandlung von P.-aeruginosa-Infektionen der Lunge (CF, Bronchiektasen) gestartet, gefördert durch das Bundesministerium für Bildung und Forschung (BMBF). Unter Beteiligung vom Leibniz-Institut DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, von Fraunhofer ITEM, der Charité-Universitätsmedizin Berlin sowie der Charité Research Organisation GmbH (CRO) hat das Projekt Phage4Cure die Entwicklung, GMP-Herstellung (GMP – „Good Manufacturing Practice“ sichert hohe Qualität von Arzneimitteln) und klinische Prüfung eines inhalativen Prüfarzneimittel-Phagencocktails zum Ziel. Das Konsortium steht dabei in engem Austausch mit der zuständigen Bundesbehörde Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), um Qualitätsstandards abzustimmen, die analytisch und bioverfahrenstechnisch möglich und biomedizinisch rational sind. Das Fraunhofer ITEM entwickelte dabei eine Produktionsplattform, die die Herstellung von den durch die DSMZ ausgewählten Phagen mit nur minimalen Prozessanpassungen ermöglichte und einen unter ökonomischen Gesichtspunkten maximalen Aufreinigungsgrad erzielte. Sicherheitspharmakologische und toxikologische präklinische Untersuchungen konnten kürzlich vom Fraunhofer ITEM (Hannover) und der Charité ohne die Beobachtung von Nebenwirkungen abgeschlossen werden. Derzeit werden die Unterlagen für die Zulassung der Phagenprüfarzneimittel zur klinischen Prüfung vorbereitet, die unter der Voraussetzung eines positiven Votums Ende 2022 an der Charité Research Organisation an Probanden beginnen soll [Dannheim, 2021].
Als Alternative zur klassischen Zulassung von Phagen-Arzneimitteln wurde über die magistrale Zubereitung von Phagen in Belgien eine regulatorische Grundlage für die geregelte Phagenanwendung etabliert [Pirnay, 2018]. Der Ansatz basiert auf dem „compounding pharmacy“-Konzept in den USA. Seit 2018 können basierend darauf Patienten mit individuell auf ihre Bedürfnisse in spezialisierten Einrichtungen hergestellten Phagen behandelt werden, ohne dass die eingesetzten Phagen unter strengen GMP-Bedingungen hergestellt wurden. Voraussetzung dabei ist die Erstellung eines Zertifikats der Phagenbestandteile durch das wissenschaftliche Gesundheitsinstitut. Unter Berücksichtigung bestimmter Richtlinien können in Apotheken dann auf den Patienten zugeschnittene Phagen-Präparate auf ärztliche Verordnung hergestellt werden.
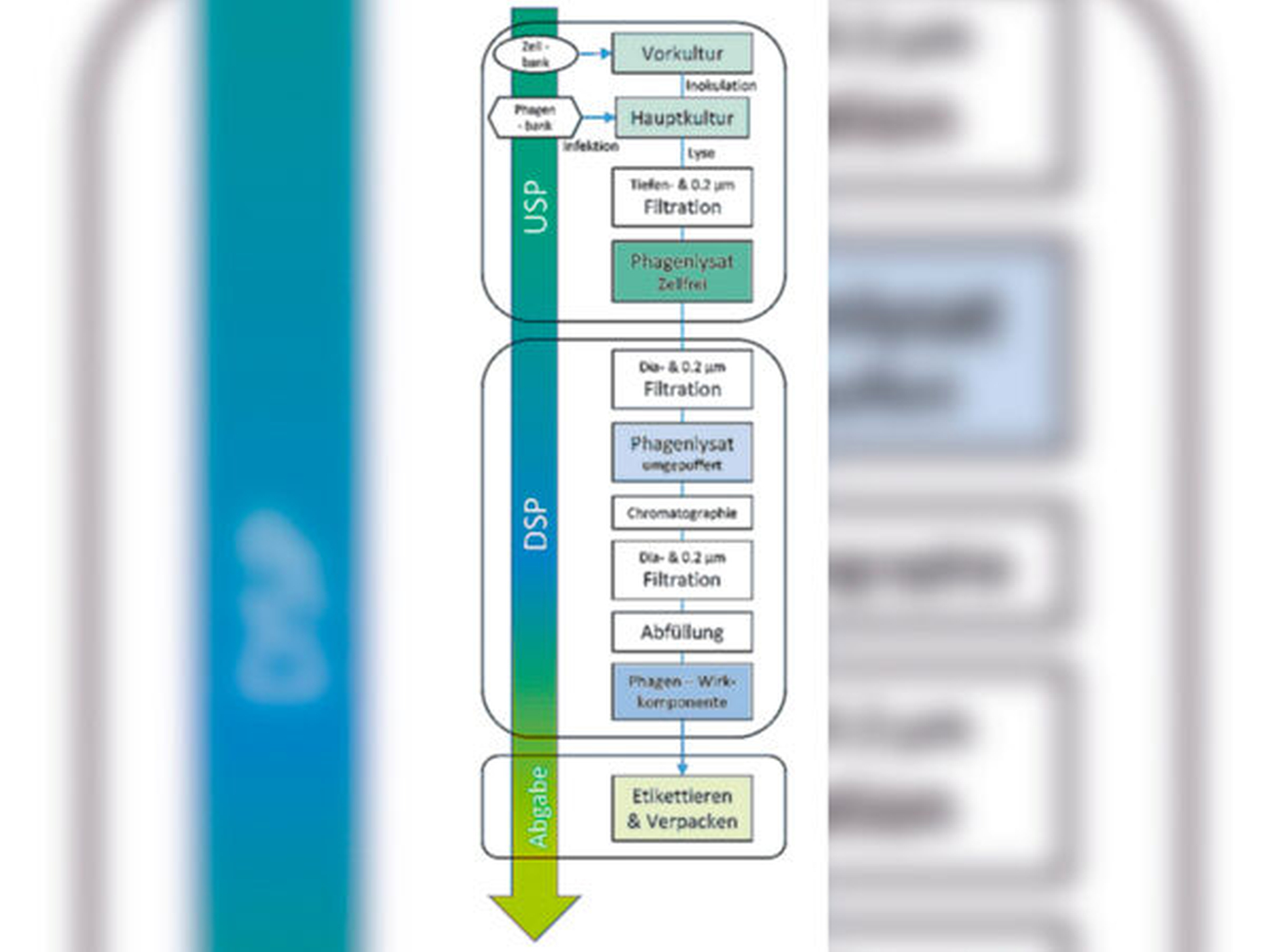
Inspiriert davon wurde 2019 das Projekt PhagoFlow zusammen vom Bundeswehrkrankenhaus Berlin, von Fraunhofer ITEM und der DSMZ, ermöglicht durch die Förderung des Innovationsfonds des Gemeinsamen Bundesausschuss (G-BA), gestartet. Ziel in diesem Projekt ist es, die infrastrukturellen Voraussetzungen für die magistrale Zubereitung von Phagen in Deutschland unter Beachtung der gesetzlichen Vorgaben zu überprüfen. Dabei sollen für klinisch relevante Bakterien wie P. aeruginosa, S. aureus und E. coli Phagen zur Therapie von Wundinfektionen an den Extremitäten zum Einsatz gebracht werden. Zunächst wurden geeignete Phagen-Wirtszell-Kombinationen von der DSMZ ausgewählt. Am Fraunhofer ITEM wird derzeit ein verfahrenstechnisch vereinfachtes Herstellungsverfahren entwickelt, das GMP-Anforderungen erfüllen muss, die für magistrale Zubereitungen notwendig sind. Die Vermehrung der Phagen erfolgt in Einwegkultivierungsbeuteln (USP = upstream prozessing), gefolgt von einer Aufarbeitungssequenz (DSP = downstream prozessing) zur Abtrennung von prozessbedingten Verunreinigungen (zum Beispiel Proteine, DNA und Membranbestandteile (Endotoxine) der Wirtsbakterien) (Abbildung 3). Vor der Abgabe der Phagen-Wirkkomponenten an den klinischen Partner erfolgt die Freigabeanalytik, die die Identitätsprüfung, die Quantifizierung und die Ermittlung des Bioburden (Gesamtkeimzahl) und des pH-Wertes umfasst, sowie die prozessbedingten Verunreinigungen adressiert. Noch in diesem Jahr sollen in der Klinikapotheke des Bundeswehrkrankenhauses Berlin erste magistrale Phagencocktails als Defekturarzneimittel für patientenspezifische Therapien formuliert werden. In Analogie zum Antibiogramm in der Antibiotikatherapie wird dazu in einem Phagogramm ermittelt, für welche Phagen das jeweilige Bakterienisolat eines Patienten empfindlich ist. Die Projektpartner rechnen mit neuen Erkenntnissen und Impulsen aus Phagoflow für qualitative Anforderungen an Phagenpräparate über den unmittelbaren Projektrahmen hinaus. Langfristiges Ziel ist es, die Integration der personalisierten Phagentherapie in den Klinikalltag zu ermöglichen [Dannheim, 2021].
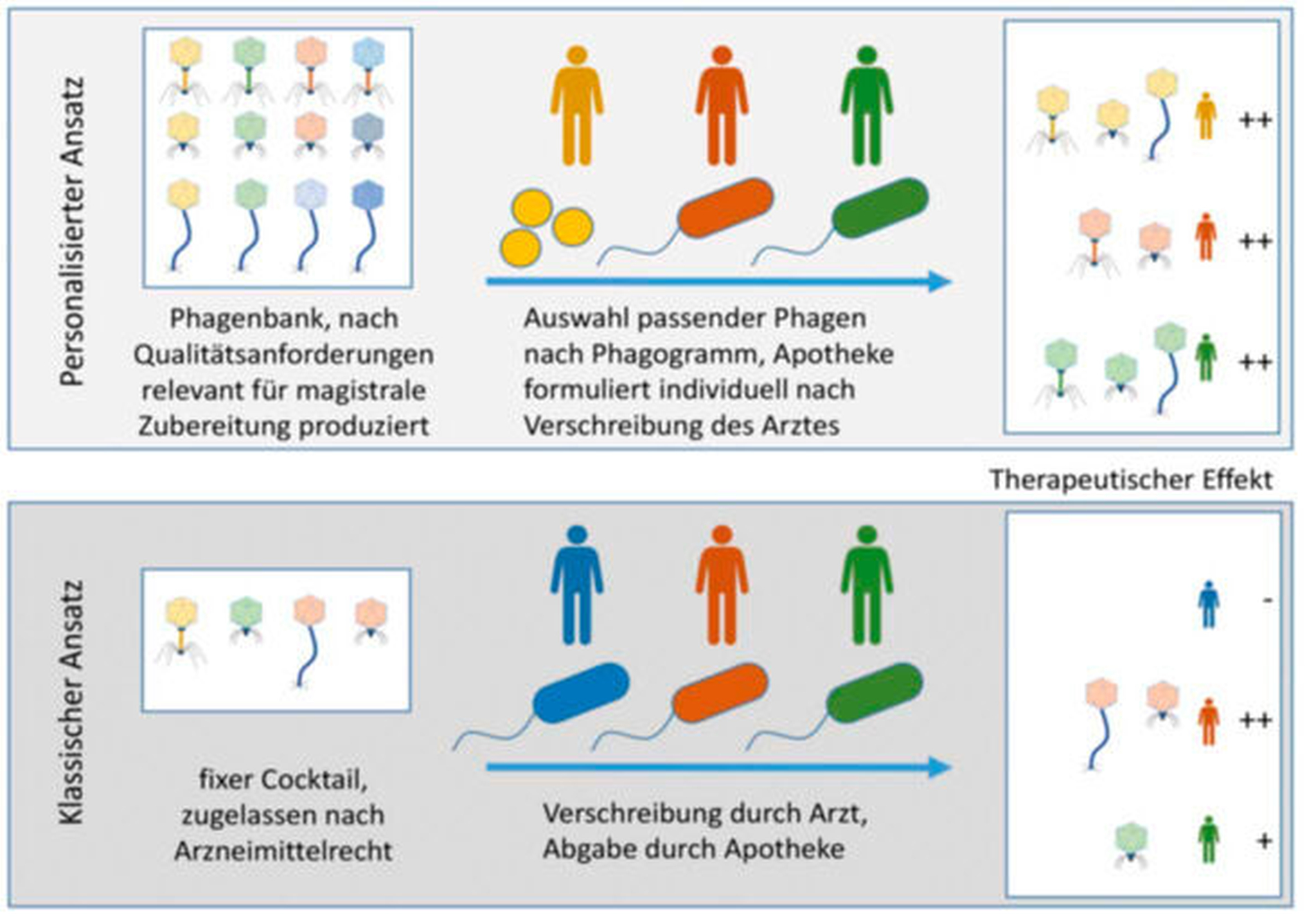
Neben der nach westlichen Ansprüchen wissenschaftlich bestätigten Wirksamkeit der Phagentherapie fehlt es bisher auch an Regularien für die Herstellung, Reinheitsanforderungen und Zulassung, die an die Bedürfnisse der Phagentherapie angepasst wurden. Zwei Herangehensweisen zur Umsetzung der Phagenanwendung kristallisieren sich heraus. Während für bestimmte Indikationen fixe Cocktails entwickelt werden (etwa Phage4Cure, BiomX, Armata Pharmaceuticals), wird auch ein personalisierter Ansatz verfolgt, bei dem die Phagen patientenindividuell zusammengestellt werden (zum Beispiel PhagoFlow, Magistral Phage – Belgien, Adaptive Phage Therapeutics) (Abbildung 4).
Phagen gelten in Deutschland offiziell als Arzneimittel und müssen nach Arzneimittelrecht ein Zulassungsverfahren durchlaufen. Potenzielle Investoren meiden gegenwärtig das Thema Phagentherapie nicht nur wegen der kosten-und zeitintensiven GMP-Produktionen / klinischen Studien. Auch die Tatsache, dass es bisher keine Möglichkeit gibt, Phagenpräparate auf sich entwickelnde epidemiologische Gegebenheiten durch Austausch der Phagen im Phagenpräparat anzupassen, bremst das Interesse von Pharmaunternehmen. Zudem sind einzelne natürliche Phagen an sich nicht patentierbar, da sie nicht zu den Erfindungen, sondern zu den Entdeckungen gezählt werden. Patente wären zwar beispielsweise für die Zusammenstellung bestimmter Phagen oder deren Produktionsverfahren möglich. Da diese jedoch leicht durch minimale Änderungen umgangen werden könnten, erscheinen sie in den Augen potenzieller Investoren wenig werthaltig.
Demnach müssen für die Phagentherapie relevante Zulassungskriterien erstellt werden, die unabhängig vom Phagen die Anforderungen an Herstellung und Qualität regulieren. Auf EU-Ebene wurde eine Arbeitsgruppe ins Leben gerufen, die sich derzeit mit der Erstellung eines allgemeinen Kapitels für das europäische Arzneibuch befasst. Aber auch der Ausbau von Phagenbanken und Herstellungskapazitäten werden nötig sein, bevor Phagen eine echte Ergänzung im Kampf gegen bakterielle Infektionen darstellen können.
Fazit
Phagenbasierte Wirkstoffe können als gut verträgliche und vielversprechende Alternative oder Ergänzung zu Antibiotika angesehen werden. Sie versprechen, die Therapieoptionen bei derzeit schwer zu behandelnden Infektionen zu verbessern. Damit sie jedoch dazu beitragen können, einen Weg aus der Antibiotika-Krise zu weisen, müssen noch verschiedene technische, medizinische und rechtliche Herausforderungen gemeistert werden. Dazu gehört die Festlegung von Qualitätsanforderungen, die die Patientensicherheit gewährleisten und gleichzeitig aber den Wirkmechanismus berücksichtigen. Daneben müssen die pharmakologischen Eigenschaften der Phagenrezepturen besser verstanden und die Effektivität des Einsatzes bewiesen werden.
Durch die staatliche Förderung ist die Entwicklung von phagenbasierten Medikationen in den vergangenen Jahren gut vorangekommen. Erste klinische Anwendungen werden in Kürze beginnen. Die Prozesse von Forschung und Entwicklung bleiben jedoch – gerade auch in der Biotechnologie – hochgradig ergebnisoffen, so dass es gegenwärtig noch zu früh ist, einen Zeitraum zu benennen, an dem Phagenpräparate als Therapieoption regulär zur Verfügung stehen werden.
Literaturliste
1. Cassini, A., Högberg, L. D., Plachouras, D., Quattrocchi, A., Hoxha, A., Simonsen, G. S. et al. (2019). Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. The Lancet Infectious Diseases 19, 56–66.
2. d’Herelle, F. (1917). On an invisible microbe antagonistic to dysentery bacilli. CR Acad Sci 165, 373–375.
3. Dannheim, A., Korf, I., Wienecke, S. & Ziehr, H. (2021). Herstellungsverfahren von Phagen für eine alte Therapie in neuen Kleidern. Phage manufacturing process for an old therapy in new clothes. Pharmakon, 446–453.
4. Dedrick, R. M., Guerrero-Bustamante, C. A., Garlena, R. A., Russell, D. A., Ford, K., Harris, K. et al. (2019). Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nature medicine 25, 730–733.
5. Duckworth, D. H. (1976). „Who discovered bacteriophage?“. Bacteriological reviews 40, 793–802.
6. Eaton, M. D. & Bayne-Jones, S. (1934). BACTERIOPHAGE THERAPY. JAMA 103, 1769.
7. Fish, R., Kutter, E., Wheat, G., Blasdel, B., Kutateladze, M. & Kuhl, S. (2018). Compassionate Use of Bacteriophage Therapy for Foot Ulcer Treatment as an Effective Step for Moving Toward Clinical Trials. Methods in molecular biology (Clifton, N.J.) 1693, 159–170.
8. Gu Liu, C., Green, S. I., Min, L., Clark, J. R., Salazar, K. C., Terwilliger, A. L. et al. (2020). Phage-Antibiotic Synergy Is Driven by a Unique Combination of Antibacterial Mechanism of Action and Stoichiometry. mBio 11.
9. Häusler, T. (2003). Gesund durch Viren. Ein Ausweg aus der Antibiotika-Krise, Piper, München, Zürich.
10. Hendrix, R. W. (2003). Bacteriophage genomics. Current opinion in microbiology 6, 506–511.
11. Jault, P., Leclerc, T., Jennes, S., Pirnay, J. P., Que, Y.-A., Resch, G. et al. (2019). Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. The Lancet Infectious Diseases 19, 35–45.
12. Krueger, A. P. & Scribner, E. J. (1941). THE BACTERIOPHAGE. JAMA 116, 2160.
13. Krupovic, M., Turner, D., Morozova, V., Dyall-Smith, M., Oksanen, H. M., Edwards, R. et al. (2021). Bacterial Viruses Subcommittee and Archaeal Viruses Subcommittee of the ICTV: update of taxonomy changes in 2021. Archiv f Virusforschung 166, 3239–3244.
14. Leitner, L., Ujmajuridze, A., Chanishvili, N., Goderdzishvili, M., Chkonia, I., Rigvava, S. et al. (2021). Intravesical bacteriophages for treating urinary tract infections in patients undergoing transurethral resection of the prostate: a randomised, placebo-controlled, double-blind clinical trial. The Lancet Infectious Diseases 21, 427–436.
15. Mirski, T., Lidia, M., Nakonieczna, A. & Gryko, R. (2019). Bacteriophages, phage endolysins and antimicrobial peptides - the possibilities for their common use to combat infections and in the design of new drugs. Annals of agricultural and environmental medicine : AAEM 26, 203–209.
16. Mulzer, J., Trampuz, A. & Potapov, E. V. (2020). Treatment of chronic left ventricular assist device infection with local application of bacteriophages. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery 57, 1003–1004.
17. Nylund, C. M., Goudie, A., Garza, J. M., Fairbrother, G. & Cohen, M. B. (2011). Clostridium difficile infection in hospitalized children in the United States. Archives of pediatrics & adolescent medicine 165, 451–457.
18. Onsea, J., Wagemans, J., Pirnay, J. P., Di Luca, M., Gonzalez-Moreno, M., Lavigne, R. et al. (2020). Bacteriophage therapy as a treatment strategy for orthopaedic-device-related infections: where do we stand? European cells & materials 39, 193–210.
19. Philipson, C. W., Voegtly, L. J., Lueder, M. R., Long, K. A., Rice, G. K., Frey, K. G. et al. (2018). Characterizing Phage Genomes for Therapeutic Applications. Viruses 10.
20. Pirnay, J.-P., Verbeken, G., Ceyssens, P.-J., Huys, I., Vos, D. de, Ameloot, C. et al. (2018). The Magistral Phage. Viruses 10.
21. Rhoads, D. D., Wolcott, R. D., Kuskowski, M. A., Wolcott, B. M., Ward, L. S. & Sulakvelidze, A. (2009). Bacteriophage therapy of venous leg ulcers in humans: results of a phase I safety trial. Journal of wound care 18, 237-8, 240-3.
22. Ruska, H., Borries, B. v. & Ruska, E. (1939). Die Bedeutung der bermikroskopie für die Virusforschung. Archiv für Virusforschung (Archiv für die gesamte Virusforschung) 1, 155–169.
23. Sarker, S. A., Sultana, S., Reuteler, G., Moine, D., Descombes, P., Charton, F. et al. (2016). Oral Phage Therapy of Acute Bacterial Diarrhea With Two Coliphage Preparations: A Randomized Trial in Children From Bangladesh. EBioMedicine 4, 124–137.
24. Schooley, R. T., Biswas, B., Gill, J. J., Hernandez-Morales, A., Lancaster, J., Lessor, L. et al. (2017). Development and Use of Personalized Bacteriophage-Based Therapeutic Cocktails To Treat a Patient with a Disseminated Resistant Acinetobacter baumannii Infection. Antimicrobial agents and chemotherapy 61.
25. Wright, A., Hawkins, C. H., Anggård, E. E. & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical otolaryngology : official journal of ENT-UK ; official journal of Netherlands Society for Oto-Rhino-Laryngology & Cervico-Facial Surgery 34, 349–357.
26. Zimmerli, W., Trampuz, A. & Ochsner, P. E. (2004). Prosthetic-joint infections. The New England journal of medicine 351, 1645–1654.
27. Zinder, N. D. & Lederberg, J. (1952). Genetic exchange in Salmonella. Journal of bacteriology 64, 679–699.
28. Zündorf, I. (2021). Jenseits der klassischen Phagentherapie - Endolysine und rekombinante Phagen. Beyond classical phage therapy - endolysins and synthetic phages. Pharmakon, 498-491.