Verändert CHX orale Keime?
Resistenzen gegenüber Antibiotika und anderen antibakteriellen Agenzien und Verfahren (Antimicrobial Resistance, AMR) gelten als eine der größten Herausforderungen für das Gesundheitswesen im 21. Jahrhundert und wurden kürzlich als „übersehene Pandemie im Schatten von COVID-19“ bezeichnet [Laxminarayan, 2022]. So wurde im Januar 2022 in der Fachzeitschrift „The Lancet“ ein aufsehenerregender Artikel veröffentlicht, in dem für das Jahr 2019 eine mittlere Zahl von 4,95 Millionen mit AMR assoziierten Todesfällen und von 1,27 Millionen direkt auf AMR zurückzuführenden Todesfällen weltweit geschätzt wurde [Antimicrobial Resistance Collaborators, 2022]. Folglich kann AMR als eine der weltweit führenden Todesursachen angesehen werden, die nur hinter COVID-19 und Tuberkulose, aber vor HIV/AIDS und Malaria rangiert, wenn es um die weltweiten Todesfälle durch Infektionen geht [Laxminarayan, 2022]. Es wird davon ausgegangen, dass uns durch die weitere Zunahme von AMR eine Rückkehr in ein prä-antibiotisches Zeitalter drohen könnte.
Obwohl die Mundhöhle und ihre Mikrobiota (siehe Abbildung 1 für eine rasterelektronenmikroskopische Aufnahme eines subgingivalen Biofilms) bereits vor einigen Jahren als potenzielles Reservoir für Antibiotikaresistenzgene hervorgehoben wurden [Al-Ahmad et al., 2014; Jiang et al., 2018], ist das Bewusstsein für potenzielle Risiken im Zusammenhang mit der Verwendung von Antiseptika im Hinblick auf AMR beim zahnärztlichen Fachpersonal gering [Cieplik et al., 2019; Mao et al., 2020]. Dies ist umso bemerkenswerter, da eine Vielzahl von Antiseptika, beispielsweise Chlorhexidindigluconat (CHX), in Mundspülungen, Gelen oder Zahnpasten enthalten ist, die entweder für die professionelle Anwendung in der Zahnarztpraxis bestimmt oder als frei verkäufliche Mundpflegeprodukte erhältlich sind. Hinzu kommt, dass es in der Literatur bereits seit längerer Zeit Hinweise auf Resistenzen gegenüber anderen breitflächig eingesetzten Antiseptika wie beispielsweise Benzalkoniumchlorid oder Triclosan gibt [Buffet-Bataillon et al., 2012; McNamara & Levy, 2016].
Das orale Goldstandard-Antiseptikum CHX
CHX ist ein zweifach positiv geladenes Bis-Biguanid-Molekül und wird in der klinischen Praxis meist als sein Digluconat-Salz eingesetzt. CHX wurde erstmals 1954 als „neues antibakterielles Mittel von hoher Wirksamkeit“ beschrieben [Davies et al., 1954] und anschließend schnell als Desinfektionsmittel von OP-Gebieten sowie in verschiedenen anderen medizinischen Bereichen wie in der Urologie, der Gynäkologie, der Augenheilkunde und der HNO-Heilkunde eingesetzt, bevor es in den späten 1960er-Jahren in die Zahnmedizin eingeführt wurde [Gjermo, 1974]. Seit den 1970er-Jahren wird CHX schließlich breitflächig in der zahnärztlichen Praxis verwendet, nachdem Harald Löe und C. Rindom Schiøtt eine vollständige Hemmung der Plaquebildung und der Ausbildung einer Gingivitis durch eine zweimal täglich durchgeführte Mundspülung mit 0,2 Prozent CHX trotz Einstellung aller weiteren Mundhygienemaßnahmen (Zähneputzen) beschrieben hatten [Löe & Schiøtt, 1970; Gjermo, 1974]. So werden CHX-haltige Mundspülungen zur Plaquekontrolle und zur Behandlung von Gingivitis [Van der Weijden et al., 2015] bei Patienten mit hohem Kariesrisiko, beispielsweise durch festsitzende kieferorthopädische Apparaturen [Pithon et al., 2015], oder bei Patienten nach parodontal- oder implantatchirurgischen Eingriffen [Solderer et al., 2019] eingesetzt. Zudem werden Antiseptika routinemäßig als Mundspülung vor der zahnärztlichen Behandlung im Rahmen des Maßnahmenbündels zum Infektionsschutz während der COVID-19-Pandemie verwendet, um die Belastung durch Mikroorganismen in zahnmedizinischen Aerosolen zu verringern [Gottsauner et al., 2020; Carrouel et al., 2021].
Die antibakterielle Wirkung von CHX wird gewöhnlich so beschrieben, dass es in niedrigen Konzentrationen bakteriostatisch und in höheren bakterizid wirkt [Jones, 1997]. Sein antibakterieller Wirkmechanismus beruht dabei auf einer Schädigung der bakteriellen Zytoplasmamembran und dem anschließenden Austritt von Zytoplasmabestandteilen [Gilbert & Moore, 2005; Cieplik et al., 2019; Muehler et al., 2020]. Abbildung 2 zeigt schematisch den Wirkmechanismus von CHX sowie transmissionselektronenmikroskopische Aufnahmen nach der Behandlung mit CHX, die die Effekte von CHX auf die bakterielle Zytoplasmamembran darstellen.
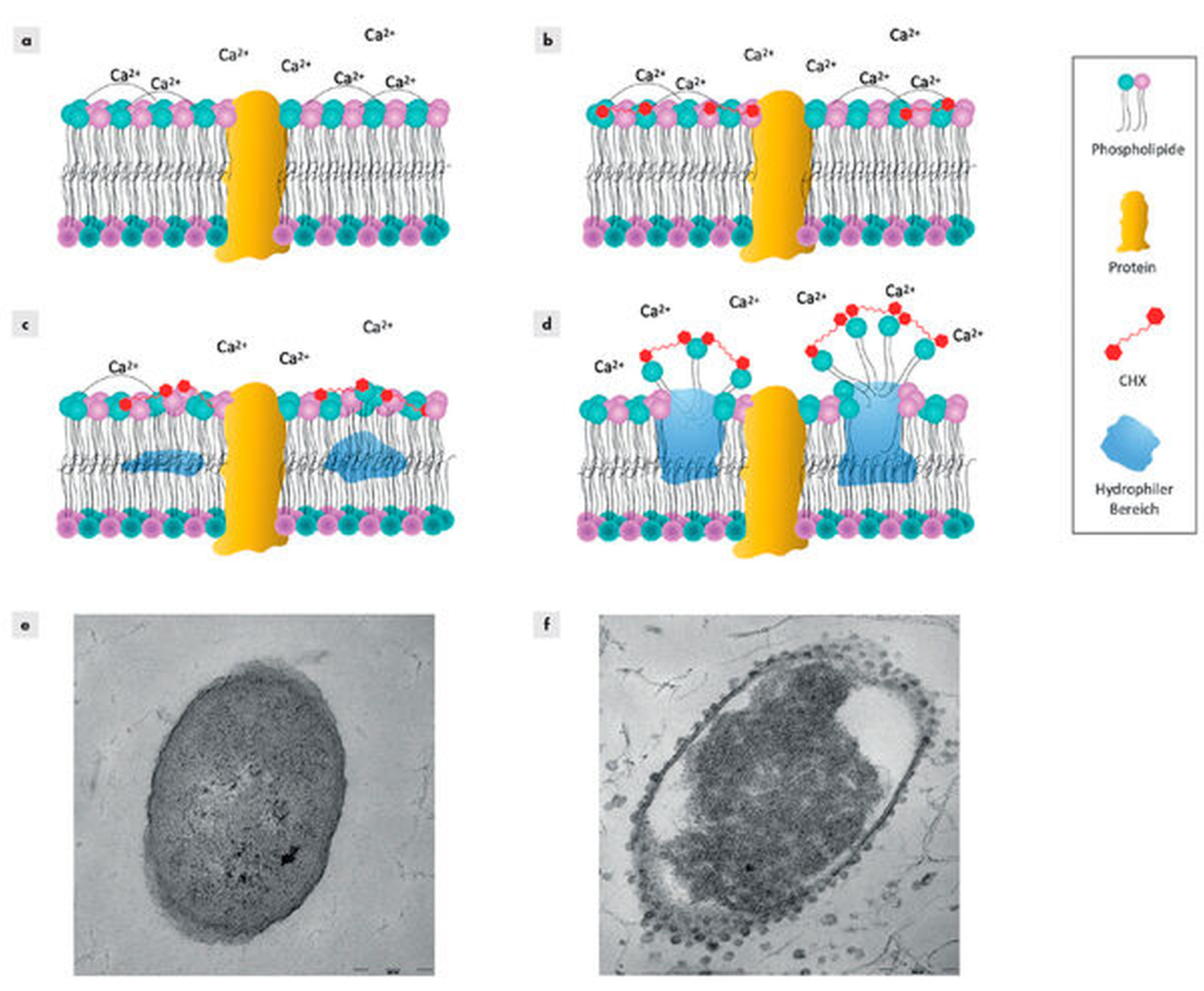
Effektivität gegenüber Bakterien in Biofilmen
Obwohl es zahlreiche Studien gibt, die zeigen, dass eine Mundspülung mit CHX die Bakterienlast im Speichel [Marui et al., 2019] und damit die Bildung oraler Biofilme verringern kann [Auschill et al., 2005; Arweiler et al., 2006], ist die antibakterielle Wirksamkeit von CHX gegenüber reifen oralen Biofilmen eher eingeschränkt [Cieplik et al., 2019; Schwarz et al., 2021]. So konnte unsere Arbeitsgruppe kürzlich zeigen, dass eine einminütige CHX-Behandlung bei Biofilmen, die aus humanem Speichel inokuliert und über 72 Stunden lang in vitro kultiviert wurden, eine Reduktion der koloniebildenden Einheiten (KBE) von weniger als 1 log10-Stufe erreichen konnte, was einer nur sehr geringen antibakteriellen Wirkung entspricht [Schwarz et al., 2021].
Diese eingeschränkte Wirksamkeit von CHX gegenüber oralen Biofilmen hat mehrere Ursachen: Zum einen kann die antibakterielle Wirkung von CHX durch Interaktion mit Speichel- oder Serumproteinen stark verringert werden [Abouassi et al., 2014]. Zum anderen wirkt die Biofilm-Matrix als Diffusionsbarriere für positiv geladene Moleküle wie CHX [Jakubovics et al., 2021]. Außerdem verändern Bakterien im Biofilm ihr Wachstumsverhalten und ihre Genexpression und werden dadurch weniger angreifbar und toleranter im Vergleich zu planktonischen Bakterien [Chambless et al., 2006]. Im oralen Biofilm führt daher die Behandlung mit CHX zu einem Konzentrationsgradienten mit hohen Konzentrationen an der Biofilmoberfläche und niedrigen in den unteren Schichten des Biofilms, was zu Arealen mit subinhibitorischen CHX-Konzentrationen führen kann [Jakubovics et al., 2021]. Diese eingeschränkte antibakterielle Wirkung von CHX in tieferen Schichten des Biofilms konnte bereits vielfach mithilfe der konfokalen Laser-Scanning-Mikroskopie (CLSM) in Kombination mit LIVE/DEAD-Färbung visualisiert werden [Zaura-Arite et al., 2001; Al-Ahmad et al., 2016]. Abbildung 3 zeigt exemplarisch eine CLSM-Aufnahme eines In-situ-Biofilms nach fünfminütiger Behandlung mit CHX, wo klar Bereiche mit subinhibitorischen Konzentrationen innerhalb des Biofilms gezeigt werden.
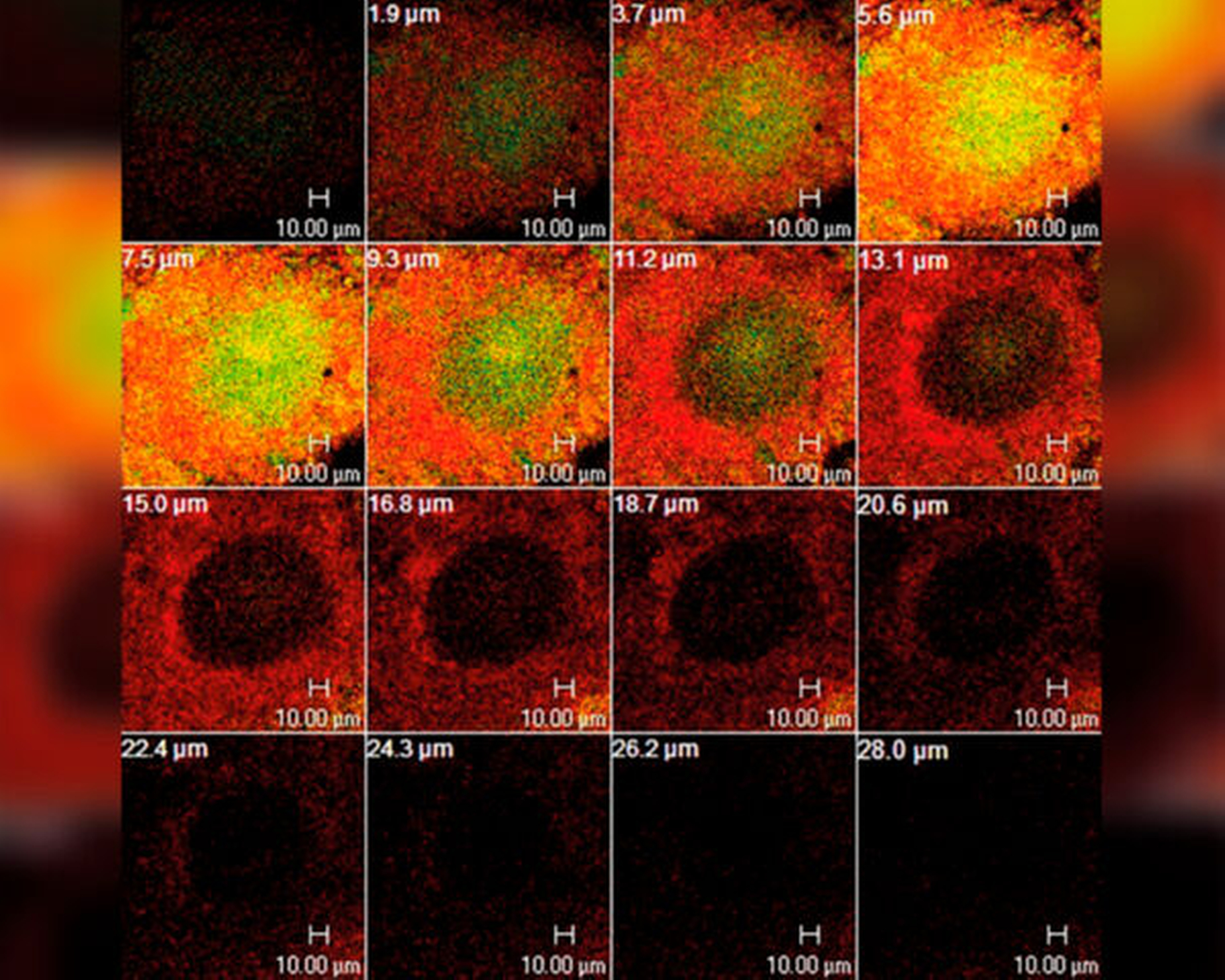
Auswirkungen auf orale Bakterien
Aufgrund der breitflächigen klinischen Anwendung von CHX ist es naheliegend, dass Mikroorganismen in einer klinischen Umgebung mit subinhibitorischen Konzentrationen von CHX in Kontakt kommen. Dabei gibt es nur wenige Studien, die die Effekte von subinhibitorischen CHX-Konzentrationen auf orale Bakterien untersucht haben [Cieplik et al., 2019; Muehler et al., 2022]. Ähnlich wie bei subinhibitorischen Konzentrationen von Antibiotika kann die Stressantwort von Bakterien hier sehr komplex sein und mehrere Prozesse umfassen. Beispiele dafür sind ein Verlust der Regulation des osmotischen Gleichgewichts an der Zytoplasmamembran, die Störung von Membrantransportprozessen und der Atmungsaktivität sowie oxidativer Stress, der sogenannte SOS-Reaktionen auslöst und wiederum eine fehleranfällige DNA-Replikation induziert, die zu Mutationen und Gentransfer führen kann [Andersson & Hughes, 2014].
Eine aktuelle Studie unserer Gruppe konnte zeigen, dass eine Behandlung von Streptococcus mutans mit subinhibitorischen Konzentrationen von CHX zu einer stark veränderten Regulation der Genexpression führte, wobei im Vergleich zur unbehandelten Kontrolle die Expression von 404 Genen hochreguliert und von 271 Genen herunterreguliert war [Muehler et al., 2022]. Weitere Analysen dieser differentiell exprimierten Gene zeigten, dass bestimmte Signalwege signifikant unterschiedlich reguliert waren. So zeigte sich eine erhöhte Expression von Genen, die mit oxidativem Stress und Säure-Stress (vermutlich infolge des sauren pH-Werts von CHX von 5,5) zusammenhängen. Darüber hinaus wurde eine Regulierung von Genen, die mit membrangebundenen Transportern und Efflux-Pumpen sowie einer verstärkten Biofilmbildung assoziiert sind, festgestellt, was zu einer möglichen Resistenzentwicklung beitragen könnte [Muehler et al., 2022]. Eine weitere aktuelle Studie unserer Gruppe zeigte zudem, dass auch subinhibitorische Konzentrationen verschiedener Antibiotika die Biofilmbildungsfähigkeit endodontischer Enterococcus-faecalis-Isolate erhöhen und somit eine ähnliche Wirkung wie CHX aufweisen [Bernardi et al., 2021]. Die genauen molekularen Mechanismen, die eine mögliche Resistenzentwicklung gegenüber CHX in oralen Bakterien bewirken sowie die Stressreaktion anderer oraler Bakterien bei Exposition gegenüber subletalen CHX-Konzentrationen sind jedoch weiterhin noch nicht gut verstanden [Cieplik et al., 2019].
Resistenzen gegenüber CHX
Interessanterweise wurden bereits ab 1972, also kurz nach der Einführung von CHX, drei Studien veröffentlicht, in denen über klinische Isolate von Streptococcus sanguinis berichtet wurde, die nach längerfristiger Anwendung von CHX-Mundspülungen oder -Gelen eine verringerte Empfindlichkeit gegenüber CHX aufwiesen, was damals jedoch als „relativ unbedenklich“ beurteilt wurde [Emilson et al., 1972; Schiøtt & Löe, 1972; Emilson & Fornell, 1976]. Einige Jahre später beschrieben Westergren und Emilson die Entwicklung einer Resistenz gegenüber CHX bei drei ursprünglich sensitiven Stämmen von Streptococcus sanguinis nach Dauerkultur in vitro in einem Fermenter mit steigenden CHX-Konzentrationen [Westergren & Emilson, 1980]. Bemerkenswerterweise blieb diese phänotypische Resistenz auch nach Unterbrechung des Selektionsdrucks bei Kultur in Medium ohne Zugabe von CHX stabil und die Zugabe extrahierter DNA aus diesen resistenten Mutanten führte bei sensitiven Streptococcus-sanguinis-Stämmen ebenfalls zu einer verminderten phänotypischen Empfindlichkeit gegenüber CHX, was auf Veränderungen der Stämme auf Genom-Ebene hinweist [Westergren & Emilson, 1980]. Beim Screening von 315 aus subgingivaler Plaque gewonnenen Isolaten hinsichtlich ihrer Empfindlichkeit gegenüber einer 0,2-prozentigen CHX-Mundspülung wurden zudem Hinweise auf eine sogenannte „relative Resistenz“ bei verschiedenen Vertretern der Gattungen Streptococcus und Capnocytophaga beschrieben [Wade & Addy, 1989].
Neben diesen älteren Studien zu klinischen Isolaten gab es in den vergangenen Jahren auch einige In-vitro-Untersuchungen, die zeigten, dass sich orale Bakterien nach wiederholter Exposition gegenüber subinhibitorischen Konzentrationen von CHX zumindest phänotypisch adaptieren können [Kulik et al., 2015; Kitagawa et al., 2016; Wang et al., 2017; Verspecht et al., 2019; Schwarz et al., 2021]. So zeigten beispielsweise Kitagawa et al., dass die wiederholte Exposition von Enterococcus faecalis gegenüber CHX durch serielles Passieren (zehn Zyklen, in denen die Bakterien subinhibitorischen Konzentrationen von CHX ausgesetzt wurden und jeweils minimale Hemmkonzentrationen (MHKs) bestimmt wurden) zu einem kontinuierlichen Anstieg dieser MHKs führte. Diese adaptierten Bakterienzellen zeigten zudem Unterschiede in ihrer Oberflächenhydrophobizität, was auf Veränderungen in der Zytoplasmamembran hinweisen könnte, und wiesen ein verändertes Proteinexpressionsprofil auf [Kitagawa et al., 2016]. Zudem konnten auch von Wang et al. MHK-Anstiege bei E. faecalis, Streptococcus gordonii, Fusobacterium nucleatum und Porphyromonas gingivalis gezeigt werden [Wang et al., 2017].
Verspecht et al. verwendeten einen ähnlichen Versuchsaufbau und berichteten MHK-Erhöhungen gegenüber CHX und der quartären Ammoniumverbindung Cetylpyridiniumchlorid (CPC) bei verschiedenen Parodontitis-assoziierten oder Karies-assoziierten Bakterienspezies [Verspecht et al., 2019]. Zudem wurde auch hier bei den adaptierten bakteriellen Stämmen eine Zunahme der Hydrophobizität an der Zelloberfläche festgestellt [Verspecht et al., 2019]. In einer eigenen Studie wurde eine mögliche Adaptation von sechs oralen beziehungsweise dermalen Bakterienspezies gegenüber den Antiseptika CHX, CPC und Benzalkoniumchlorid (BAC) untersucht [Schwarz et al., 2021]. Dabei konnten stabile Adaptationen bei Escherichia coli gegenüber allen drei getesteten Antiseptika, bei E. faecalis gegenüber CHX und BAC und bei Staphylococcus aureus gegenüber CPC gezeigt werden, wohingegen bei den anderen oralen Bakterienspezies Streptococcus mutans, Actinomyces naeslundii, Fusobacterium nucleatum keine stabile Adaptation festgestellt wurde [Schwarz et al., 2021]. Der adaptierte E.-coli-Stamm wies zudem ein verändertes Proteinexpressionsprofil im Vergleich zum Wildtyp-Stamm auf [Schwarz et al., 2021].
Kreuzresistenzen durch CHX?
Copin et al. berichteten kürzlich über die Verbreitung eines auffälligen MRSA-Stamms (USA300) in einer orthodoxen jüdischen Gemeinde in Brooklyn [Copin et al., 2019]. Aufwendige genetische Analysen zeigten, dass eine metabolische Veränderung (Mutation in pyrA) und die Aufnahme eines speziellen Bakteriophagen (Prophage Φ11) die Verbreitung dieses Stammes vermutlich begünstigt haben, indem diese beiden Veränderungen die Kolonisierung und Abszessbildung gefördert haben. Es wurde jedoch auch festgestellt, dass die weite Verbreitung dieses Stammes erst durch die Entwicklung und Aufnahme eines Plasmids (pBSRC1) ermöglicht wurde, das Gene beinhaltete, die eine Resistenz gegen CHX (qacA/B) und Mupirocin (mupA) vermitteln, was stark darauf hindeutet, dass die Resistenz gegen Antiseptika, die für die Dekolonisierungstherapie verwendet werden (wie CHX und Mupirocin), Schlüsselelemente für die Verbreitung eines solchen multiresistenten Stammes waren [Copin et al., 2019]. Dieses Beispiel verdeutlicht die Bedeutung von CHX für medizinische Disziplinen außerhalb der Zahnmedizin und die Auswirkungen einer CHX-Resistenz für diese medizinischen Bereiche [Kampf, 2016; Cieplik et al., 2019]. So wurde kürzlich gezeigt, dass die Exposition klinischer Klebsiella-pneumoniae-Isolate gegenüber subinhibitorischen CHX-Konzentrationen in vitro nicht nur zu einer stabilen Resistenz gegenüber CHX, sondern auch zu einer Kreuzresistenz gegenüber dem Reserve-Antibiotikum Colistin führen kann [Wand et al., 2017].
Dieser enge Zusammenhang zwischen Antibiotika- und Antiseptikaresistenzen lässt sich hauptsächlich damit erklären, dass genetische Determinanten dieser Resistenzen häufig miteinander verknüpft sind, das heißt Resistenzgene gegenüber CHX finden sich häufig auf Plasmiden mit verschiedenen anderen Resistenzgenen [Jaglic & Cervinkova, 2012; Cieplik et al., 2019]. Ein klinisches Isolat eines Vancomycin-resistenten Staphylococcus-aureus-Stammes beherbergte zum Beispiel ein Multiresistenz-Plasmid, das Gene enthielt, die für Resistenzen gegen Vancomycin (vanA), Betalactam-Antibiotika (blaZ), Aminoglykosiden (aacA-aphD), Trimethoprim (dfrA) sowie kationische Antiseptika wie CHX (qacC) kodierten [Weigel et al., 2003]. Ebenso wurde bereits in den 1980er-Jahren aus einem Staphylococcus-aureus-Stamm mit bekannten Resistenzen gegenüber Methicillin und Gentamicin ein Plasmid isoliert, das neben Resistenzen gegenüber den Antibiotika Kanamycin, Gentamicin, Tobramycin und Amikacin sowie gegen Ethidiumbromid auch Resistenz gegenüber den Antiseptika Benzalkoniumchlorid, Acriflavin und CHX vermittelte [Yamamoto et al., 1988].
Während die bisher genannten Beispiele über „typische Krankenhauskeime“ berichten, gibt es zunehmend ähnliche Berichte zu Bakterien aus der oralen Mikrobiota [Cieplik et al., 2019]. So wurden beispielsweise Bakterien aus der oralen Plaque von fünf gesunden Probanden isoliert, um diese auf Stämme mit phänotypischer CHX-Resistenz zu untersuchen [Saleem et al., 2016]. Die Isolate mit nachgewiesener CHX-Resistenz wiesen auch Resistenzen gegenüber einer Reihe von Antibiotika auf, darunter Ampicillin, Kanamycin, Gentamicin und Tetrayclin. Daher forderten die Autoren dieser Studie auch eine größere Aufmerksamkeit in Bezug auf multiresistente Bakterien in der oralen Mikrobiota und wiesen zudem auf mögliche Risiken hin, die mit einer langfristigen Verwendung von Mundpflegeprodukten mit antibakteriellen Wirkstoffen wie CHX zur Biofilmkontrolle einhergehen [Saleem et al., 2016].
Eine genomweite Assoziationsstudie (engl. genome-wide association study, GWAS) zeigte, dass bei klinischen Isolaten von Escherichia coli eine reduzierte Empfindlichkeit gegenüber CHX mit der Präsenz von tetA-Genen der Klasse B assoziiert war, die für Efflux-Pumpen kodieren und zu einer Resistenz gegen Tetracyclin führen [Royer et al., 2022]. Weiterhin wurde auch vor Kurzem bei Staphylococcus aureus die Assoziation einer reduzierten Empfindlichkeit gegenüber CHX und dem Antibiotikum Ciprofloxacin durch erhöhte Expression von Effluxpumpsystemen nachgewiesen [Truong-Bolduc et al., 2021]. Zudem muss betont werden, dass orale Mikroorganismen im Biofilm räumlich eng benachbart koexistieren und somit für horizontalen Gentransfer prädestiniert sind. Somit können entstandene Resistenzen durch den Austausch von Resistenzgenen weiterverbreitet werden [Madsen et al., 2012; Wolcott et al., 2013].
Schlussfolgerungen und Empfehlungen
Auf der Basis der vorliegenden Erkenntnisse kann aktuell keine Aussage darüber getroffen werden, ob es bereits Grund zur Besorgnis hinsichtlich einer CHX-Resistenz bei oralen Bakterien gibt. Vielmehr sollte diese Thematik differenzierter betrachtet werden: CHX zeigt trotz seiner vielfältigen klinischen Einsatzgebiete, wie in der Intensivmedizin, in Handseifen und als orales Antiseptikum, weiterhin eine hohe antibakterielle Wirksamkeit gegenüber Bakterien, die nicht in Biofilmen organisiert sind. Auf der anderen Seite gibt es zunehmend Studien, die vom Auftreten CHX-resistenter Isolate berichten. Die Verbreitung von Resistenzen gegenüber CHX hätte allerdings verheerende Folgen für das gesamte Gesundheitswesen, gerade was die Intensivpflege angeht [Kampf, 2016].
Da das Risiko, das mit dem sehr breitflächigen Einsatz von CHX in der Zahnmedizin und in Mundpflegeprodukten einhergehen könnte, derzeit kaum abzuschätzen ist, sollte diese Thematik noch stärker Gegenstand der aktuellen zahnmedizinischen Forschung werden. Hierzu ist die Kombination verschiedenster mikrobiologischer und molekularbiologischer Methoden notwendig. Grundlegend müssen Antworten darauf gefunden werden, ob der breitflächige Einsatz von CHX zu einer Anreicherung von CHX-resistenten Stämmen in der oralen Mikrobiota und dem Auftreten von Kreuzresistenzen gegenüber Antibiotika führen kann und welche molekularen Mechanismen eine CHX-Resistenz bei oralen Bakterien vermitteln können.
Kliniker sollten noch stärker auf mögliche Risiken einhergehend mit einem zu breitflächigen Einsatz von Antibiotika und Antiseptika hingewiesen und hinsichtlich eines restriktiveren und risikoorientierten Einsatzes von Antibiotika und Antiseptika sensibilisiert werden. Konkret sollten aus Sicht der Autoren Mundspülungen mit CHX eher nur kurzfristig und bei entsprechender Indikation (zum Beispiel nach parodontalchirurgischen Eingriffen) beziehungsweise bei Risikopatienten (zum Beispiel Menschen mit körperlichen oder geistigen Beeinträchtigungen) eingesetzt werden. Ein langfristiger oder sogar Dauereinsatz sollte – falls immer möglich – vermieden werden.
Die Autoren danken der Deutschen Forschungsgemeinschaft für die Förderung der aktuellen Arbeiten. Außerdem gilt unser Dank Dr. Nicholas S. Jakubovics (Newcastle upon Tyne, GB), Prof. Dr. Elmar Hellwig, Dr. Annette Anderson (beide Freiburg), Dr. Sara Bernardi (L’Aquila, IT), Dr. Denise Mühler (München), Prof. Dr. Tim Maisch, Heike Preuschl und Helga Ebensberger (alle Regensburg).
Literaturliste
Abouassi T, Hannig C, Mahncke K, Karygianni L, Wolkewitz M, Hellwig E, Al-Ahmad A. 2014. Does human saliva decrease the antimicrobial activity of chlorhexidine against oral bacteria? Bmc Res Notes. 7(1):711.
Al-Ahmad A, Ameen H, Pelz K, Karygianni L, Wittmer A, Anderson AC, Spitzmüller B, Hellwig E. 2014. Antibiotic Resistance and Capacity for Biofilm Formation of Different Bacteria Isolated from Endodontic Infections Associated with Root-filled Teeth. J Endodont. 40(2):223–230.
Al-Ahmad A, Walankiewicz A, Hellwig E, Follo M, Tennert C, Wittmer A, Karygianni L. 2016. Photoinactivation Using Visible Light Plus Water-Filtered Infrared-A (vis+wIRA) and Chlorine e6 (Ce6) Eradicates Planktonic Periodontal Pathogens and Subgingival Biofilms. Front Microbiol. 7:1900.
Andersson DI, Hughes D. 2014. Microbiological effects of sublethal levels of antibiotics. Nat Rev Microbiol. 12(7):465–478.
Arweiler NB, Boehnke N, Sculean A, Hellwig E, Auschill TM. 2006. Differences in efficacy of two commercial 0.2% chlorhexidine mouthrinse solutions: a 4‐day plaque re‐growth study. J Clin Periodontol. 33(5):334–339.
Auschill TM, Hein N, Hellwig E, Follo M, Sculean A, Arweiler NB. 2005. Effect of two antimicrobial agents on early in situ biofilm formation. J Clin Periodontol. 32(2):147–152.
Bernardi S, Anderson A, Macchiarelli G, Hellwig E, Cieplik F, Vach K, Al-Ahmad A. 2021. Subinhibitory Antibiotic Concentrations Enhance Biofilm Formation of Clinical Enterococcus faecalis Isolates. Antibiotics. 10(7):874.
Buffet-Bataillon S, Tattevin P, Bonnaure-Mallet M, Jolivet-Gougeon A. 2012. Emergence of resistance to antibacterial agents: the role of quaternary ammonium compounds—a critical review. Int J Antimicrob Ag. 39(5):381–389.
Burchard T, Karygianni L, Hellwig E, Follo M, Wrbas T, Wittmer A, Vach K, Al-Ahmad A. 2019. Inactivation of oral biofilms using visible light and water-filtered infrared A radiation and indocyanine green. Future Med Chem. 11(14):1721–1739.
Carrouel F, Gonçalves LS, Conte MP, Campus G, Fisher J, Fraticelli L, Gadea-Deschamps E, Ottolenghi L, Bourgeois D. 2021. Antiviral Activity of Reagents in Mouth Rinses against SARS-CoV-2. J Dent Res. 100(2):124–132.
Chambless JD, Hunt SM, Stewart PS. 2006. A Three-Dimensional Computer Model of Four Hypothetical Mechanisms Protecting Biofilms from Antimicrobials. Appl Environ Microb. 72(3):2005–2013.
Cieplik F, Jakubovics NS, Buchalla W, Maisch T, Hellwig E, Al-Ahmad A. 2019. Resistance Toward Chlorhexidine in Oral Bacteria – Is There Cause for Concern? Front Microbiol. 10:587.
Antimicrobial Resistance Collaborators, Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, Han C, Bisignano C, Rao P, et al. 2022. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet Lond Engl. 399(10325):629–655.
Copin R, Sause WE, Fulmer Y, Balasubramanian D, Dyzenhaus S, Ahmed JM, Kumar K, Lees J, Stachel A, Fisher JC, et al. 2019. Sequential evolution of virulence and resistance during clonal spread of community-acquired methicillin-resistant Staphylococcus aureus. Proc National Acad Sci. 116(5):201814265.
Davies GE, Francis J, Martin AR, Rose FL, Swain G. 1954. 1:6‐di‐4′‐chlorophenyldiguanidohexane ("Hibitane”*). Laboratory investigation of a new antibacterial agent of high potency. Brit J Pharm Chemoth. 9(2):192–196.
Emilson CG, Ericson T, Heyden G, Lilia J. 1972. Effect of chlorhexidine on human oral streptococci. J Periodontal Res. 7(2):189–191.
Emilson CG, Fornell J. 1976. Effect of toothbrushing with chlorhexidine gel on salivary microflora, oral hygiene, and caries. Eur J Oral Sci. 84(5):308–319.
Gilbert P, Moore LE. 2005. Cationic antiseptics: diversity of action under a common epithet. J Appl Microbiol. 99(4):703–715.
Gjermo P. 1974. Chlorhexidine in dental practice. J Clin Periodontol. 1(3):143–152.
Gottsauner MJ, Michaelides I, Schmidt B, Scholz KJ, Buchalla W, Widbiller M, Hitzenbichler F, Ettl T, Reichert TE, Bohr C, et al. 2020. A prospective clinical pilot study on the effects of a hydrogen peroxide mouthrinse on the intraoral viral load of SARS-CoV-2. Clin Oral Invest. 24(10):1–7.
Jaglic Z, Cervinkova D. 2012. Genetic basis of resistance to quaternary ammonium compounds – the qac genes and their role: a review. Veterinární Medicína. 57(No. 6):275–281.
Jakubovics NS, Goodman SD, Mashburn-Warren L, Stafford GP, Cieplik F. 2021. The dental plaque biofilm matrix. Periodontol 2000. 86(1):32–56.
Jiang S, Zeng J, Zhou X, Li Y. 2018. Drug Resistance and Gene Transfer Mechanisms in Respiratory/Oral Bacteria. J Dent Res. 97(10):1092–1099.
Jones CG. 1997. Chlorhexidine: is it still the gold standard? Periodontol 2000. 15(1):55–62.
Kampf G. 2016. Acquired resistance to chlorhexidine – is it time to establish an ‘antiseptic stewardship’ initiative? J Hosp Infect. 94(3):213–227.
Kitagawa H, Izutani N, Kitagawa R, Maezono H, Yamaguchi M, Imazato S. 2016. Evolution of resistance to cationic biocides in Streptococcus mutans and Enterococcus faecalis. J Dent. 47:18–22.
Kulik EM, Waltimo T, Weiger R, Schweizer I, Lenkeit K, Filipuzzi-Jenny E, Walter C. 2015. Development of resistance of mutans streptococci and Porphyromonas gingivalis to chlorhexidine digluconate and amine fluoride/stannous fluoride-containing mouthrinses, in vitro. Clin Oral Invest. 19(6):1547–1553.
Laxminarayan R. 2022. The overlooked pandemic of antimicrobial resistance. Lancet Lond Engl. 399(10325):606–607.
Löe H, Schiøtt CR. 1970. The effect of mouthrinses and topical application of chlorhexidine on the development of dental plaque and gingivitis in man. J Periodontal Res. 5(2):79–83.
Madsen JS, Burmølle M, Hansen LH, Sørensen SJ. 2012. The interconnection between biofilm formation and horizontal gene transfer. Fems Immunol Medical Microbiol. 65(2):183–195.
Mao X, Auer DL, Buchalla W, Hiller K-A, Maisch T, Hellwig E, Al-Ahmad A, Cieplik F. 2020. Cetylpyridinium Chloride: Mechanism of Action, Antimicrobial Efficacy in Biofilms, and Potential Risks of Resistance. Antimicrob Agents Ch. 64(8).
Marui VC, Souto MLS, Rovai ES, Romito GA, Chambrone L, Pannuti CM. 2019. Efficacy of preprocedural mouthrinses in the reduction of microorganisms in aerosol A systematic review. J Am Dent Assoc. 150(12):1015-1026.e1.
McNamara PJ, Levy SB. 2016. Triclosan: an Instructive Tale. Antimicrob Agents Ch. 60(12):7015–7016.
Muehler D, Mao X, Czemmel S, Geißert J, Engesser C, Hiller K-A, Widbiller M, Maisch T, Buchalla W, Al-Ahmad A, et al. 2022. Transcriptomic Stress Response in Streptococcus mutans following Treatment with a Sublethal Concentration of Chlorhexidine Digluconate. Microorg. 10(3):561.
Muehler D, Rupp CM, Keceli S, Brochhausen C, Siegmund H, Maisch T, Hiller K-A, Buchalla W, Cieplik F. 2020. Insights Into Mechanisms of Antimicrobial Photodynamic Action Toward Biofilms Using Phenalen-1-One Derivatives as Photosensitizers. Front Microbiol. 11:589364.
Pithon MM, Sant’Anna LIDA, Baião FCS, Santos RL dos, Coqueiro R da S, Maia LC. 2015. Assessment of the effectiveness of mouthwashes in reducing cariogenic biofilm in orthodontic patients: a systematic review. J Dent. 43(3):297–308.
Royer G, Rosa J-MO de la, Vuillemin X, Lacombe B, Chau F, Clermont O, Mercier-Darty M, Decousser J-W, Ricard J-D, Nordmann P, et al. 2022. Reduced chlorhexidine susceptibility is associated with tetracycline resistance tet genes in clinical isolates of Escherichia coli. Antimicrob Agents Ch.:AAC0197221.
Saleem HGM, Seers CA, Sabri AN, Reynolds EC. 2016. Dental plaque bacteria with reduced susceptibility to chlorhexidine are multidrug resistant. Bmc Microbiol. 16(1):214.
Schiøtt CR, Löe H. 1972. The sensitivity of oral streptococci to chlorhexidine. J Periodontal Res. 7(2):192–194.
Schwarz SR, Hirsch S, Hiergeist A, Kirschneck C, Muehler D, Hiller K-A, Maisch T, Al-Ahmad A, Gessner A, Buchalla W, et al. 2021. Limited antimicrobial efficacy of oral care antiseptics in microcosm biofilms and phenotypic adaptation of bacteria upon repeated exposure. Clin Oral Invest. 25(5):2939–2950.
Solderer A, Kaufmann M, Hofer D, Wiedemeier D, Attin T, Schmidlin PR. 2019. Efficacy of chlorhexidine rinses after periodontal or implant surgery: a systematic review. Clin Oral Invest. 23(1):21–32.
Truong-Bolduc QC, Wang Y, Reedy JL, Vyas JM, Hooper DC. 2021. Staphylococcus aureus Efflux Pumps and Tolerance to Ciprofloxacin and Chlorhexidine following Induction by Mupirocin. Antimicrob Agents Ch. 66(2):e01845-21.
Van der Weijden FA, Sluijs EV der, Ciancio SG, Slot DE. 2015. Can Chemical Mouthwash Agents Achieve Plaque/Gingivitis Control? Dent Clin N Am. 59(4):799–829.
Verspecht T, Herrero ER, Khodaparast Ladan, Khodaparast Laleh, Boon N, Bernaerts K, Quirynen M, Teughels W. 2019. Development of antiseptic adaptation and cross-adapatation in selected oral pathogens in vitro. Sci Rep 9(1):8326.
Wade WG, Addy M. 1989. In vitro Activity of a Chlorhexidine–Containing Mouthwash Against Subgingival Bacteria. J Periodontol. 60(9):521–525.
Wand ME, Bock LJ, Bonney LC, Sutton JM. 2017. Mechanisms of Increased Resistance to Chlorhexidine and Cross-Resistance to Colistin following Exposure of Klebsiella pneumoniae Clinical Isolates to Chlorhexidine. Antimicrob Agents Ch. 61(1):e01162-16.
Wang S, Wang H, Ren B, Li H, Weir MD, Zhou X, Oates TW, Cheng L, Xu HHK. 2017. Do quaternary ammonium monomers induce drug resistance in cariogenic, endodontic and periodontal bacterial species? Dent Mater. 33(10):1127–1138.
Weigel LM, Clewell DB, Gill SR, Clark NC, McDougal LK, Flannagan SE, Kolonay JF, Shetty J, Killgore GE, Tenover FC. 2003. Genetic Analysis of a High-Level Vancomycin-Resistant Isolate of Staphylococcus aureus. Science. 302(5650):1569–1571.
Westergren G, Emilson C-G. 1980. In vitro development of chlorhexidine resistance in Streptococcus sanguis and its transmissibility by genetic transformation. Eur J Oral Sci. 88(3):236–243.
Wolcott R, Costerton JW, Raoult D, Cutler SJ. 2013. The polymicrobial nature of biofilm infection. Clin Microbiol Infec. 19(2):107–112.
Yamamoto T, Tamura Y, Yokota T. 1988. Antiseptic and antibiotic resistance plasmid in Staphylococcus aureus that possesses ability to confer chlorhexidine and acrinol resistance. Antimicrob Agents Ch. 32(6):932–935.
Zaura-Arite E, Marle J van, Cate JM ten. 2001. Confocal Microscopy Study of Undisturbed and Chlorhexidine-treated Dental Biofilm. J Dent Res. 80(5):1436–1440.






