Oberflächen haben hohes Innovationspotenzial
Das Einheilen eines Implantats in den Kiefer erfolgt nach ähnlichen Prinzipien wie ganz allgemein das Schließen einer Knochenwunde. Zunächst baut der Körper eine Leit-Struktur an der Implantatoberfläche auf, ein mikroporöses Netzwerk aus dem in der Leber gebildeten Glykoprotein Fibrinogen (= Blutgerinnungsfaktor I) und Blutplättchen (Thrombozyten). Dort hinein können später Blutkapillaren, perivaskuläres Gewebe und Knochen einwachsen.
Im Einzelnen werden die Implantatoberflächen zunächst von Fibrinogen belegt. Und an dieses Glykoprotein wiederum können sich die Thrombozyten anheften. Ihre nachfolgende Aktivierung führt zu einer Erhöhung ihrer Affinität zum Fibrinogen, und im Endeffekt bildet sich ein Netzwerk aus Fibrinogen und Thrombozyten aus. Diese sondern darüber hinaus bestimmte Wachstumsfaktoren ab; sie bringen osteogene Stammzellen dazu, aus dem Kieferknochen durch das Thrombozyten-Fibrinogen-Netzwerk zur Implantatoberfläche zu migrieren.
Soweit die Osseokonduktion – nun zur Knochenneubildung: Sie beginnt an der Implantatoberfläche. Die dort anhaftenden osteogenen Zellen scheiden nach und nach Knochen ab, der das Thrombozyten-Fibrinogen-Netzwerk als Stützmatrix nutzt und sozusagen durch sie hindurchwächst (Osseointegration).
Die Matrix selbst hat am Ende ihren Dienst getan und wird mineralisiert (Ablagerung von Kalziumphosphat). Nun beginnt die Remodellierung. Sie umfasst Knochenabbau- und -aufbauvorgänge zur Anpassung an die neu entstandene klinische Situation. Das gesamte menschliche Skelett durchläuft ein Leben lang ein solches Bone-remodelling. Im ersten Lebensjahr wird dadurch sogar praktisch das gesamte Skelett „ausgetauscht“, beim Erwachsenen sind es immerhin noch zehn Prozent.
Neben der knöchernen Einheilung spielen für den Erfolg einer Implantation selbst- verständlich auch die Heilungsvorgänge im Weichgewebe eine wesentliche Rolle. Zunächst kommt es zu Entzündungserscheinungen, wobei der Körper Zelldebris abbaut und die Wunde vor eindringenden Keimen schützt. Gleichzeitig werden Wachstumsfaktoren ausgeschüttet. Sie sorgen letztlich für die Bildung neuer Gefäße für die Blutversorgung in den neu gebil- deten knöchernen Strukturen. Schließlich bildet sich in der Remodellierungsphase faserreiches periimplantäres Narbengewebe, insbesondere dort, wo das Implantat aus dem Knochen heraustritt.
Knochenwachstum lässt sich fördern
Die vorstehend beschriebenen komplexen Vorgänge bieten eine Vielzahl von Möglichkeiten zur Beeinflussung durch eine geeig-nete Gestaltung der Implantatoberfläche. Ein gebräuchliches Kriterium für den Erfolg der Osseointegration ist dabei der BIC-Wert (bone implant contact), definitionsgemäß die Fläche, auf der Implantat und Knochen ohne dazwischenliegendes Bindegewebe aneinander liegen. Darüber hinaus können nach längerer Zeit persistierende entzünd- liche Erscheinungen ein Anzeichen für eine suboptimale Weichgewebsheilung darstellen.
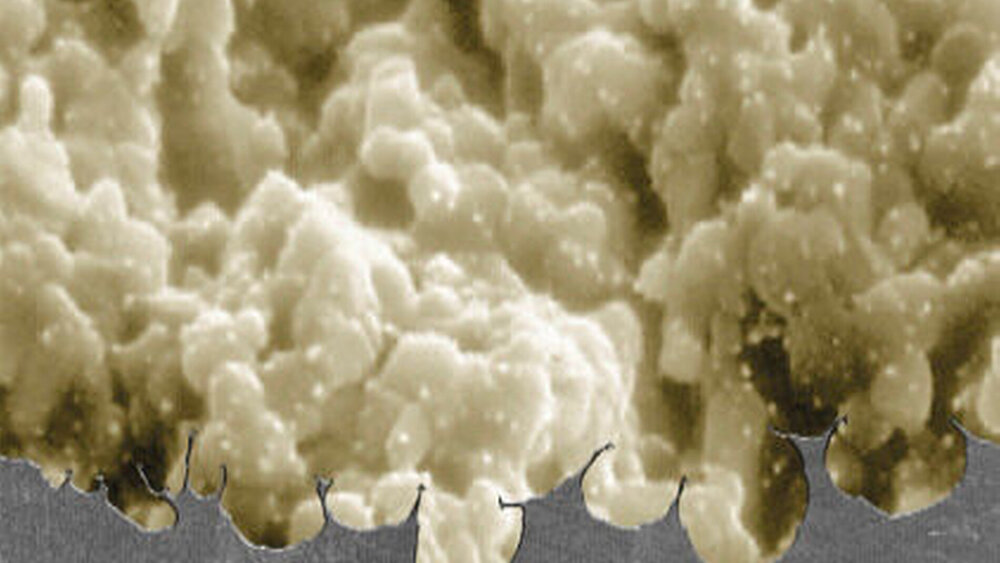
Mechanische Modifikation: die Rauigkeit
Die Oberfläche eines Implantats kann in weiten Bereichen variiert werden – mechanisch, chemisch, biologisch. Es versteht sich von selbst, dass Rauigkeit, Benetzbarkeit, Textur, chemische Beschaffenheit und Modifikationen, wie etwa Beschichtungen, die Wechselwirkung mit dem menschlichen Körper beeinflussen. So dürfte die erste der oben angesprochenen Heilungsphasen, die Osseokonduktion, sogar am deutlichsten von der Oberflächenrauigkeit beeinflusst werden. Das üblicherweise verwendete Maß ist die durchschnittliche 3-D-Rauigkeit Sa, wobei als Faustregel gilt: Glatte (Sa< 0,5 µm) und geringfügig raue (Sa> 0,5 bis 1 µm) Oberflächen führen zu weniger guter Osseointegration als raue Oberflächen (Sa> 2 µm). Die größten BIC-Werte erhält man bei mittlerer Rauigkeit (Sa> 1 bis 2 µm) [Wennerberg et al., 2009]. Dabei wirken entgegengesetzte Kräfte: Während sich, gemäß In-vitro-Experimenten, die Osteoblasten am besten auf glatten Flächen ausbreiten und dort proliferieren können, werden die höheren Zell-Differenzierungs-, Matrix-Mineralisierungs- und Wachstumsfaktor-Produktions-Quoten bei rauen Flächen beobachtet [Novaes et al., 2010]. Das gezielte Einbringen von Struk-turen im Nanometerbereich kann die Entstehung einer mineralisierten Matrix beschleunigen, während Nanoporositäten selektiv die Adhäsion von Osteoblasten begünstigen – und damit den Heilungsprozess [Novaes et al., 2010].
Durch gezielte topografische Gestaltung von Implantatoberflächen lässt sich nicht nur der BIC-Wert erhöhen. Auch die bio- mechanische Wechselwirkung an dieser Grenzfläche bei Frühimplantationen kann günstig beeinflusst werden [Albrektsson et al., 2004]. Dabei sind raue Oberflächen gefragt, die sich auf unterschiedliche Weise erzeugen lassen, zum Beispiel durch das Plasmasprayverfahren (TPS), durch Sandstrahlen mit Keramikpartikeln, durch Säureätzung oder durch anodische Oxidation. Tendenziell schafft TPS die größten durchschnittlichen Rauigkeiten (Größenordnung: 7 µm) im Vergleich zur kombinierten Säureätzung/Sandstrahlung (Größenordnung: 2,75 µm) und die komplexeren Ober- flächenstrukturen. Grundsätzlich ist dabei aber zu bedenken, dass stets Durchschnittswerte angegeben werden. So schließen die höheren Rauigkeiten auch Porengrößen bis hin zu 50 µm ein – mögliche Einfallstore beziehungsweise Rückzugsgebiete für potenziell krankheitserregende Keime.
Weder in tierexperimentellen Vergleichen von zweimaligem Ätzen und TPS-Verfahren noch in klinischen Vergleichen von kombiniertem Ätzen/Sandstrahlen und TPS-Verfahren bei schwierigen Sofort-Implantationen (parodontale Vorschädigung) ergaben sich signifikante Vorzüge eines bestimmten Verfahrens. Die grundsätzliche Überlegenheit von Implantaten mit rauen Oberflächen gegenüber glatten konnte jedoch demonstriert werden [Al-Nawas et al., 2008].
Vorteilhaft könnte sich im Anschluss an eine kombinierte Ätzung/Sandstrahlung die Spülung des betreffenden Implantats unter Stickstoff-Schutz-Gas und seine anschließende Lagerung in isotonischer Kochsalzlösung auswirken [Zhao et al., 2005; Rupp et al., 2006].
Chemisch betrachtet wird dadurch die Titandioxidoberfläche hydroxyliert, was wiederum einen wichtigen physikalischen Parameter, die Benetzbarkeit, erhöht. Tierexperimente [Buser et al., 1999; Schwarz et al., 2007; Bornstein et al., 2008] legen nahe, dass sich zumindest in den ersten Wochen der Einheilung bei Implantaten mit hydroxylierter Oberfläche höhere BIC-Werte erreichen lassen.
Zu einer deutlicheren chemischen Ver- änderung führt die anodische Oxidierung, analog zum bekannten Eloxal-Verfahren, mit dem man eine Oxid-Schutzschicht auf Aluminiumoberflächen schafft. Titan weist immer eine solche „Haut“ auf; diese lässt sich jedoch unter Verwendung des elektrochemischen Verfahrens, bei hohen Stromdichten und in Anwesenheit starker Säuren, verstärken. Einige Autoren vermuten, dass sich dadurch das osseokonduktive Potenzial, zumindest bei Typ-4-Knochen im Oberkiefer-Molarenbereich, erhöht [Huang et al., 2005].
Bio-Moleküle im Einsatz
Die Osteokonduktivität lässt sich auch durch Kalziumphosphat-Beschichtung steigern, wohl weil es sich um ein knochenähnliches und damit biomimetisches Material handelt. Durch chemische Bindungen soll eine starke Wechselwirkung zwischen der Implantatoberfläche und dem umgebenden Knochengewebe induziert werden [Junker et al., 2009]. Im Endeffekt käme es dann zu einer besseren Fixierung [Barrère et al., 2003; Quaranta et al., 2010; Yang et al., 2010], wobei allerdings auch vor dem Risiko einer späteren Ablösung der Kalziumphosphat-Beschichtung gewarnt wird [Lee et al., 2000].
Titanimplantat-Oberflächen, nicht zuletzt auch die mit Kalziumphosphat modifizierten, könnten in Zukunft auch zur Einlagerung von Wachstumsfaktoren und anderen biologisch aktiven Molekülen dienen, die zum Beispiel die Differenzierung von Osteoblasten beschleunigen. Ein solches System entfaltet eine „Retard-Wirkung“: Die bio-aktiven Moleküle werden mit zeitlicher Verzögerung nach und nach freigesetzt und fördern den Heilungsprozess damit über eine längere Zeitspanne.
Titanoberflächen können auch direkt mit bioaktiven Molekülen modifiziert werden, etwa mit BMPs (bone morphogenetic proteins) oder mit extrazellu- lären Matrixproteinen. Zum Beispiel mit Typ-I-Collagen: Beschichtet man damit eine Titanoberfläche, so kommt es zur Förderung des Zellwachstums während der Osteoblasten-Differenzierung. Im Besonderen stellen darüber hinaus Titanoberflächen, die mit Peptiden mit Proteindomänen der Sequenz „Arginin-Glycin-Aspartat“ funktionalisiert sind, eine Bindungsstelle für bestimmte Eiweißmoleküle dar, die Integrine. Diese fördern ihrerseits die Adhäsion von körpereigenen Zellen untereinander und an Implantatoberflächen.
Die Ergebnisse von Labor- und Tier- experimenten sind allerdings widersprüchlich. Der Nutzen einer rhBMP2- Integration (rekombinantes humanes BMP-2) in Implantat-Oberflächen hängt von der Konzentration ab, wobei keineswegs „viel hilft viel“ gilt, sondern, es scheint ein Optimum zwischen „zu wenig BMP“ und „zu viel BMP“ zu geben. Auch die Art der Fixation spielt eine Rolle. Lediglich oberflächlich adsorbiertes BMP-2 ist in seiner Wirkung deutlich beeinträchtigt. Wie BMPs können auch andere Wachstumsfaktoren eine osseointegrative Kraft entfalten, etwa wenn das Fusionsprotein FGF-FN (Fibroblastenwachstumsfaktor-Fibronektin) in eine anodisch oxidierte Titanimplantat-Oberfläche inkorporiert wird. Die BIC-Werte sind dann höher als für eine Oberfläche ohne diese Funktionalisierung.
Kurz: Die Integration von Bio-Molekülen kann den Einheilungsprozess in unterschiedlichen Phasen beschleunigen. Die Vorgänge, die dabei ablaufen, sind aber nicht immer leicht zu durchschauen, sie sind längst nicht alle aufgeklärt.
Relativ einfach erscheint dagegen zum Beispiel die Idee, Fluorid in die Titanoberfläche zu inkorporieren. Der Theorie nach sollte es mit dem Knochenbestandteil Hydroxylapatit Fluorapatit bilden, und dieser Stoff soll seinerseits die Osteoblastenproliferation antreiben. Vielversprechenden In-vitro-Resultaten ist allerdings noch kein klinischer Nachweis gefolgt.
Biomimetik und Biofunktionalisierung
Zusammenfassend lässt sich sagen, dass es eine ganze Reihe vielversprechender Ansätze in Forschung und Wissenschaft zu einer Verbesserung der Einheilung von Implantaten gibt. Im Allgemeinen bewirken rauere Oberflächen, wie nach TPS-Behandlung oder Sandstrahlen, auf der Grundlage von BIC-Werten, eine bessere mechanische Verankerung. Darüber hinaus zielt eine zusätzliche Nanotexturierung auf biologische Unterstützung: Die Adhäsion von Proteinen und Osteoblasten verbessert sich, und es kommt gerade in der Frühphase der Einheilung zu einer besseren und/oder schnelleren Osseointegration.
Als Schritt in die Zukunft können die biomimetische Beschichtung und Biofunktionalisierung von Implantatoberflächen gelten. Die dazu teilweise schwer interpretierbaren oder gar widersprüchlichen Studienergebnisse können auch bedeuten, dass man hier auf ein differenzierteres Design, eine regiospezifische Rauigkeit und auf eine personalisierte Medizin setzen muss. Rauigkeiten im zervikalen Bereich können die Einheilung fördern, während im Schulterbereich, wo das Weichgewebe anliegt, eine glattere Oberfläche günstiger sein kann (geringeres Risiko für Entzündungserscheinungen). Auch dürfte in der Regel in weniger dichtem Knochen eine höhere Rauigkeit wünschenswert sein. Darüber hinaus mag eine BMP-Konzentration X in der Implantatoberfläche bei Patient A die Einheilung fördern, während sie für Patient B zu groß sein kann. Um dies vorab einschätzen zu können, bedarf es allerdings (messbarer!) Biomarker.
Der Vollständigkeit halber sei an dieser Stelle darauf hingewiesen, dass sich der vorliegende Artikel bis hierhin stillschweigend auf Titanimplantate konzentriert hat. Daneben sind als neue Option Zirkonoxidimplantate verfügbar – allerdings mit zurzeit kleinem Marktanteil und naturgemäß weniger starker Untermauerung durch In-vivo- Untersuchungen. Aus physiologischer Sicht mag man eine Titanoberfläche, die ja chemisch betrachtet eine Titandioxid-Oberfläche darstellt (TiO2), und eine Zirkonxidoberfläche (ZrO2) als relativ ähnlich einschätzen. Beide Materialien sind im Bereich des Hüftgelenkersatzes eine medizinisch gängige Option. Man darf jedoch gespannt sein, welche Studienergebnisse die Zahnheilkunde dazu in Zukunft beisteuern wird.
Dr. Christian EhrensbergerHolbeinstr. 2060596 Frankfurtcu_ehrensberger@web.de
Info
Fazit: IDS für IDS einen Schritt weiter
Der Implantologie stellen sich heute zwei Herausforderungen:
• trotz bereits hoher Erfolgsquoten in den einschlägigen Studien eine weitere Steigerung, auch in der Breite der Anwendung bei den niedergelassenen Kollegen,
• je nach Patientenwunsch häufigere Sofort- beziehungsweise Frühimplantationen.
Auf dem Weg zu diesen Zielen kommt die Forschung mal nur schrittweise, mal mit einem großen Schub voran. Welche bestehenden Verfahren aufgrund neuer Studienergebnisse jetzt erst interessant werden und vor allem, wie sich der Fortschritt in innovativen Methoden und Produkten der Dentalindustrie manifestiert, das lässt sich kaum an einem anderen Ort so umfassend erfahren wie auf der Internationalen Dental-Schau vom 12. bis zum 16. März 2013 in Köln.