Systemische Antibiotika in der Parodontaltherapie: Nutzen und Risiken
Aufgrund der Bedeutung von Bakterien in der Pathogenese der Parodontitis wird der Einsatz systemischer Antibiotika in der Parodontaltherapie bereits seit mehreren Jahrzehnten propagiert. Frühere Therapieansätze waren dadurch motiviert, spezifische parodontale Pathogene, die durch eine rein mechanische Therapie nicht zu beseitigen waren, durch Antibiotikagabe zu eliminieren und den Erfolg der Behandlung durch mikrobiologische Diagnostik nachzuweisen. Mit der heutigen Kenntnis der Komplexität des oralen beziehungsweise subgingivalen Mikrobioms und der antibiotischen Resistenz dysbiotischer subgingivaler Biofilme [Rupf & Hannig, 2021; Hagenfeld et al., 2021] besteht Einvernehmen darüber, dass eine systemische Antibiotikagabe immer mit einer mechanischen Disruption des Biofilms einhergehen und sich bei Indikation und Therapiebewertung an klinischen Kriterien orientieren sollte. Ziel ist es, durch eine adjuvante Antibiotikagabe die klinischen Ergebnisse (Reduktion von Taschensondierungstiefen/TST und Blutungsneigung/BOP, Gewinn klinischen Attachments/CAL) der mechanischen subgingivalen Instrumentierung zu verbessern.
Häufig werden systemische Antibiotika auch während der Parodontalchirurgie und hier insbesondere im Rahmen regenerativer/rekonstruktiver Therapiemaßnahmen, bei denen Biomaterialien zum Einsatz kommen, verschrieben. Ziel ist hier, dadurch postoperative Infektionen beziehungsweise Komplikationen zu vermeiden und die klinischen Ergebnisse zu verbessern.
Angesichts der hohen Prävalenz der parodontalen Erkrankungen in der deutschen Bevölkerung macht der Anteil der aufgrund von Parodontitis verordneten Antibiotika einen nicht unerheblichen Anteil aller zahnärztlichen Antibiotikaverschreibungen aus. In diesem Beitrag wird die aktuelle Bewertung und Einordnung der systemischen Antibiotikatherapie im Rahmen der systematischen Behandlung der Parodontitis vor dem Hintergrund der zunehmenden globalen Antibiotikaresistenzen (siehe „Antibiotikaresistenzen – die stille Pandemie“ in der zm 10/2022, S. 36–38) vorgestellt.
Antibiotika bei subgingivaler Instrumentierung (Stufe 2)
Nutzen
Verbessern adjuvante, systemisch verabreichte Antibiotika das klinische Ergebnis der subgingivalen Instrumentierung? Zahlreiche randomisierte klinische Studien und systematische Übersichten sind dieser wichtigen Frage nachgegangen [Herrera et al., 2002; Haffajee et al., 2003; Herrera et al., 2008; Sgolasta et al., 2021a und b; Keestra et al., 2015a und b; Zandbergen et al., 2016]. Eine aktuelle, sehr umfangreiche Metaanalyse [Teughels et al., 2020] bestätigte statistisch signifikant verbesserte Resultate für systemisch verabreichte Antibiotika zusätzlich zur subgingivalen Instrumentierung. Dieser Effekt war nur bei einer begrenzten Anzahl von Antibiotika nachweisbar. Eine signifikante Verbesserung der TST-Reduktion wurde zum Sechs-Monats-Follow-up für Metronidazol (MET) und Amoxicillin (AMOX) beobachtet. Die adjuvante Gabe von MET+AMOX resultierte in einem statistisch signifikant höheren prozentualen Anteil von „Pocket Closure“ nach sechs und zwölf Monaten. Statistisch signifikant höhere CAL-Gewinne und eine BOP-Reduktion konnten ebenfalls nachgewiesen werden. Der zusätzliche Effekt von MET+AMOX auf die TST-Reduktion und den CAL-Gewinn war bei initial tiefen Taschen ausgeprägter als bei moderat tiefen Taschen. Es gibt keine relevanten Daten zum Langzeiteffekt (> 12 Monate) der systemischen Antibiotikagabe zusätzlich zur subgingivalen Instrumentierung. Der adjuvante Einsatz systemischer Antibiotika im Vergleich zur alleinigen subgingivalen Instrumentierung zeigt einen geschätzten vergrößerten Effekt von etwa 40 bis 50 Prozent hinsichtlich der TST-Reduktion.
Die meisten Studien wurden an Patienten mit generalisierter Parodontitis im Stadium III oder im Stadium IV durchgeführt. Eine exploratorische Analyse einer großen randomisierten Studie an deutschen Parodontitispatienten [Harks et al., 2015] erwies, dass insbesondere Patienten im Alter von bis zu 55 Jahren mit TST ≥ 5 mm an mehr als 35 Prozent aller Messstellen von einer zusätzlichen Antibiotikagabe profitierten [Eickholz et al., 2019]. Weniger schwer erkrankte Patienten mit flacheren Sondierungstiefen hingegen zeigten in der Regel ein sehr gutes Ansprechen auf die alleinige mechanische Therapie [Jepsen & Jepsen, 2016]. Bezüglich der Dosierung von AMOX und MET variieren die untersuchten Protokolle zwischen 200 und 500 mg und bezüglich der Dauer zwischen drei und 14 Tagen [McGowan et al., 2018]. In einem deutschen Konsensusbericht wird eine Dosierung von 500 mg AMOX und 400 mg MET dreimal täglich für sieben Tage beziehungsweise bei Penicillinunverträglichkeit von MET allein empfohlen [Pretzl et al., 2019]. Im Bestreben, die Antibiotikaexposition zu reduzieren und die Compliance der Patienten zu verbessern, wurden auch alternative Protokolle überprüft, die eine Gabe über nur drei Tage vorsahen [Cosgarea et al., 2016, 2017, 2020]. Dabei erwiesen sich beide Protokolle (AMET + AMOX für drei oder für sieben Tage) der alleinigen Instrumentierung überlegen.
Risiken
Die Kombination MET + AMOX wies die größten Effekte auf die klinischen Ergebnisse auf, war allerdings gleichzeitig auch mit den häufigsten unerwünschten Nebenwirkungen verbunden [Teughels et al., 2018]. Zu nennen sind hier Geschmacksstörungen, Kopfschmerzen, schwerer Durchfall, Erbrechen/Übelkeit und andere mehr. Auch globale Bedenken bezüglich der übermäßigen Anwendung von Antibiotika und der Entwicklung von Antibiotikaresistenzen müssen bedacht werden [WHO, 2021; Murray et al., 2022]. Nutzen-Risiko-Analysen beinhalten Überlegungen bezüglich des allgemeinen Antibiotikagebrauchs für den einzelnen Patienten und die öffentliche Gesundheit. Systemische Antibiotikagaben haben lang andauernde Auswirkungen auf das fäkale Mikrobiom gezeigt – einschließlich einer vermehrten Expression von Genen, die mit Antibiotikaresistenz assoziiert sind [Jepsen & Jepsen, 2016; Cassini et al., 2019]. In aktuellen Untersuchungen aus Deutschland erwiesen sich parodontalpathogene Bakterien von circa 8.000 Parodontitispatienten in circa zwei Dritteln der Fälle als resistent gegenüber mindestens einem der getesteten Antibiotika, darunter Amoxicillin (ohne oder mit Clavulansäure), Metronidazol, Doxycyclin, Clindamycin, Azithromycin, Ciprofloxacin und Ampicillin [Jepsen et al., 2021]. Über die untersuchen acht Jahre hinweg war allerdings keine zunehmende Resistenz gegenüber AMOX und MET festzustellen. Eine weitere Studie an Proben von circa 16.000 Parodontitispatienten belegte eine zwar geringe, aber beständige Präsenz von Enterokokken und Enterobacteriaceae im subgingivalen Biofilm. Die Anwesenheit dieser Erreger sollte als potenzielles Reservoir für die Entwicklung und Ausbreitung von antibiotikaresistenten Erregern bedacht werden [Jepsen at al., 2022].
Empfehlung der aktuellen S3-Leitlinie
In der aktuellen S3-Leitlinie zur Therapie der Parodontitis [Sanz et al., 2020; AWMF, 2020] wird aufgrund von Bedenken bezüglich der Patientengesundheit und der Auswirkungen einer systemischen Antibiotikagabe auf die öffentliche Gesundheit die routinemäßige Gabe als Zusatz zur subgingivalen Instrumentierung nicht empfohlen (Tabelle). Basierend auf der verfügbaren Evidenz kann der adjuvante Einsatz in speziellen Patientengruppen (zum Beispiel generalisiertes Stadium III/IV der Parodontitis bei jungen Erwachsenen) erwogen werden.
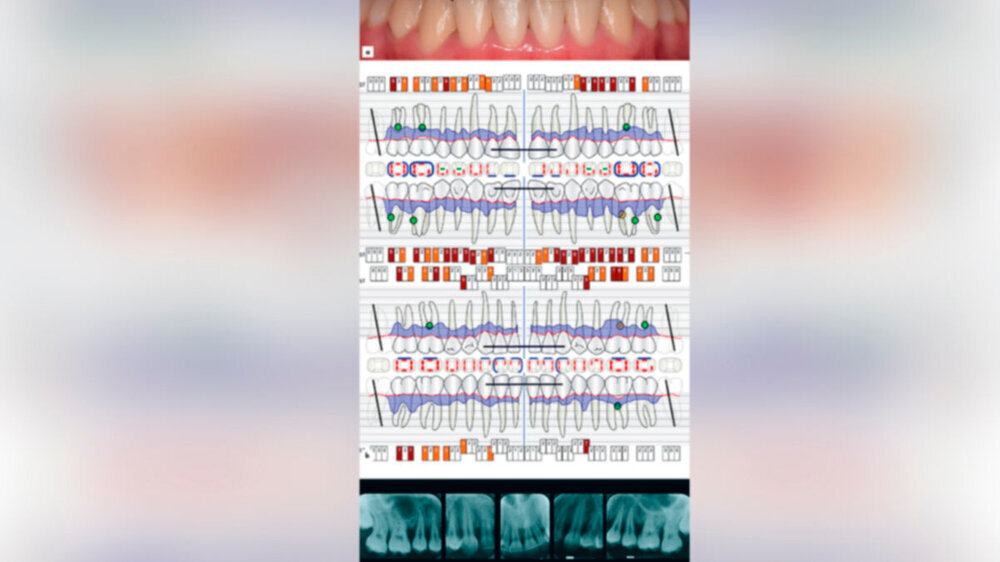
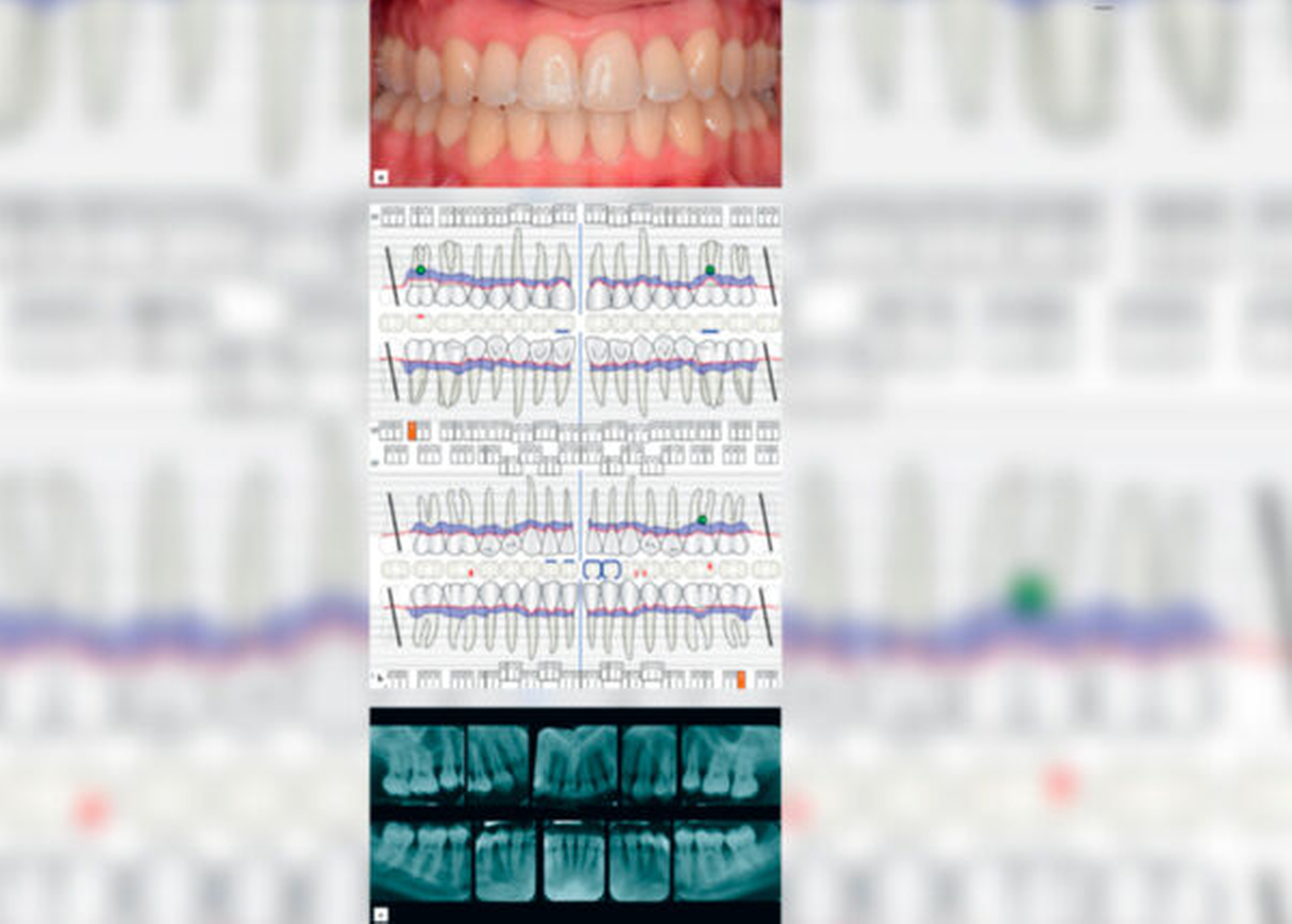
Die Leitliniengruppe betont, dass die für eine adjuvante Antibiotikatherapie infrage kommenden Patientenfälle in der Regel durch eine rasche Progressionsrate – oft in Abwesenheit von modifizierbaren Risikofaktoren – gekennzeichnet sind. Ein Beispiel für eine solche Patientin und deren Therapie zeigen die Abbildungen 1 und 2. Deshalb sollte die Behandlung dieser Hochrisikopatienten durch spezifisch fort- und weitergebildete Zahnärzte (zum Beispiel DG-PARO-Spezialisten für Parodontologie) durchgeführt werden. Die Zugänglichkeit zu dieser Versorgung sollte für die Patienten verbessert werden. Mit der Wahl der Antibiotikasubstanzen, der begrenzten Dauer und der Limitation auf eine Hochrisikogruppe jüngeren Alters sind wichtige Prinzipien von Antibiotic Stewardship berücksichtigt, wie sie in den aktuellen internationalen und nationalen Leitlinien und Empfehlungen der WHO, des ECDC (European Centre for Disease Prevention and Control), der Kommission ART (Antiinfektiva, Resistenz und Therapie) beim Robert Koch-Institut (RKI) einschließlich der deutschen S3-Leitlinie „Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus“ (AWMF-Register Nr. 092–001) beschrieben sind.
Antibiotika bei chirurgischer Parodontaltherapie (Stufe 3)
Nutzen
Verbessern adjuvante, systemisch verabreichte Antibiotika das klinische Ergebnis der chirurgischen Parodontaltherapie? Häufig werden systemische Antibiotika auch während der Parodontalchirurgie und hier insbesondere im Rahmen regenerativer/rekonstruktiver Therapiemaßnahmen, bei denen Biomaterialien zum Einsatz kommen, verschrieben. Ziel ist es, dadurch postoperative Infektionen beziehungsweise Komplikationen zu vermeiden und die klinischen Ergebnisse zu verbessern. Erstaunlich ist allerdings, dass nur wenige Studien den Nutzen von Antibiotika in dieser Indikation untersucht haben. Dementsprechend gibt es auch keine Leitlinie, an der sich parodontalchirurgisch tätige Zahnärztinnen und Zahnärzte orientieren könnten. Es ist offenbar so, dass die Verschreibung von Antibiotika rein empirisch und oft auch aufgrund einer Patientenerwartung erfolgt [Liu et al., 2017; Hai et al., 2020].
Zu unterscheiden ist zwischen einer prophylaktischen, oftmals nur einmaligen, perioperativen systemischen Antibiotikagabe zur Vermeidung von Wundinfektionen (Surgical Site Infections – SSI) und einer mehrtägigen Antibiotikagabe ähnlich derjenigen im Rahmen der nicht-chirurgischen Therapie. Das Ziel der perioperativen Antibiotikaprophylaxe (PAP) ist, die Rate postoperativer Wundinfektionen durch Bakterien zu reduzieren, die während einer Operation ins OP-Gebiet gelangen oder dort schon vorhanden sind. Allgemein anerkannte Indikationen für eine PAP sind Eingriffe mit hohen Infektionsraten bei „sauber kontaminierten“ oder bei „kontaminierten“ Operationen sowie „saubere“ Eingriffe mit Einbringen alloplastischen Materials mit niedrigen Infektionsraten, jedoch gravierenden Folgen einer SSI. Laut dem neuesten Stand der Bundesvereinigung der Deutschen Chirurgen [Eckmann, 2021] sind bei der Auswahl und dem Einsatz eines Antibiotikums folgende Faktoren zu berücksichtigen: Patient (mit eventuellen Risikofaktoren), Art der Operation, zu erwartendes Erregerspektrum, lokale Resistenzepidemiologie, Pharmakokinetik und Halbwertszeit, Konzentration im Zielgewebe, Toxizität und Verträglichkeit, Vorliegen prospektiver, randomisierter, kontrollierter Studien sowie Kosten. Unstrittig ist die PAP bei Operationen mit hohen SSI-Raten (meist > 10 Prozent) wie beispielsweise kolorektalen Eingriffen. Ob eine PAP auch indiziert ist, wenn es sich um Eingriffe mit niedrigen (< 1–3 Prozent) SSI-Raten handelt wie in der Parodontalchirurgie, wird infrage gestellt [Powell et al., 2005; Liu et al., 2017]. Eine randomisierte klinische Studie über parodontalchirurgische Routineeingriffe mit oder ohne PAP konnte keinen zusätzlichen Nutzen nachweisen [Mohan et al., 2014].
Eine aktuelle Placebo-kontrollierte, randomisierte Studie ist der Frage nachgegangen, ob die einwöchige Gabe von Metronidazol (500 mg, dreimal täglich) die Ergebnisse parodontaler Zugangslappenoperationen verbessern könnte [Collins et al., 2022]. Insgesamt war die Inzidenz unerwünschter Ereignisse minimal, allerdings gaben 20 Prozent der Patienten der Antibiotikagruppe gastro-intestinale Beschwerden an. In Bezug auf die klinischen Ergebnisse war kein zusätzlicher Nutzen der adjuvanten systemischen Antibiotikagabe zu beobachten und die Autoren kamen zu dem Schluss, dass somit in dieser Indikation keine systemischen Antibiotika angezeigt wären.
Die andere häufige Anwendung von systemischen Antibiotika findet während der regenerativen Parodontalchirurgie statt. Diese Verfahren zielen darauf ab, die Schaffung eines neuen parodontalen Attachments unter Verwendung verschiedener Arten von Biomaterialien zu stimulieren, was klinisch zu einer höheren Taschenreduktion und einem höheren klinischen Attachmentgewinn führt [Nibali et al., 2020; Jepsen et al., 2020]. Die aktuelle S3-Leitlinie empfiehlt diese Verfahren in der Therapiestufe 3 in bestimmten vertikalen Defekten und in Furkationen [Sanz et al., 2020], äußert sich aber nicht zu einer begleitenden systemischen Antibiotikagabe. Erstmals wurde nun auch diese Frage unter Einschluss von über einhundert randomisierten Studien zur regenerativen Parodontalchirurgie ganz aktuell analysiert [Nibali et al., 2022]. Zwar zeigten Meta-Regressionsanalysen im indirekten Vergleich geringfügig bessere Ergebnisse für diejenigen Studienarme, bei denen Antibiotika gegeben worden waren, aber bei der Analyse der vergleichenden Studien (direkter Vergleich: regenerative Therapie mit versus ohne adjuvante AB-Therapie) fanden sich keine klinischen Vorteile [Loos et al., 2002; Abu-Ta´A, 2016; Eickholz et al., 2014; Pietruska et al., 2021]. Auch waren insgesamt keine klaren Unterschiede hinsichtlich der Häufigkeit unerwünschter Ereignisse (postoperative Infektion, Exposition des Biomaterials, Abszessbildungen et cetera) erkennbar. Basierend auf diesen Daten folgerten die Autoren, dass der Einsatz adjuvanter systemischer Antibiotika bei regenerativer Parodontalchirurgie auch im Sinne von Antibiotic Stewardship [Dyar et al., 2017] infrage gestellt werden sollte [Nibali et al., 2022].
Risiken
Die oben erwähnten Studien machten zumeist leider keine Angaben über unerwünschte Nebenwirkungen in Verbindung mit der Antibiotikagabe. Dennoch gelten dieselben Erwägungen und Bedenken, die bei Therapiestufe 2 ausgeführt wurden.
Zusammenfassung
Im Ergebnis einer Nutzen-Risiken-Abwägung gibt es trotz nachweislich verbesserter klinischer Ergebnisse einen nur begrenzten Einsatzbereich von adjuvanten systemischen Antibiotika in der Stufe 2 der antiinfektiösen Therapie der Parodontitis. Dieser wird durch die aktuelle S3-Leitlinie klar beschrieben. Keineswegs darf eine Antibiotikagabe Kompensation für eine unzureichende Instrumentierung oder mangelhafte Mundhygiene sein. Hingegen ist der Nutzen einer Antibiotikagabe im Rahmen der chirurgischen Therapie (Stufe 3) offenbar nicht durch Evidenz belegt, weshalb deren routinemäßiger Einsatz nicht zu rechtfertigen ist.
Literaturliste
Abu-Ta'a, M. (2016). Adjunctive Systemic Antimicrobial Therapy vs Asepsis in Conjunction with Guided Tissue Regeneration: A Randomized, Controlled Clinical Trial. J Contemp Dent Pract, 17(1), 3-6. doi:10.5005/jp-journals-10024-1794
C
assini, A., Högberg, L. D., Plachouras, D., Quattrocchi, A., Hoxha, A., Simonsen, G. S., et al. (2019). Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect. Dis. 19, 56–66.
Collins, J. R., Ogando, G., Gonzalez, R., Figuero, E., Marin, M. J., Sanz, M., & Herrera, D. (2022). Adjunctive efficacy of systemic metronidazole in the surgical treatment of periodontitis: a double-blind parallel randomized clinical trial. Clin Oral Investig. doi:10.1007/s00784-022-04392-2
Cosgarea, R., Juncar, R., Heumann, C., Tristiu, R., Lascu, L., Arweiler, N., . . . Sculean, A. (2016). Non-surgical periodontal treatment in conjunction with 3 or 7 days systemic administration of amoxicillin and metronidazole in severe chronic periodontitis patients. A placebo-controlled randomized clinical study. J Clin Periodontol, 43(9), 767-777. doi:10.1111/jcpe.12559
Cosgarea, R., Heumann, C., Juncar, R., Tristiu, R., Lascu, L., Salvi, G. E., . . . Sculean, A. (2017). One year results of a randomized controlled clinical study evaluating the effects of non-surgical periodontal therapy of chronic periodontitis in conjunction with three or seven days systemic administration of amoxicillin/metronidazole. PLoS One, 12(6), e0179592. doi:10.1371/journal.pone.0179592
Cosgarea, R., Eick, S., Jepsen, S., Arweiler, N. B., Juncar, R., Tristiu, R., . . . Sculean, A. (2020). Microbiological and host-derived biomarker evaluation following non-surgical periodontal therapy with short-term administration of systemic antimicrobials: secondary outcomes of an RCT. Sci Rep, 10(1), 16322. doi:10.1038/s41598-020-73054-8
Dyar, O. J., Huttner, B., Schouten, J., Pulcini, C., & Esgap. (2017). What is antimicrobial stewardship? Clin Microbiol Infect, 23(11), 793-798. doi:10.1016/j.cmi.2017.08.026
Eckmann, C. (2021). Perioperative Antibiotikaprophylaxe. https://www.bdc.de/category/wissen/qualitatpatientensicherheit/
Eickholz, P., Rollke, L., Schacher, B., Wohlfeil, M., Dannewitz, B., Kaltschmitt, J., . . . Kim, T. S. (2014). Enamel matrix derivative in propylene glycol alginate for treatment of infrabony defects with or without systemic doxycycline: 12- and 24-month results. J Periodontol, 85(5), 669-675. doi:10.1902/jop.2013.130290
Eickholz, P., Koch, R., Kocher, T., Hoffmann, T., Kim, T. S., Meyle, J., . . . Ehmke, B. (2019). Clinical benefits of systemic amoxicillin/metronidazole may depend on periodontitis severity and patients' age: An exploratory sub-analysis of the ABPARO trial. Journal of Clinical Periodontology, 46(4), 491-501. doi:10.1111/jcpe.13096
Haffajee, A. D., Socransky, S. S., & Gunsolley, J. C. (2003). Systemic anti-infective periodontal therapy. A systematic review. Ann Periodontol, 8(1), 115-181. doi:10.1902/annals.2003.8.1.115
Hagenfeld, D., Prior, K., Ehmke, B. (2021) Das parodontalpathogene Mikrobiom bei Parodontitispatienten. zm 111, Nr. 01-02, 16.1.2021, (42)
Hai, J. H., Lee, C., Kapila, Y. L., Chaffee, B. W., & Armitage, G. C. (2020). Antibiotic prescribing practices in periodontal surgeries with and without bone grafting. J Periodontol, 91(4), 508-515. doi:10.1002/JPER.19-0195
Harks, I., Koch, R., Eickholz, P., Hoffmann, T., Kim, T. S., Kocher, T., . . . Ehmke, B. (2015a). Is progression of periodontitis relevantly influenced by systemic antibiotics? A clinical randomized trial. J Clin Periodontol, 42(9), 832-842. doi:10.1111/jcpe.12441
Herrera, D., Sanz, M., Jepsen, S., Needleman, I., & Roldan, S. (2002). A systematic review on the effect of systemic antimicrobials as an adjunct to scaling and root planing in periodontitis patients. J Clin Periodontol, 29 Suppl 3, 136-159; discussion 160-132.
Herrera, D., Contreras, A., Gamonal, J., Oteo, A., Jaramillo, A., Silva, N., . . . Leon, R. (2008). Subgingival microbial profiles in chronic periodontitis patients from Chile, Colombia and Spain. J Clin Periodontol, 35(2), 106-113. doi:10.1111/j.1600-051X.2007.01170.x
Jepsen, K., & Jepsen, S. (2016). Antibiotics/antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontol 2000, 71(1), 82-112. doi:10.1111/prd.12121
Jepsen, S., Gennai, S., Hirschfeld, J., Kalemaj, Z., Buti, J., Graziani, F. (2020) Regenerative surgical treatment of furcation defects: Asystematic review and Bayesian network meta-analysis of randomized clinical trials. J Clin Periodontol 47, 352–374.
Jepsen, K., Falk, W., Brune, F., Fimmers, R., Jepsen, S., & Bekeredjian-Ding, I. (2021). Prevalence and antibiotic susceptibility trends of periodontal pathogens in the subgingival microbiota of German periodontitis patients: A retrospective surveillance study. J Clin Periodontol, 48(9), 1216-1227. doi:10.1111/jcpe.13468
Jepsen, K., Falk, W., Brune, F., Cosgarea, R., Fimmers, R., Bekeredjian-Ding, I., & Jepsen, S. (2022). Prevalence and Antibiotic Susceptibility Trends of Selected Enterobacteriaceae, Enterococci, and Candida albicans in the Subgingival Microbiota of German Periodontitis Patients: A Retrospective Surveillance Study. Antibiotics (Basel), 11(3). doi:10.3390/antibiotics11030385
Keestra, J. A., Grosjean, I., Coucke, W., Quirynen, M., & Teughels, W. (2015). Non-surgical periodontal therapy with systemic antibiotics in patients with untreated chronic periodontitis: a systematic review and meta-analysis. J Periodontal Res, 50(3), 294-314. doi:10.1111/jre.12221
Keestra, J. A., Grosjean, I., Coucke, W., Quirynen, M., & Teughels, W. (2015a). Non-surgical periodontal therapy with systemic antibiotics in patients with untreated aggressive periodontitis: a systematic review and meta-analysis. J Periodontal Res, 50(6), 689-706. doi:10.1111/jre.12252
Liu, Y., Duan, D., Xin, Y., Bai, L., Li, T., Li, C., & Xu, Y. (2017). A review of the literature: antibiotic usage and its relevance to the infection in periodontal flaps. Acta Odontol Scand, 75(4), 288-293. doi:10.1080/00016357.2017.1295165
Loos, B. G., Louwerse, P. H. G., Van Winkelhoff, A. J., Burger, W., Gilijamse, M., Hart, A. A. M., & Van Der Velden, U. (2002). Use of barrier membranes and systemic antibiotics in the treatment of intraosseous defects. Journal of Clinical Periodontology, 29, 910–921. doi:org/10.1034/j.1600-051X.2002.291006.x
McGowan, K., McGowan, T., & Ivanovski, S. (2018). Optimal dose and duration of amoxicillin-plus-metronidazole as an adjunct to non-surgical periodontal therapy: A systematic review and meta-analysis of randomized, placebo-controlled trials. J Clin Periodontol, 45(1), 56-67. doi:10.1111/jcpe.12830
Mohan, R. R., Doraswamy, D. C., Hussain, A. M., Gundannavar, G., Subbaiah, S. K., & Jayaprakash, D. (2014). Evaluation of the role of antibiotics in preventing postoperative complication after routine periodontal surgery: A comparative clinical study. J Indian Soc Periodontol, 18(2), 205-212. doi:10.4103/0972-124X.131327
Murray CJL, Ikuta KS, Sharara F, et al. (2022) Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet 399 (10325):629-655. doi:10.1016/s0140-6736(21)02724-0
Nibali, L., Koidou, V. P., Nieri, M., Barbato, L., Pagliaro, U., & Cairo, F. (2020). Regenerative surgery versus access flap for the treatment of intra-bony periodontal defects: A systematic review and meta-analysis. J Clin Periodontol, 47 Suppl 22, 320-351. doi:10.1111/jcpe.13237
Nibali, L., Buti, J., Barbato, L., Cairo, F., Graziani, F., & Jepsen, S. (2022). Adjunctive Effect of Systemic Antibiotics in Regenerative/Reconstructive Periodontal Surgery-A Systematic Review with Meta-Analysis. Antibiotics 11, 8. doi.org/10.3390/antibiotics11010008
Pietruska, M., Dolinska, E., Milewski, R., & Sculean, A. (2021). Effect of systemic antibiotics on the outcomes of regenerative periodontal surgery in intrabony defects: a randomized, controlled, clinical study. Clin Oral Investig, 25(5), 2959-2968. doi:10.1007/s00784-020-03616-7
Powell, C. A., Mealey, B. L., Deas, D. E., McDonnell, H. T., & Moritz, A. J. (2005). Post-surgical infections: prevalence associated with various periodontal surgical procedures. J Periodontol, 76(3), 329-333. doi:10.1902/jop.2005.76.3.329
Pretzl, B., Salzer, S., Ehmke, B., Schlagenhauf, U., Dannewitz, B., Dommisch, H., . . . Jockel-Schneider, Y. (2019). Administration of systemic antibiotics during non-surgical periodontal therapy-a consensus report. Clin Oral Investig, 23(7), 3073-3085. doi:10.1007/s00784-018-2727-0
Rupf, S., Hannig, M. (2020) Das humane Mikrobiom und seine Bedeutung für die Zahnmedizin. zm 110, Nr. 23-24, 1.12.2020, (2292)
Sanz, M., Herrera, D., Kebschull, M., Chapple, I., Jepsen, S., Berglundh, T., . . . Methodological, C. (2020). Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline. J Clin Periodontol, 47 Suppl 22, 4-60. doi:10.1111/jcpe.13290
Sgolastra, F., Petrucci, A., Gatto, R., & Monaco, A. (2012). Effectiveness of systemic amoxicillin/metronidazole as an adjunctive therapy to full-mouth scaling and root planing in the treatment of aggressive periodontitis: a systematic review and meta-analysis. J Periodontol, 83(6), 731-743. doi:10.1902/jop.2011.110432
Teughels, W., Feres, M., Oud, V., Martin, C., Matesanz, P., & Herrera, D. (2020). Adjunctive effect of systemic antimicrobials in periodontitis therapy. A systematic review and meta-analysis. J Clin Periodontol. doi:10.1111/jcpe.13264
WHO. (2021). Global Antimicrobial Resistance and Use Surveillance System (GLASS) Report. 1-167.
Wollkopf, A.D., Mutters, N.T. (2022) Antibiotikaresistenzen – die stille Pandemie. Zahnärztliche Mitteilungen zm 112, Nr. 10, 16.05.2022
Zandbergen, D., Slot, D. E., Cobb, C. M., & Van der Weijden, F. A. (2013). The clinical effect of scaling and root planing and the concomitant administration of systemic amoxicillin and metronidazole: a systematic review. J Periodontol, 84(3), 332-351. doi:10.1902/jop.2012.120040