Die Behandlung periimplantärer Infektionen an Zahnimplantaten
Periimplantäre Infektionen an Zahnimplantaten entstehen durch bakterielle Plaque-Biofilme und betreffen sowohl Titan- als auch Keramikimplantate. In experimentellen Untersuchungen konnte gezeigt werden, dass eine periimplantäre Mukositis beim Menschen bereits innerhalb einer dreiwöchigen Plaque-Akkumulationsphase entstehen kann. Innerhalb von fünf Jahren trat bei 43,9 Prozent der Fälle von klinisch manifestierter periimplantärer Mukositis unbehandelt eine Konversion in eine Periimplantitis auf. Unter regelmäßiger vorbeugender Therapie konnte die Inzidenz auf 18,0 Prozent reduziert werden. Ohne Behandlung führt die Periimplantitis zum Verlust des Implantats [Schwarz et al., 2018]. Der frühzeitigen Diagnostik und Therapie periimplantärer Infektionen kommt daher eine herausragende Bedeutung zu.
Diagnostik
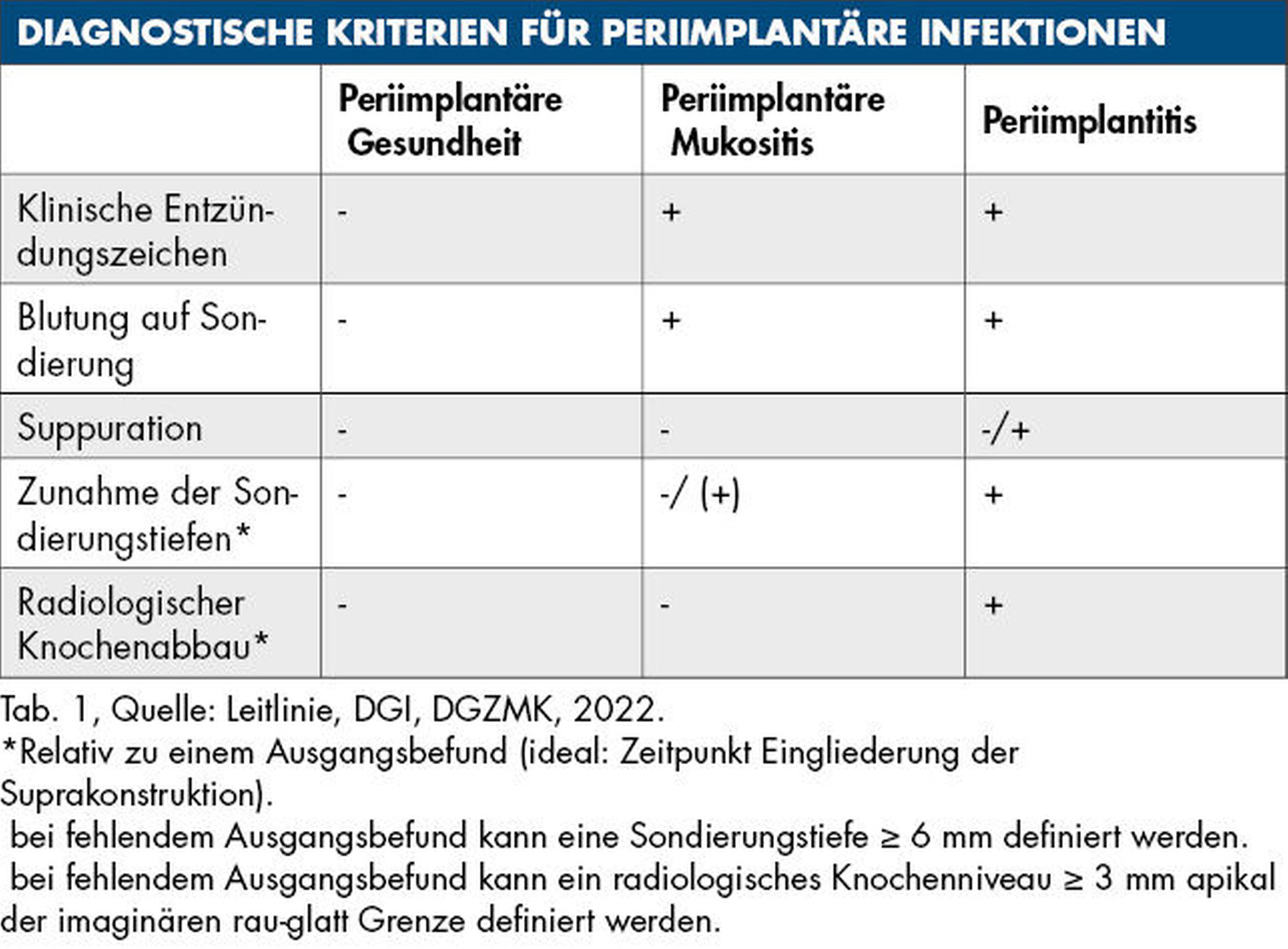
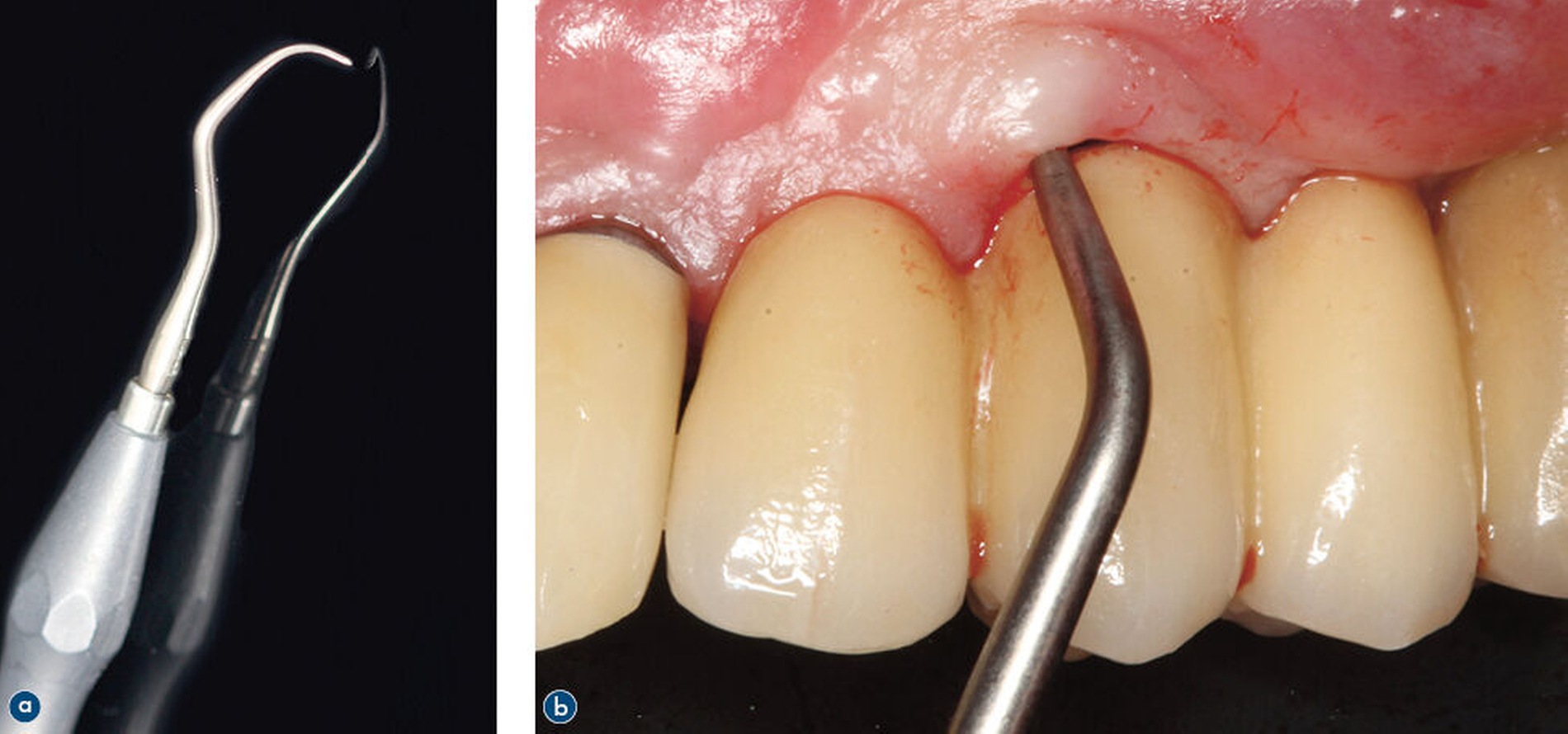
Periimplantäre Infektionen lassen sich durch visuelle Inspektion, Palpation und Sondierung diagnostizieren. Die Erhebung der Blutung auf Sondierung (BOP) spielt hierbei eine übergeordnete Rolle. Bei bestehendem Verdacht auf Periimplantitis sollte eine radiologische Untersuchung erfolgen und frühere Messungen der Sondierungstiefen sollten berücksichtigt werden. Ein Anstieg der Sondierungstiefen in Verbindung mit positiver BOP ist ein Hinweis auf Periimplantitis und ein Indikator für den Schweregrad der Erkrankung. Suppuration ist charakteristisch für eine Periimplantitis – deren Fehlen schließt die Diagnose aber nicht aus [Schwarz et al., 2018]. Weiterhin kann die Entstehung mukosaler Rezessionen ein Indikator für eine fortgeschrittene Periimplantitis sein.
Nichtchirurgische Therapie der periimplantären Mukositis
Das Ziel der nichtchirurgischen Therapie der periimplantären Mukositis besteht darin, klinische Anzeichen der Infektion zu reduzieren. Anzustreben wären residuale positive Blutungsstellen von ≤ 1 je Implantat. Alle in der Leitlinie bewerteten Therapieverfahren führten zu klinischen Verbesserungen, jedoch wurde ein vollständiges Abheilen der periimplantären Mukositis innerhalb der kurzen Beobachtungszeiträume nur vereinzelt beobachtet [Ramanauskaite et al., 2021].
Alternative Verfahren zur Biofilmentfernung wie Glycinpulver-basiertes Air-Polishing und Chitosan-Bürsten zeigten keinen zusätzlichen klinischen Effekt im Vergleich zum konventionellen Debridement. Eine Metaanalyse ergab keine Unterschiede hinsichtlich der Reduktionen von Blutung auf Sondierung (BOP) und Sondierungstiefe (ST).
In mehreren randomisierten kontrollierten Studien wurden die antimikrobielle Photodynamische Therapie (aPDT) sowie ein Diodenlaser als zusätzliche Therapie zum konventionellen Debridement getestet. Die adjuvante aPDT zeigte über einen Beobachtungszeitraum von drei Monaten vergleichbare Ergebnisse wie die Kontrollgruppe, obwohl eine Studie höhere ST-Reduktionen nach der aPDT berichtete. Die Metaanalyse ergab jedoch keinen Vorteil der adjuvanten aPDT. Auch der zusätzliche Einsatz eines Diodenlasers zeigte über einen Beobachtungszeitraum von drei und zwölf Monaten keinen zusätzlichen Effekt auf die Veränderungen der BOP- und ST-Werte im Vergleich zum alleinigen mechanischen Debridement. Adjuvante antiseptische Maßnahmen wie Chlorhexidindiglukonat (CHX)-Gel, Full-mouth-Desinfektionsprotokoll mit CHX-Gel und Mundspülung oder Natriumhypochlorid zeigten über einen Beobachtungszeitraum von drei bis sechs Monaten vergleichbare Ergebnisse in Bezug auf BOP- und ST-Werte wie das alleinige mechanische Debridement. Die Metaanalyse ergab keinen Vorteil einer adjuvanten CHX-Therapie in Bezug auf BOP-Werte (Abbildung 1).
Verschiedene adjuvante Maßnahmen wie eine systemische antibiotische Therapie oder Probiotika zeigten in zwei RCTs keinen zusätzlichen Effekt auf die Veränderungen der BOP- und ST-Werte. Eine adjuvante häusliche antiseptische Therapie mit verschiedenen Mitteln zeigte in drei RCTs vergleichbare oder leicht verbesserte BOP- und ST-Werte im Vergleich zur Kontrollgruppe. Metaanalysen ergaben keinen zusätzlichen Nutzen durch diese Maßnahmen im Vergleich zum mechanischen Debridement [Ramanauskaite et al., 2021].
Nichtchirurgische Therapie der Periimplantitis
Das Ziel der nichtchirurgischen Therapie der Periimplantitis ist, klinische Anzeichen der Infektion sowie tiefe Taschen zu reduzieren. Anzustreben wären residuale positive Blutungsstellen von ≤ 1 je Implantat, fehlende Suppuration sowie Sondierungstiefen von ≤ 5 mm. Die Beobachtungszeiträume in den Studien lagen zwischen sechs und zwölf Monaten und die Falldefinition für Periimplantitis basierte auf dem Vorliegen von BOP und/oder Suppuration sowie dem Nachweis eines radiologischen Knochenabbaus.
Die nicht-chirurgischen Therapieverfahren führten zu einer signifikanten Verbesserung der untersuchten klinischen Parameter, jedoch zeigten behandelte Stellen häufig residuale BOP-Werte [Ramanauskaite et al., 2021].
Als alternative Verfahren zur Biofilmentfernung wurden ein Erbium (Er): YAG-Laser, Ultraschall und Glycinpulver-basiertes Air-Polishing gegen ein mechanisches Debridement (Kunststoff-/ Titan-/ Karbonküretten) verglichen. Die Anwendung von Laser und Air-Polishing führte nach sechs Monaten zu einer höheren BOP-Reduktion im Vergleich zur Kontrollgruppe, während Ultraschall keinen zusätzlichen Effekt zeigte (Abbildung 2). Eine Metaanalyse zeigte eine Überlegenheit alternativer Verfahren zur Biofilmentfernung hinsichtlich der BOP-Reduktion, jedoch nicht bezüglich der ST-Werte [Ramanauskaite et al., 2021].
Die adjuvante aPDT-Therapie zeigte nach sechs Monaten eine signifikant höhere Reduktion von Sulkus-Blutungs-Index (SBI) und Sondierungstiefe im Vergleich zu alleinigem mechanischem Debridement, während der adjuvante Einsatz eines Diodenlasers zu vergleichbaren klinischen Ergebnissen wie die Kontrollgruppe führte.
Als weitere adjuvante Verfahren zu einem konventionellen Debridement wurden lokale Applikationen von Minocyclin-Mikrosphären, CHX 1,0 Prozent-Gel und CHX-haltigen Chips sowie die submukosale Applikation eines Trocknungsmittels untersucht. Einmaliger adjuvanter Einsatz von Minocyclin-Mikrosphären führte zu einer höheren ST-Reduktion, während der wiederholte Einsatz eine höhere BOP-Reduktion bewirkte. Wiederholte Anwendung von CHX-Chips oder einmalige Applikation eines Trocknungsmittels zeigten nach sechs Monaten vergleichbare BOP-, aber höhere ST-Reduktionen im Vergleich zur Placebo-Anwendung. Die Metaanalyse ergab keinen zusätzlichen Effekt von adjuvanter lokaler antiseptischer/ antibiotischer Therapie im Vergleich zum konventionellen Debridement in Bezug auf BOP- und ST-Werte.
Eine adjuvante systemische antibiotische Therapie wurde in einer RCT und einer CCT (Controlled Clinical Trial) untersucht. Azithromycin führte zu höheren BOP- und ST-Reduktionen im Vergleich zu einem alleinigen konventionellen Debridement. Eine Kombination von Metronidazol (400 mg) und Amoxicillin (500 mg) zeigte bei fortgeschrittener Periimplantitis jedoch keinen zusätzlichen Effekt auf BOP- und ST-Reduktionen. Die Metaanalyse deutete auf einen begünstigenden Effekt einer adjuvanten systemischen antibiotischen Therapie hin [Ramanauskaite et al., 2021].
Es wird dennoch empfohlen, bei der nichtchirurgischen Therapie einer fortgeschrittenen Periimplantitis keine adjuvante systemische antibiotische Therapie routinemäßig einzusetzen [DGI, DGZMK, 2022]. Dies begründet sich in Bedenken hinsichtlich der Gesundheit des Patienten und der Auswirkungen systemischer Antibiotika auf den Gesundheitszustand der Bevölkerung. [DG PARO, DGZMK, 2020].
Zwei RCTs untersuchten den Effekt adjuvanter Probiotika (L. reuteri) und berichteten widersprüchliche Ergebnisse. Eine Studie zeigte keine zusätzlichen Effekte, während die andere eine höhere Abnahme der ST-Werte nach systemischer täglicher Probiotikabgabe über sechs Monate aufwies. Die Metaanalyse ergab keinen zusätzlichen Effekt adjuvanter probiotischer Therapie zum mechanischen Debridement alleine [Ramanauskaite et al., 2021].
Chirurgische Therapie der Periimplantitis
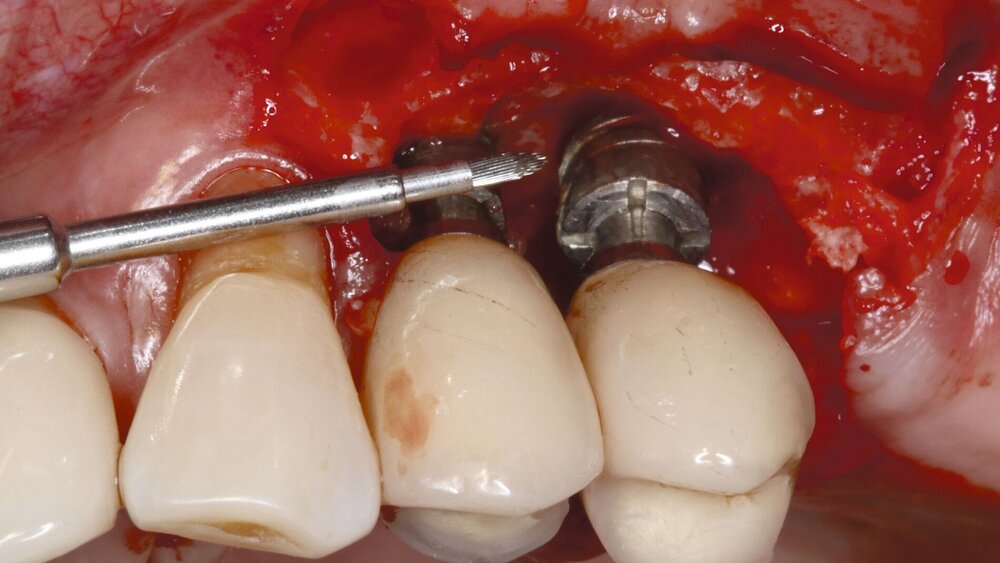
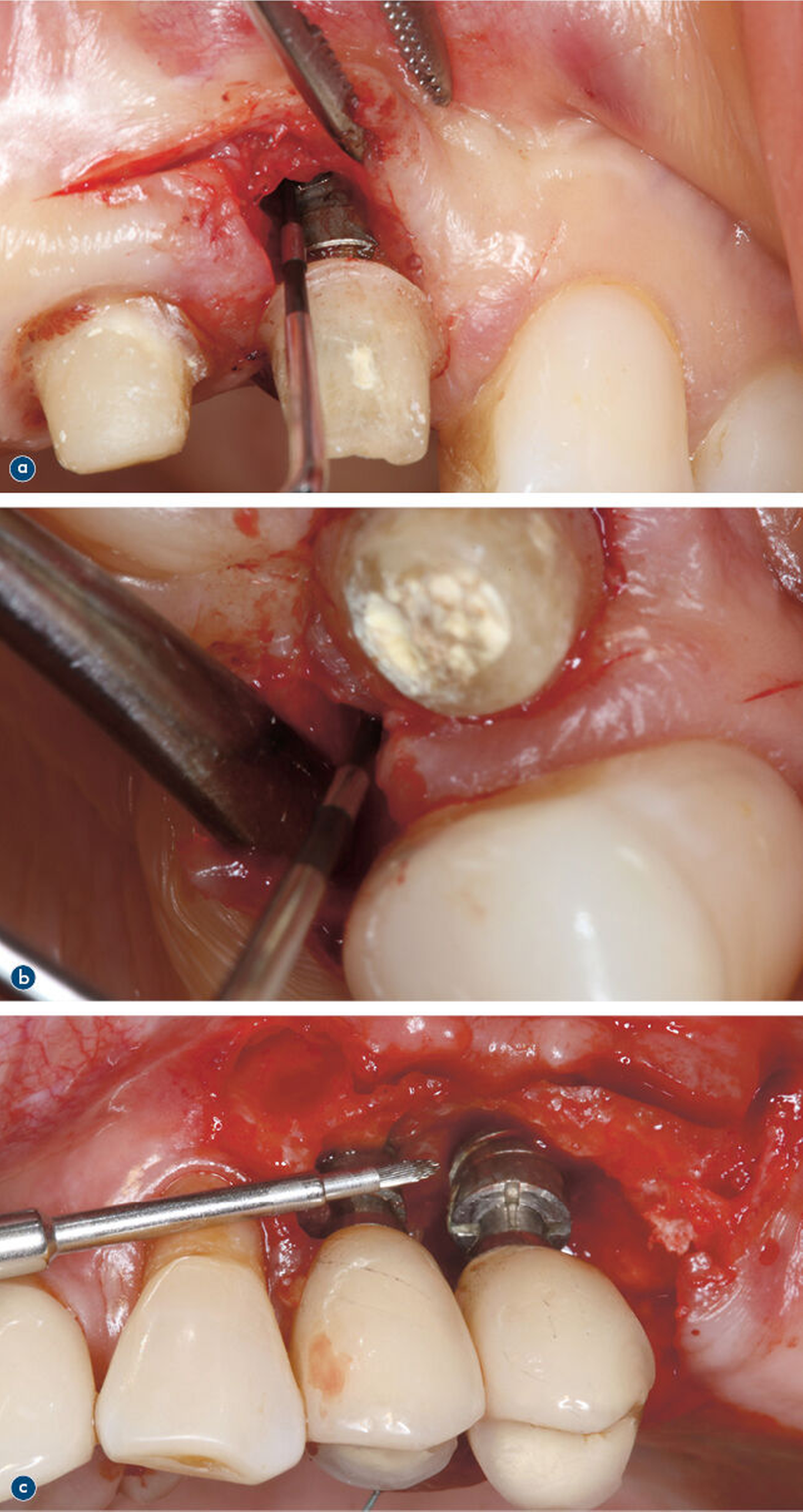
Wenn das Therapieziel (BOP ≤ 1 je Implantat, fehlende Suppuration, ST ≤ 5 mm) durch eine nichtchirurgische Therapie nicht erreicht werden kann, wird frühzeitig eine chirurgische Intervention empfohlen (Abbildung 3). Verschiedene chirurgische Therapiemaßnahmen werden beschrieben, einschließlich Lappenoperation, resektiver und rekonstruktiver Maßnahmen sowie einer Kombination aus beiden (Abbildung 4). Alle umfassen die Entfernung von Granulationsgewebe und eine Dekontamination der Implantatoberflächen [Schwarz et al., 2022].
Adjuvante und alternative Verfahren zur Implantatoberflächendekontamination bei nicht-rekonstruktiver chirurgischer Therapie
Alternative Verfahren zur Oberflächendekontamination wie eine Titanbürste oder Air-Polishing führten über sechs Monate zu höheren BOP- und ST-Reduktionen als ein konventionelles Debridement. Die Titanbürste verbesserte auch signifikant das radiologische Knochenniveau. Der adjuvante Einsatz von aPDT oder Diodenlaserapplikation zeigte nach sechs Monaten keinen zusätzlichen Effekt auf die BOP- und ST-Reduktion. Der adjuvante Einsatz von 0,2 Prozent CHX oder 0,12 Prozent CHX + 0,05 Prozent Cetylpiridinumchlorid als Teil des Dekontaminationsprozesses führte über ein bis drei Jahre zu keiner zusätzlichen Verbesserung der klinischen oder radiologischen Parameter [Ramanauskaite et al., 2021].
Adjuvante Verfahren zur Implantatoberflächendekontamination bei rekonstruktiver und kombinierter chirurgischer Therapie
Es wurden unterschiedliche adjuvante Therapieansätze untersucht. Eine Ozontherapie zeigte ein Jahr nach rekonstruktiver Therapie eine größere radiologische Defektauffüllung, aber keinen zusätzlichen Effekt auf BOP- und ST-Werte. Der Einsatz eines Kohlenstoffdioxidlasers führte über fünf Jahre zu vergleichbaren klinischen und radiologischen Verbesserungen wie Air-Polishing. Eine Titanbürste führte zu einer höheren ST-Reduktion als Wasserstoffperoxid, aber vergleichbaren BOP-Reduktionen. Eine alternative Er:YAG-Laseroberflächendekontamination führte über sieben Jahre zu vergleichbaren BOP- und ST-Reduktionen wie eine konventionelle Dekontamination [Ramanauskaite et al., 2021].
Adjuvante Implantatplastik bei nicht-rekonstruktiver chirurgischer Therapie
Eine Implantatplastik wurde in zwei RCTs bei der nicht-rekonstruktiven Therapie der Periimplantitis untersucht. Eine Langzeitbeobachtung über drei Jahre zeigte positive Ergebnisse, aber auch eine höhere Abnahme des mukosalen Levels. Eine Sechs-Monats-Beobachtung ergab keine signifikanten Unterschiede bei BOP- und ST-Reduktion im Vergleich zur alleinigen Implantatoberflächendekontamination. Eine Metaanalyse zeigte einen zusätzlichen Effekt einer Implantatplastik hinsichtlich der ST-Reduktionen [Ramanauskaite et al., 2021]. Dieses Verfahren kann insbesondere bei suprakrestalen oder kombinierten Defekten erwogen werden [DGI, DGZMK, 2022].
Adjuvante lokale und systemische antibiotische Therapie bei nicht-rekonstruktiver chirurgischer Therapie
In einer RCT wurde die wiederholte lokale Applikation von Minocyclin untersucht, welche zu höheren ST-Reduktionen und radiologischen Knochenniveaus als die Kontrollgruppe führte. Zwei RCTs untersuchten die Effektivität einer systemischen antibiotischen Therapie, wobei eine adjuvante Gabe von Azithromycin zu vergleichbaren Ergebnissen wie die Kontrollgruppe führte, und eine adjuvante Gabe von Amoxicillin nur im Bereich von Implantaten mit rauer Oberfläche einen positiven Effekt zeigte. Eine Metaanalyse ergab keinen zusätzlichen Effekt einer adjuvanten systemischen antibiotischen Therapie bei der nicht-rekonstruktiven Therapie der Periimplantitis [Ramanauskaite et al. 2021].
Rekonstruktive versus nicht rekonstruktive chirurgische Therapie
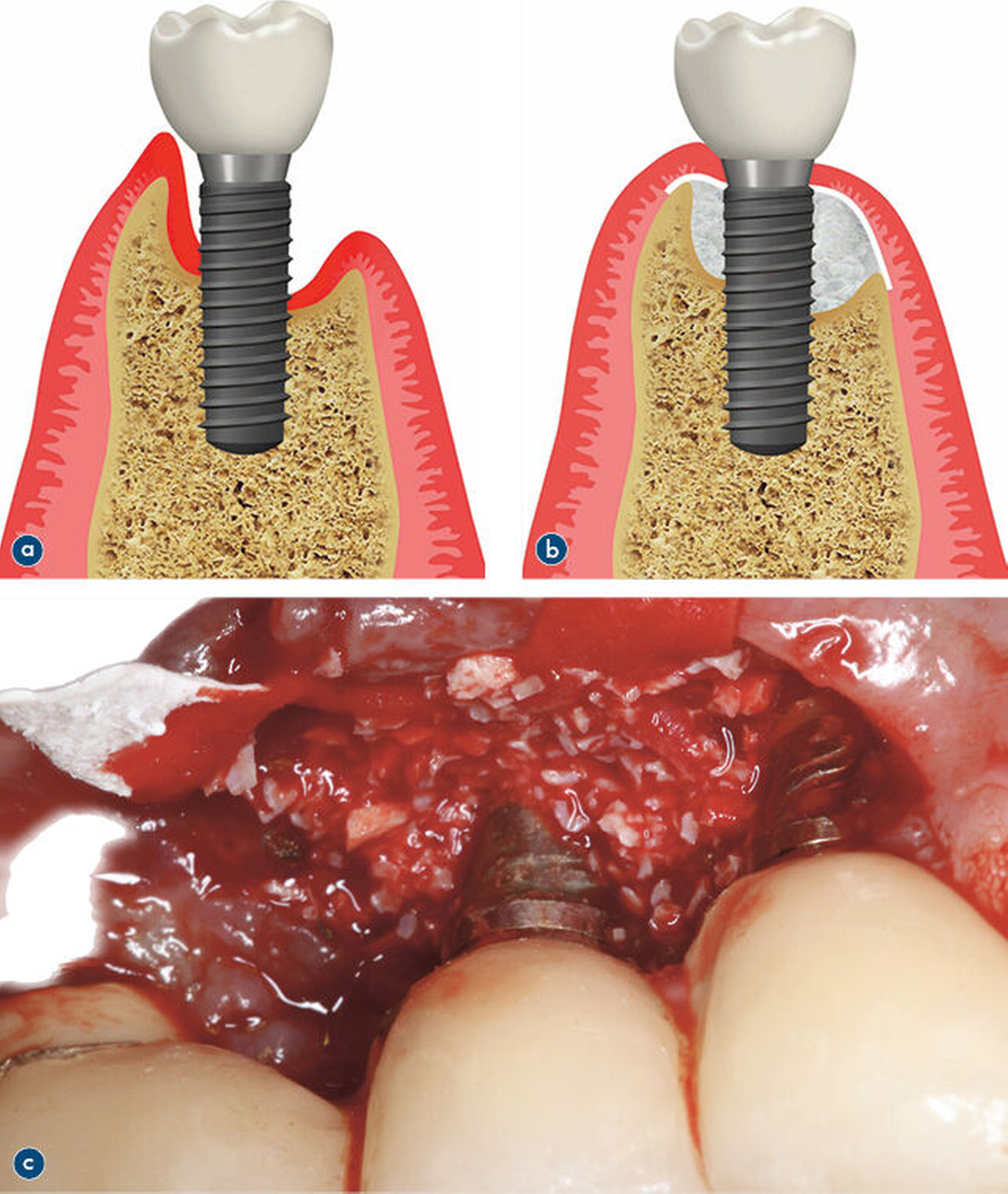
Sechs RCTs verglichen die klinische Effektivität rekonstruktiver mit nicht-rekonstruktiven Therapien bei Periimplantitis. Eine höhere radiologische Defektauffüllung wurde nach der Applikation poröser Titangranula oder xenogener Knochenfüller beobachtet. Adjuvante Schmelz-Matrix Proteine oder plättchenreiches Fibrin zeigten keinen Vorteil. Die Metaanalyse ergab signifikante Unterschiede zugunsten rekonstruktiver Verfahren hinsichtlich der ST-Reduktionen, sowie der radiologischen Defektauffüllung und der mukosalen Level [Ramanauskaite et al., 2021]. Eine sorgfältige Indikationsstellung ist jedoch zu beachten, bevor rekonstruktive chirurgische Verfahren eingesetzt werden. Diese sollten auf intraossäre Defekte beschränkt sein, die mindestens drei- bis vierwandig sind und eine intraossäre Komponente von mehr als 2 mm aufweisen (Abbildung 4). Darüber hinaus sollten nur Implantate mit ausreichender keratinisierter Mukosabreite behandelt werden [DGI, DGZMK, 2022].
Rekonstruktive chirurgische Therapie unter Verwendung unterschiedlicher Knochenfüller – mit und ohne Barrieremembran
Die Verwendung eines xenogenen (bovinen) Knochenfüllers führte nach zwölf Monaten zu höheren Reduktionen der mittleren ST- und RDF-Werte im Vergleich zu autogenem Knochen und einem alloplastischen Material (RDF – Radiologische Defektauffüllung). Auch poröse Titangranula zeigten sechs Monate nach der Anwendung höhere BOP- und RDF-Reduktionen im Vergleich zu einem xenogenen (porcinen) Knochenfüller. Ein Vergleich zweier xenogener (boviner) Knochenfüller zeigte vergleichbare Ergebnisse.
Die Verwendung einer nicht-resorbierbaren Barrieremembran zusammen mit autogenem Knochen führte zu geringeren Reduktionen der ST-Werte sowie einer geringeren radiologischen Defektauffüllung im Vergleich zu autogenem Knochen allein oder in Kombination mit einer resorbierbaren Barrieremembran. Die Kombination eines xenogenen Knochenfüllers mit einer nativen Kollagenmembran führte zu höheren BOP- und ST-Reduktionen im Vergleich zu einem alloplastischen Material ohne Barrieremembran. Kein zusätzlicher Effekt einer synthetischen resorbierbaren Barrieremembran wurde bei einem pflanzlichen Knochenfüller beobachtet [Ramanauskaite et al., 2021].
Fazit für die Praxis:
Die vollständige Abheilung einer periimplantären Mukositis kann auch nach Anwendung alternativer oder konventioneller Verfahren zur Biofilmentfernung nicht bei allen Patienten erreicht werden. Aus diesem Grund wird empfohlen, regelmäßige Nachkontrollen im Abstand von drei Monaten durchzuführen, um frühzeitig einen Bedarf für eine Nachbehandlung zu erkennen.
Für die nichtchirurgische Therapie der Periimplantitis sollten alternative Verfahren zur Biofilmentfernung zum Einsatz kommen.
Es wird empfohlen, frühzeitig eine chirurgische Therapie bei fortgeschrittenen Läsionen in Betracht zu ziehen, insbesondere wenn das Behandlungsziel durch eine nichtchirurgische Therapie nicht erreicht werden kann.
Die S3-Leitlinie "Die Behandlung periimplantärer Infektionen an Zahnimplantaten" (AWMF-Registriernummer: 083 - 023) ist auf den Webseiten der DGZMK (www.dgzmk.de/leitlinien) und AWMF (www.awmf.org/leitlinien/detail/ll/083-023.html) verfügbar.
Literaturliste
Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. Journal of Clinical Periodontology. 2018;45 Suppl 20:S246-S66.
Ramanauskaite A, Fretwurst T, Schwarz F. Efficacy of alternative or adjunctive measures to conventional non-surgical and surgical treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Internation Journal of Implant Dentistry. 2021; 15, 7:112.
Schwarz F, Jepsen S, Obreja K, Galarraga-Vinueza, ME, Ramanauskaite A. Surgical therapy of peri-implantitis. Periodontology 2000. 2022;88 145-181.
DGI, DGZMK: „Periimplantäre Infektionen an Zahnimplantaten, Behandlung“, Langfassung, Version 2.0, 2022, AWMF-Registriernummer: 083-023, www.awmf.org/leitlinien/detail/ll/083-023.html, (Zugriff am 29.03.2023).
DG PARO, DGZMK: S3-Leitlinie Die Behandlung von Parodontitis Stadium I bis III - Die deutsche Implementierung der S3-Leitlinie „Treatment of Stage I–III Periodontitis“ der European Federation of Periodontology (EFP). AWMF-Registriernummer: 083-043, register.awmf.org/de/leitlinien/detail/083-043 (Zugriff am 29.03.2023).