So tarnt sich die Hypophosphatasie
Herr Prof. Barvencik, was ist Hypophosphatasie und welche Auswirkungen hat sie auf die Mundhöhle und den Knochen?
Prof. Dr. Florian Barvencik: Hypophosphatasie ist eine seltene, genetisch bedingte Störung des Knochen- und Mineralstoffwechsels. Ursache sind Mutationen im ALPL-Gen, das für ein Enzym kodiert: die tissue-nonspecific alkaline phosphatase (TNSALP), also die alkalische Phosphatase. Dieses Enzym spielt eine zentrale Rolle bei der Mineralisation von Knochen und Zahngewebe.
Liegt hier ein Enzymdefekt vor, kann die alkalische Phosphatase ihre Aufgabe nicht mehr ausreichend erfüllen – insbesondere die Spaltung von anorganischem Pyrophosphat, das als Mineralisationshemmstoff wirkt. Wenn Pyrophosphat im Körper akkumuliert, entsteht eine Fehlbalance von Phosphat und Pyrophosphat, diese hemmt die Einlagerung von Hydroxylapatit in Knochen- und Zahnhartgewebe. Die Folge ist eine gestörte Mineralisation von Knochen und Zähnen. Klinisch kann das bis zu einer Knochenerweichung (Osteomalazie) führen – mit Stressfrakturen, Knochenheilungsstörungen und den entsprechenden Beschwerden.
Für das Skelett erklärt das die Osteomalazie-ähnlichen Veränderungen: Knochen werden schlechter mineralisiert, was klinisch zu Schmerzen, einer erhöhten Frakturgefahr und Heilungsstörungen führen kann. Im Bereich der Zähne betrifft die Hypomineralisation verschiedene Strukturen: Schmelz, Dentin, Zement sowie den Alveolarknochen. Dadurch kann es zu einer instabilen Zahnverankerung kommen – ein zentraler Mechanismus hinter den typischen dentalen Auffälligkeiten bei Hypophosphatasie. Neben Knochen und Zähnen wird die gestörte anorganische Pyrophosphat-Homöostase zudem als möglicher Beitrag zu Muskelschwäche, Muskelschmerzen und Gelenkschmerzen gesehen, sodass das klinische Bild häufig über den rein „orthopädisch-zahnmedizinischen“ Bereich hinausgeht.
Welche klinischen Formen unterscheiden Sie – und was bedeutet das praktisch für die Zahnmedizin?
Barvencik: Klassisch wird Hypophosphatasie in perinatale, infantile, kindliche/juvenile und adulte Verlaufsformen sowie die sogenannte Odonto- Hypophosphatasie eingeteilt. Bei der Odonto-HPP ist die Manifestation im Wesentlichen auf die Zähne begrenzt. Diese Einteilung orientiert sich historisch vor allem am Zeitpunkt, zu dem die Erkrankung klinisch auffällig beziehungsweise diagnostiziert wird: Wenn Babys bereits früh mit deutlichen Symptomen auffallen, spricht das für eine infantile Form. Gleichzeitig ist wichtig zu wissen: Obwohl mildere Formen oft erst später im Erwachsenenalter klinisch sichtbar werden (adulte Formen), besteht der Gendefekt lebenslang.
Neben dieser klassischen Einteilung wird heute zunehmend eine modernere Klassifikation diskutiert, bei der eher Schweregrad und Erbgang im Vordergrund stehen. Dabei kann man grob drei Gruppen unterscheiden: schwere Verläufe (häufig autosomal-rezessiv), moderate und milde Formen. Praktisch gilt oft: Je früher die Erkrankung symptomatisch wird, desto schwerer ist der Verlauf tendenziell.
Für die Zahnmedizin ist entscheidend, dass in allen Formen frühe und auffällige orale Veränderungen auftreten können. Bei der Odonto-Hypophosphatasie sind die dentalen Auffälligkeiten häufig sogar das einzige oder das erste klinische Zeichen. Damit ist die Zahnarztpraxis in der Realität oft die „Eintrittspforte“ zur Diagnose: Wenn man diese Zeichen erkennt und weiterdenkt, kann die Erkrankung überhaupt erst ins Blickfeld kommen.
Wie häufig ist Hypophosphatasie – und wie groß schätzen Sie die Dunkelziffer?
Barvencik: Die schweren, frühkindlichen Verlaufsformen sind insgesamt ausgesprochen selten; je nach Literatur werden Prävalenzen um 1:100.000 genannt, teils auch noch seltener. Demgegenüber sind die leichten bis moderaten Formen – insbesondere die adulte und die Odonto-Hypophosphatasie – deutlich häufiger, werden aber klar unterdiagnostiziert. In der Literatur werden hier Prävalenzen im Bereich von ungefähr 1:500 bis 1:10.000 diskutiert. Das passt auch dazu, dass pathogene ALPL-Varianten in der Bevölkerung häufiger vorkommen, als es die Zahl gesicherter Diagnosen vermuten lässt.
Aus Untersuchungen und auch aus eigenen Daten lässt sich ableiten, dass die Wahrscheinlichkeit, eine Variante im ALPL-Gen zu tragen, aber deutlich höher liegen kann. In einer Auswertung von Laborproben konnten wir außerdem die Häufigkeit einer erniedrigten alkalischen Phosphatase in einer norddeutschen Population beobachten – auch hier landet man größenordnungsmäßig bei etwa 1:250. Das heißt aber nicht, dass all diese Personen eine Hypophosphatasie-Diagnose haben – im Gegenteil: Viele laufen unter Fehldiagnosen. Wie groß die Dunkelziffer exakt ist, lässt sich derzeit nicht seriös beziffern – belastbare Daten fehlen –, aber man muss von einer erheblichen Unterdiagnostik ausgehen.
Warum wird sie in der Praxis so oft übersehen?
Barvencik: Das liegt daran, dass die Beschwerden häufig unspezifisch und „zerstreut“ wirken und dadurch kein klares Krankheitsbild ergeben. Stattdessen wird Hypophosphatasie dann mit anderen Erkrankungen verwechselt, die ähnliche Symptome aufweisen – typisch sind Diagnosen aus dem rheumatologischen Spektrum. Entscheidend ist außerdem, dass man die Kombination aus muskuloskelettalen Symptomen (zum Beispiel Schmerzen, Schwäche, Frakturen) und dentalen Auffälligkeiten überhaupt als zusammengehörig erkennt. Genau dieses „Zusammendenken“ passiert in der Routine oft nicht – ohne das entsprechende Wissen beziehungsweise den richtigen Überblick bleibt Hypophosphatasie dann unter dem Radar.
Welche Fehldiagnosen sehen Sie am häufigsten – und warum ist eine korrekte HPP-Diagnose so entscheidend?
Barvencik: Die häufigsten Fehldiagnosen hängen davon ab, ob man osteologisch oder zahnärztlich schaut: Osteologisch werden milde bis moderate Verläufe oft als Osteoporose oder Osteomalazie eingeordnet, bei Kindern auch als Rachitis-Differenzialdiagnosen; unspezifische Beschwerden wie Gelenkschmerzen und Muskelschwäche führen zudem nicht selten zu rheumatologischen Diagnosen (zum Beispiel rheumatoide Arthritis, Polymyalgie, Myalgie/Fibromyalgie). Teilweise berichten Betroffene zudem über unspezifische Allgemeinsymptome, ohne dass jemand die Verbindung zur Hypophosphatasie herstellt.
Zahnärztlich werden Hypophosphatasie-assoziierte Befunde häufig als eine rasch progrediente Parodontitis, eine atypische Kariesanfälligkeit, MIH oder schlicht als Folge „schlechter Mundhygiene“ fehlinterpretiert. Typisch für Hypophosphatasie ist jedoch eine strukturell bedingte parodontale Instabilität bei im Verhältnis oft geringer oder inkonsistenter Entzündung – das passt initial häufig nicht zu einem klassischen parodontalen Krankheitsbild und erklärt daher viele dieser Fehlzuordnungen.
Die korrekte Diagnose ist deshalb so entscheidend, weil die Fehldeutung zu einer falschen – teils schädlichen – Behandlung führen kann; besonders kritisch ist die Verwechslung mit Osteoporose, da Bisphosphonate bei Hypophosphatasie das Mineralisationsproblem verschärfen und orale Komplikationen (bis MRONJ/BRONJ) begünstigen können.
Herr Prof. Beikler, was sind die frühesten oralen Warnzeichen bei Kindern?
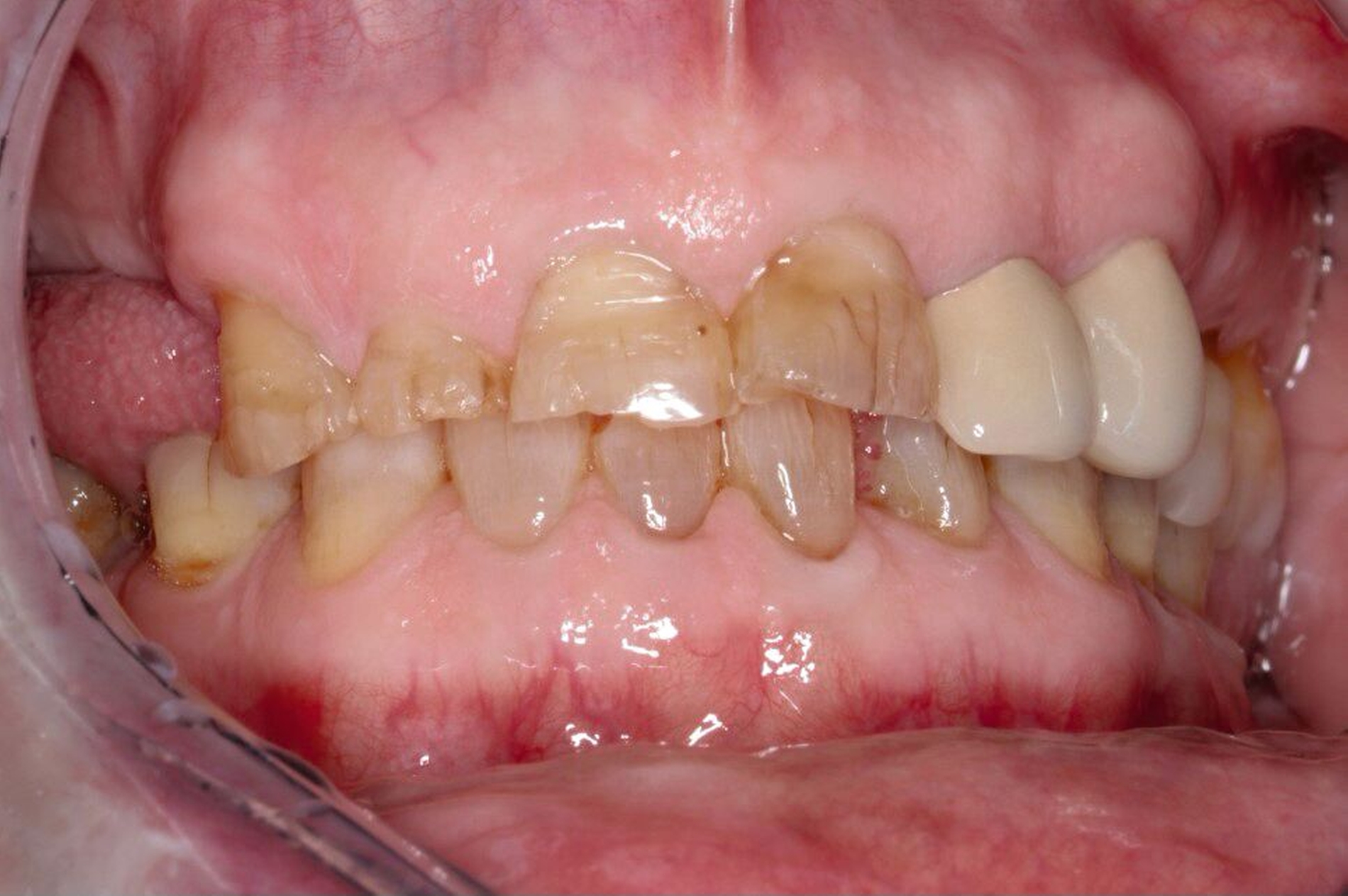
Prof. Dr. Dr. Thomas Beikler: Das Kardinalsymptom ist der vorzeitige Verlust von Milchzähnen – typischerweise nicht mit fünf oder sechs Jahren, sondern bereits zwischen dem ersten und dem dritten Lebensjahr. Charakteristisch ist ein atraumatischer Milchzahnverlust mit intakter Wurzel, also ohne physiologische Wurzelresorption. Entzündungszeichen fehlen meist, die Gingiva wirkt häufig unauffällig. Diese Konstellation – sehr früher Milchzahnverlust, intakte Wurzeln, kaum Trauma und wenig/keine Entzündung – ist hochspezifisch für Hypophosphatasie.
Wie häufig sind bleibende Zähne betroffen – und wie äußert sich das klinisch?
Beikler: Bleibende Zähne sind bei Hypophosphatasie sehr häufig betroffen: In unseren Kohorten zeigen über 50 Prozent der Patientinnen und Patienten eine deutliche parodontale und/oder strukturelle Beeinträchtigung der bleibenden Zähne. Dabei ist nicht nur ein einzelnes Zahnmuster betroffen, wie man es zum Beispiel von MIH kennt, sondern grundsätzlich können sämtliche Zähne Auffälligkeiten zeigen, was den Systemcharakter der Erkrankung unterstreicht. Typischerweise finden sich im Median zwei bis vier fehlende bleibende Zähne – teils deutlich mehr, insbesondere bei metabolisch ungünstigeren Parametern.
Auffällig ist zudem: Patientinnen und Patienten mit hohen PLP-Werten (Pyridoxal-5-Phosphat, aktive Form von Vitamin B6) verlieren fast doppelt so viele bleibende Zähne wie jene mit niedrigeren PLP-Werten.
Klinisch besonders charakteristisch ist eine atraumatische Zahnlockerung, teils sogar bei wirklich guter Mundhygiene. Zahnverluste können auftreten, obwohl die parodontale Entzündung disproportioniert gering ist – also ohne „ersichtliche“ klassische entzündliche Ursache. Parodontal zeigen sich häufig erhöhte Sondierungstiefen und Attachmentverlust; gleichzeitig müssen typische gingivale oder parodontale Entzündungszeichen im Initialstadium nicht zwingend auffällig sein. Genau diese Kombination – Lockerung plus wenig Entzündung – sollte sofort hellhörig machen.
Es gibt zudem Muster, die man sich merken kann: Häufig kommt es zu frühzeitigen Zahnextraktionen bereits im dritten/vierten Lebensjahrzehnt; überproportional betroffen sind dabei unter anderem die Unterkiefer-Front sowie die Molaren (teils mit verkürzter Wurzellänge). Begünstigende Faktoren wie ein Vitamin-D-Mangel oder ein erhöhter BMI können die parodontalen Befunde zusätzlich verschärfen; in unseren Daten zeigen Patientinnen und Patienten mit Vitamin-D-Mangel beispielsweise signifikant häufiger Sondierungstiefen > 4 mm und > 6 mm, mehr Stellen mit erhöhtem Attachmentverlust sowie häufiger eine Parodontitis Stadium III oder Stadium IV.
Gibt es typische Befunde an den Zahnhartsubstanzen oder am Zement/Parodont – und wie relevant ist das diagnostisch?
Beikler: Ja, die gibt es – und diagnostisch ist das sehr wertvoll, weil es erklärt, warum die klinischen Befunde oft nicht zur Entzündungslogik passen. An den Zahnhartsubstanzen sieht man häufig eine Hypomineralisation des Schmelzes, teils mit hypoplastischen Schmelzformen. Klinisch auffällig ist auch eine deutlich erhöhte Schmelz-Transluzenz, was dazu führt, dass die Zähne dunkler aussehen. Seltener ist auch das Dentin betroffen: Es kann hypomineralisiert sein, oft mit vergrößerten Pulpakammern.
Besonders charakteristisch sind Veränderungen am Wurzelzement: Häufig finden sich zementarme oder zementfreie Wurzeloberflächen, histologisch nicht selten eine ausgeprägte Hypoplasie bis Aplasie des azellulären Zements. Dadurch können die Sharpey-Fasern nicht ausreichend inserieren – die Verankerung ist strukturell geschwächt, ohne dass primär eine ausgeprägte Entzündung vorliegen muss. Auch der Alveolarknochen ist oft hypomineralisiert, was die Stabilität zusätzlich beeinträchtigen kann. In der Praxis ist diese Konstellation insbesondere dann diagnostisch wegweisend, wenn sie mit frühem Zahnverlust beziehungsweise auffälliger Lockerung einhergeht.
Wie grenzen Sie Hypophosphatasie oral am ehesten gegen MIH, Amelogenesis imperfecta, eine aggressive Parodontitis oder Papillon-Lefèvre ab?
Beikler: Eine saubere Abgrenzung gelingt am besten über die Gesamtschau: Es zählen nicht nur die rein oralen Befunde, sondern immer auch die allgemeinmedizinische Anamnese (vor allem Skelettsymptome/Frakturen). Differenzialdiagnostisch gilt zunächst: MIH und Amelogenesis imperfecta betreffen primär den Schmelz. Bei Hypophosphatasie stehen dagegen typischerweise nicht nur Schmelzveränderungen, sondern auch Zement- und Dentinveränderungen sowie die parodontale/strukturelle Instabilität im Vordergrund.
Gegenüber einer rasch progredienten Parodontitis (Grad C) oder dem Papillon-Lefèvre-Syndrom ist entscheidend, dass diese Krankheitsbilder meist durch eine ausgeprägte Entzündung und Plaque sowie tiefgreifende Attachmentverluste geprägt sind. Bei Hypophosphatasie sind diese Entzündungszeichen häufig nicht proportional zu dem, was man klinisch an Lockerung und Attachmentverlust sieht. Der wichtigste praktische Marker ist daher: atraumatischer Zahnverlust beziehungsweise ausgeprägte Zahnlockerung bei primär wenig Entzündung – häufig schon im Milchgebiss – in Kombination mit muskuloskelettalen Beschwerden, Stressfrakturen oder einer entsprechenden Familienanamnese.
Welche radiologischen Zeichen könnten auf Hypophosphatasie hinweisen?
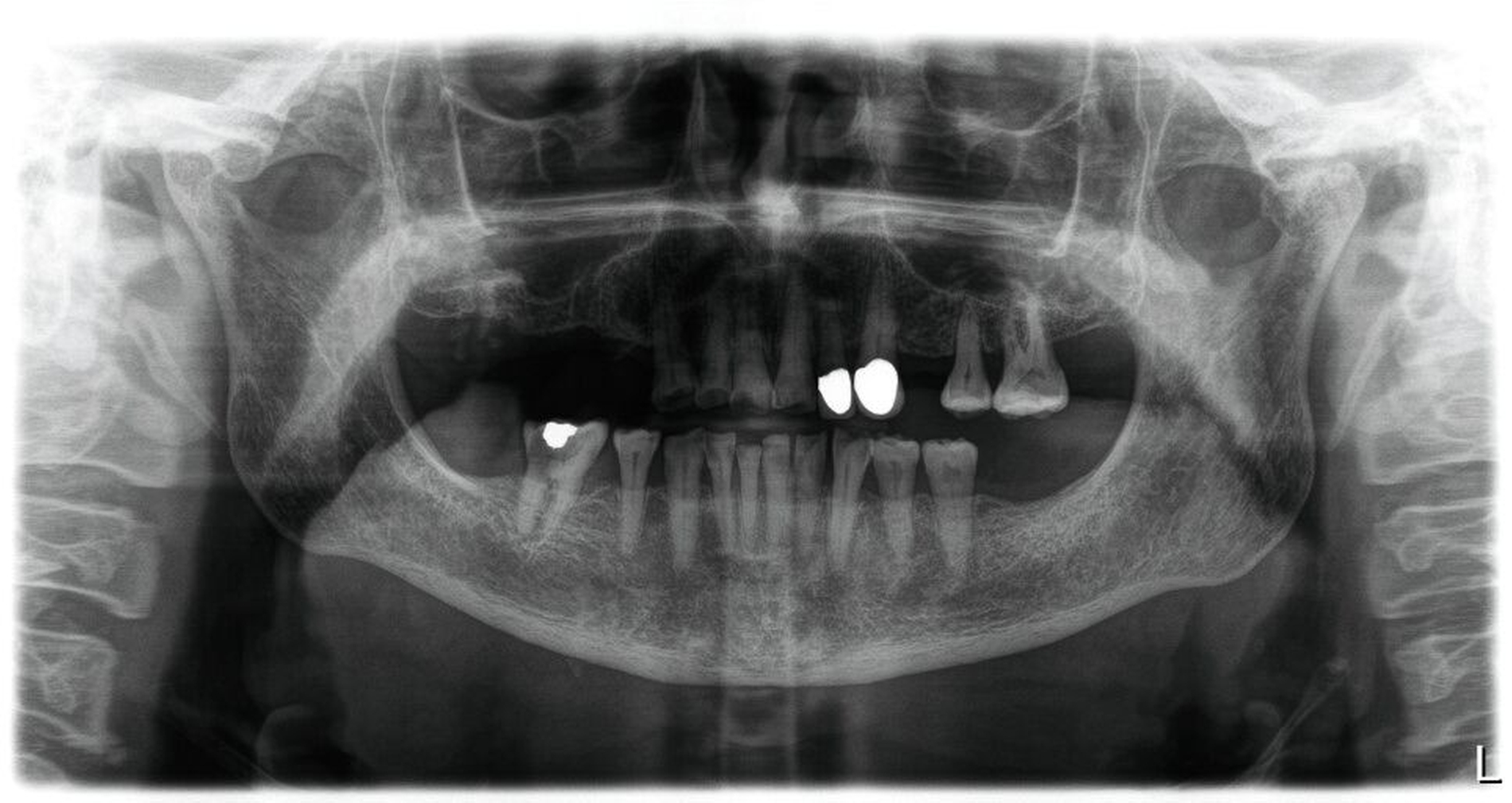
Beikler: Typisch sind häufig eine reduzierte Alveolarknochenhöhe und vor allem eine verminderte Alveolarknochendichte. In unseren eigenen zahnmedizinischen Analysen zeigten Hypophosphatasie-Patientinnen und -Patienten zudem niedrigere Mineralisationsgrade des Alveolarknochens im Vergleich zu Kontrollen, was diese radiologischen Eindrücke stützt. Zusätzlich kann die Lamina dura ausgedünnt, unklar oder insgesamt weniger eindeutig abgrenzbar erscheinen.
Auf Zahnebene können – teils im Zusammenhang mit Dentinmineralisationsstörungen – vergrößerte Pulpenkammern und Wurzelkanäle auffallen, bis hin zum Bild von „Shell teeth“. Zudem werden verkürzte und teils atypisch geformte Wurzeln beschrieben. Insgesamt sind all das Zeichen einer Hypomineralisation, die sich radiologisch sowohl am Knochen als auch an den Zahnhartsubstanzen zeigen kann. Wichtig ist die Einordnung: Diese bildgebenden Befunde sind für sich genommen nicht pathognomonisch, werden in Kombination mit der Klinik aber hochgradig wegweisend.
Welche Hinweise über die Mundhöhle hinaus sollten Zahnärztinnen und Zahnärzte bei einem Hypophosphatasie-Verdacht aktiv erfragen – und bei welchen Symptomkombinationen gehört Hypophosphatasie sofort ganz nach oben bei der Differenzialdiagnose?
Barvencik:Genau das ist in der Praxis oft der Punkt, an dem aus einem „komischen“ dentalen Befund ein stimmiges Gesamtbild wird: Außerhalb der Mundhöhle sollte man gezielt nach rezidivierenden oder schwer erklärbaren oder schlecht heilenden Frakturen, Pseudofrakturen oder Stressfrakturen (zum Beispiel am Fuß) fragen. Häufig berichten Betroffene außerdem über langanhaltende Knochen- und Muskelschmerzen, Gelenkschmerzen und eine chronische Fatigue; ergänzende Hinweise können eine Nephrokalzinose oder Nierensteine sein. Ebenfalls wichtig ist eine auffällige Familienanamnese (ähnliche Beschwerden, Frakturen, auffälliger Zahnstatus).
Wichtig ist die Einordnung: Muskuloskelettale Beschwerden sind häufig. Rückenschmerzen allein sind allerdings kein Grund, direkt an Hypophosphatasie zu denken. Wenn aber zu diesen anamnestischen Hinweisen typische dentale Auffälligkeiten kommen, die entzündlich nicht schlüssig sind (Lockerung/Zahnverlust bei wenig Plaque/Entzündung) erhöht dieses Gesamtbild die Vortestwahrscheinlichkeit deutlich und sollte die Abklärung in Richtung Hypophosphatasie auslösen.
Wie sieht Ihr bevorzugter Diagnose- und Überweisungspfad aus: Wohin zuerst, welche Dringlichkeit, welche Disziplinen?
Barvencik: Erste Adresse ist in der Regel der Hausarzt, bei Kindern der Kinderarzt. Wenn sich ein Verdacht ergibt, sollte zeitnah die Überweisung an ein spezialisiertes osteologisches Zentrum erfolgen, das mit der weiterführenden Diagnostik und Einordnung vertraut ist.
Parallel dazu halte ich eine strukturierte zahnmedizinische Befunderhebung in einer spezialisierten Poliklinik für sinnvoll, um die oralen Manifestationen sauber zu dokumentieren und einzuordnen – gerade, weil die Zahnmedizin die Erkrankung in vielen Fällen überhaupt erst „sichtbar“ macht. In unserem Verbund wurden die zahnmedizinischen Analysen zu den oralen Manifestationen und zur Wirkung der Enzymersatztherapie unter Leitung von Prof. Dr. Dr. Thomas Beikler in der Poliklinik für Parodontologie, Präventive Zahnmedizin und Zahnerhaltung am Universitätsklinikum Hamburg-Eppendorf durchgeführt. Eine solche interdisziplinäre Struktur ist aus meiner Sicht das ideale Setting, weil so Befunde schneller zusammengeführt werden und keine Disziplin „allein“ im Blindflug bleibt.
Welche Laborparameter sind beim HPP-Verdacht zentral – und wann empfehlen Sie eine genetische Diagnostik?
Barvencik: Zentral ist die Serum-ALP (alkalische Phosphatase), wichtig ist dabei die alters- und geschlechtskorrigierte Interpretation. Eine erniedrigte ALP ist ein starkes Signal, die Abklärung konsequent weiterzuführen.
Ergänzend empfehle ich PLP als Vitamin-B6-Metabolit und gegebenenfalls auch Phosphoethanolamin (PEA) zu bestimmen. Typischerweise findet sich die Konstellation „niedrige ALP bei erhöhtem PLP“, bei der Interpretation muss man aber berücksichtigen, ob die Patientin oder der Patient Vitamin-B6- oder Multivitaminpräparate einnimmt, da dies den PLP-Wert künstlich erhöhen kann.
Eine genetische Diagnostik (Testung des ALPL-Gens) empfehle ich, wenn Laborkonstellation (insbesondere erniedrigte ALP, häufig kombiniert mit erhöhtem PLP) und typische Klinik zusammenpassen – idealerweise in einem spezialisierten Zentrum, um Diagnose, Prognose und Therapieoptionen fundiert beurteilen zu können.
Herr Dr. Dudde, was können Zahnärztinnen und Zahnärzte bis zur Abklärung sinnvoll tun, was sollten sie vermeiden?
Dr. Florian Dudde: Bis zur gesicherten Diagnose ist vor allem ein konsequentes, vorsichtiges Vorgehen sinnvoll. Dazu gehören engmaschige Verlaufskontrollen und eine starke präventive Strategie, weil die Zahnhartsubstanzen häufig hypomineralisiert sind: Fluoridierung, Fissurenversiegelungen und regelmäßige professionelle Zahnreinigung. Parallel sollte man frühzeitig parodontal unterstützend arbeiten.
Sehr wichtig ist außerdem die saubere Dokumentation: Zahnverluste und orale Befunde sollten zeitnah mit Fotos und Röntgenbildern festgehalten werden. Und bei Verdacht sollte frühzeitig an eine interdisziplinäre Abklärung gedacht werden – idealerweise über Einrichtungen mit osteologischer und zahnmedizinischer Expertise, häufig an Universitätskliniken.
Vermeiden sollte man vor allem vorschnelle irreversible Maßnahmen, bevor die systemische Situation geklärt ist – also keine reflexhaften größeren Sanierungen, insbesondere keine umfangreichen Extraktionskonzepte und keine vorschnellen implantologischen Versorgungen. Wenn der Verdacht im Raum steht, gilt: erst diagnostisch sauber abklären, dann planen.
Welche Rolle spielt die Enzymersatztherapie – und was ändert sich dadurch an der oralen Situation?
Barvencik: Die Enzymersatztherapie (ERT) mit Asfotase alfa ist ein zentraler therapeutischer Baustein bei schwerer Hypophosphatasie mit pädiatrischem Krankheitsbeginn – sie wird klinisch insbesondere bei schwer betroffenen Kindern eingesetzt. Ihre Hauptindikation ist die Behandlung der lebensbedrohlichen systemischen Manifestationen, vor allem der schweren Skelettbeteiligung: Viele dieser Kinder haben einen sehr weichen Thorax mit teils massiven Atemproblemen und Beatmungspflicht. Seit Einführung der Therapie war das ein echter Game Changer, der die Überlebenswahrscheinlichkeit deutlich verbessert hat.
Auch oral kann sich unter ERT etwas verändern – insbesondere bei frühem Therapiebeginn: Die Therapie kann den vorzeitigen Zahnverlust reduzieren und einzelne Hinweise sprechen für eine verbesserte Mineralisation von Zahnhartsubstanzen und Alveolarknochen sowie für eine geringere Zahnbeweglichkeit. In Auswertungen internationaler Daten zeigen sich dabei deutlich reduzierte Zahnverlustraten unter ERT sowie entsprechende Verbesserungen bei den Mineralisationsparametern. Gleichzeitig muss man realistisch bleiben: Eine vollständige Normalisierung des Zahnhalteapparats gelingt auch unter ERT nicht.
Und es gilt klar: Das ist kein Medikament, das man gibt, um die Zähne „schick zu machen“; ein möglicher Benefit für die orale Gesundheit ist eher ein Nebeneffekt. Hauptgrund für die Gabe bleibt die Behandlung der lebensbedrohlichen systemischen Auswirkungen.
Welche Therapien stehen für Erwachsene mit Hypophosphatasie zur Verfügung?
Barvencik: Für Erwachsene mit Hypophosphatasie stehen aktuell vor allem symptomatische und unterstützende Therapien im Vordergrund: Dazu gehören eine physiotherapeutische Betreuung (Schmerz, Funktion, Muskulatur) und eine osteologische Mitbetreuung durch spezialisierte Expertinnen und Experten. Dort gibt es Möglichkeiten, Knochenprobleme gezielt zu managen und Komplikationen zu vermeiden – medikamentös aber eben sehr bedacht und individuell, weil manche Standardtherapien bei Hypophosphatasie problematisch sein können. Insbesondere antiresorptive Osteoporose-Therapien sollten bei Verdacht kritisch geprüft werden. Gleichzeitig besteht Hoffnung, dass in den nächsten Jahren weitere Therapieoptionen auch für mildere erwachsene Verläufe verfügbar werden.
Herr Dr. Dudde, worauf müssen Zahnärztinnen und Zahnärzte bei Extraktionen, chirurgischen Eingriffen, Implantologie oder KFO achten?
Dudde: Bei Hypophosphatasie ist die Knochenqualität verändert und die Frakturgefahr erhöht. Das gilt prinzipiell für den ganzen Körper und ist damit auch relevant für den Kiefer-/Gesichtsbereich. Heilungsprozesse können potenziell verzögert ablaufen. Deshalb sollten invasiv-chirurgische Eingriffe besonders sorgfältig geplant, möglichst atraumatisch durchgeführt und idealerweise interdisziplinär abgestimmt werden. Bei Unsicherheit gilt eher: lieber frühzeitig an spezialisierte Strukturen überweisen.
Bei Implantaten ist die Datenlage bei Hypophosphatasie aktuell sehr begrenzt, sodass belastbare, allgemeingültige Aussagen schwierig sind. Daraus folgt eine zurückhaltende Indikationsstellung und – wenn überhaupt – ein Vorgehen mit engmaschiger Nachsorge. In der KFO muss man sich bewusst sein, dass Wurzeln und Parodont bei Hypophosphatasie strukturell vulnerabel sind. Da die Zahnverankerung ohnehin durch die gestörte Mineralisation (insbesondere des Zements) kompromittiert sein kann, können starke kieferorthopädische Kräfte die parodontale Instabilität aggravieren und im ungünstigsten Fall sogar einen Zahnverlust begünstigen. Praktisch heißt das: sanfte Kräfte, längere Intervalle und eine besonders sorgfältige parodontale Begleitdiagnostik sowie engmaschige Betreuung im Gesamtkonzept.
Was ist die wichtigste Take-home-message für Zahnärzte – und was müsste sich im Praxisalltag ändern, damit Hypophosphatasie früher erkannt wird?
Dudde: Der wichtigste Hebel ist ein geschärftes Bewusstsein, dass orale Befunde Hinweise auf systemische Stoffwechselerkrankungen geben können. Dafür braucht es in der Praxis wenige einfache Routinen: bei unplausiblen Verläufen differenzialdiagnostisch konsequent „Systemerkrankung“ mitdenken, eine kurze, strukturierte Anamnese mit Blick auf Fraktur-/Schmerz- und Familienhinweise erheben, Befunde sauber dokumentieren und bei Verdacht frühzeitig interdisziplinär in die passende Abklärung überführen. Wenn diese Mini-Routinen breiter etabliert sind, stehen die Chancen gut, dass Hypophosphatasie deutlich häufiger und früher erkannt wird.
Das Gespräch führte Dr. Nikola Lippe.




 169
169



