So verändert sich das Zahnfleischgewebe bei einer Parodontitis
Die Forschungsarbeit wurde von Vitor CM Neves – Oberarzt an der Universität Sheffield sowie Honorary Consultant für Parodontologie, Translationale und Regenerative Zahnmedizin am Sheffield Teaching Hospitals NHS Foundation Trust – in Zusammenarbeit mit Wental Zhu vom Karolinska-Institut und Cheng Zhang vom King’s College London geleitet und vom National Institute for Health and Care Excellence, der Academy of Medical Sciences, und dem National Academic Infrastructure for Supercomputing in Schweden gefördert.
Die Transformation auf zellulärer Ebene
Um die Entstehung von Krankheiten zu verstehen, untersuchten die Forscher die biologischen Veränderungen, die beim Übergang von gesundem zu krankem Gewebe auftreten. Dabei konzentrierten sie sich auf das Parodontium, das Zahnhaltegewebe, einschließlich Zahnfleisch und Bänder. Bei einer Parodontitis entzünden sich diese Gewebe und bilden Narbengewebe, was zu Knochenabbau und letztendlich zu Zahnverlust führt. Trotz der weltweiten Auswirkungen dieser Erkrankung ist bisher wenig darüber bekannt, wie diese Transformation auf zellulärer Ebene abläuft.
Zum Studiendesign
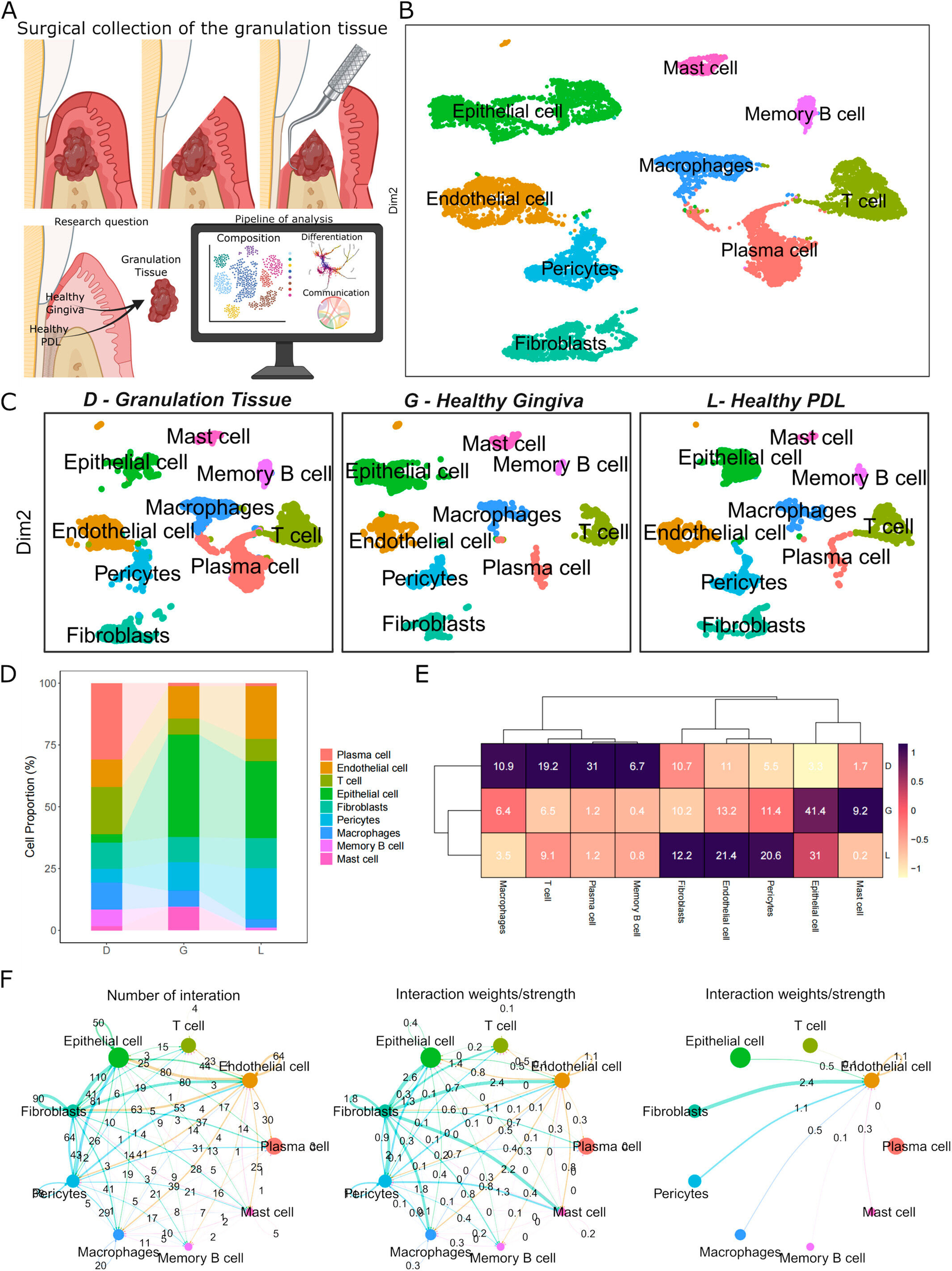
Für die Studie wurden Granulationsgewebeproben von drei Patienten entnommen, die sich einer Parodontaloperation unterzogen hatten. Das frische Gewebe wurde zu Einzelzellsuspensionen verarbeitet und mittels scRNA-Sequenzierung analysiert. Die Daten wurden integriert und mit bestehenden Datensätzen von gesundem Zahnfleisch und Parodontalligament verglichen. Die durchgeführten computergestützten Analysen wurden via Immunfluoreszenzfärbung validiert. In den Proben wurden zehn verschiedene Zellcluster identifiziert. Granulationsgewebe wies im Vergleich zu gesundem Gewebe eine höhere Dichte an Immunzellen auf. Eine neuartige, ausschließlich im Granulationsgewebe vorkommende Endothelzell-Subpopulation wurde entdeckt und durch NOTCH3-Expression sowie Beteiligung an Ossifikationsprozessen charakterisiert. Darüber hinaus zeigten Fibroblasten-Subpopulationen des Granulationsgewebes einen progenitorähnlichen Zustand, der durch eine Reorganisation der extrazellulären Matrix und eine geringe Differenzierung gekennzeichnet ist, ähnlich wie bei tumorassoziierten Fibroblasten.
Mithilfe der sogenannten Einzelzell-RNA-Sequenzierung (scRNA-seq) konnten die Wissenschaftler jede einzelne Zelle eines Gewebes kartieren und die darin aktivierten Gene identifizieren. Im Unterschied zu herkömmlichen Methoden, die Signale über viele Zellen mitteln, zeigt scRNA-seq, wie sich verschiedene Zellen im gesunden und kranken Zustand verhalten und liefert so ein detailliertes Bild davon, wie sich das Zahnfleischgewebe bei der Entstehung einer Parodontitis verändert.
Eine hochauflösende Zellkarte der Parodontitis
So entstand eine hochauflösende Zellkarte der Zahnfleischerkrankung. Die Ergebnisse zeigen, dass das Zahnfleisch die größte Anzahl an Zellen in einem Zwischenzustand zwischen gesundem Gewebe und erkranktem Granulationsgewebe aufweist. „Dies deutet darauf hin, dass die gezielte Behandlung spezifischer Zahnfleischzellpopulationen dazu beitragen könnte, das Fortschreiten der Erkrankung zu verlangsamen oder zu verhindern“ erläutern die Autorinnen und Autoren.
Das Team identifizierte zudem eine bisher unbekannte Population vaskulärer Stammzellen, die durch das Gen NOTCH3 markiert ist und ausschließlich in erkranktem Gewebe vorkommt. Diese Zellen scheinen zu versuchen, Knochen in Bereichen zu regenerieren, in denen dieser verloren gegangen ist. Die Studie legt jedoch nahe, dass Fibroblasten, Zellen, die normalerweise an der Gewebereparatur beteiligt sind, diesen Regenerationsprozess stören und die Heilungsreaktionen in Richtung der Bildung von erkranktem Gewebe anstatt von Knochen lenken könnten.
„Unsere Ergebnisse verdeutlichen, wie komplex erkranktes Zahnfleischgewebe tatsächlich ist“, resümiert Vitor. "Einige Zellen scheinen die Regeneration zu fördern, während andere sie aktiv behindern. Dieses Verständnis auf Einzelzellebene eröffnet uns neue Möglichkeiten, Therapien zu entwickeln, die die Heilung unterstützen, anstatt nur die Symptome zu lindern.“
Einige Zellen fördern die Regeneration, andere behindern sie aktiv
Die Daten zeigen, dass dieses Gewebe eine komplexe Mikroumgebung aufweist, die sowohl Zellpopulationen enthält, die die Heilung behindern können, als auch solche, die die Regeneration fördern. „Aktuelle Parodontitistherapien zielen nicht spezifisch auf diese Zellen oder die in der Studie identifizierten biologischen Signalwege ab. Dies verdeutlicht die Möglichkeit, neue Behandlungsansätze zu entwickeln, die die körpereigene Reaktion auf die Erkrankung besser modulieren“, bilanzieren die Forschenden.
„Die Ergebnisse tragen zu einem besseren Verständnis der Granulationsgewebsbildung bei Parodontitis bei und liefern Informationen für die Entwicklung von Materialien zur Modulation spezifischer zellulärer Signalwege, um die Behandlung von Parodontitis zu verbessern“, lautet ihr Fazit.
Zhu, W., K. Fung, P. Dhami, et al. 2026. “Characterising the Periodontal Granulation Tissue Using scRNAseq.” Journal of Clinical Periodontology 53, no. 2: 308–320. https://doi.org/10.1111/jcpe.70048.

 169
169
 169
169

