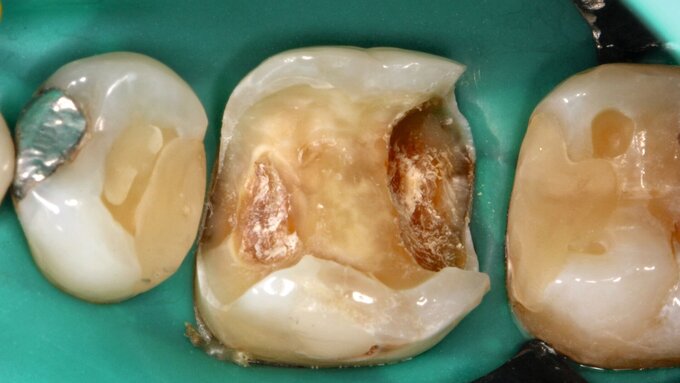
Therapie der Wurzelkaries
Voraussetzung für Wurzelkaries ist – wie der Begriff bereits andeutet – die Exposition von Wurzeloberflächen gegenüber einem kariogenen Milieu. Wegbereiter dazu sind Parodontalerkrankungen, die mit Attachmentverlusten einhergehen. Daten der aktuellen Mundgesundheitsstudie (DMS • 6) zeigen, dass etwa ein Viertel der 35- bis 44-Jährigen und zwei Drittel der 65- bis 74-Jährigen Attachmentverluste von 5 mm und mehr aufweisen [Eickholz et al., 2025].
Attachmentverlust ist mit der Vergrößerung der klinischen Interdentalräume verbunden, was zu vermehrter Retention von (kariogenen) Speiseresten führt und die Plaqueentfernung wie auch die Diagnostik erschwert. Gleichzeitig nimmt mit dem Anstieg der Parodontitisprävalenz der Pro-Kopf-Verbrauch von Medikamenten deutlich zu, darunter auch von solchen, die die Speichelsekretion und damit viele wichtige Schutzfunktionen in der Mundhöhle beeinflussen können [AOK, 2023].
Prof. Dr. Carolina Ganẞ
Poliklinik für Zahnerhaltungskunde, Sektion Kariologie,
Medizinisches Zentrum für
Zahn-, Mund- und Kieferheilkunde, Philipps-Universität Marburg und Universitätsklinikum Gießen und Marburg
Georg-Voigt-Str. 3,
35039 Marburg
ganss@staff.uni-marburg.de
1982–1987: Studium der Zahnmedizin an der Philipps-Universität Marburg
1988–1992: Wissenschaftliche Mitarbeiterin, Abteilung für Zahnerhaltungskunde, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde, Philipps-Universität Marburg
1992: Promotion, Philipps-Universität Marburg
1992–2022: Oberärztin,
Poliklinik für Zahnerhaltungskunde und Präventive Zahnheilkunde, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde, Justus-Liebig-Universität Gießen2003: Habilitation, Justus-Liebig-Universität Gießen
2008: apl. Professur, Justus-Liebig-Universität Gießen
seit 2022: Leitung Sektion Kariologie, Poliklinik für Zahnerhaltung, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde der Philipps-Universität Marburg
seit 2022: Professur Kariologie des Alterns, Philipps-Universität Marburg
Forschungsschwerpunkte: Prävention und nicht-invasive Therapie von Zahnhartsubstanzerkrankungen, Beobachtungs- und Interventionsstudien zum Mundhygieneverhalten, Plaquemonitoring
Die Gruppe der alternden und alten Menschen ist jedoch eher heterogen, so dass das Alter in Jahren nicht mit Bedürftigkeit in Verbindung steht. So leben viele Menschen bis ins hohe Alter gesund und selbstständig, während andere bereits in früheren Phasen des Alterns erkranken und Unterstützung benötigen.
Das alles bedeutet, dass die Therapieentscheidung bei Wurzelkaries von vielen Faktoren beeinflusst wird und komplexer Überlegungen bedarf. Das betrifft in erster Linie die Präventionsmaßnahmen, die sich im Falle von Wurzelkaries deutlich von Maßnahmen in jüngerem Alter unterscheiden. Wesentlich ist dabei die im Vergleich zu Schmelz deutlich höhere Kariesanfälligkeit der Wurzeloberfläche bei gleichzeitig geringerer Effektivität von Fluoridierungsmaßnahmen.
Daher erlangen Mundhygieneberatung und -training sowie Ernährungsfragen einen deutlich höheren Stellenwert – zu individualisierten begleitenden Präventionsmaßnahmen haben die Autoren bereits in der zm publiziert [Ganß et al., 2023]. Im Folgenden soll der Schwerpunkt jedoch auf der Frage liegen, ob und wenn ja in welcher Form Therapiemaßnahmen bei bestehenden Läsionen der Wurzeloberfläche durchgeführt werden können.
Was unterscheidet koronale Karies von Wurzelkaries?
Bei der koronalen Karies stehen in den Anfangsstadien nicht-invasive Verfahren im Vordergrund, invasive Maßnahmen sind erst dann indiziert, wenn die Läsion das Dentin erreicht hat. In diesem Stadium ist die Progression der Läsion wahrscheinlich [Mejare et al., 2004], da die Häufigkeit von Kavitationen des approximalen Schmelzes und damit das Ausmaß der bakteriellen Besiedelung des Dentins mit der Läsionsausbreitung zunimmt [Ratledge et al., 2001]. Solche Läsionen lassen sich mit nicht-invasiven Maßnahmen nur bedingt beeinflussen und sollten daher in der Regel restaurativ versorgt werden. Bei ausgedehnteren Läsionen dient die Restauration außerdem dazu, die Restzahnhartsubstanz zu stabilisieren und die Funktionalität der Zahnkrone wieder herzustellen.
Obwohl sowohl die Wurzelkaries als auch die über das Initialstadium hinaus fortgeschrittene koronale Karies das Dentin betreffen, sind die Entstehungsbedingungen und Therapieoptionen sehr unterschiedlich. Einerseits ist die Wurzeloberfläche den kariogenen Bedingungen an der Grenzfläche zu stoffwechselaktiven Biofilmen sehr viel direkter ausgesetzt, und kariöse Läsionen sind oftmals so ungünstig lokalisiert, dass eine gute Füllungstherapie mit einem dauerhaften Verbund von Kompositen an der Zahnhartsubstanz schwierig ist. Andererseits, und das ist sehr entscheidend, ist sie aber auch sehr viel zugänglicher für nicht-invasive Therapieformen. Indikationsstellungen für die Behandlung koronaler Dentinkaries sind daher nicht einfach auf Wurzelkaries übertragbar. Während der Therapieentscheid bei koronaler Dentinkaries eher vorrangig bei der restaurativen Versorgung liegt, sollte bei Wurzelkaries die Arretierung in der Mehrzahl der Fälle die erste Option sein.
Ist die Läsion aktiv oder inaktiv? Die Beantwortung dieser Frage ist die Ausgangsbedingung für den Therapieentscheid. Wenngleich die Unterscheidung nicht immer einfach ist, ist eine weiche Textur bei Sondieren und eine deutliche Plaquebedeckung ein sicheres Zeichen für Kariesaktivität [Carvalho und Lussi, 2017]. Bei aktiven Läsionen sollten Lokalisation und Ausdehnung genau exploriert werden, was die Behandlungsoptionen wesentlich bestimmt (Abbildung 1). Bei inaktiven Läsionen ist keine restaurative Therapie erforderlich, jedoch sind risikoadaptierte Präventionsmaßnahmen angezeigt.
Wie exkavieren?
Nach der Entscheidung zur restaurativen Therapie stellt sich zunächst die Frage nach der geeigneten Zugangskavität. Im Gegensatz zu koronalen Läsionen kann für Läsionen der Wurzeloberfläche ein direkter, approximaler Zugang unter Schonung gesunder Zahnhartsubstanz gewählt werden. Eine intakte Randleiste kann somit belassen werden. Auch hier kann wie bei der Exkavation tiefreichender koronaler Karies auch bei Läsionen der Wurzel zwischen selektiver (Belassen kariösen Dentins in pulpanahen Bereichen) und konventioneller Exkavation unterschieden werden. Letztere ist bei leicht zugänglichen kleineren Läsionen, speziell im sichtbaren Bereich, angezeigt, wenn anschließend eine ästhetisch ansprechende Kompositrestauration erfolgen soll.
Liegt eine pulpanahe oder schwierig zugängliche Läsion vor, kann die selektive Exkavation erwogen werden. Zu deren Erfolgsraten gibt es allerdings keine direkte Evidenz, so dass nur Analogschlüsse aus Studien bei der Exkavation koronaler Karies möglich sind.
Eine systematische Übersichtsarbeit [Schwendicke et al., 2021] konnte nur zwei klinische Studien einschließen, die die selektive mit der konventionellen Exkavation von koronaler Karies an bleibenden Zähnen verglichen haben. Beide Verfahren zeigten dabei ähnliche Erfolgsraten (Abwesenheit von Pulpitis, Nekrosen oder periapikalen Veränderungen). Die eine Studie untersuchte 14- bis 54-Jährige über einen Zeitraum von 18 Monaten, dabei lag die Erfolgsrate bei konventioneller Exkavation bei 98,2 Prozent und bei selektiver Exkavation bei 92,5 Prozent. Die andere Studie [Orhan et al., 2010], die 4- bis 14-Jährige eingeschlossen hatte, fand dagegen nach einem Jahr für beide Verfahren eine Erfolgsrate von 100 Prozent. Ein weitergehendes Konzept ist die atraumatische restaurative Behandlung (ART), bei der Karies mit Handinstrumenten entfernt und die entstandene Kavität mit Glasionomerzement gefüllt wird. Diese Methode wurde ursprünglich für Regionen mit eingeschränktem Zugang zu zahnärztlicher Versorgung entwickelt [Frencken et al., 2012], da sie relativ einfach anzuwenden ist und keine elektrischen Geräte benötigt werden. ART wurde häufig bei älteren oder pflegebedürftigen Patienten, speziell in der aufsuchenden Versorgung sowie in der Kinderzahnheilkunde, eingesetzt, da sie eine schonendere Alternative zur konventionellen Kariesbehandlung darstellt.
Auch für die Erfolge dieser Behandlungsoption bei Wurzelkaries gibt es wenig Evidenz. Eine systematische Übersichtsarbeit konnte nur drei geeignete klinische Studien identifizieren [Göstemeyer et al., 2019]. Dabei zeigte die Exkavation mit rotierenden Instrumenten und anschließender Versorgung mit kunststoffmodifizierten Glasionomerzementen gegenüber der ART etwas bessere Resultate mit Misserfolgsraten von acht gegenüber 16 Prozent. Allerdings lagen die Nachuntersuchungszeiten nur zwischen sechs und 24 Monaten.
Welche Füllungsmaterialien?
Zur Füllungstherapie von Wurzelkaries kommen Komposite sowie verschiedene Varianten von Glasionomerzementen zur Anwendung [Burrow and Stacey, 2017]. Bislang gibt es jedoch nur wenig Evidenz zur Wahl des Füllungsmaterials bei verschiedenen klinischen Fragestellungen und zu Erfolgsraten der verschiedenen Restaurationstechniken. Hauptgründe dafür sind, dass vielfach nur einfach zugängliche Klasse-V-Läsionen untersucht wurden oder die Lokalisationen der Läsionen nicht klar beschrieben und die Nachbeobachtungszeiten kurz sind.
Eine aktuelle Übersichtsarbeit [Wen et al., 2025] hat die Erfolgsraten von Restaurationen mit verschiedenen Materialien bei Wurzelkaries und deren Einflussfaktoren untersucht, dabei wurden neun klinische Studien aus den Jahren 2005 bis 2022 einbezogen. Die Ergebnisse zeigen, dass bei Beobachtungsintervallen zwischen sechs und 24 Monaten nur geringe Unterschiede zwischen verschiedenen Glasionomeren und Kompositen bestehen.
Die Erfolgsraten lagen nach zwölf Monaten Beobachtungszeit für Komposite mit 96,3 Prozent etwas höher als für Glasionomere (86,8 Prozent) und kunststoffmodifizierte Glasionomere (87,5 Prozent). Nach 24 Monaten zeigten sich jedoch keine signifikanten Unterschiede mehr (Komposite 81,3 Prozent, Glasionomere 76,9 Prozent und kunststoffmodifizierte Glasionomere 82,4 Prozent). Weitere Faktoren wie Behandlungsbedingungen (in-office oder aufsuchend), Feuchtigkeitskontrolle (Watterollen oder zusätzliche Maßnahmen), Verwendung von Unterfüllungen oder unterschiedliche restaurative Techniken zeigten keine signifikanten Zusammenhänge mit dem Behandlungserfolg. Die häufigsten Versagensursachen waren vollständiger oder teilweiser Verlust der Restauration sowie größere Randdefekte.
Indikation zur Füllungstherapie
Insgesamt ist die Evidenz für die Therapie von Wurzelkaries sehr schwach und meist nur auf wenige Studien begründet. Zudem wird die Komplexität des klinischen Problems oft nur unzulänglich erfasst. Die Erfahrung zeigt jedoch, dass die Füllungstherapie nicht immer erfolgreich ist, daher sollte sorgfältig abgewogen werden, ob invasive Interventionen überhaupt sinnvoll erscheinen. Darüber hinaus bedeutet die restaurative Versorgung allein keine Verbesserung der Mundgesundheit alternder und alter Menschen.
Die Entscheidung zur Füllungstherapie ist bei gut zugänglichen Läsionen im sichtbaren Bereich einfach, da hier auch ästhetische Fragen eine Rolle spielen. Solche Läsionen können meist sehr leicht und mit gutem Erfolg konventionell exkaviert und mit Kompositen versorgt werden.
Bei Läsionen im nicht sichtbaren Bereich sollte jedoch immer der Versuch im Vordergrund stehen, aktive Stadien in inaktive zu überführen. Das setzt die Compliance der Patienten ebenso voraus wie die Zugänglichkeit des entsprechenden Bereichs für Mundhygienemittel. Entsprechende Maßnahmen umfassen die Glättung überhängender Schmelzränder, Verbesserung der Mundhygiene, Anwendung einer 5.000 ppm-Zahnpaste und die bestmögliche Vermeidung kariogener Lebensmittel [Ganß et al., 2023; Meyer-Lueckel et al., 2019; Paris et al., 2020]. Mitunter sind Lebensmittel, wie prozessierte Stärke, die im Bereich des koronalen Zahnanteils nicht oder nur sehr wenig kariogen sind, für die Wurzeloberfläche bei entsprechender Biofilmbedeckung bereits kariesfördernd, so dass im Rahmen der Ernährungsberatung ein besonderer Fokus auf diese Lebensmittel gelegt werden sollte. Eine weitere effektive Option ist die Verwendung von Silberdiamminfluorid (SDF).
Zur Schreibweise des SDF
In den Texten des Fortbildungsteils wird SDF (AgF(NH3)2) chemisch korrekt mit Silberdiamminfluorid ausgeschrieben. Die Benennung ergibt sich daraus, dass zwei Ammoniak-Moleküle ((NH3)2; „diammin“) das Silber-Ion als Zentralteilchen als Liganden komplexieren. Amine sind dagegen organische Verbindungen, deren funktionelle Gruppe eine Aminogruppe (-NH2) ist, beispielsweise als Aminfluorid. In den meisten Veröffentlichungen wird SDF „Silberdiaminfluorid“ (mit einem „m“) ausgeschrieben – in zahnmedizinischen Kontexten handelt es sich dabei nur um unterschiedliche Schreibweisen, gemeint ist die identische chemische Verbindung beziehungsweise das gleiche Produkt.
Sollte schließlich doch die Entscheidung für eine restaurative Versorgung fallen, kommen bei guten Behandlungsmöglichkeiten die bekannten Restaurationstechniken zur Anwendung, die sich über einfache Kompositfüllungen, wenn möglich mit Zugang von approximal, Techniken mit Boxelevation [Muscholl und Wolff, 2022] oder die Versorgung mit Kronen erstrecken.
Versorgungen mit Glasionomeren (gegebenenfalls ART) sind für die Situationen angezeigt, in denen die Behandlungsmöglichkeiten eingeschränkt sind [Paris et al., 2020]. Dies ist der Fall bei schwierig zugänglichen zirkulären Läsionen, mangelnder Feuchtigkeitskontrolle, bei gesundheitlichen Einschränkungen der Patienten und nicht zuletzt bei der aufsuchenden Behandlung. Schließlich sollte die Indikation zur Extraktion bei ausgedehnten Läsionen und sehr kompromittierten Patienten gestellt werden.
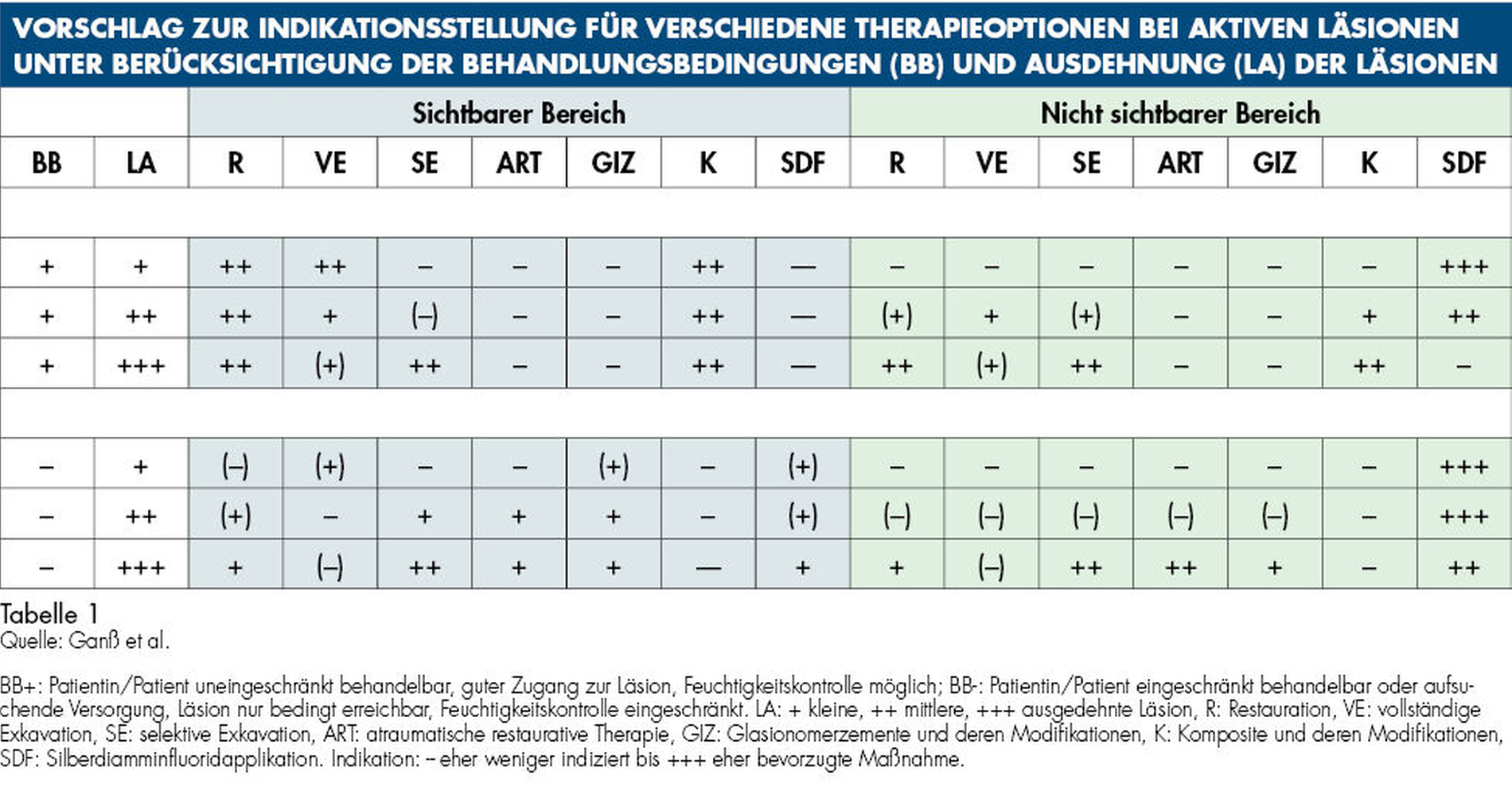
Die klinische Erfahrung zeigt, dass die restaurative Behandlung von Wurzelkaries oftmals mühsam, zeitraubend und nicht immer erfolgreich ist. SDF kann jedoch in vielen Fällen diese klinischen Herausforderungen lösen. In Tabelle 1 finden Sie einen Vorschlag zur Indikationsstellung der beschriebenen Verfahren.
Wirkung und Anwendung von SDF
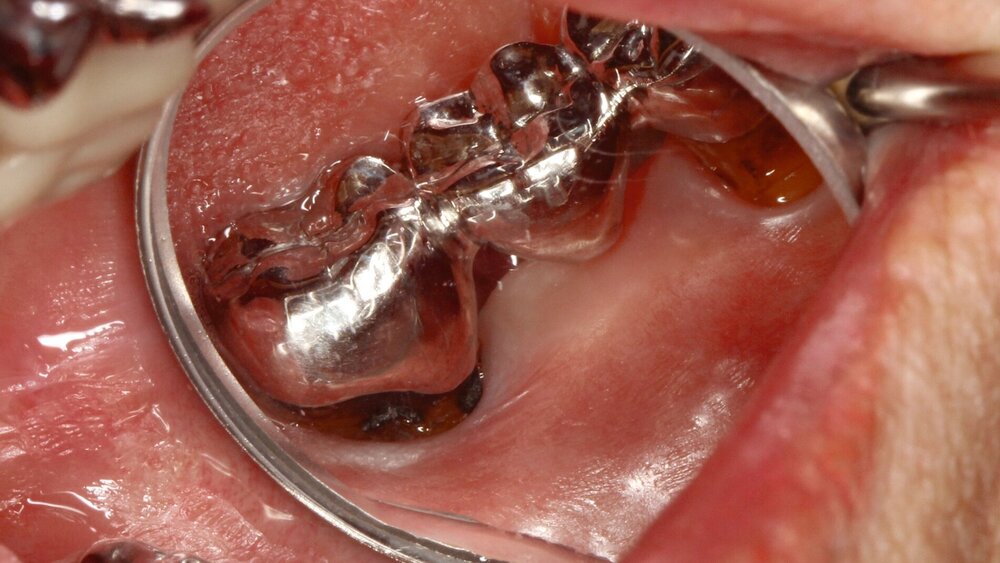
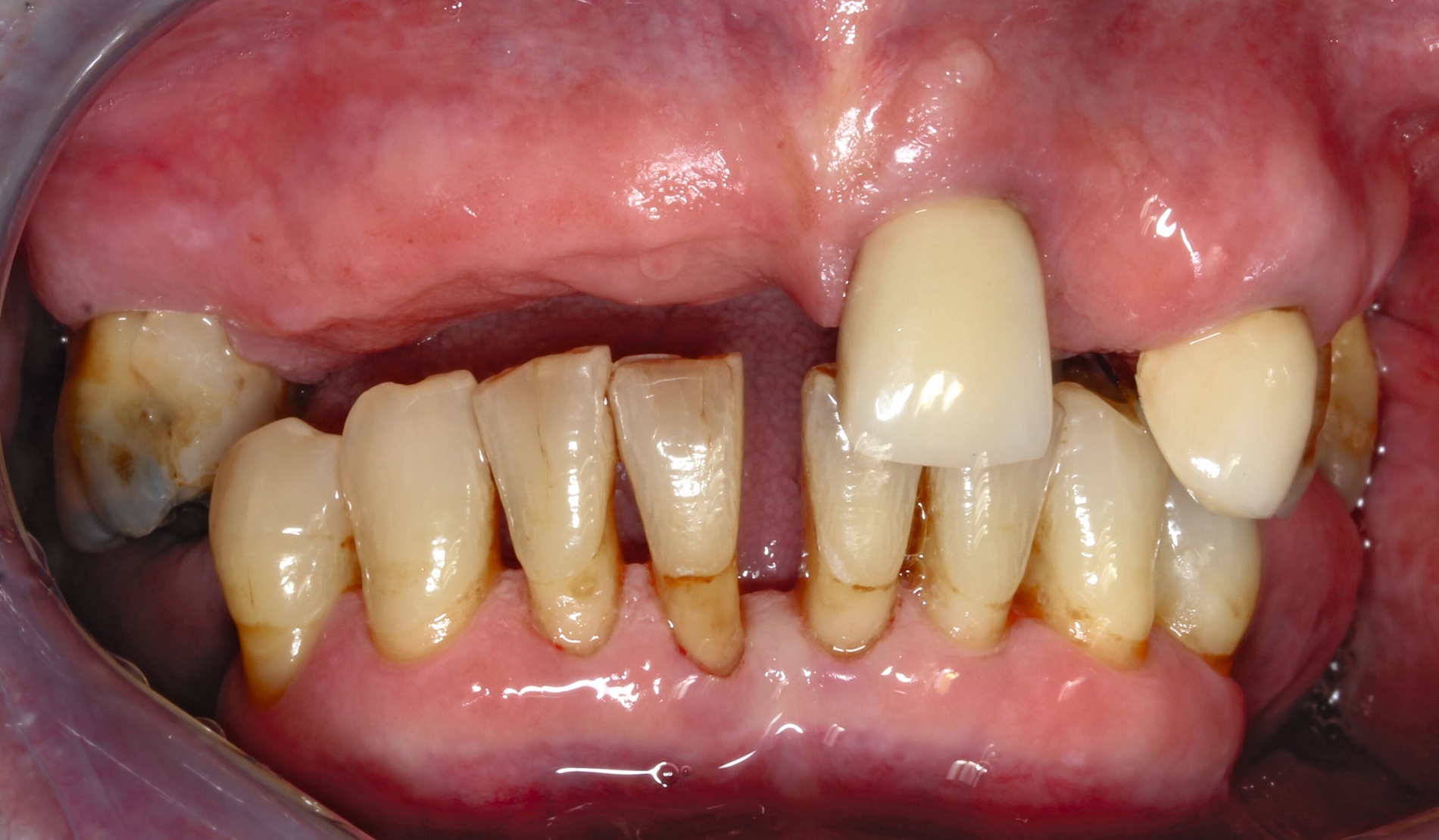
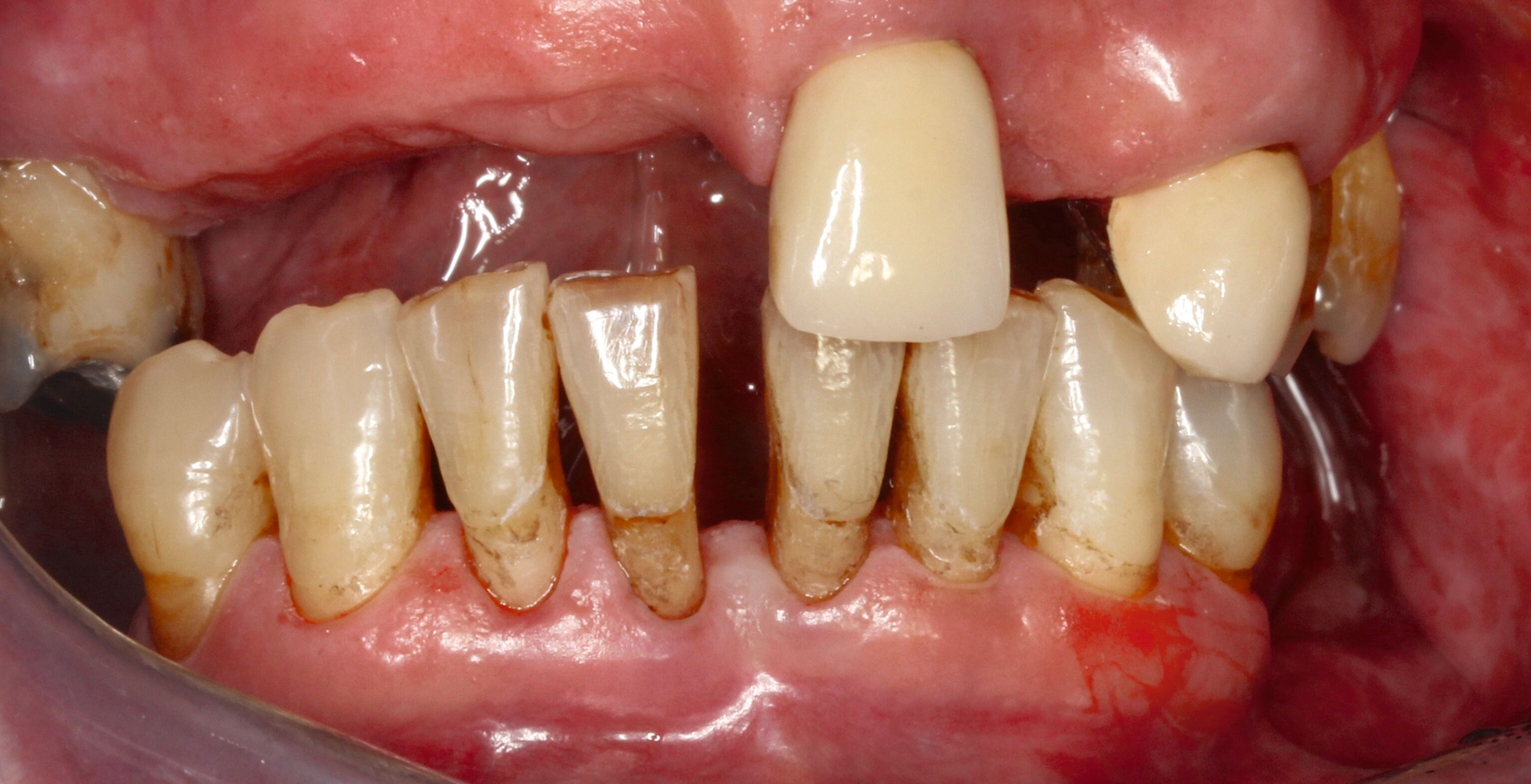
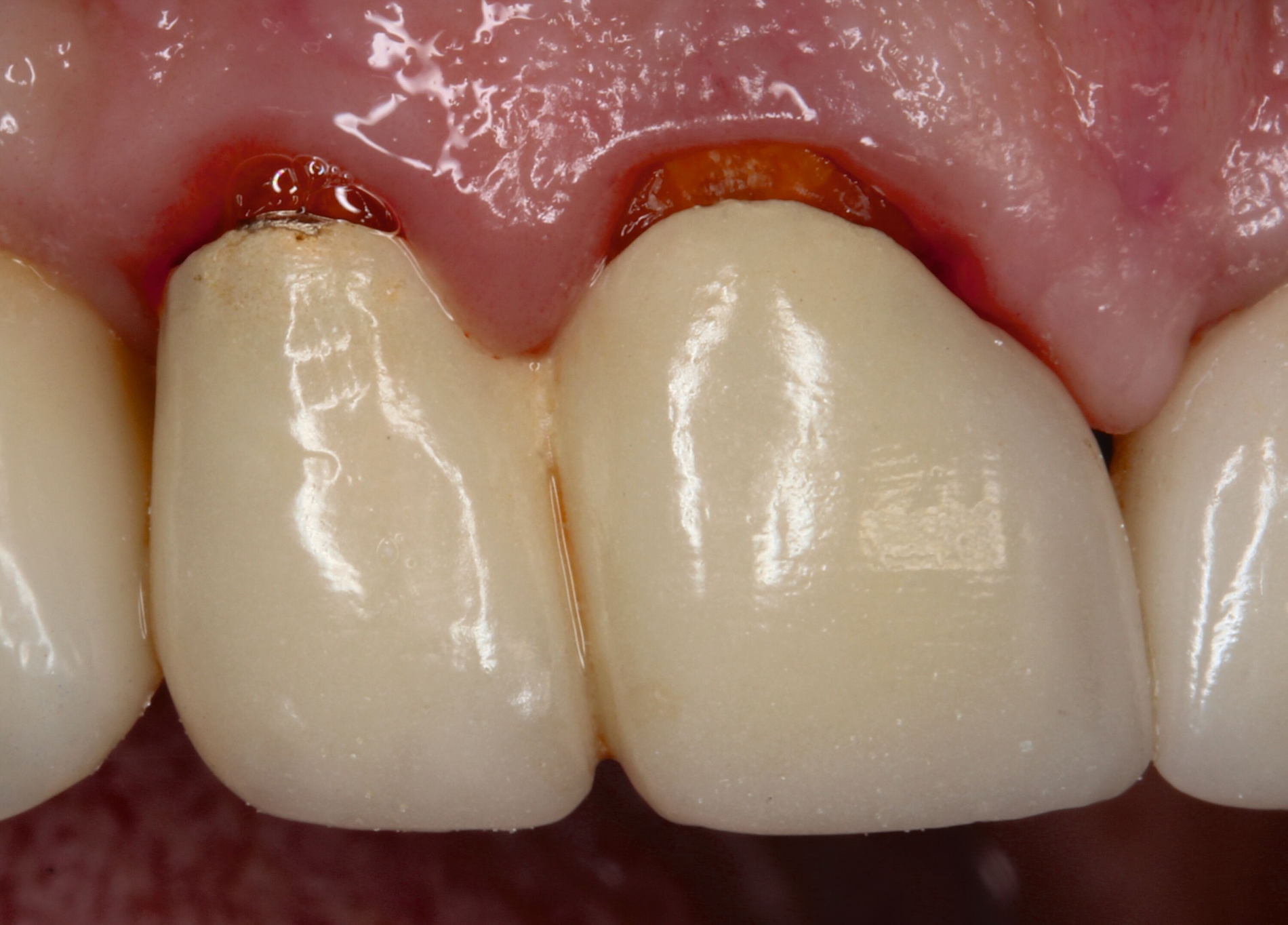
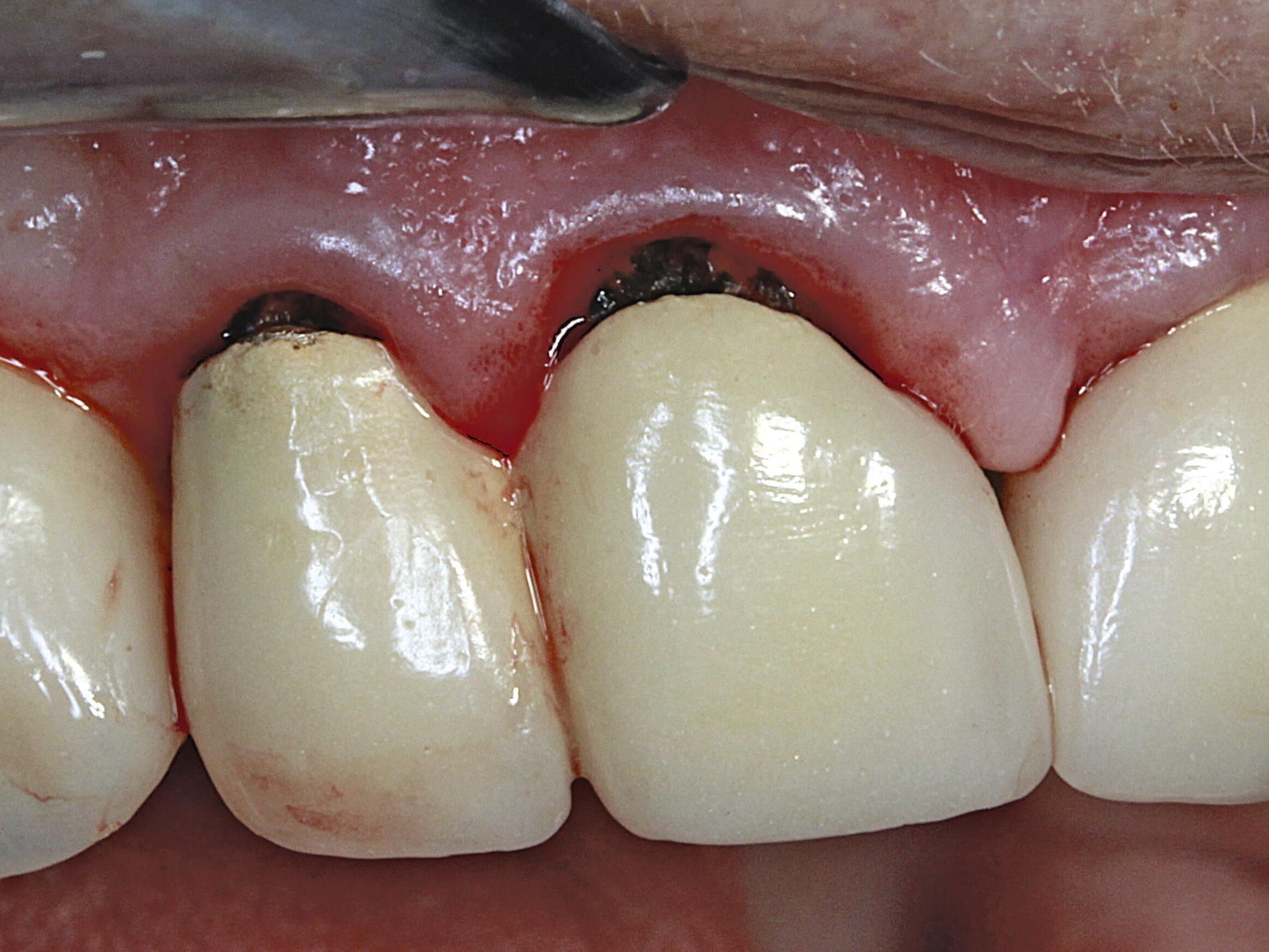
Silberdiamminfluorid ist eine wasserlösliche Verbindung, die aus Silberionen (Ag+), Ammoniak (NH₃) und Fluoridionen (F-) besteht. Ammoniak dient in dieser Verbindung als Stabilisator, indem es die Lösung alkalisch hält. Bei einer Konzentration von 38 Prozent entspricht das einer Konzentration von 44.800 ppm Fluorid und 255.000 ppm Silberionen. In seiner physikalischen Erscheinung ist SDF eine klare bis leicht gelbliche Flüssigkeit mit einem charakteristischen metallischen und leicht ammoniakartigen Geruch. Aufgrund der hohen Alkalität kann es bei Schleimhautkontakt zu leichten Reizungen kommen (Abbildung 2).
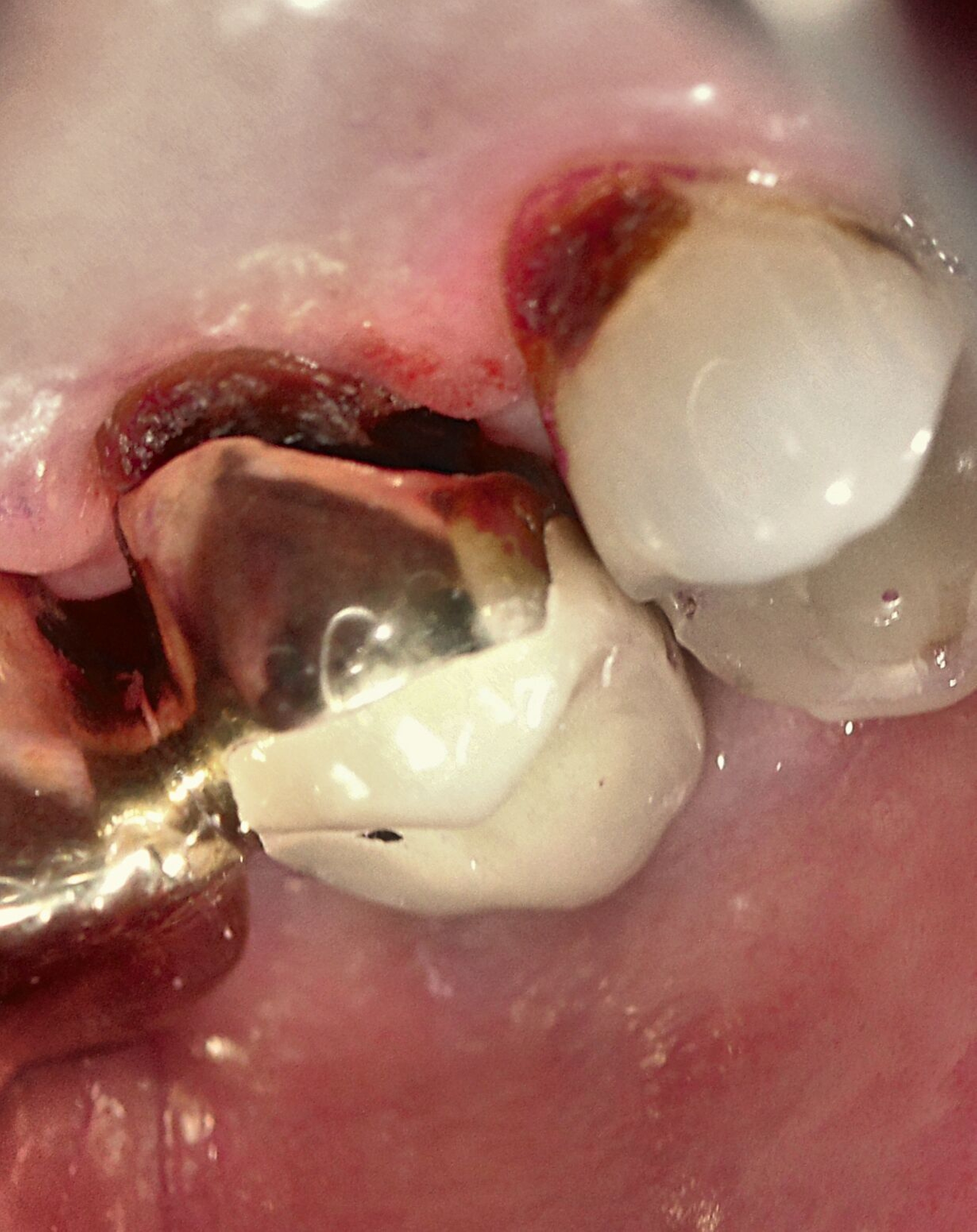
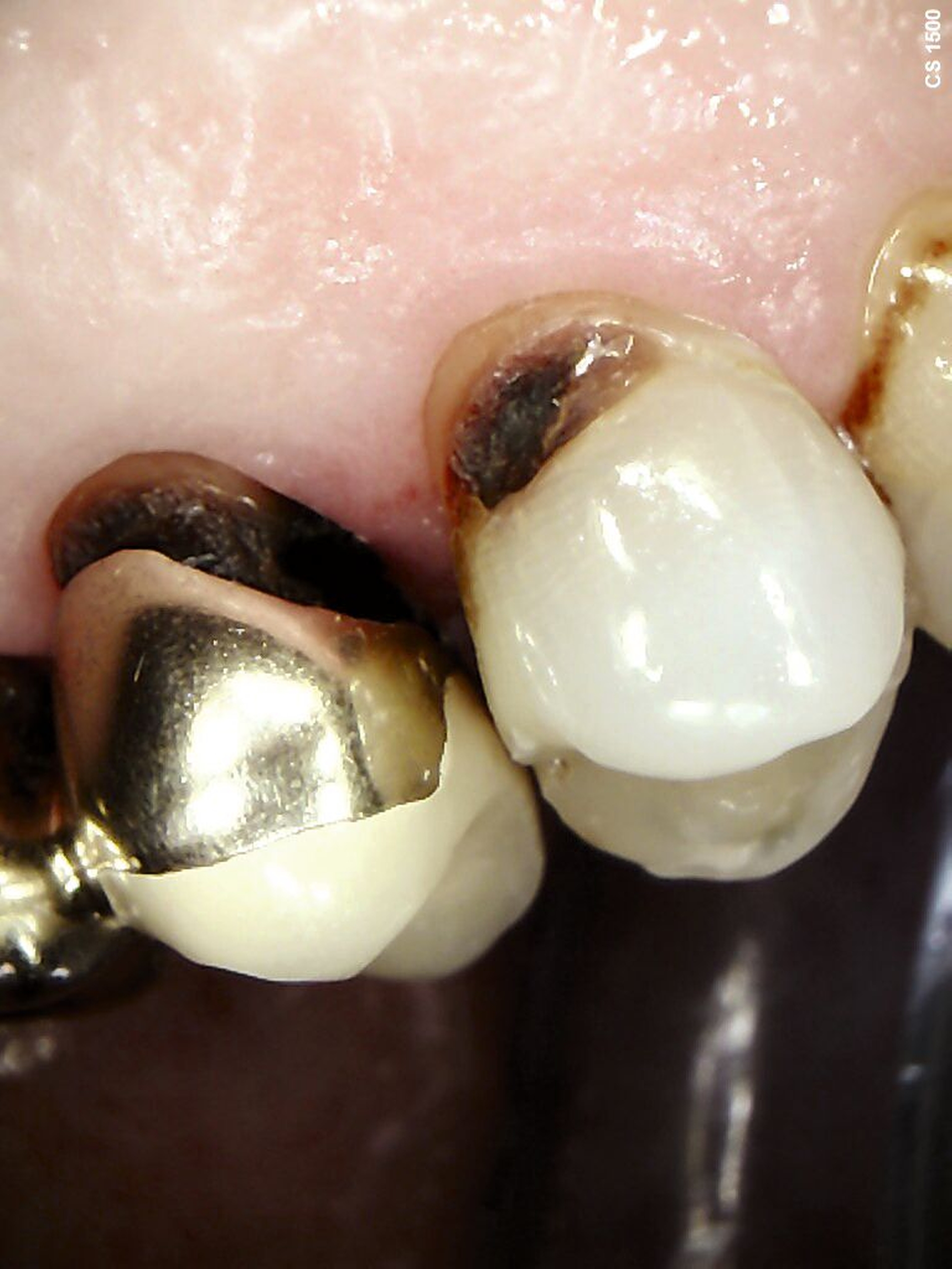
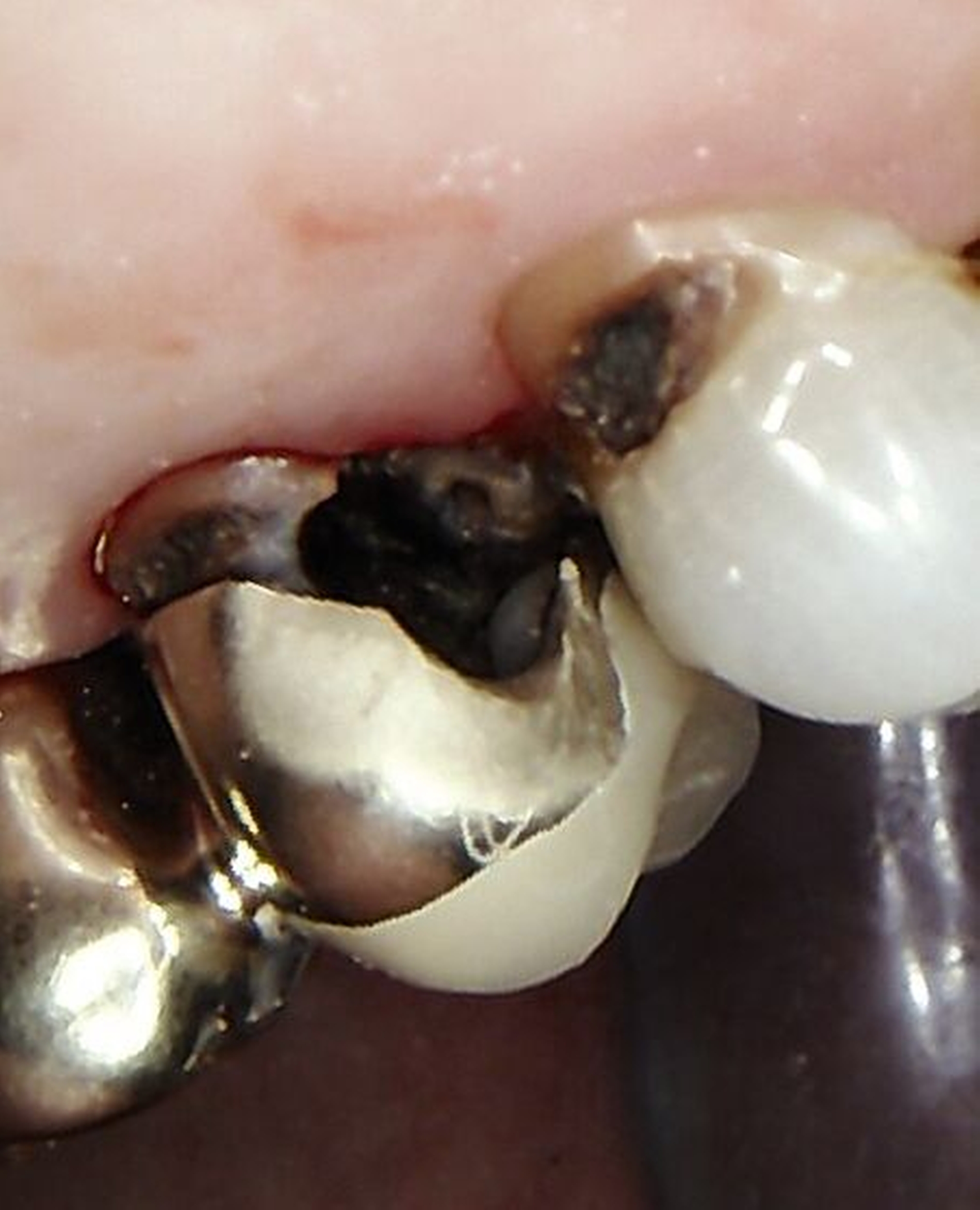
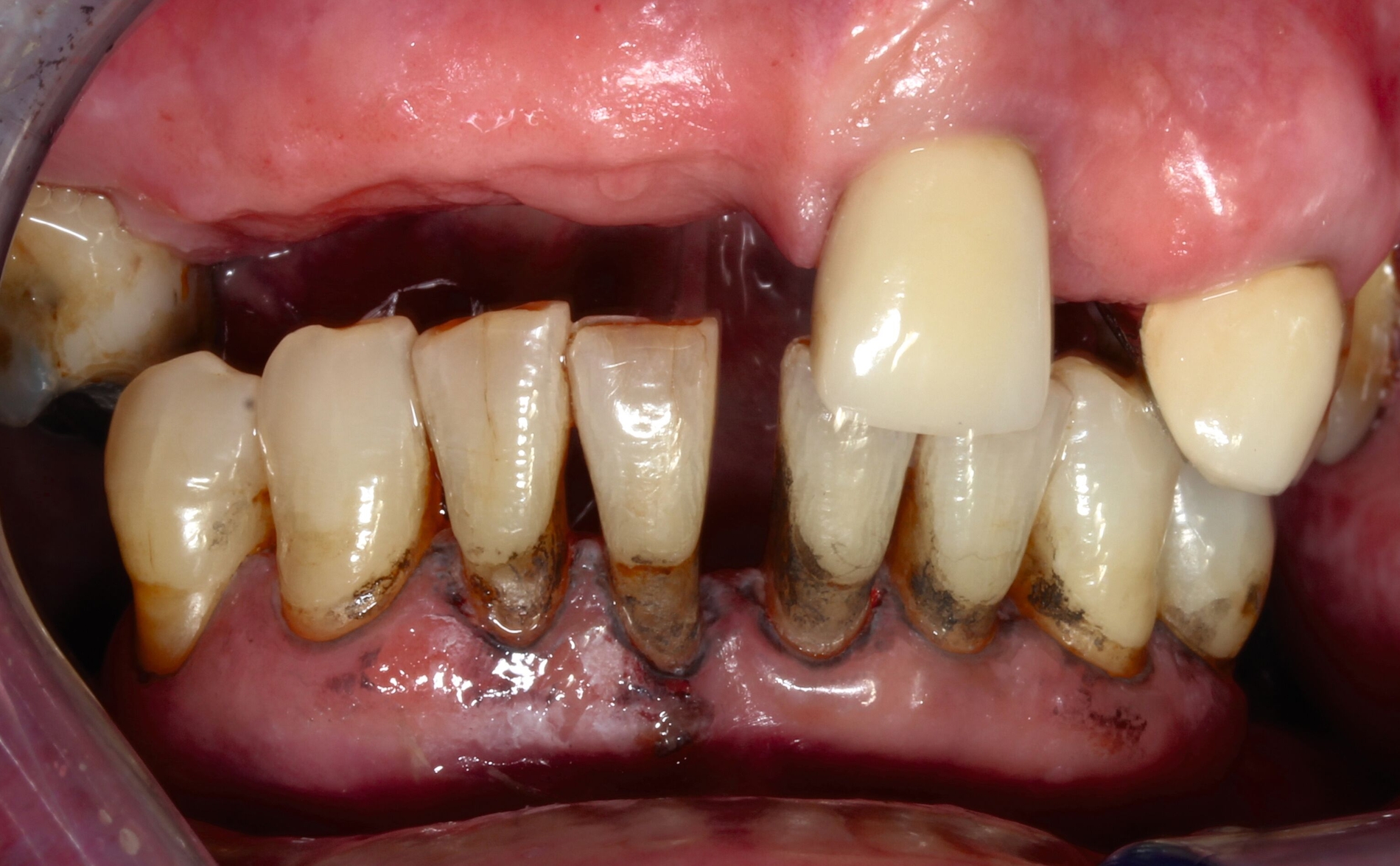
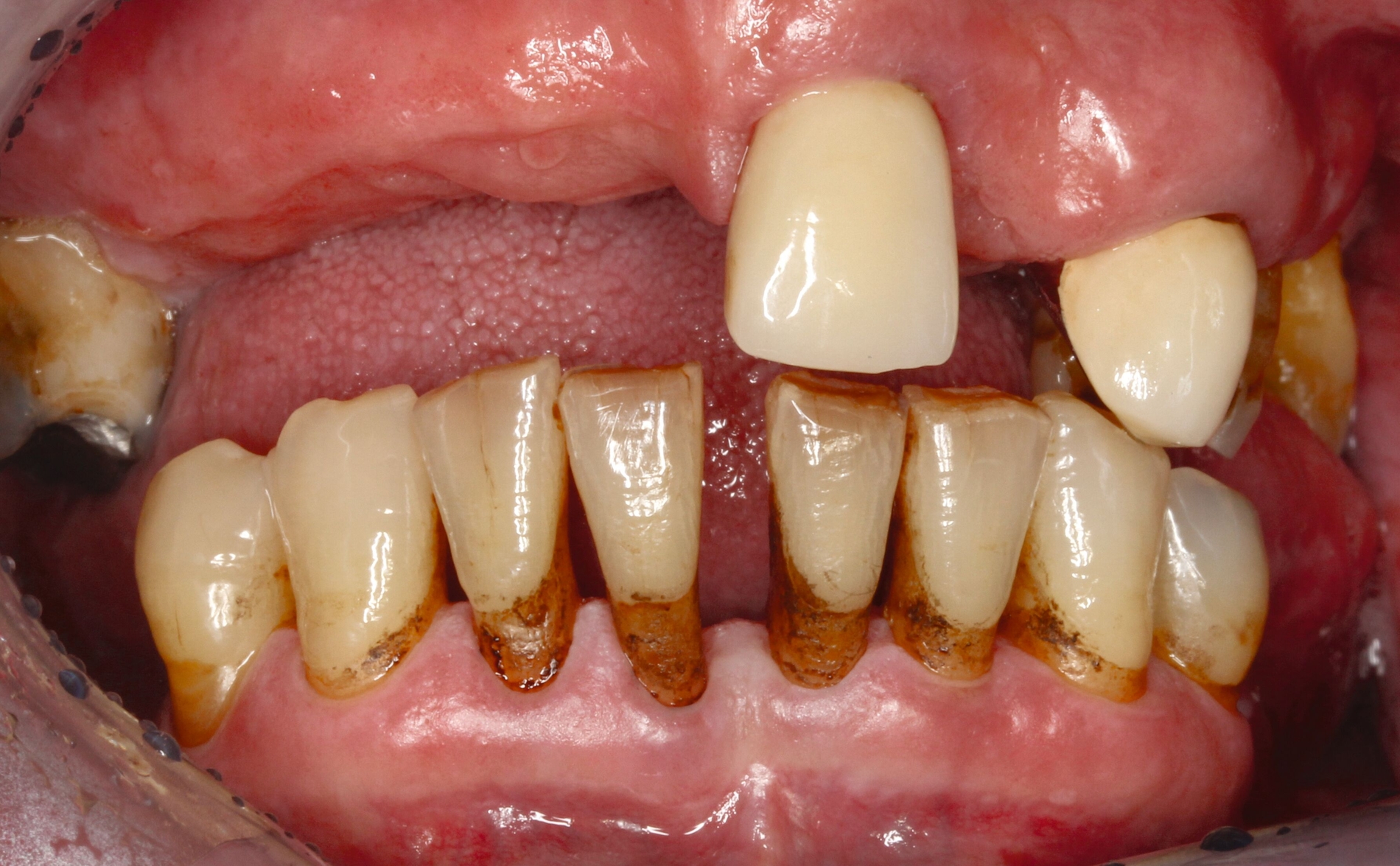
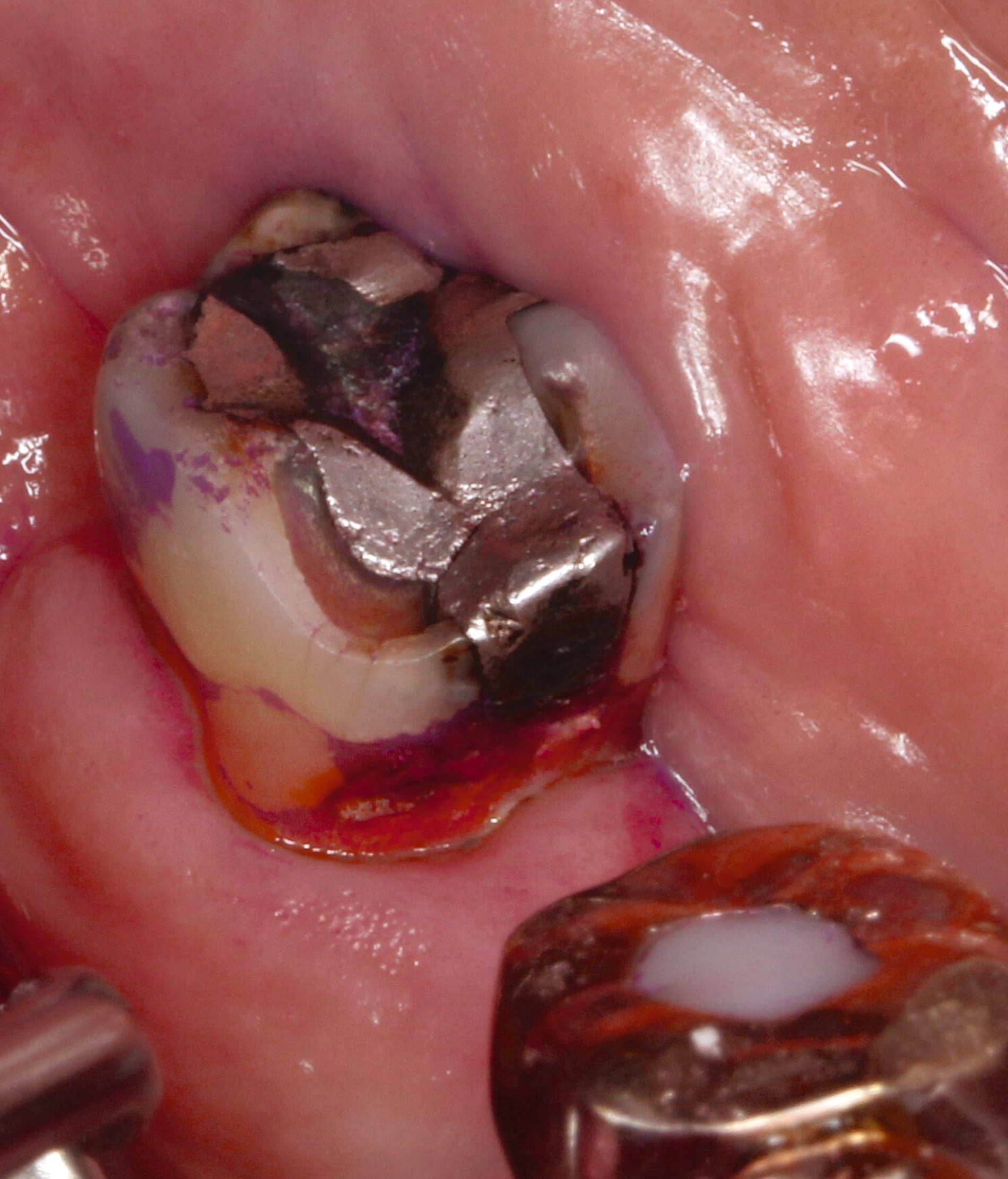
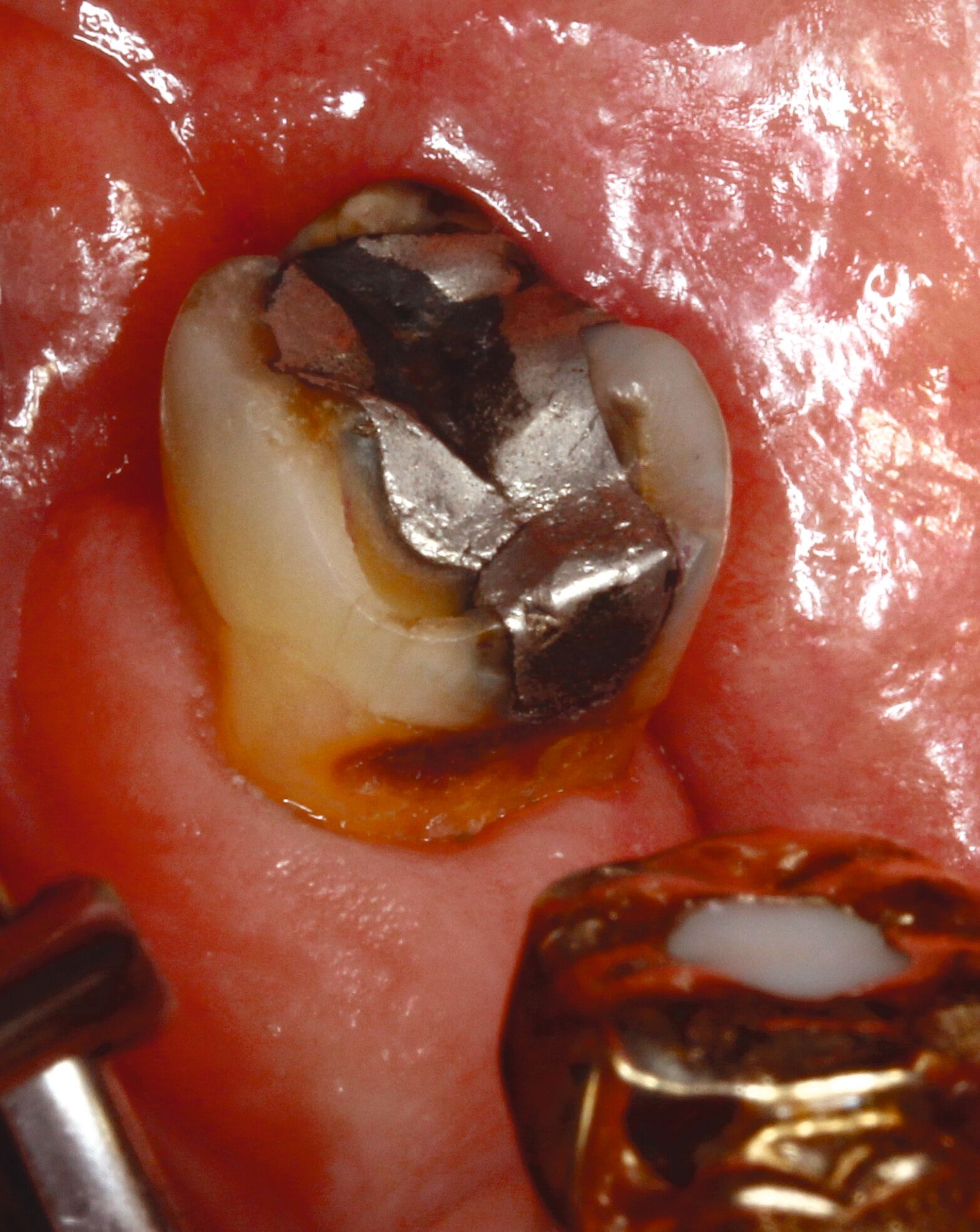
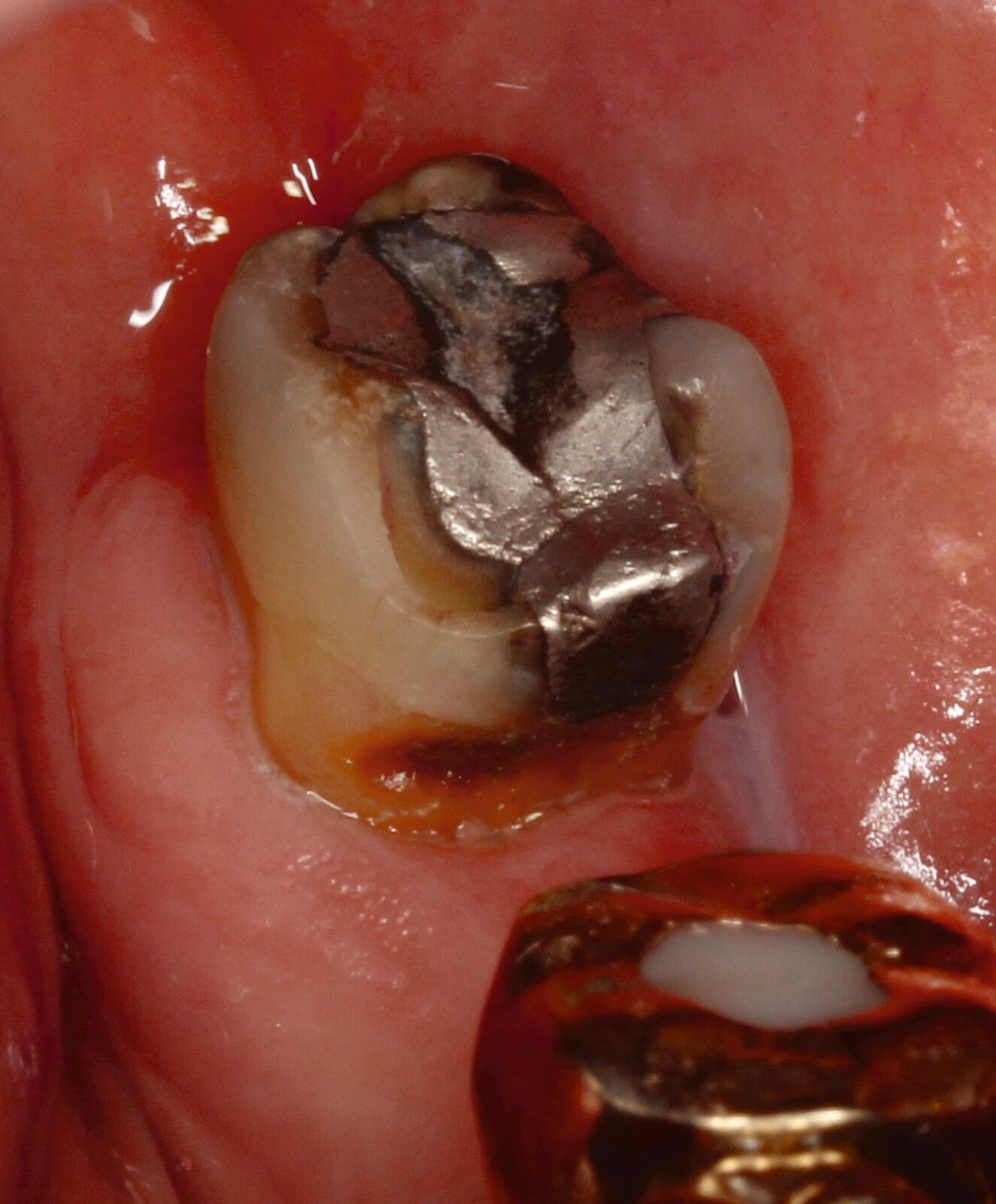
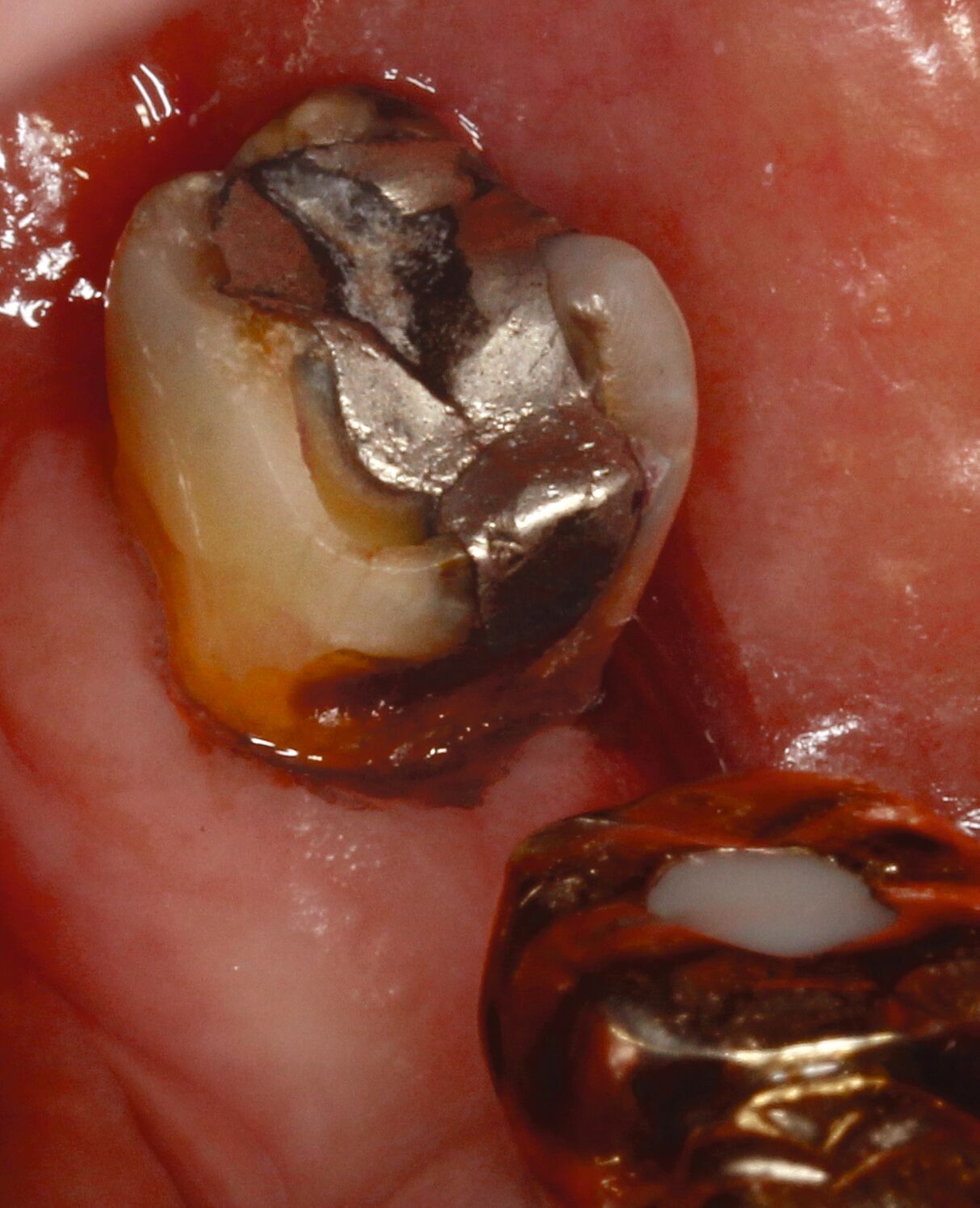
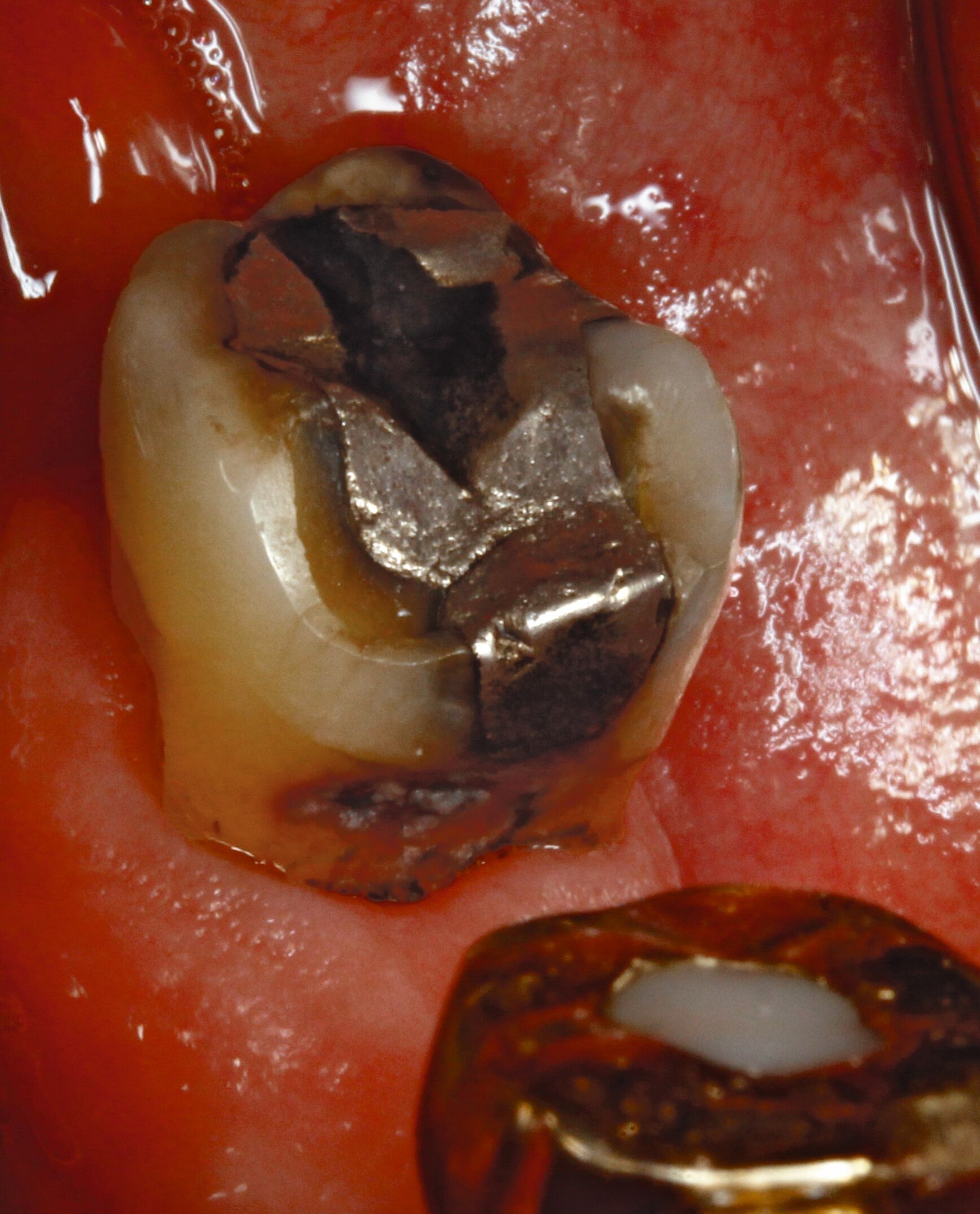
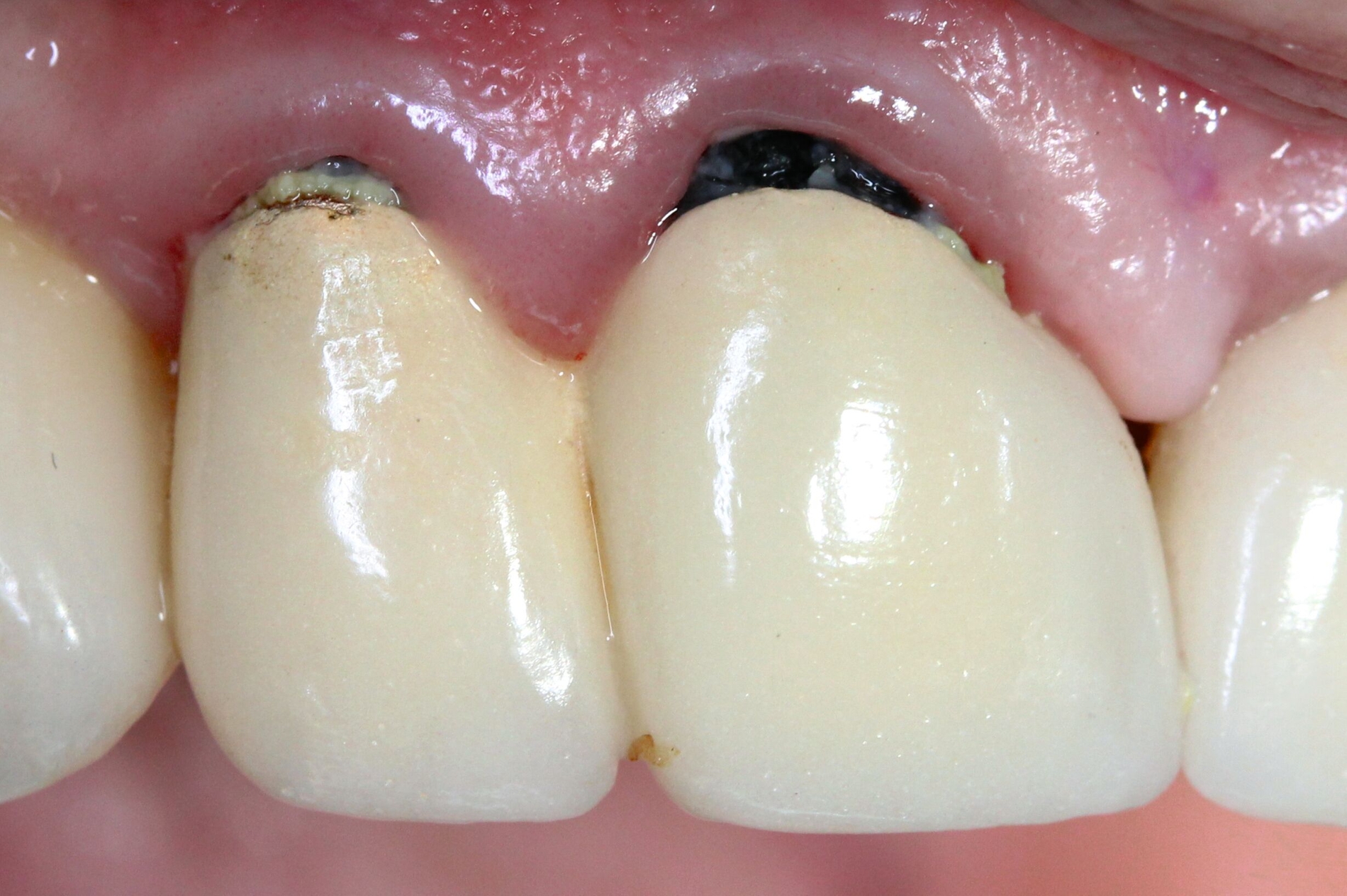
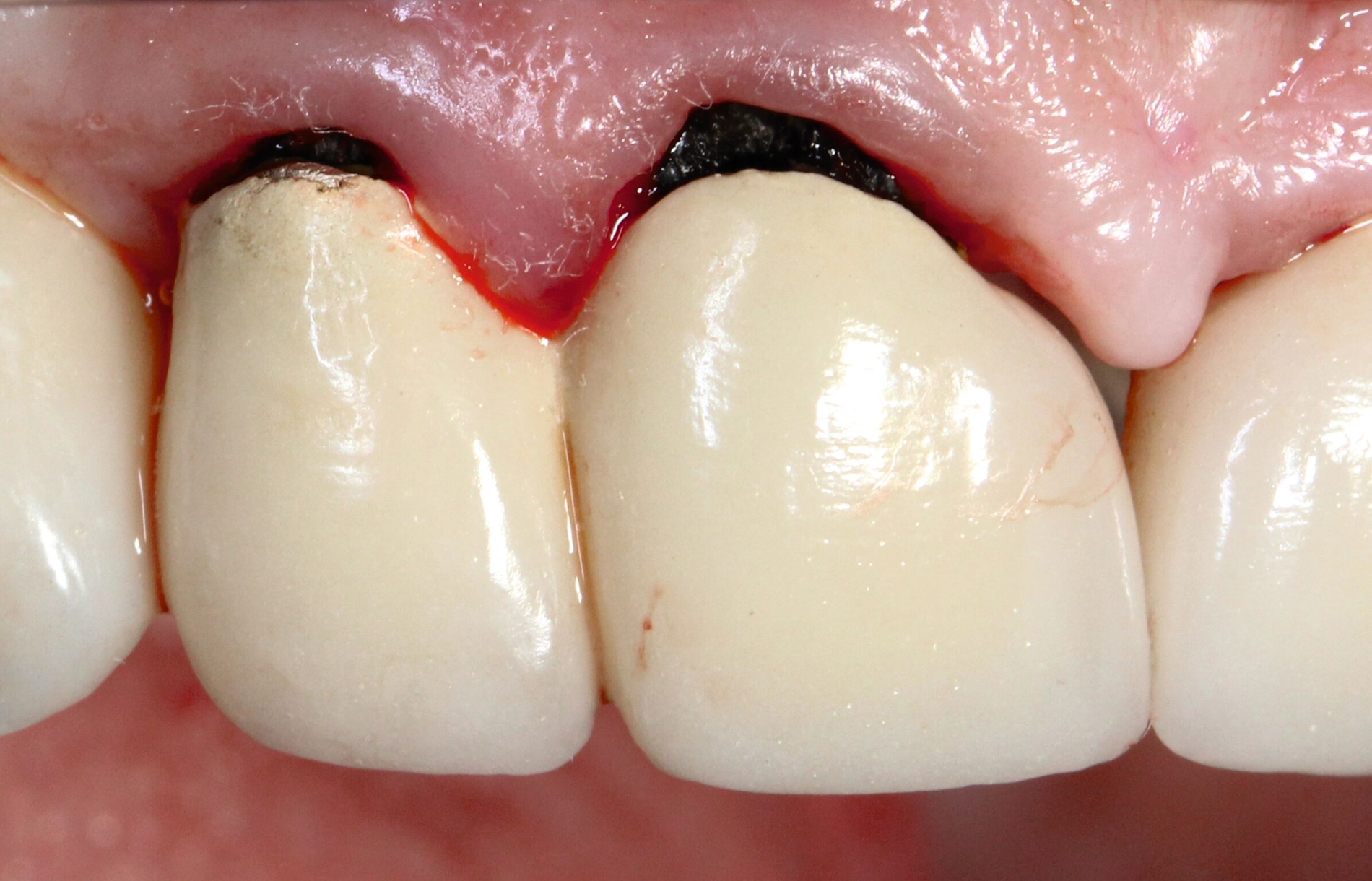
Eine bekannte Nebenwirkung bei Anwendung auf kariösen Läsionen ist die Schwarzfärbung des behandelten Bereichs (Abbildungen 3, 4). Verfärbungen können aber auch bei Applikation auf kariesfreien Wurzeloberflächen entstehen, diese sind jedoch mit einer professionellen Zahnreinigung gut zu entfernen (Abbildung 2).
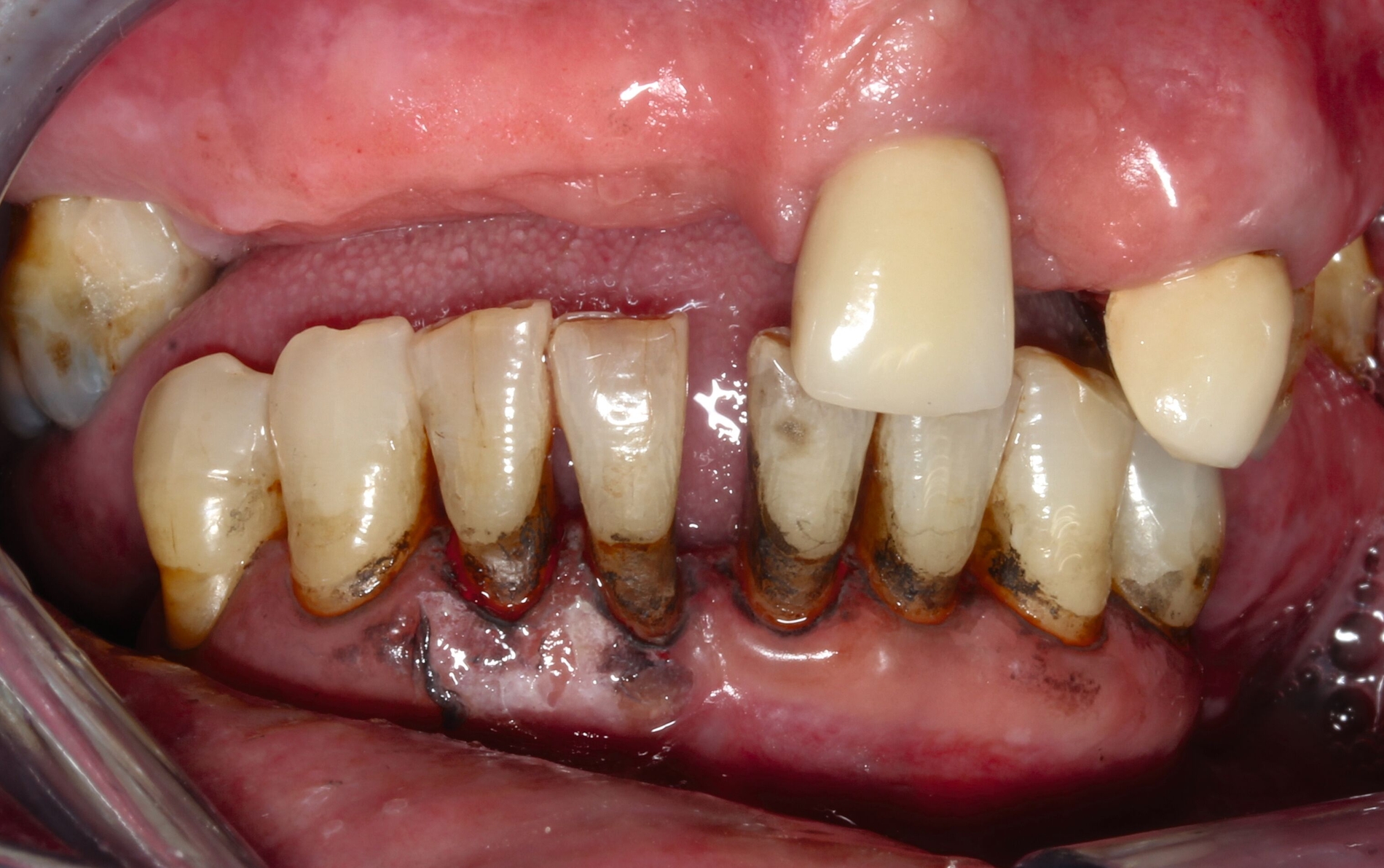
Silberdiamminfluorid wird bei Kindern, aber auch bei Älteren erfolgreich zur Primärprävention von Karies sowie zur Arretierung von bestehenden Läsionen eingesetzt [Worthington et al., 2024] und hat in den letzten zehn Jahren zunehmend wissenschaftliches Interesse gefunden [Qasim et al., 2021]. Bei Wurzelkaries ist die Evidenz allerdings noch relativ gering [Zhang et al., 2020].
Die Wirksamkeit von SDF bei der Behandlung von Wurzelkaries wurde in vier wesentlichen Studien untersucht, die Beobachtungszeiträume zwischen zwölf und 36 Monaten umfassten und unterschiedliche Fragestellungen behandelten. Dabei zeigte sich, dass SDF im Vergleich zu Placebo oder alleiniger Mundgesundheitsberatung signifikant positive Effekte aufweist [Li et al., 2017; Tan et al., 2010; Zhang et al., 2013]. Allerdings war kein deutlicher Vorteil gegenüber Chlorhexidin (CHX)- oder Natriumfluorid (NaF)-Lacken erkennbar [Tan et al., 2010]. Eine mögliche Einschränkung letzterer Ergebnisse liegt jedoch in der Anwendungsfrequenz: Während die Lacke in der betreffenden Studie vierteljährlich aufgetragen wurden, erfolgte die Applikation von SDF lediglich einmal pro Jahr. Eine weitere Untersuchung [Ericson et al., 2023] ergab, dass SDF keinen zusätzlichen Nutzen für Personen mit sehr geringer Kariesaktivität hat.
Die jährliche oder halbjährliche Anwendung von SDF in diesen Studien entspricht der Anwendungsfrequenz von Fluoridlacken in Kariespräventionsprogrammen bei Jugendlichen. Angesichts der Charakteristik der Wurzelkaries, die ja durch eine erhebliche bakterielle Besiedelung des Dentins bis in tiefere Schichten und der Tendenz zu rascher Progredienz gekennzeichnet ist, erscheint dieses Anwendungsintervall möglicherweise zu lang.
Tatsächlich zeigt die klinische Erfahrung, dass es möglich ist, bei mehrmaliger Applikation innerhalb eines Vierteljahrs auch sehr aktive Läsionen mit taktil weicher Oberfläche trotz eingeschränkter Mundhygiene gut zu erhärten (Abbildung 4). Für die koronale Karies bei Kindern konnte die bessere Wirkung nach wiederholter Anwendung allerdings nicht bestätigt werden. [Smutkeeree et al., 2025].
Die Anwendung ist denkbar einfach. Zunächst sollte die Zahnoberfläche bestmöglich gereinigt werden, die Läsion wird jedoch nicht exkaviert. Anschließend kann SDF unter relativer Trockenlegung mit einem Applikator aufgetragen werden. Das Präparat sollte 30 bis 60 Sekunden einwirken. Die Bestrahlung mit Licht aus Polymerisationsgeräten scheint die Mikrohärte von SDF-behandelten Läsionen [Min et al., 2024] und die Penetrationstiefe von Silberionen deutlich zu erhöhen [Crystal et al., 2023].
Der Wirkungsmechanismus ist bislang nicht aufgeklärt. Die wesentlichen Verbindungen in SDF-behandelten Läsionen sind Silberphosphat, Silberoxid und Silbersulfid. Silberphosphat ist ein guter Photokatalysator [Yi et al., 2010], der spezifische chemische Reaktionen mit oder zwischen den verschiedenen beteiligten Verbindungen und Zahnstrukturen induzieren oder aber die auch ohne Licht eintretenden Reaktionen einfach beschleunigen könnte. Es wird vermutet, dass beispielsweise metallische Silbernanopartikel entstehen könnten [Li et al., 2019]. Abbildung 3 zeigt bräunliche Verfärbungen der Schleimhaut nach Lichteinwirkung.
Allerdings ist unklar, welchen Effekt die zusätzliche Lichtexposition auf die Kariesprogression hat. Zumindest bei Kindern scheint der Anteil arretierter Läsionen in Milchzähnen nach halbjährlicher Anwendung von SDF (hier 10 s) durch Lichtexposition (hier 20 s) nicht verbessert zu werden [Min et al., 2025].
SDF scheint keine negativen Auswirkungen auf den adhäsiven Verbund zu haben [Fröhlich et al., 2022], sollte es in Kombination mit einer Füllungstherapie angewendet werden. Es konnte sogar gezeigt werden, dass die Haftwerte nach Alterung über zwei Jahre im Vergleich zu Haftwerten an unbehandeltem Dentin deutlich höher waren [Muniz et al., 2024]. Allerdings ist unklar, ob dies auf alle gängigen Adhäsivsysteme zutrifft.
Welche Einflussfaktoren den Behandlungserfolg optimieren können, ist gegenwärtig noch nicht hinlänglich untersucht. Das betrifft beispielsweise Faktoren wie Feuchtigkeitsbedingungen (Trockenlegung, Applikation auf trockene oder feuchte Zahnoberflächen, Lufttrocknung nach Applikation), Einwirkzeit, unterstützende Lichtapplikation (Dauer, Intensität) sowie Applikationsfrequenz oder Recallintervalle. Daher sollten Patienten nach SDF-Behandlung von Wurzelkaries engmaschig begleitet werden.
SDF in der EU nur als „Off-Label-Use“
Es muss jedoch festgehalten werden, dass SDF in der Europäischen Union nur zur Behandlung überempfindlicher Zähne zugelassen ist, die Anwendung zur Prävention und Arretierung von (Wurzel-)Karies ist daher ein „Off-Label-Use“. Da inzwischen Studien zum Nutzen von SDF zur Arretierung von Karies vorliegen, ist die Anwendung außerhalb des zugelassenen Anwendungsbereichs zu rechtfertigen. Dennoch ist besondere Sorgfalt bei der Aufklärung erforderlich. Dazu sollten alle Behandlungsalternativen aufgezeigt und Nebenwirkungen von SDF ebenso wie dessen Off-Label-Use besprochen werden.
Nebenwirkungen bestehen in lokalen Reizungen und temporären bräunlichen Verfärbungen der Gingiva und der Schleimhäute nach direktem Kontakt mit der SDF-Lösung, welche jedoch nach kurzer Zeit verschwinden. Personen mit Allergien gegenüber den Bestandteilen von SDF und gegenüber Silberverbindungen sollten kein SDF erhalten. Eine gravierende Nebenwirkung ist die dunkle Verfärbung der kariösen Läsion, was jedoch gleichzeitig der Indikator für die eingetretene Wirkung von SDF ist. Insgesamt kann die Behandlung jedoch als sicher eingestuft werden (siehe beispielsweise www.ada.org/resources/ada-library/oral-health-topics/silver-diamine-fluoride).
Fazit
Die Entscheidung, wie Patientinnen und Patienten mit aktiver Wurzelkaries am besten versorgt werden können, erfordert die Integration einer Vielzahl von Aspekten. Dabei bestimmen patientenbezogene Behandlungsbedingungen die Therapieoptionen ebenso wie läsionsbezogene. Die wissenschaftliche Evidenz zu Indikation und Modalitäten sowie zu den Erfolgsraten invasiver Verfahren ist jedoch gering. Silberdiamminfluorid stellt in vielen Fällen eine nicht-invasive Therapieoption dar, die die klinischen Herausforderungen invasiver Therapien lösen kann.
Literaturliste
AOK WId: Der GKV-Arzneimittelmarkt: Klassifikation, Methodik und Ergebnisse 2023. Berlin, 2023.
Burrow MF, Stacey MA: Management of Cavitated Root Caries Lesions: Minimum Intervention and Alternatives. Monogr Oral Sci 2017;26:106-114.
Carvalho TS, Lussi A: Assessment of Root Caries Lesion Activity and Its Histopathological Features. Monogr Oral Sci 2017;26:63-69.
Crystal YO, Rabieh S, Janal MN, Cerezal G, Hu B, Bromage TG: Effects of LED curing light on silver diamine fluoride penetration into dentin. The Journal of clinical pediatric dentistry 2023;47:44-50.
Eickholz P, Holtfreter B, Kuhr K, Dannewitz B, Jordan AR, Kocher T: Prevalence of the periodontal status in Germany: results of the 6th German Oral Health Study (DMS • 6). Quintessence international (Berlin, Germany : 1985) 2025;56:S40-s47.
Ericson D, Carlsson P, Gabre P, Wårdh I, Zimmerman M, Sjögren P: Effect of a single application of silver diamine fluoride on root caries after 12 months in institutionalised older adults-A randomised clinical trial. Gerodontology 2023;40:390-397.
Frencken JE, Leal SC, Navarro MF: Twenty-five-year atraumatic restorative treatment (ART) approach: a comprehensive overview. Clin Oral Investig 2012;16:1337-1346.
Fröhlich TT, Botton G, Rocha RO: Bonding of glass-ionomer cement and adhesives to silver diamine fluoride-treated dentin: an updated systematic review and meta-analysis. J Adhes Dent 2022;24:29-38.
Ganß C, Frankenberger R, Jung K, Schlüter N: Wurzelkaries – Prävention und individualisierte Therapiestrategien. ZM 13/2023.
Göstemeyer G, da Mata C, McKenna G, Schwendicke F: Atraumatic vs conventional restorative treatment for root caries lesions in older patients: Meta- and trial sequential analysis. Gerodontology 2019;36:285-293.
Li R, Lo ECM, Liu BY, Wong MCM, Chu CH: Randomized clinical trial on preventing root caries among community-dwelling elders. JDR Clin Trans Res 2017;2:66-72.
Li Y, Liu Y, Psoter WJ, Nguyen OM, Bromage TG, Walters MA, Hu B, Rabieh S, Kumararaja FC: Assessment of the silver penetration and distribution in carious lesions of deciduous teeth treated with silver diamine fluoride. Caries Res 2019;53:431-440.
Mejare I, Stenlund H, Zelezny-Holmlund C: Caries incidence and lesion progression from adolescence to young adulthood: a prospective 15-year cohort study in Sweden. Caries Res 2004;38:130-141.
Meyer-Lueckel H, Machiulskiene V, Giacaman RA: How to Intervene in the Root Caries Process? Systematic Review and Meta-Analyses. Caries Res 2019;53:599-608.
Min SN, Duangthip D, Detsomboonrat P: Effects of light curing on silver diamine fluoride-treated carious lesions: A systematic review. PLoS One 2024;19:e0306367.
Min SN, Duangthip D, Phyo WM, Somboonsavatdee A, Samaranayake L, Detsomboonrat P: A clinical trial of 38% silver diamine fluoride with light curing in arresting dentine caries in primary teeth. Int Dent J 2025.
Muniz LP, Wendlinger M, Cochinski GD, Moreira P, Cardenas A, Carvalho TS, Loguercio AD, Reis A, Siqueira F: Effect of silver diamine fluoride on the longevity of the bonding properties to caries-affected dentine. J Dent 2024;143:104897.
Muscholl C, Wolff D: The two-step direct composite restoration (R2 restoration) – a current review. Deutsche Zahnärztliche Zeitschrift International 2022;4:125-133.
Orhan AI, Oz FT, Orhan K: Pulp exposure occurrence and outcomes after 1- or 2-visit indirect pulp therapy vs complete caries removal in primary and permanent molars. Pediatr Dent 2010;32:347-355.
Paris S, Banerjee A, Bottenberg P, Breschi L, Campus G, Domejean S, Ekstrand K, Giacaman RA, Haak R, Hannig M, Hickel R, Juric H, Lussi A, Machiulskiene V, Manton D, Jablonski-Momeni A, Santamaria R, Schwendicke F, Splieth CH, Tassery H, Zandona A, Zero D, Zimmer S, Opdam N: How to Intervene in the Caries Process in Older Adults: A Joint ORCA and EFCD Expert Delphi Consensus Statement. Caries Res 2020;54:1-7.
Peng JJ, Botelho MG, Matinlinna JP J Dent (2012) Silver compounds used in dentistry for caries management: a review. J Dent;40:531-541. doi.org/10.1016/j.jdent.2012.03.009.
Qasim SSB, Ali D, Khan AS, Rehman SU, Iqbal A, Baskaradoss JK: Evidence-based bibliometric analysis of research on silver diamine fluoride use in dentistry. BioMed research international 2021;2021:9917408.
Ratledge DK, Kidd EA, Beighton D: A clinical and microbiological study of approximal carious lesions. Part 1: the relationship between cavitation, radiographic lesion depth, the site-specific gingival index and the level of infection of the dentine. Caries Res 2001;35:3-7.
Schwendicke F, Walsh T, Lamont T, Al-Yaseen W, Bjørndal L, Clarkson JE, Fontana M, Gomez Rossi J, Göstemeyer G, Levey C, Müller A, Ricketts D, Robertson M, Santamaria RM, Innes NP: Interventions for treating cavitated or dentine carious lesions. Cochrane Database Syst Rev 2021;7:Cd013039.
Smutkeeree A, Charoentumnukit P, Jirarattanasopha V: Silver diamine Fluoride to arrest dentine caries of permanent teeth in people with intellectual disability. Int Dent J 2025.
Tan HP, Lo EC, Dyson JE, Luo Y, Corbet EF: A randomized trial on root caries prevention in elders. J Dent Res 2010;89:1086-1090.
Wen Y, Zhao X, Li SKY, Lo ECM, Jiang CM: Factors associated with the success of restorative treatment for root caries: A systematic review with meta-analysis. J Dent 2025;153:105539.
Worthington HV, Lewis SR, Glenny AM, Huang SS, Innes NP, O'Malley L, Riley P, Walsh T, Wong MCM, Clarkson JE, Veitz-Keenan A: Topical silver diamine fluoride (SDF) for preventing and managing dental caries in children and adults. Cochrane Database Syst Rev 2024;11:Cd012718.
Yi Z, Ye J, Kikugawa N, Kako T, Ouyang S, Stuart-Williams H, Yang H, Cao J, Luo W, Li Z, Liu Y, Withers RL: An orthophosphate semiconductor with photooxidation properties under visible-light irradiation. Nature materials 2010;9:559-564.
Zhang J, Sardana D, Li KY, Leung KCM, Lo ECM: Topical fluoride to prevent root caries: systematic review with network meta-analysis. J Dent Res 2020;99:506-513.
Zhang W, McGrath C, Lo EC, Li JY: Silver diamine fluoride and education to prevent and arrest root caries among community-dwelling elders. Caries Res 2013;47:284-290.