Wie viel muss entfernt werden?
Um die Wende zum 20. Jahrhundert vertraten die meisten europäischen Autoren wie zum Beispiel Andrieu [1889], Miller [1896] und Preiswerk [1903] die Meinung, dass ein geringer Anteil von erweichtem, kariösem Dentin am Boden der Kavität belassen werden könne, sofern alle Karies an den Rändern vollständig entfernt wird. Dieser Ansicht widersprach Black [1908], der die vollständige Entfernung des gesamten kariösen Dentins forderte, auch wenn dies eine Freilegung der Pulpa bedeutet. Seitdem werden die beiden gegensätzlichen Lehrmeinungen diskutiert.
Prof. Dr. Till Dammaschke
Universität Münster
Poliklinik für Parodontologie und Zahnerhaltung
Waldeyerstrasse 30, 48149 Münster
tillda@uni-muenster.de
1987 bis 1993: Studium der Zahnmedizin
seit 1994: Mitarbeiter in der Poliklinik für Zahnerhaltung an der Universität Münster
1996: Promotion an der Universität Göttingen
1998: Ernennung zum Oberarzt
2008: Habilitation
2012: Ernennung zum außerordentlichen Professor
seit 2015: Leiter der Sektion „Kariologie und Kinderzahnmedizin“ in der Klinik für Parodontologie und Zahnerhaltung in Münster
Zertifiziertes Mitglied der Europäischen Gesellschaft für Endodontie (ESE)
Mitglied des Editorial Board nationaler und internationaler Fachzeitschriften
Mitglied der Arzneimittelkommission der BZÄK
Über 100 Publikationen und Mitautor verschiedener Kapitel in internationalen Lehrbüchern
Ein Grund für die Bevorzugung des Belassens von Karies waren damals sicherlich die Schwierigkeiten bei der Durchführung einer adäquaten endodontischen Behandlung. Auch gab es seinerzeit keine geeigneten Überkappungsmaterialien, um die Pulpa nach Freilegung vital zu erhalten. Daher hat Rebel vor über 100 Jahren die – inzwischen falsifizierte – Lehrmeinung postuliert: „Eine freigelegte Pulpa ist ein verlorenes Organ“ [Rebel, 1922]. Erst einige Jahre später konnte Hermann nachweisen, dass die nach vollständiger Kariesexkavation freigelegte und mit Kalziumhydroxid überkappte Pulpa eine hohe Überlebensrate aufweist [Hermann, 1928; 1930].
Trotzdem propagierte Bonsack in den 1940er Jahren erneut das Belassen von Restkaries unter Füllungen und bezeichnete dies als „Coiffage Naturel“ [Bonsack, 1948; 1949]. Noch heute findet sich im Französischen der Begriff „Coiffage Naturel de Bonsack“ als ein Synonym für die „indirekte Überkappung“ [Lasfargues und Machtou, 2010]. Auch im Englischen versteht man unter „indirect pulp capping“ das bewusste, dauerhafte Belassen von wenig kariös-verändertem Dentin in Pulpanähe unter definitiven Füllungen [Fehrenbach, 2020].
Dies steht im Widerspruch zur deutschen Definition, wo die indirekte Überkappung als medikamentöse Abdeckung einer dünnen, pulpanahen, kariesfreien Dentinschicht definiert wird [Schäfer et al., 2000]. Diese Unterschiede können zu einer Verwirrung bei der Interpretation der internationalen Literatur führen [Dammaschke et al., 2025]. Heute wird das Belassen von wenig kariös-erweichtem, pulpanahem Dentin als „selektive Kariesexkavation“ bezeichnet [Schmidt et al., 2024].
„The seal is the deal“
Die Idee hinter der selektiven Kariesexkavation ist, einen dichten adhäsiven Verschluss über dem verbliebenen kariös veränderten Dentin aufzubringen, um so die Kariesbakterien vom Zugang zu fermentierbaren Kohlenhydraten abzuschneiden. Eine bakteriendichte Restauration soll eine adäquate Ernährung der Mikroorganismen und damit eine weitere Infektion verhindern. Die Bakterien sollen unter der Füllung „verhungern“. Die adhäsive Versiegelung des kariösen Dentins arretiert so die Kariesprogression. Dies führt demzufolge nicht zu mehr klinischen Misserfolgen als die vollständige Kariesexkavation, vielmehr erscheint die selektive Kariesentfernung im Vergleich zur vollständigen Exkavation sogar überlegen zu sein [Kidd, 2004; Schwendicke et al., 2013; Schmidt et al., 2024].
Auch zwei systematische Cochrane Reviews kamen zu dem Schluss, dass die selektive Kariesexkavation klinische Vorteile hinsichtlich der Vitalerhaltung der Pulpa hat und der vollständigen Kariesexkavation überlegen ist. Durch selektive Kariesexkavation könnten signifikant mehr Zähne pulpavital erhalten werden. Daher sollte in pulpanahen Bereichen auf eine vollständige Entfernung sämtlichen kariös veränderten Dentins verzichtet werden. Diese Empfehlung ist demnach evidenzbasiert [Ricketts et al., 2013; Schwendicke et al., 2021].
So kam auch die Deutsche Gesellschaft für Zahnerhaltung (DGZ) 2017 in einer wissenschaftlichen Mitteilung zu dem Schluss, dass eine sorgfältig durchgeführte selektive Kariesexkavation heute als das zu bevorzugende Exkavationskonzept bei tiefer, pulpanaher Ausdehnung der Dentinkaries gilt [Buchalla et al., 2017]. Die Europäische Gesellschaft für Endodontie (ESE) befürwortet ebenfalls die selektive Kariesexkavation bei Zähnen mit reversibler Pulpitis, sofern eine Röntgenuntersuchung zeigt, dass die Karies nicht tiefer als bis zum letzten Dentinviertel Richtung Pulpa vorgedrungen ist und eine Restdentinschicht die kariöse Läsion von der Pulpakammer trennt [ESE, 2019].
„The seal is NOT the deal“
Klinische Erfolgsraten
Im Laufe der Zeit sinken die in der Literatur angegebenen klinischen Erfolgsquoten für die selektive Kariesexkavation von 87 Prozent nach einem Jahr [Labib et al., 2019] und 83 Prozent nach zwei Jahren [Maltz et al., 2018] auf 63 Prozent nach zehn Jahren [Maltz et al., 2011]. Dies sind nur einige beispielhafte Ergebnisse. Eine vollständige Literaturübersicht findet sich bei Schwendicke et al. [2021].
Die Alternative zur selektiven Kariesexkavation ist die vollständige Kariesexkavation bis hin zur Pulpafreilegung mit anschließender Überkappung. Aus der Literatur zur Vitalerhaltung der Pulpa ist aber bekannt, dass hier höhere klinische Erfolgsquoten erzielt werden können. Ricucci et al. [2023] berichteten, dass die Erfolgsquote der direkten Pulpaüberkappung mit Kalziumhydroxid bei 225 Zähnen von 148 Patienten nach 1, 5, 10, 20 beziehungsweise 35 Jahren bei der Nachuntersuchung 100 Prozent, 95 Prozent, 95 Prozent, 86 Prozent und 89 Prozent betrug.
In einer anderen Studie lag die Erfolgsrate der direkten Überkappung mit Kalziumhydroxid nach 13 Jahren bei 76 Prozent [Dammaschke et al., 2010]. Eine Metaanalyse kam zu dem Schluss, dass die klinischen Langzeiterfolgsquoten nach vollständiger Kariesexkavation und Verwendung von Kalziumhydroxid für die indirekte Überkappung bei 81,7 Prozent (± 8,9 Prozent), für die direkte Überkappung bei 70,1 Prozent (± 10,1 Prozent) und für die partielle Pulpotomie bei 79,3 Prozent (± 12,5 Prozent) liegen [Gulabivala und Ng, 2019]. Das Risiko eines Misserfolgs ist signifikant geringer, wenn ein Kalziumsilikatzement anstelle von Kalziumhydroxid zur direkten Pulpaüberkappung verwendet wird [Cushley et al., 2019]. Verschiedene Studien konnten nachweisen, dass bei Verwendung von Kalziumsilikatzementen zur Überkappung der freigelegten Pulpa nach vollständiger Kariesexkavation langfristige klinische Erfolgsquoten von circa 80 Prozent auch unter Praxisbedingungen durchaus realistisch sind (Übersicht siehe: [Dammaschke, 2024]).
Bisher liegen nur wenige Studien vor, die direkt die selektive der vollständigen Kariesexkavation gegenüberstellen. Im direkten klinischen Vergleich zeigten Zähne zehn Jahre nach selektiver Kariesexkavation und adhäsiver Restauration eine Erfolgsquote von 86 Prozent; bei vollständiger Kariesexkavation (ohne Pulpafreilegung) dagegen 98 Prozent [Mertz-Fairhurst et al., 1998]. Kam es bei der vollständigen Kariesexkavation zu einer Pulpafreilegung mit anschließender Pulpotomie, lag die klinische Erfolgsquote nach einem Jahr bei 97,9 Prozent; bei der selektiven Kariesexkavation indes nur bei 86 Prozent [Chua et al.; 2023]. In einer anderen Studie lag die Erfolgsquote für beide Behandlungsalternativen nach einem Jahr bei 95 Prozent [Rechithra et al., 2023].
In Studien, in denen die direkte Überkappung der Pulpa deutlich niedrigere klinische Erfolgsquoten als die selektive Kariesexkavation aufwies, wurden zuweilen Fehler bei der Durchführung gemacht. So fehlten beispielsweise Informationen zum genauen Vorgehen bei der direkten Überkappung, es wurden keine optischen Vergrößerungshilfen (wie Lupenbrillen) verwendet, es wurde keine Kavitätendesinfektion durchgeführt, statt eines Kalziumsilikatzements wurde ein Kalziumhydroxid-Salicylatester-Zement (Dycal®, Kerr Life™) verwendet, welcher aber für die direkte Überkappung ungeeignet ist, und die Kavitäten wurden zunächst provisorisch versorgt, statt eine sofortige definitive Restauration zu legen [Barthel et al., 2000; Bjørndal et al., 2017]. Dieses Vorgehen widerspricht eindeutig dem aktuellen Erkenntnisstand zur Vitalerhaltung der Pulpa [Dammaschke et al., 2025]. Daher können solche falsch durchgeführten Studien nicht als Beleg dafür dienen, dass die selektive Kariesexkavation überlegen ist.
Diagnostik
In allen Studien, die die selektive Kariesexkavation positiv bewerten, wurde der klinische „Erfolg“ nur durch einen Sensibilitätstest und anhand einer Beschwerdefreiheit überprüft. Man weiß aber, dass in 15,6 Prozent der Fälle die klinische und die histologische Diagnose nicht übereinstimmen [Ricucci et al. 2014]. In 14 bis 60 Prozent der Fälle kann eine irreversible Pulpitis völlig symptomfrei sein [Seltzer et al. 1963; Michaelson und Holland, 2002]. Der histologische Befund weicht daher nicht selten vom klinischen Krankheitsbild ab. Zumeist wird klinisch der Zustand der Pulpa zu positiv eingeschätzt („Hypodiagnose”) [Seltzer et al. 1963; Barańska-Gachowska et al., 1969; Barańska-Gachowska und Waszkiewicz-Goloś, 1969; Michaelson und Holland, 2002].
Die Genauigkeit und Reproduzierbarkeit der üblichen diagnostischen Tests zur Beurteilung der Vitalität der Pulpa (Sensibilitätsprobe) sind daher begrenzt oder sogar unzureichend. Es fehlt bisher an gesicherten Erkenntnissen, um den tatsächlichen Status der Pulpa klinisch zu bestimmen. Fundierte prognostische Indikatoren, die eine zuverlässige Abschätzung des Behandlungsergebnisses auch nach selektiver Kariesexkavation ermöglichen, sind derzeit nicht verfügbar [Donnermeyer et al., 2023].
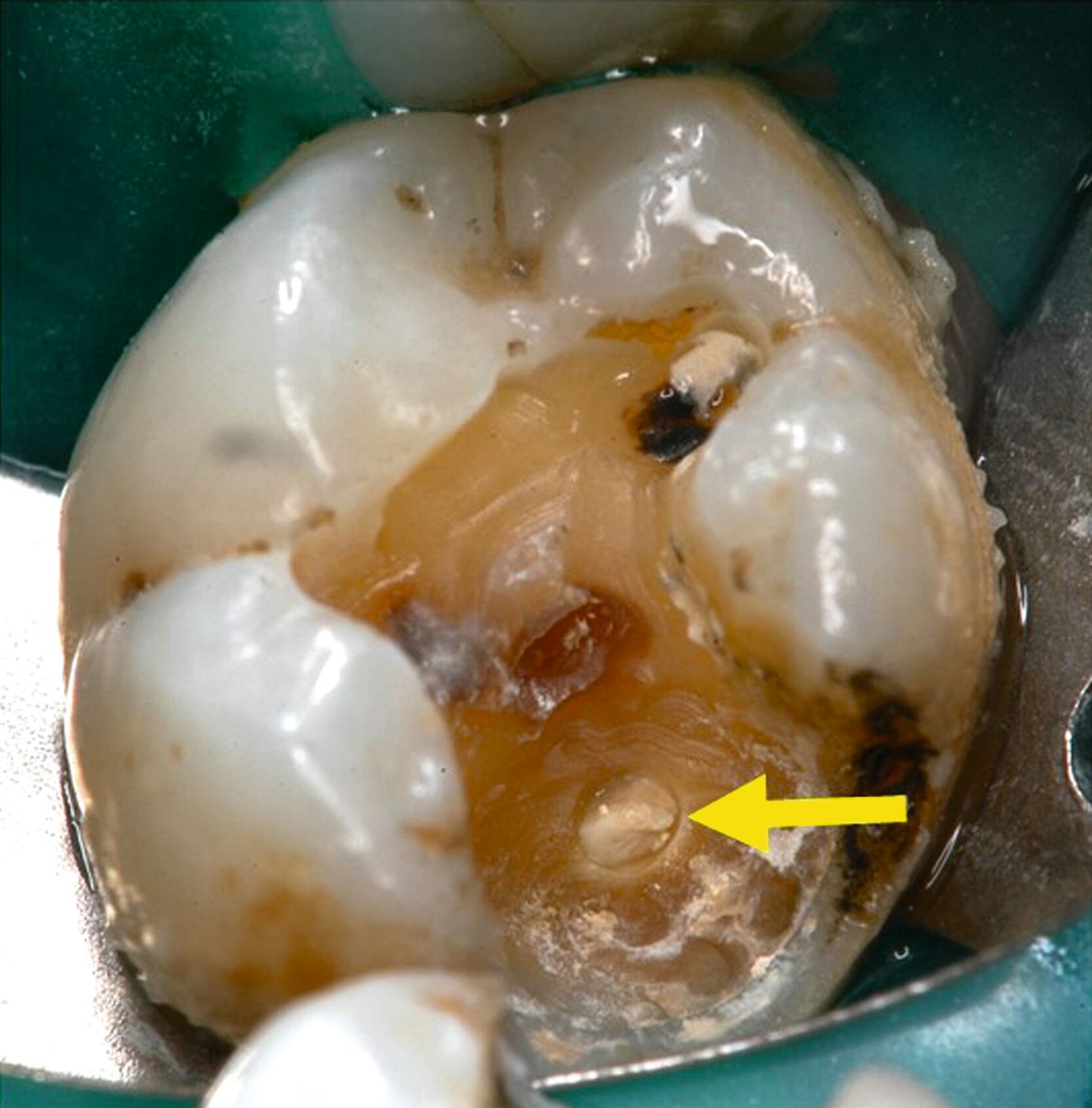
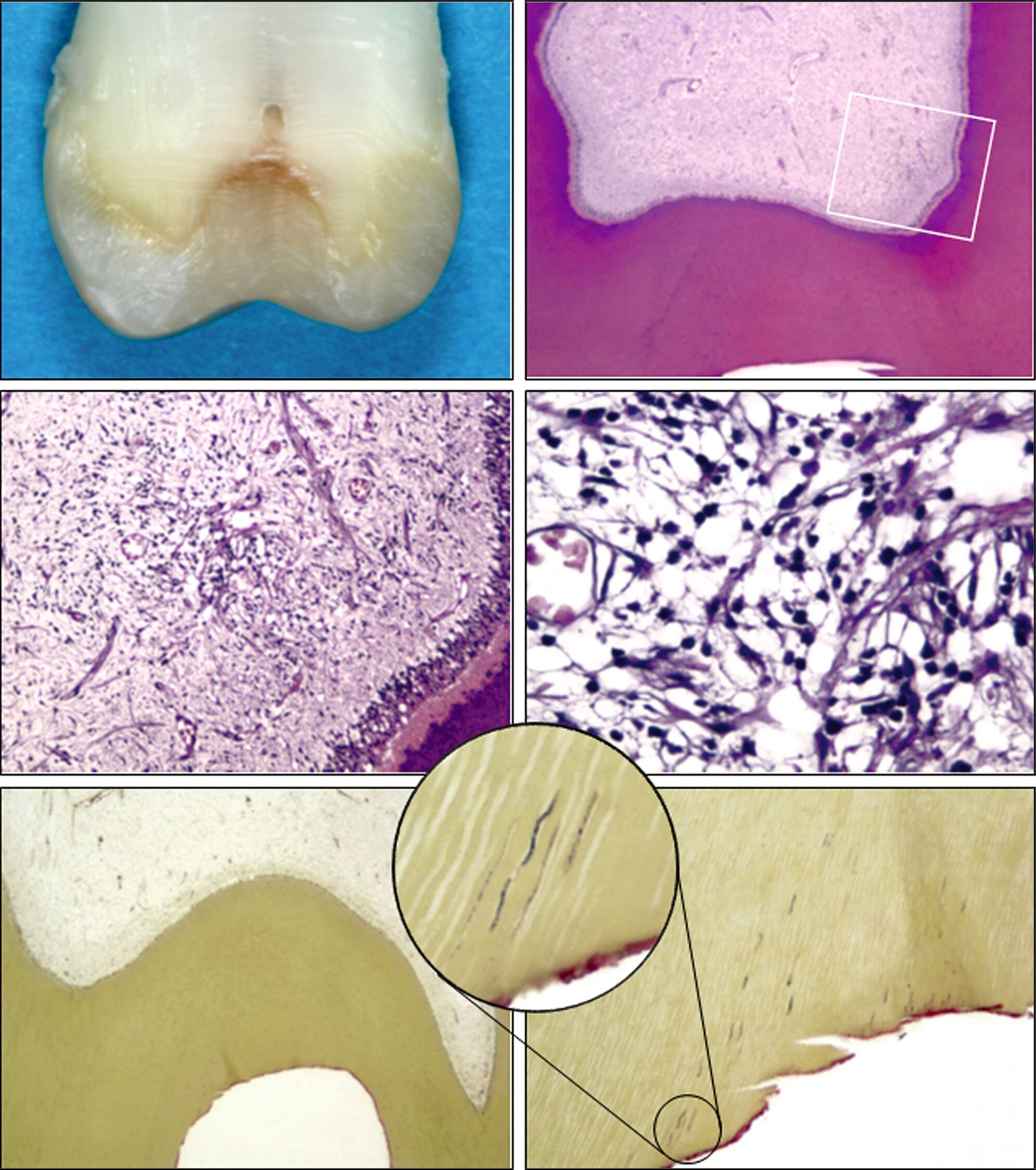
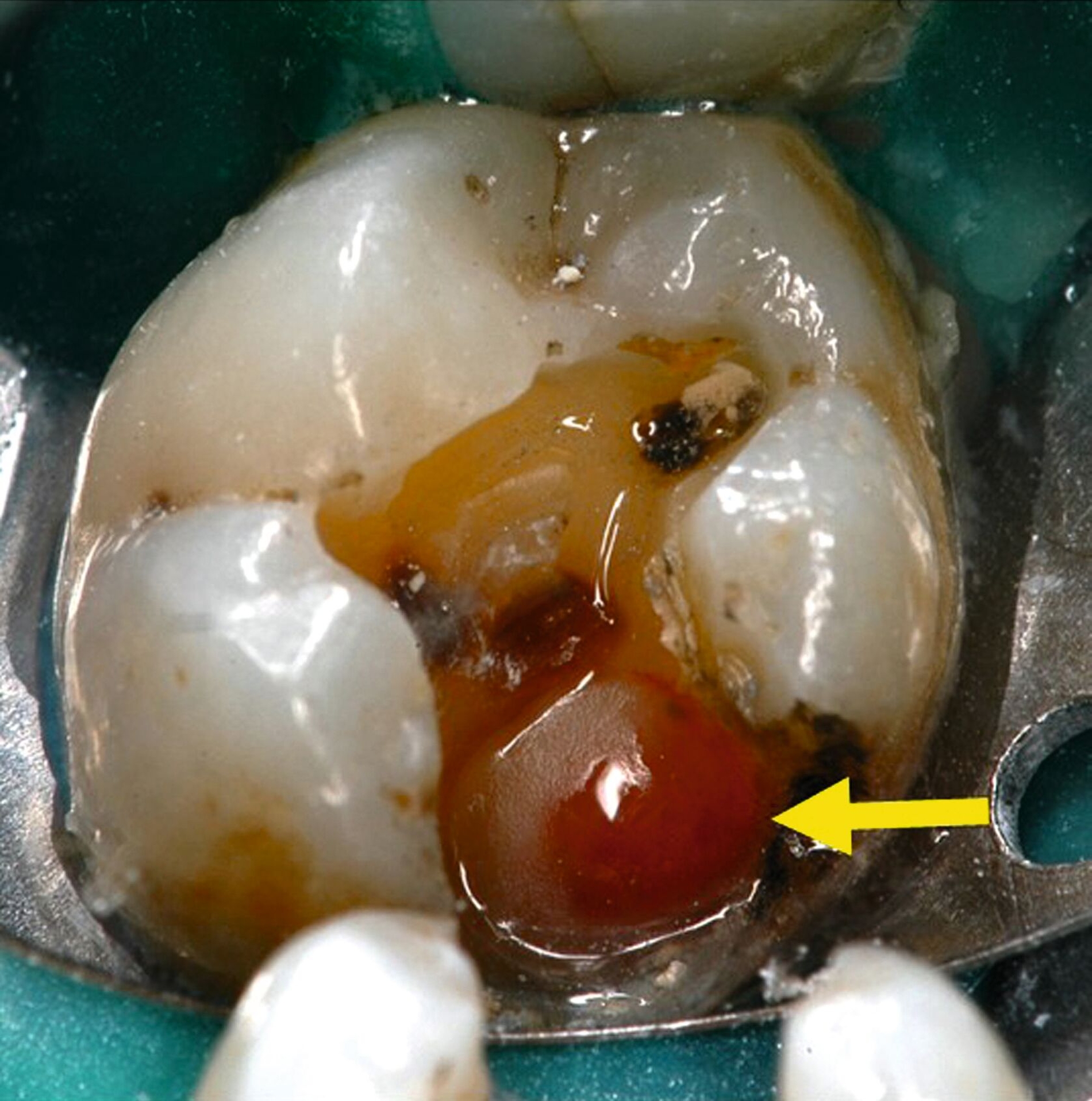
Lediglich eine klinische Symptomlosigkeit nach selektiver Kariesexkavation als Behandlungserfolg zu werten, ist daher zu kurz gedacht. Die klinischen Angaben der Patienten auf den Sensibilitätstest korrelieren möglicherweise nicht mit den histologischen Befunden. Histologisch sichtbare chronische Entzündungen, Mikroabszesse und Nekrosen nach selektiver Kariesexkavation können auftreten, ohne dass Patienten Beschwerden haben (Abbildungen 1a, b); das heißt, die Pulpa kann nach selektiver Kariesexkavation irreversibel entzündet sein, ohne dass dies vom Patienten bemerkt wird. Bei 81 von 224 Zähnen (36 Prozent) traten trotz partieller Nekrose der Pulpa und einer ausgeprägten Entzündungsreaktion keine Schmerzen auf [Langeland, 1959]. Trotz klinischer Beschwerdefreiheit und positiver Sensibilitätstestung fanden sich in allen der 12 untersuchten Zähne ein bis neun Monate nach selektiver Kariesexkavation histologisch Entzündungszellen in der Pulpa und Granulozyten in den afferenten Blutgefäßen [Ricucci et al., 2020] (Abbildung 2).
Histologisch findet sich eben kein Zusammenhang zwischen klinischen Symptomen oder positivem Sensibilitätstest und dem Entzündungsprozess in der Pulpa [Langeland, 1976; Langeland, 1981]. Die Annahme ist daher falsch, dass, wenn keine Beschwerden bestehen oder die Sensibilitätsprobe positiv ausfällt, die selektive Kariesexkavation erfolgreich war [Langeland, 1981]. Das Fehlen von Schmerzen oder ein positiver Sensibilitätstest bedeutet nicht das Fehlen von Entzündungen oder Nekrosen der Pulpa [Langeland, 1987]. Dies sind keine neuen Erkenntnisse, sondern sie sind seit fast 100 Jahren wissenschaftlich nachgewiesen [Greth, 1933].
Histologie
Da eine klinische Beurteilung bewiesenermaßen nicht ausreicht, um den Erfolg der selektiven Kariesexkavation zu belegen, erscheint es sinnvoll, die Auswirkung des Belassens von Karies auf die Pulpa histologisch zu untersuchen. Histologisch zeigte sich, dass eine selektive Kariesentfernung mit anschließender definitiver Versorgung der Zähne in 68 bis 100 Prozent der Fälle zu einer entzündlichen Veränderung der Pulpa führt (irreversible Pulpitis). Dagegen kam es nach vollständiger Kariesexkavation und anschließender indirekter beziehungsweise direkter Überkappung mit Kalziumhydroxid in nur 7 (indirekte Überkappung) bis 33 Prozent (direkte Überkappung) zu einem histologischen Misserfolg. Die Patienten waren in allen Fällen im gesamten Nachuntersuchungszeitraum von drei Monate bis zu fünf Jahren klinisch beschwerdefrei. Die Sensibilitätsprobe fiel in allen Fällen positiv aus [Wang, 1953; Ricucci et al., 2019].
Nach selektiver Kariesexkavation ließen sich histologisch in den Pulpen aller zwölf untersuchten Zähne chronisch-entzündliche Zellinfiltrate identifizieren. Nach ein bis neun Monaten waren sowohl verstreute Entzündungszellenals auch ausgedehnte lokale Ansammlungen von Entzündungszellen nachzuweisen. Die Kapillaren waren deutlich mit Erythrozyten und polymorphkernigen Leukozyten gefüllt. Im Dentin unterhalb des Kavitätenbodens wurde bei allen Proben eine große Menge an anfärbbaren Bakterien beobachtet. Die im Dentin verbliebenen Bakterien provozierten über den gesamten Untersuchungszeitraum eine subklinische Pulpaentzündung. Alle Patienten waren daher klinisch völlig beschwerdefrei, die Sensibilitätsprobe positiv.
Selektive Kariesexkavation führt eben nicht zu einer Kontrolle oder gar zu einem Verschwinden der bakteriellen Infektion (Abbildung 2) [Ricucci et al., 2020]. Eine Degeneration beziehungsweise Entzündung des Pulpagewebes nach selektiver Kariesexkavation ist eher die Regel denn die Ausnahme [Langeland, 1981]. Histologische Studien, die nach selektiver Kariesexkavation einen Erfolg (= gesundes Pulpagewebe) zeigen können, fehlen bisher völlig.
Teilweise wird von einigen Autoren in einer Kariesläsion zwischen kariös-infiziertem und kariös-verändertem Dentin unterschieden. Demnach ist die äußere Schicht mit Bakterien infiziert (caries infected dentine), was zu einer nicht remineralisierbaren nekrotischen Kollagenmatrix führt. Dieses Dentin muss entfernt werden. In der inneren Schicht seien Bakterien gar nicht oder viel seltener zu beobachten (caries affected dentine). Dieses Dentin könne belassen werden, auch wenn es (lederartig) erweicht ist [Massler, 1967; Ogushi und Fusayama, 1975].
Entnimmt man nun aber unter Füllungen Proben aus dieser kariös-verändertem Dentinschicht, konnte in histologischen und mikrobiologischen Studien gezeigt werden, dass sich immer Bakterien nachweisen lassen und diese Mikroorganismen vermehrungsfähig sind [Lichtenberg Crone, 1968; Langeland et al., 1976; Langeland, 1981; Ricucci et al, 2020]. Lebensfähige Mikroorganismen konnten auch noch lange Zeit nach dem Legen einer Füllung aus der kariös-veränderten Dentinschicht gewonnen werden [Lichtenberg Crone, 1968].
Bakterien überleben unter Füllungen und führen zu einer irreversiblen Pulpitis [Langeland, 1981]. Entfernt man nur die oberflächlichen kariös-infizierten Dentinschichten, lässt man mit hoher Wahrscheinlichkeit eine beträchtliche Menge an vermehrungsfähigen Bakterien in der kariös-veränderten Dentinschicht zurück [Langeland et al., 1976]. Die Vorstellung, dass es eine kariös-veränderte Dentinschicht gibt, die mehr oder weniger frei von Mikroorganismen ist, dürfte eher Wunschdenken und nicht die Realität sein.
Darüber hinaus finden sich Bakterien auch in den Dentintubuli unterhalb der kariös-veränderten Dentinschicht, die Richtung Pulpa diffundieren [Langeland et al., 1976; Langeland, 1981; Ricucci et al., 2020]. Eine bakterielle Besiedlung der Dentintubuli ist dabei von entscheidender Bedeutung für das Fortschreiten der Karies und die Entwicklung von pulpalen und periapikalen Entzündungen. Aufgrund der einzigartigen Lage der Bakterien während des kariösen Prozesses in den Dentintubuli können körpereigene Abwehrmechanismen dort nicht aktiv werden. Eine Phagozytose (Abtöten der Mikroorganismen) durch Abwehrzellen tritt nicht eher auf, bis das Pulpagewebe in direkten Kontakt mit den Kariesbakterien steht [Hahn und Liewehr, 2007 a-c].
Bakterientoxine
Grundsätzlich ist fraglich, ob sich klinisch tatsächlich immer bakteriendichte Füllungen legen lassen. Gerade im Approximalbereich lässt sich klinisch eine Dichtigkeit kaum überprüfen. Die Randdichtigkeit von Füllungen nach selektiver Kariesexkavation ist daher langfristig nicht garantiert [Hotz, 2003].
Abgesehen davon, ob eine Füllung bakteriendicht ist oder nicht: Neben kariogenen Bakterien, die sich von Kohlenhydraten ernähren, kommen im infizierten Dentin auch bestimmte anaerobe asaccharolytische Bakterien vor, welche stickstoffhaltige Substrate zur Energiegewinnung benutzen. Proteine und Glykoproteine aus demineralisiertem Kollagen und Gewebeflüssigkeit aus den Dentintubuli dienen diesen Mikroorganismen als Nahrung. Anaerobe asaccharolytische Bakterien können sich auch unter „versiegelten“ Füllungen vermehren. Die Abbauprodukte dieser Mikroorganismen führen dann zu einer Entzündung des Pulpagewebes [Paddick et al., 2005; Lima et al., 2011; Rôças et al., 2015; Rôças et al., 2016].
Auch die Applikation von Kalziumhydroxid führt nicht zu einer Desinfektion der Kavität: Nach selektiver Kariesexkavation und achtwöchiger Applikation von Kalziumhydroxid wurden zwar azidogene und azidurische Streptokokken und Laktobazillen in ihrer Überlebensfähigkeit limitiert, aber Aktinomyzeten sowie Streptomyzeten, die das basische Milieu bevorzugen, begünstigt [Heinrich et al., 1991]. Diese Bakterien können im kariösen Dentin unter Füllungen überleben.
Zurückgelassene Bakterien im Dentin bergen daher immer die Gefahr eines Kariesrezidivs und bilden selbst nach dem Absterben der Mikroorganismen ein Reservoir an Toxinen (Endotoxine), wodurch Entzündungsvorgänge in der Pulpa aufrechterhalten werden können [Cooper et al., 2010]. Werden diese bakteriellen Stoffwechselprodukte (Endodotoxine wie zum Beispiel Lipopolysaccharide und Lipoteichonsäuren) in tiefen Kavitäten freigesetzt, diffundieren sie durch das verbliebene Dentin und dringen in die Pulpa ein. Dadurch werden aus den Odontoblasten und Makrophagen Entzündungsmediatoren freigesetzt, die zu einer chronischen Entzündung des Pulpagewebes führen [Schweikl et al., 2017].
Das heißt, auch wenn Bakterien unter der Füllung nicht überleben und absterben, kommt es zu einer Entzündung der Pulpa. Dazu müssen nicht die Bakterien selber in das Gewebe eindringen, es reichen deren Stoffwechselprodukte. Letztlich ist es also unerheblich, ob die Mikroorganismen unter einer Füllung „verhungern“ oder nicht.
Sowohl Bakterien als auch bakterielle Stoffwechselprodukte aus der Karies (Endotoxine) können durch Dentinkanälchen Richtung Pulpa diffundieren und dann eine entzündliche Veränderung des Pulpagewebes verursachen [Love, 2002; Love und Jenkinson, 2002]. Mikroorganismen können innerhalb von sieben Wochen bis acht Monaten 500 bis 3.000 μm tief in das Dentin pulpavitaler Zähne Richtung Pulpa eindringen [Lundy und Stanley, 1969, Taschieri et al., 2014]. Endotoxine diffundieren dabei problemlos durch 0,5 mm dickes Dentin [Nissan et al., 1995]. Daher führt auch eine inaktive Karies histologisch zu Veränderungen des Pulpagewebes [Kuwabara und Massler, 1966], nur dauert dies oft Jahre [Langeland, 1981].
Selbst eine ausgeprägte Schicht von Reizdentin am Kavitätenboden schützt die Pulpa nicht vor Kariesbakterien und deren Stoffwechselprodukten und damit nicht vor einer Nekrose durch Karies [Langeland und Langeland, 1968; Bergenholtz, 2000]. Auch ohne Freilegung des Pulpagewebes kommt es demnach zu einer Entzündung durch bakterielle Zerfallsprodukte (Endotoxine). Pulpareaktionen treten bereits als Folge einer oberflächlichen Dentinkaries auf. Dabei gibt es eine direkte Korrelation zwischen dem Ausmaß der Karies und den Reaktionen der Pulpa darauf.
Sobald die Dentinkaries sich pulpawärts ausbreitet, nehmen die Pulpareaktionen zu. Dabei ist nicht die gesamte Pulpa entzündet, sondern es sind nur die Bereiche, wo Bakterien oder Endotoxine eindringen [Langeland und Langeland, 1968; Ricucci et al., 2019; Ricucci et al., 2020]. Dort verliert die Pulpa die Fähigkeit zur Regeneration (Übergang von einer reversiblen zu einer irreversiblen Pulpitis) [Hahn und Liewehr, 2007 a-c]. Ein Rückgang der Entzündung kann histologisch dagegen nachgewiesen werden, wenn das gesamte kariöse Dentin entfernt wird [Langeland und Langeland, 1968].
Mikroorganismen und ihre Stoffwechselprodukte spielen die entscheidende Rolle bei der Entstehung von pathogenen Pulpaveränderungen und periapikalen Erkrankungen. Das Vorkommen beziehungsweise das Fehlen von Mikroorganismen ist DER bestimmende Faktor bei der Erkrankung beziehungsweise Heilung von Pulpagewebe [Kakehashi et al., 1965; Möller et al., 1981].
Füllungsfrakturen
Eine Grundvoraussetzung für den Erfolg der selektiven Kariesexkavation soll sein, dass die kariöse Läsion durch die hermetisch dichte, adhäsive Restauration von der oralen Umgebung effektiv isoliert wird. Allerdings ist die Haftung von Dentinadhäsiven und Kompositen an kariös verändertem Dentin im Vergleich zur Haftung an kariesfreiem Dentin signifikant niedriger [Xie et al., 1996; Yoshiyama et al., 2002; Say et al., 2005; Tjäderhane, 2015]. Daher zeigen Zähne nach selektiver Kariesexkavation und dentinadhäsiver Restauration einen hochsignifikant niedrigeren Frakturwiderstand der Kompositfüllungen im Vergleich zu vollständig exkavierten und restaurierten Zähnen. Es kam signifikant häufiger zu Frakturen innerhalb der Kompositfüllung und damit zu Undichtigkeiten [Hevinga et al., 2010].
Falls nun Mikroorganismen über diese Frakturspalte unter die Füllung vordringen oder überlebende Bakterien über den eindringenden Speichel Zugang zu Substraten bekommen, setzen sie ihren Dentin-auflösenden Prozess unterhalb der Hybridschicht fort. Die Hybridschicht wird zerstört und es kommt zu einem Kollaps des Dentins sowie einer Separation und damit zu Spaltbildung zwischen Füllung und Dentin. Über dieses Mikroleakage können weitere Bakterien eindringen und zu einer Pulpadegeneration führen.
Ein anderes Problem stellen die Bestandteile der Dentinadhäsive und Kompositmaterialien dar, wenn diese nach der selektiven Kariesexkavation ohne Unterfüllung direkt auf das Dentin in der tiefen Kavität aufgetragen werden. Unpolymerisierte Bestandteile aus Dentinadhäsiven und Kompositen zeigen eine Immunsuppression auf Abwehrzellen der Pulpa und die natürliche Abwehrleistung der Pulpa ist eingeschränkt [Jontell et al., 1995; Bergenholtz, 2000].
Neben den bakteriellen Stoffwechselprodukten (Endotoxine) werden zusätzlich Kompositbestandteile (zum Beispiel Monomere) freigesetzt, die ebenfalls durch das verbliebene Dentin diffundieren und in die Pulpa eindringen. Dadurch wird das Pulpagewebe zusätzlich geschädigt [Schweikl et al., 2017]. Dentinadhäsivbestandteile können dabei problemlos dünne Dentinschichten durchdringen. Zwar führt Karies zu Dentinsklerosierung, aber TEGMA und HEMA diffundieren beispielsweise auch durch sklerosiertes Dentin [Schweikl et al., 2006]. Pulpanekrosen können daher als Folge der kumulativen Auswirkungen von verbleibenden Mikroorganismen durch die selektive Kariesexkavation in Kombination mit pulpatoxischen Restaurationsmaterialien auftreten [Ricucci und Siqueira, 2013].
Fazit
Es gibt eindeutige histologische Beweise dafür, dass ein direkter Zusammenhang zwischen Bakterien, die in der Kavität unter einer Restauration verbleiben, und einer Pulpaentzündung besteht. Histologisch ist das Belassen von Karies unter einer Füllung im Sinne einer selektiven Kariesexkavation nicht zu empfehlen, da dies nachweislich zu einer chronischen, subklinischen Entzündung des Pulpagewebes führt. Um die Pulpa langfristig vital zu erhalten, sollte das kariös-veränderte Dentin vollständig entfernt werden [Wang, 1953; Langeland und Langeland, 1968; Lichtenberg Crone, 1968; Langeland et al.; 1976; Langeland, 1981; Langeland, 1987; Ricucci und Siqueira, 2013; Ricucci et al., 2019; Ricucci et al., 2020].
Das Belassen von kariösem Dentin über der Pulpa ist vergleichbar mit dem Belassen oder Ansiedeln von Bakterien in der Nähe einer chirurgischen Wunde, die dann eine Entzündung unterhalten und zu Nekrosen führen kann [Ricucci et al., 2019]. Aus der Humanmedizin ist kein Behandlungskonzept bekannt, bei dem ein infiziertes, pathologisch verändertes Körpergewebe belassen wird, obwohl es technisch problemlos entfernt werden kann.
Aus all diesen Gründen empfehlen sowohl die Deutsche Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET) als auch die Amerikanische Gesellschaft für Endodontie (AAE) in ihren aktuellen wissenschaftlichen Stellungnahmen zur Vitalerhaltung der Pulpa die vollständige Kariesexkavation. Nur dadurch ist es möglich, den tatsächlichen Zustand des Pulpagewebes klinisch zu beurteilen. Verbleibt kariöses Dentin am Kavitätenboden, behindert dies die Sicht auf mögliche Pulpaveränderungen wie Hyperämie oder Nekrosen (Abbildung 1). Auch besteht das Risiko, eine bereits bestehende minimale Freilegung der Pulpa zu übersehen, wenn eine dünne Schicht kariösen Dentins an der tiefsten Stelle der Kavität verbleibt. Wissenschaftlich lässt sich zudem eine höhere Erfolgswahrscheinlichkeit der derzeit propagierten selektiven Kariesexkavation gegenüber den vitalerhaltenden Maßnahmen nach Freilegung der Pulpa nicht feststellen [Dammaschke et al., 2019; AAE, 2021].
Für eine langfristig erfolgreiche Vitalerhaltung der Pulpa sollte daher auch in tiefen Kavitäten die Karies vollständig exkaviert werden. Abschließend muss die Kavität desinfiziert (Natriumhypochlorit) und der Pulpa-Dentin-Komplex mit einem geeigneten Überkappungsmaterial (Kalziumsilikatzement) versorgt werden [Dammaschke & Benjamin, 2021; Dammaschke et al., 2025].
Letztlich ist die Frage, was man mit seiner Behandlung erreichen möchte. Eine selektive Kariesexkavation führt nach der Behandlung vermutlich „nur“ zu einer klinischen Symptomlosigkeit, aber langfristig nicht zu histologisch gesundem Pulpagewebe. Exkaviert man hingegen vollständig, bleibt das Pulpagewebe auch nach direkter Überkappung oder partieller Pulpotomie zu einem hohen Prozentsatz histologisch gesund.
Da die pulpalen Veränderungen bei Belassen von Karies unter Füllungen in der Regel langsam ablaufen [Langeland, 1981], besteht für die selektive Kariesexkavation möglicherweise dann eine Indikation, wenn die klinische Behandlungssituation schwierig ist und Zähne nur (noch) eine begrenzte Verweildauer im Mund haben, wie zum Beispiel bei sehr jungen Patienten im Milchgebiss oder sehr alten Patienten mit Grunderkrankungen.
Literaturliste
American Association of Endodontists. AAE position statement on vital pulp therapy. J Endod 2021, 47: 1340-1344.
Andrieu E. Traité de Dentisterie Opératiore. 3. ed. J.B. Ballière et Fils, Paris 1889.
Barańska-Gachowska M, Zaleski W, Waszkiewicz-Goloś B. Clinical diagnosis and the histological findings in dental pulp. Pol Med J 1969; 8: 712-724.
Barańska-Gachowska M, Waszkiewicz-Goloś H. Diagnostic significance of clinical manifestations in evaluation of the stage of dental pulp in the light of histological examinations. Pol Med J 1969; 8: 725-735.
Barthel CR, Rosenkranz B, Leuenberg A, Roulet J-F. Pulp capping of carious exposures: treatment outcome after 5 and 10 years: a retrospective study. J Endod 2000; 9: 525-528.
Bergenholtz G. Evidence for bacterial causation of adverse pulpal responses in resin-based dental restorations. Crit Rev Oral Biol Med 2000; 11: 467-480.
Bjørndal L, Fransson H, Bruun G, Markvart M, Kjældgaard M, Näsman P, Hedenbjörk-Lager A, Dige I, Thordrup M. Randomized Clinical Trials on Deep Carious Lesions: 5-Year Follow-up. J Dent Res 2017; 96: 747-753.
Black GV. A work on operative dentistry. Volume I. The pathology of the hard tissues of the teeth. Volume II. Technical procedures in filling teeth. Medico-Dental Publishing Company, Chicago 1908.
Bonsack C. Peut-on laisser de la dentine cariée sous une obturation? SSO Schweiz Monatsschr Zahnheilkd 1948; 58: 586-601.
Bonsack C. Le coiffage naturel peut-on laisser de la dentine cariée sous une obturation? Rev Odontol Parana 1949; 71: 554-567.
Buchalla W, Frankenberger R, Galler K, Krastl G, Kunzelmann K-H, Paris S, Schäfer E. Aktuelle Empfehlungen zur Kariesexkavation. Wissenschaftliche Mitteilung der Deutschen Gesellschaft für Zahnerhaltung (DGZ). Dtsch Zahnärztl Z 2017; 72: 484-494.
Chua SKX, Sim YF, Wang WC, Mok BYY, Yu VSH. One-year outcome of selective caries removal versus pulpotomy treatment of deep caries: A pilot randomized controlled trial. Int Endod J 2023; 56: 1459-1474.
Cooper PR, Takahashi Y, Graham LW, Simon S, Imazato S, Smith AJ. Inflammation-regeneration interplay in the dentine-pulp complex. J Dent 2010; 38: 687-697.
Cushley S, Duncan HF, Lappin MJ, Chua P, Elamin AD, Clarke M, El-Karim IA. Efficacy of direct pulp capping for management of cariously exposed pulps in permanent teeth: a systematic review and meta-analysis. Int Endod J 2021; 54: 556-571.
Dammaschke T. Vital Pulp Treatment Modalities: Direct Pulp Capping. In: Duncan H, El-Karim IA (eds.) Vital Pulp Treatment. Wiley & Sons, Oxford 2024, 84-107.
Dammaschke T, Ather A, Hirschberg C, Bogen G. Vital Pulp Therapy. In: Berman L, Hargreaves K (eds.) Cohen´s Pathways of the Pulp. 13th ed., Elsevier, St. Louis 2025, in Druck.
Dammaschke T,Galler K, Krastl G. Aktuelle Empfehlungen zur Vitalerhaltung der Pulpa. Dtsch Zahnärztl Z 2019; 74: 54-63.
Dammaschke T, Leidinger J, Schäfer E. Long-term evaluation of direct pulp capping--treatment outcomes over an average period of 6.1 years. Clin Oral Investig 2010; 14: 559-567.
Donnermeyer D, Dammaschke T, Lipski M, Schäfer E. Effectiveness of diagnosing pulpitis: A systematic review. Int Endod J 2023; 56 (Suppl 3): 296-325.
European Society of Endodontology (ESE) developed by: Duncan HF, Galler KM, Tomson PL, Simon S, El-Karim I, Kundzina R, Krastl G, Dammaschke T, Fransson H, Markvart M, Zehnder M, Bjørndal L. European Society of Endodontology position statement: Management of deep caries and the exposed pulp. Int Endod J 2019; 52: 923-934.
Fehrenbach MJ (ed.) Mosby’s Dental Dictionary, 4th ed, Mosby Elsevier, St. Louis 2020.
Greth H. Diagnostik der Pulpaerkrankungen. Sammlung Meuser, Heft 25, Hermann Meuser, Berlin 1933.
Gulabivala K, Ng Y-L. Outcomes of endodontic therapy. In: Rotstein I, Ingle JI (eds.) Ingle´s Endodontics. 7th ed. PMPH USA, New Haven 2019, 1019-1066.
Hahn CL, Liewehr FR. Relationships between caries bacteria, host responses, and clinical signs and symptoms of pulpitis. J Endod 2007a; 33: 213-219.
Hahn CL, Liewehr FR. Innate immune responses of the dental pulp to caries. J Endod 2007b; 33: 643-651.
Hahn CL, Liewehr FR. Update on the adaptive immune responses of the dental pulp. J Endod 2007c; 33: 773-781.
Heinrich R, Kneist S, Künzel W. Klinisch kontrollierte Untersuchung zur Caries-profunda-Therapie am Milchmolaren. Dtsch Zahnärztl Z 1991; 46: 581-584.
Hermann B. Ein weiterer Beitrag zur Frage der Pulpenbehandlung. Zahnärztl Rundsch 1928; 37: 1327-1376.
Hermann B. Dentinobliteration der Wurzelkanäle nach Behandlung mit Calcium. Zahnärztl Rundsch 1930; 39: 888-899.
Hevinga MA, Opdam NJ, Frencken JE, Truin GJ, Huysmans MCDNJM. Does incomplete caries removal reduce strength of restored teeth? J Dent Res 2010; 89: 1270-1275.
Hotz PR. Muss Karies vollständig entfernt werden? Schweiz Monatsschr Zahnmed 2003; 113: 262-266.
Jontell M, Hanks CT, Bratel J, Bergenholtz G. Effects of unpolymerized resin components on the function of accessory cells derived from the rat incisor pulp. J Dent Res 1995; 74: 1162-1167.
Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposure of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol 1965; 20: 340-349.
Kidd EA. How “clean” must a cavity be before restoration? Caries Res 2004; 38: 305-313.
Kuwabara RK, Massler M. Pulpal reactions to active and arrested carious lesions. J Dent Child 1966; 33: 190-204.
Labib ME, Hassanein OE, Moussa M, Yassen A, Schwendicke F. Selective versus stepwise removal of deep carious lesions in permanent teeth: a randomised controlled trial from Egypt - an interim analysis. BMJ Open 2019; 9: e030957.
Langeland K. Histologic evaluation of pulp reactions to operative procedures. Oral Surg Oral Med Oral Pathol 1959; 12: 1235-1248.
Langeland K. Management of the inflamed pulp associated with deep carious lesion. J Endod 1981; 7: 169-181.
Langeland K. Tissue response to dental caries. Endod Dent Traumatol 1987; 3: 149-171.
Langeland K, Anderson DM, Cotton WR, Shklair IL. Microbiological aspects of dentin caries and their pulpal sequelae. In: Proceedings International Symposium on Amalgam and Tooth-Coloured Restorative Materials. University of Nijmegen, Nijmegen 1976, 173-202.
Langeland K, Langeland LK. Indirect capping and the treatment of deep carious lesions. Int Dent J 1968; 18: 326-380.
Lasfargues J-J, Machtou P. Collège National des Enseignants en Odontologie Conservatrice et Endodontie (CNEOC). Dictionnaire Francophone des termes d´Odontologie Conservatrice. Endodontie & Odontologie restauratrice, 2ème édition, Espace id, Paris 2010.
Lichtenberg Crone F. Deep dentinal caries from a microbiological point of view. Int Dent J 1968; 18: 481-488.
Lima KC, Coelho LT, Pinheiro IV, Rôças IN, Siqueira JF jr. Microbiota of dentinal caries as assessed by reverse-capture checkerboard analysis. Caries Res 2011; 45: 21-30.
Love RM. Bacterial adhesins - their role in tubule invasion and endodontic disease. Aust Endod J 2002; 28: 25-28.
Love RM, Jenkinson HF. Invasion of dentinal tubules by oral bacteria. Crit Rev Oral Biol Med 2002; 13: 171-183.
Lundy T, Stanley HR. Correlation of pulpal histopathology and clinical symptoms in human teeth subjected to experimental irritation. Oral Surg Oral Med Oral Pathol 1969; 27: 187-201.
Maltz M, Alves LS, Jardim JJ, dos Santos Moura M, Ferreira de Oliveira E. Incomplete caries removal in deep lesions: A 10-year prospective study. Am J Dent 2011; 24: 211-214.
Maltz M, Koppe B, Jardim JJ, Alves LS, de Paula LM, Yamaguti PM, Almeida JCF, Moura MS, Mestrinho HD. Partial caries removal in deep caries lesions: a 5-year multicenter randomized controlled trial. Clin Oral Investig 2018; 22: 1337-1343.
Massler M. Pulpal reaction to dental caries. Int Dent J 1967; 17: 441-460.
Mertz-Fairhurst EJ, Curtis JW jr, Ergle JWW, Rueggeberg FA, Adair SM. Ultraconservative and cariostatic sealed restorations: results at year 10. J Am Dent Assoc 1998; 129: 55-66.
Michaelson PL, Holland GR. Is pulpitis painful? Int Endod J 2002; 35: 829-832.
Miller WD. Lehrbuch der Conservirenden Zahnheilkunde. Thieme, Leipzig 1896.
Möller AJ, Fabricius L, Dahlén G, Ohman AE, Heyden G. Influence on periapical tissues of indigenous oral bacteria and necrotic pulp tissue in monkeys. Scand J Dent Res 1981; 89:475-484.
Nissan R, Segal H, Pashley D, Stevens R, Trowbridge H. Ability of bacterial endotoxin to diffuse through human dentin. J Endod 1995; 21: 62-64.
Ogushi K, Fusayama T. Electron microscopic structure of the two layers of carious dentin. J Dent Res 1975; 54: 1019-1026.
Paddick JS, Brailsford SR, Kidd EA, Beighton D. Phenotypic and genotypic selection of microbiota surviving under dental restorations. Appl Environ Microbiol 2005; 71: 2467-2472.
Preiswerk G. Lehrbuch und Atlas der Zahnheilkunde mit Einschluß der Mundkrankheiten. Lehmann, München 1903.
Rebel H-H. Über die Ausheilung der freigelegten Pulpa. Dtsch Zahnheilkd 1922; 55: 3-83.
Rechithra R, Wani W, Sharma S, Kumar V, Chawla A, Kalaivani M, Logani A. Selective removal to soft dentine versus full pulpotomy for management of proximal deep carious lesions: a randomized controlled non-inferiority trial. Caries Res 2023; 57: 536-545.
Ricketts D, Lamont T, Innes NP, Kidd E, Clarkson JE. Operative caries management in adults and children. Cochrane Database Syst Rev 2013; 3: CD003808.
Ricketts D, Lamont T, Innes NP, Kidd E, Clarkson JE. WITHDRAWN: Operative caries management in adults and children. Cochrane Database Syst Rev 2019; 7: CD003808.
Ricucci D, Loghin S, Siqueira JF jr. Correlation between clinical and histologic pulp diagnoses. J Endod 2014; 40: 1932-1939.
Ricucci D, Rôças IN, Alves FRF, Cabello PH, Siqueira JF jr. Outcome of direct pulp capping using calcium hydroxide: a long-term retrospective study. J Endod 2023; 49: 45-54.
Ricucci D, Siqueira JF jr, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent 2019; 86: 41-52.
Ricucci D, Siqueira JF jr, Rôças IN, Lipski M, Shiban A, Tay FR. Pulp and dentine responses to selective caries excavation: A histological and histobacteriological human study. J Dent 2020; 100: 103430.
Ricucci D, Siqueira JF jr. Endodontology. An integrated biological and clinical view. Quintessence, London 2013.
Rôças IN, Alves FR, Rachid CT, Lima KC, Assunção IV, Gomes PN, Siqueira JF jr. Microbiome of deep dentinal caries lesions in teeth with symptomatic irreversible pulpitis. PLoS One 2016; 11: e0154653.
Rôças IN, Lima KC, Assuncao IV, Gomes PN, Bracks IV, Siqueira JF jr. Advanced caries microbiota in teeth with irreversible pulpitis. J Endod 2015; 41: 1450-1455.
Say EC, Nakajima M, Senawongse P, Soyman M, Ozer F, Tagami J. Bonding to sound vs caries-affected dentin using photo- and dual-cure adhesives. Oper Dent 2005; 30: 90-98.
Schäfer E, Hickel R, Geurtsen W, Heidemann D, Löst C, Petschelt A, Raab WH-M. Offizielles Endodontologisches Lexikon – mit einem Anhang für Materialien und Instrumente – der Deutschen Gesellschaft für Zahnerhaltung. Endodontie 2000; 9: 129-160.
Schmidt J, Ziebolz D, Haak R. Selektive Kariesentfernung. Vitalerhaltung der Pulpa aus kariologischer Sicht. Endodontie 2024; 33: 159-168.
Schweikl H, Buchalla W, Krifka S. Cell responses to cariogenic microorganisms and dental resin materials - crosstalk at the dentin-pulp interface? Dent Mater 2017; 33: 514-524.
Schweikl H, Spangnuolo G, Schmalz G. Genetic and cellular toxicology of dental resin monomers. J Dent Res 2006; 85: 870-877.
Schwendicke F, Dörfer CE, Paris S. Incomplete caries removal: a systematic review and meta-analysis. J Dent Res 2013; 92: 306-314. Erratum in: J Dent Res 2013; 92: 759.
Schwendicke F, Walsh T, Lamont T, Al-Yaseen W, Bjørndal L, Clarkson JE, Fontana M, Gomez Rossi J, Göstemeyer G, Levey C, Müller A, Ricketts D, Robertson M, Santamaria RM, Innes NP. Interventions for treating cavitated or dentine carious lesions. Cochrane Database Syst Rev 2021; 7: CD013039.
Seltzer S, Bender IB, Ziontz M. The dynamics of pulpal inflammation: correlations between diagnostic data and actual histologic findings in the pulp. Oral Surg Oral Med Oral Pathol 1963; 16: 871-876.
Taschieri S, Del Fabbro M, Samaranayake L, Chang JW, Corbella S. Microbial invasion of dentinal tubules: a literature review and a new perspective. J Investig Clin Dent 2014; 5: 163-170.
Tjäderhane L. Dentin bonding: can we make it last? Oper Dent 2015; 40: 4 - 18.
Wang U. Die indirekte Pulpaüberkappung mit Calxyl im Vergleich zur sogenannten „natürlichen Pulpaüberkappung“ - Klinische und histologische Untersuchung. SSO Schweiz Monatsschr Zahnheilkd 1953; 63: 1135-1175.
Xie J, Flaitz CM, Hicks MJ, Powers JM. Bond strength of composite to sound and artificial carious dentin. Am J Dent 1996; 9: 31-33.
Yoshiyama M, Tay FR, Doi J, Nishitani Y, Yamada T, Itou K, Carvalho RM, Nakajima M, Pashley DH. Bonding of self-etch and total-etch adhesives to carious dentin. J Dent Res 2002; 81: 556-560.