Wurzelresorptionen frühzeitig erkennen und richtig behandeln
Zahnhartsubstanzdefekte, die durch Resorptionen verursacht werden, werden häufig zufällig bei routinemäßigen zahnärztlichen Untersuchungen entdeckt. Ihr klinisches und röntgenologisches Erscheinungsbild ist äußerst vielfältig, was die genaue Diagnosestellung für Zahnärztinnen und Zahnärzte erschwert. Im Gegensatz zur natürlichen Resorption von Milchzahnwurzeln handelt es sich bei Resorptionsvorgängen an bleibenden Zähnen immer um pathologische Vorgänge, die in der Regel eine therapeutische Intervention erfordern.
Prof. Dr. Matthias Widbiller
Poliklinik für Zahnerhaltung und Parodontologie / Zahntraumazentrum
Universitätsklinikum Regensburg,
Franz-Josef-Strauß-Allee 11, 93053 Regensburg
matthias.widbiller@ukr.de
2008–2013: Studium der Zahnheilkunde an der Universität Regensburg
seit 2014: Wissenschaftlicher Mitarbeiter an der Poliklinik für Zahnerhaltung und Parodontologie des Universitätsklinikums Regensburg
2015: Promotion zum Dr. med. dent.
seit 2016: Koordination des Zahntraumazentrums am Universitätsklinikum Regensburg
2017–2018: Postdoc am University of Texas Health Science Center in San Antonio (UTHSCSA), USA
2019: Habilitation und Ernennung zum Privatdozenten an der Fakultät für Medizin der Universität Regensburg
seit 2021: Leitung des Forschungslabors der Poliklinik für Zahnerhaltung und Parodontologie
2023: Berufung zum ordentlichen Professor für Endodontologie an der Universität Regensburg
Forschungsschwerpunkte: Immunprozesse in der Zahnpulpa, bioaktive Proteine der Dentinmatrix, Tissue Engineering der Zahnpulpa. Klinische Schwerpunkte: dentale Traumatologie, Vitalerhaltung der Pulpa, endodontische Regeneration.
Prof. Dr. Gabriel Krastl
Poliklinik für Zahnerhaltung und Parodontologie / Zahnunfallzentrum
Universitätsklinikum Würzburg,
Pleicherwall 2, 97070 Würzburg
Krastl_G@ukw.de
1998–2005: Wissenschaftlicher Assistent (ab 2002 Oberarzt), Poliklinik für Zahnerhaltung, Tübingen
2005–2014: Oberarzt, Klinik für Parodontologie, Endodontologie und Kariologie, Basel, Schweiz
seit 2014: Direktor der Poliklinik für Zahnerhaltung und Parodontologie und Leiter des Zahnunfallzentrums, Würzburg
seit 2016: Generalsekretär der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie e.V. (DGET)
seit 2018: Geschäftsführender Direktor des Zentrums für Zahn-, Mund- und Kiefergesundheit am Universitätsklinikum Würzburg
Klinische und wissenschaftliche Schwerpunkte: Dentale Traumatologie, Ästhetische Zahnheilkunde, Endodontologie. Über 250 Publikationen, vornehmlich in den genannten Bereichen. Mitglied des Herausgeberbeirats verschiedener wissenschaftlicher Zeitschriften, unter anderem Dental Traumatology, Journal of Adhesive Dentistry, International Endodontic Journal, Dentistry Journal.
Pathophysiologie
Obwohl der menschliche Knochen einem ständigen Umbau unterliegt, sind die Zähne über den Parodontalapparat im Kieferknochen verankert, ohne selbst an den Knochenumbauprozessen beteiligt zu sein. Dies ist speziellen Gewebeelementen zu verdanken, die das Eindringen von Hartgewebe abbauenden Zellen, den Odontoklasten, in den Zahn verhindern. Schutzbarrieren an der Außenseite der Zahnwurzel sind das Präzement, die Zementoblasten und das parodontale Ligament (Abbildung 1). Gleichzeitig wird das Pulpenkavum durch eine Schicht aus Prädentin und Odontoblasten, die die Kanalwand auskleidet, vor resorptiven Prozessen von innen geschützt (Abbildung 1) [Heboyan et al., 2022; Trope, 1998].
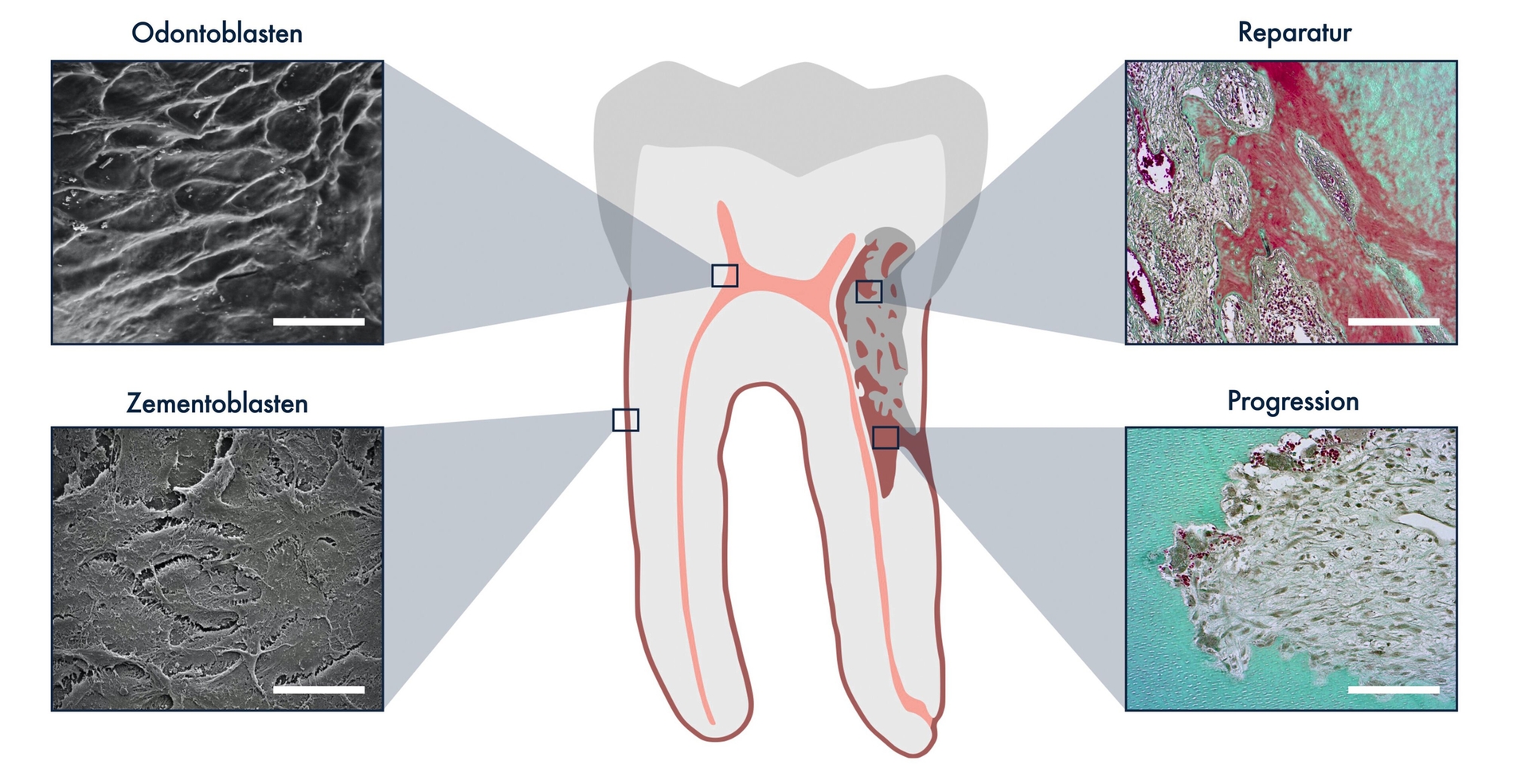
Die genauen Ursachen pathologischer Wurzelresorptionen sind oft unbekannt. Man weiß jedoch, dass die Zerstörung der Schutzbarriere des Zahnes und ein zusätzlicher Reiz notwendig sind, damit die Odontoklasten das Dentin angreifen und abbauen können. Bei relativ kleinflächigen Defekten (< 20 Prozent der Wurzeloberfläche) kann eine autonome Regeneration durch parodontale Zellen erfolgen, wodurch die Schutzbarriere wiederhergestellt wird [Andreasen und Kristerson, 1981]. Ist das Ausmaß der regenerationsfähigen Defektgröße überschritten, dringt das entzündliche Resorptionsgewebe zunächst in die Zahnwurzel ein. Bei weiteren Reizen breitet sich die Resorption allmählich im Zahn in alle Richtungen aus (Progression). Nach der Auflösung durch das entzündliche Gewebe kommt es zu einem knochenähnlichen Umbau der Zahnhartsubstanz, der als Reparatur bezeichnet wird. Während die Resorptionen in der Progressionsphase radiologisch transluzent sind, stellen sich die Defekte in der anschließenden Reparaturphase als radioopak dar.
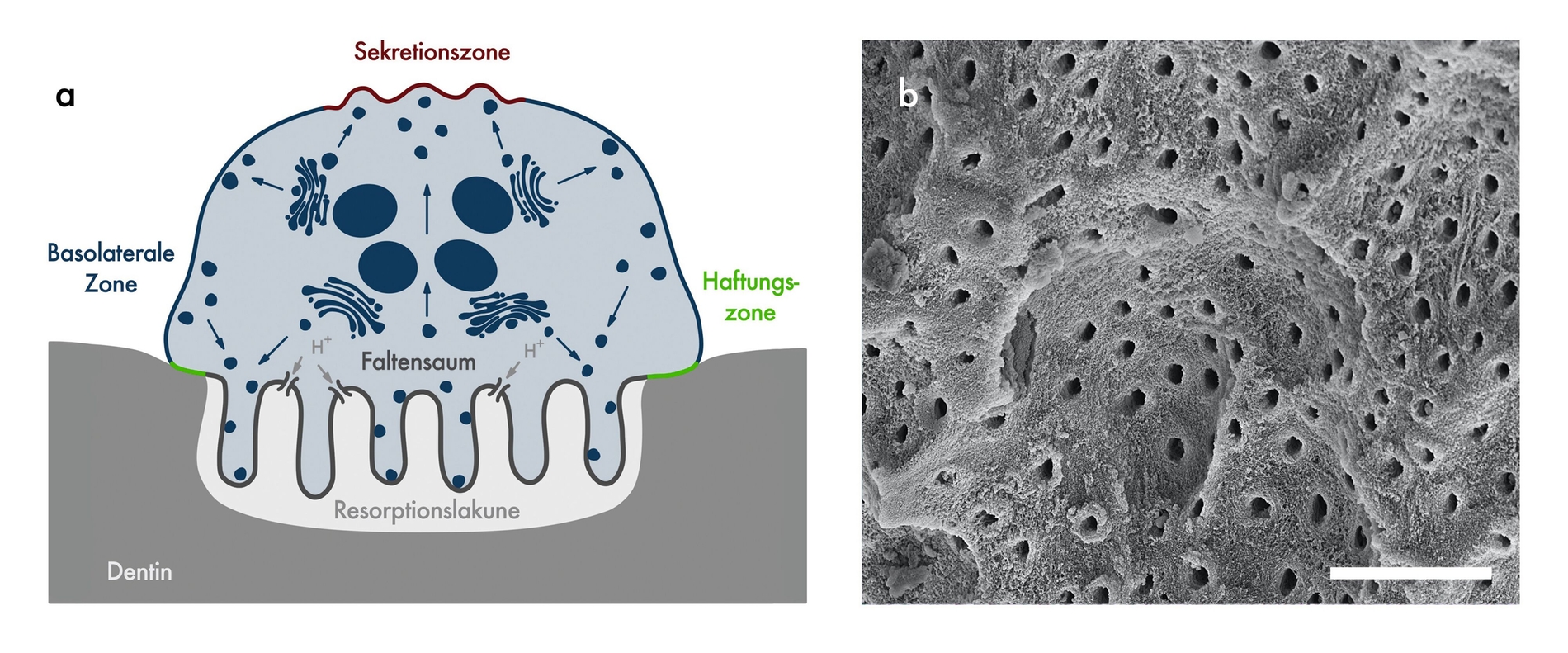
Odontoklasten sind mehrkernige Riesenzellen, die durch ihre Haftung am Dentin stabile Resorptionslakunen bilden (Abbildung 2). Im Bereich des basalen Faltensaumes setzen sie Enzyme wie Kollagenasen und Proteasen aus den Lysosomen frei, die die organische Matrix abbauen. Zusätzlich bewirken die sezernierten Ionen (H+, Cl-) eine Absenkung des pH-Wertes, was zur Auflösung des mineralisierten Gewebes führt. Odontoklasten sind eng verwandt mit den etwas größeren Osteoklasten, die zum mononukleär-phagozytären System gehören und am physiologischen Knochenumbau beteiligt sind. Diese Zellen entstehen aus Vorläuferzellen, die sich durch Bindung von Signalmolekülen wie RANKL (Receptor Activator of NF-κB Ligand) und M-CSF (Macrophage Colony-stimulating Factor) an zelleigene Rezeptoren in mehreren Schritten differenzieren [Suda et al., 1999; Widbiller, 2020]. Die Signalmoleküle RANKL und M-CSF sowie der biologische Gegenspieler von RANKL, OPG (Osteoprotegerin) werden von Osteoblasten, den knochenbildenden Zellen, gebildet. Darüber hinaus können auch Zementoblasten und Pulpazellen OPG als Teil eines Schutzmechanismus produzieren, um die Differenzierung und Aktivierung klastischer Zellen zu hemmen und so Resorptionen zu verhindern [Galler et al., 2021; Iglesias-Linares und Hartsfield, 2017; Kim et al., 2020].
Ätiologie
Verletzungen der schützenden Barriere auf der Oberfläche der Zahnwurzel treten häufig als Folge von Zahnunfällen auf. Bei schweren Traumata, zum Beispiel Intrusionen, können erhebliche mechanische Schäden auftreten. Nach Avulsionen können unsachgemäße Lagerung und Austrocknung zu Schädigungen der Desmodontalzellen führen [Krastl et al., 2021; Souza et al., 2020].
Häufig werden auch übermäßige kieferorthopädische Belastungen als Auslöser von Wurzelresorptionen beobachtet. Weitere mögliche Ursachen sind Verletzungen bei zahnärztlichen Eingriffen wie Zahnextraktionen, parodontalen Reinigungen oder intrakoronalen Zahnaufhellungen. Impaktierte Zähne, Zysten oder Tumoren können ebenfalls zu Resorptionen in benachbarten Regionen führen [Fuss et al., 2003]. Eine besondere Situation ergibt sich bei Resorptionen im Rahmen von systemischen Erkrankungen oder Syndromen, die mit Störungen des Knochenstoffwechsels einhergehen [Yu et al., 2011]. In diesen Fällen treten resorptive Defekte meist bilateral an mehreren Zähnen auf.
Klassifikation
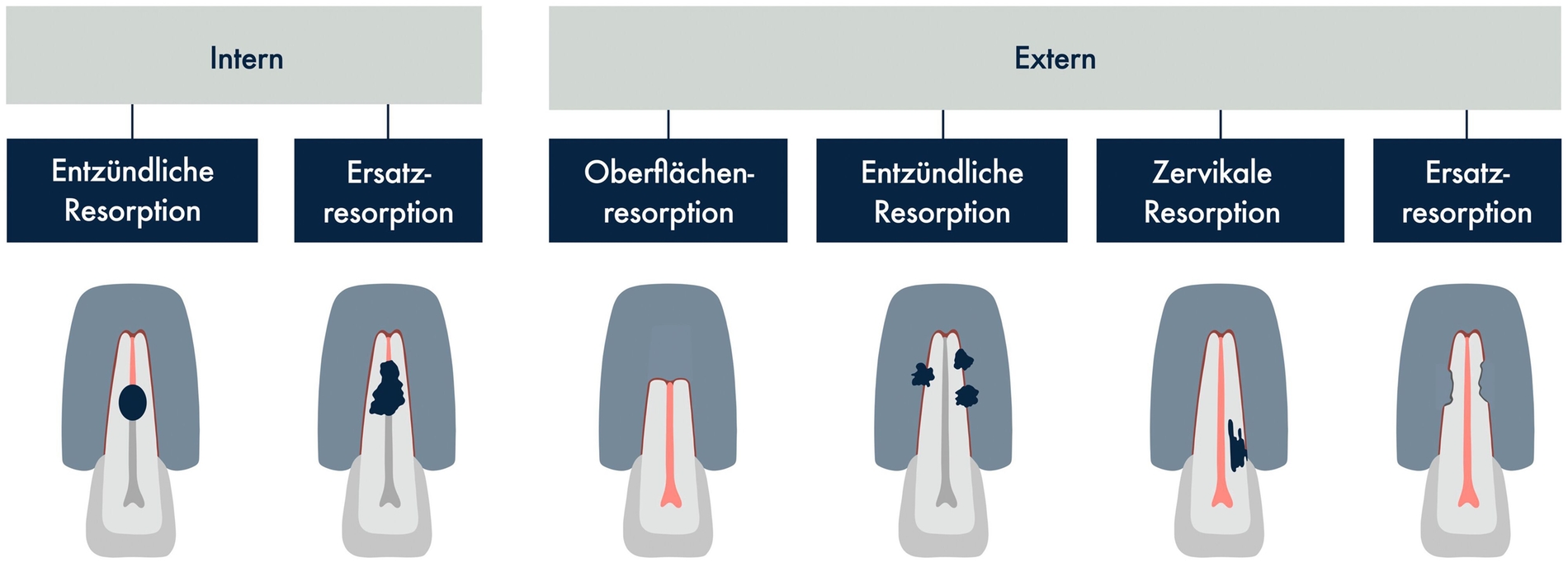
Je nach Ursprungsort der Resorption kann zunächst zwischen interner (vom Zahninneren ausgehender) und externer (von der Wurzelaußenseite ausgehender) Resorption unterschieden werden. Die systematische Kategorisierung berücksichtigt auch die Lokalisation der Läsion und den Infektionsstatus (Abbildung 3). Während transiente Resorptionen in der Regel von selbst abheilen, erfordern progressive Resorptionen eine therapeutische Intervention [Fuss et al., 2003; Patel et al., 2023; Patel und Ford, 2017].
Interne Wurzelresorption
Interne Wurzelresorptionen zeigen in der Regel einen progressiven Verlauf und können in entzündliche Resorptionen und Ersatzresorptionen unterteilt werden [Fuss et al., 2003; Patel et al., 2023]. Über die Prävalenz interner Wurzelresorptionen liegen in der Literatur kaum gesicherte Daten vor, ihr Vorkommen scheint jedoch häufig unterschätzt zu werden [Patel et al., 2022].
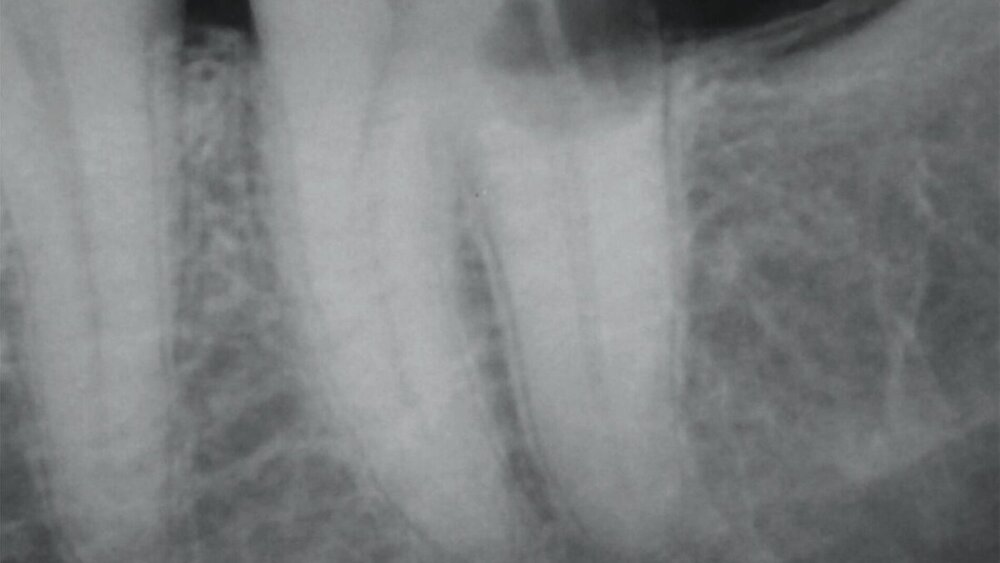
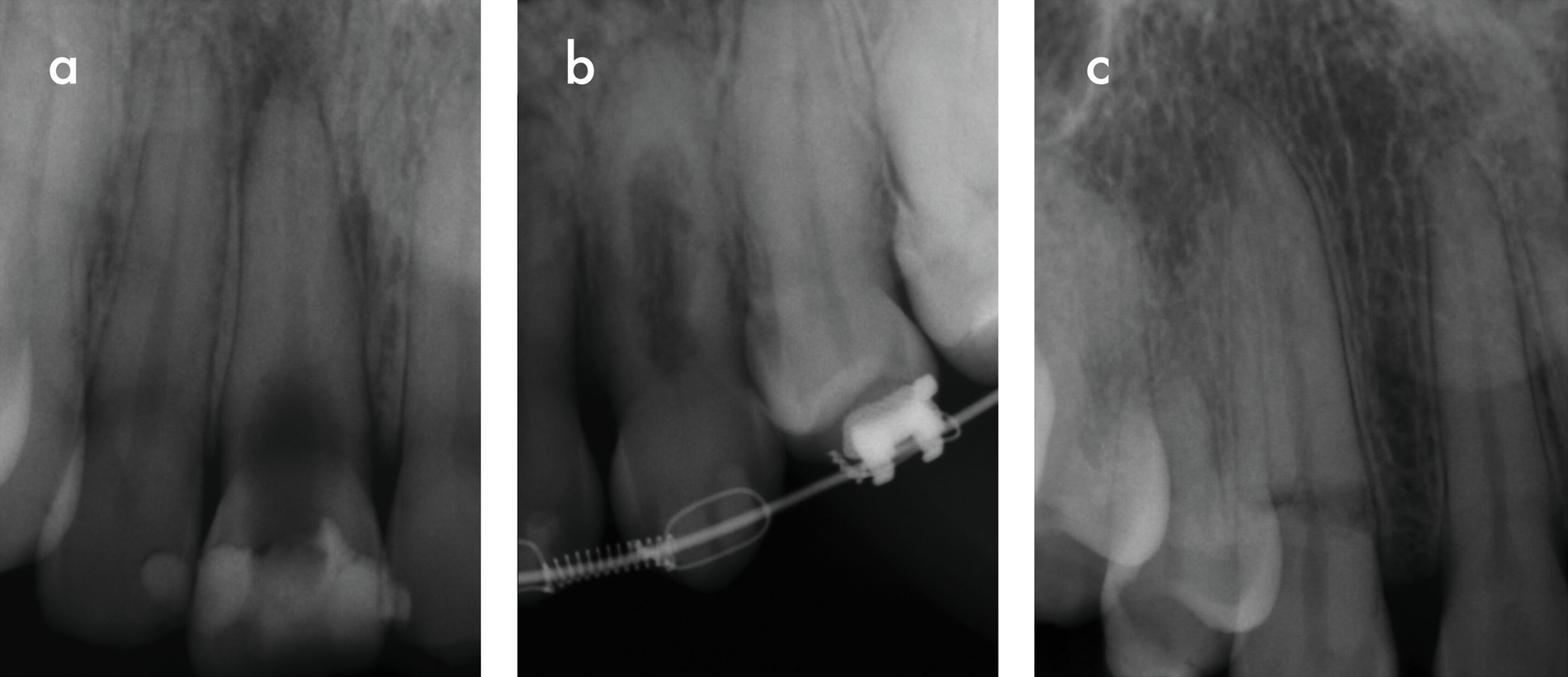
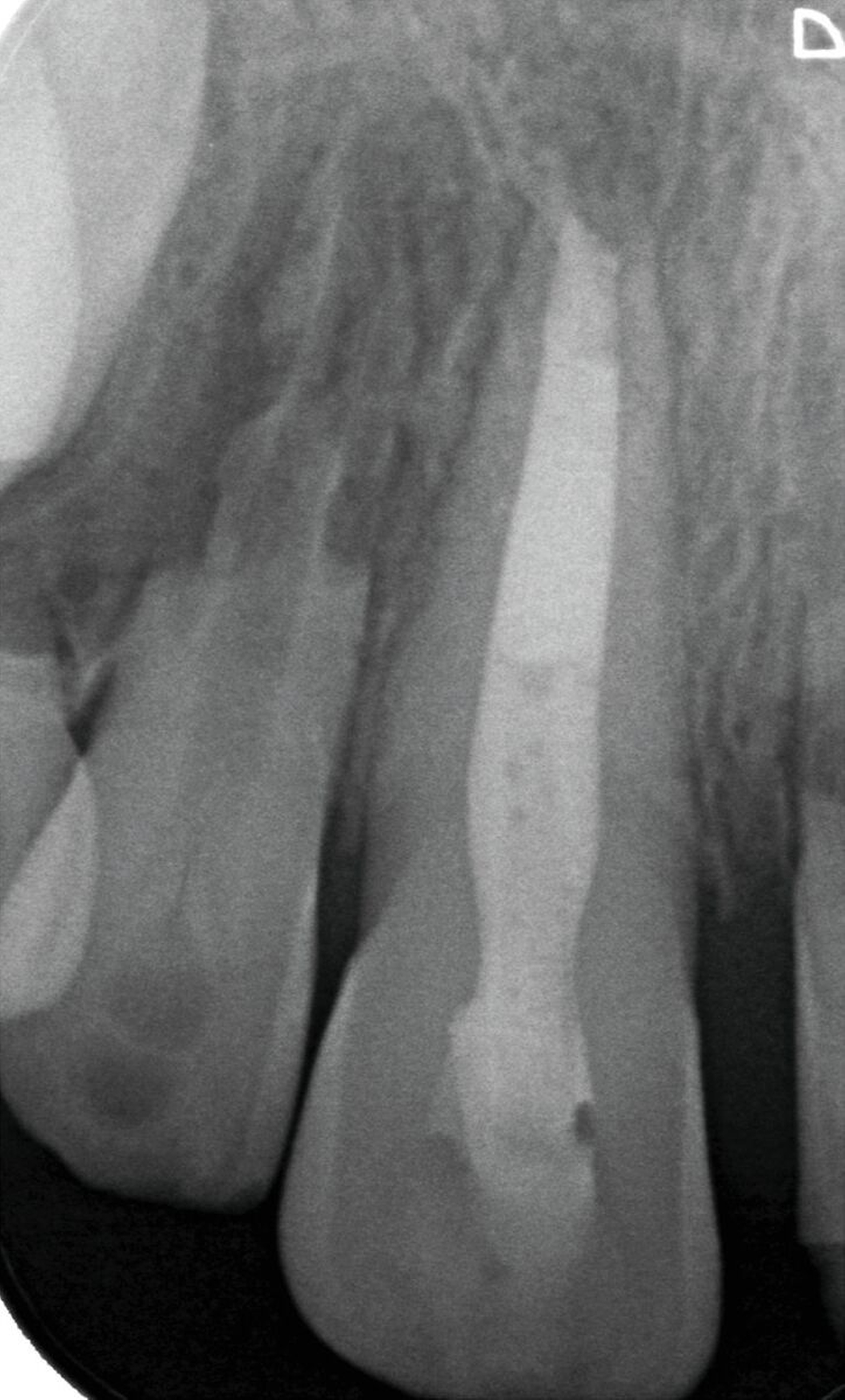
Die entzündliche Resorption wird durch Bakterien aus der nekrotischen koronalen Pulpa stimuliert und durch vitales Pulpagewebe apikal der Resorptionsfront aufrechterhalten (Abbildung 4a). Zusätzlich findet sich Granulationsgewebe im Inneren der Zahnwurzel. Wenn zusätzlich zu diesem Granulationsgewebe knochenähnliches Reparaturgewebe gebildet wird, spricht man von interner Ersatzresorption (Abbildung 4b). In beiden Fällen können je nach Pulpastatus Schmerzen auftreten. Radiologisch stellt sich die entzündliche interne Wurzelresorption meist als ovale oder zirkuläre, ballonartige Aufhellung des Wurzelkanals dar, während die Ersatzresorption ein unregelmäßiges, wolkiges und oft unscharf begrenztes Erscheinungsbild zeigt [Nilsson et al., 2013; Patel et al., 2010]. Es ist zu beachten, dass externe invasive zervikale Resorptionen (siehe unten) bei entsprechender Projektion häufig als interne Resorptionen fehlinterpretiert werden.
Eine Sonderform interner Wurzelresorptionen tritt im Rahmen von Reparaturvorgängen nach intraalveolären Wurzelfrakturen auf. Diese verlaufen häufig transient (Abbildung 4c). Eine klinische Symptomatik ist in der Regel nicht vorhanden, radiologisch lassen sich jedoch transiente Umbauprozesse entlang der Frakturlinie nachweisen [Andreasen, 2003; Andreasen und Andreasen, 1988].
Externe Oberflächenresorption
Als Ursache für diese Art der Resorption wird übermäßiger Druck angesehen, der zunächst zu Sauerstoffmangel und Kompression der Blutgefäße im parodontalen Ligament führt. Der auslösende Druck kann durch verlagerte Zähne, kieferorthopädische Kräfte, Zysten oder Tumore entstehen. Dies wiederum führt im weiteren Verlauf zu einer Schädigung der Zementoblasten und des Präzements, wodurch die Wurzeloberfläche für Odontoklasten angreifbar wird [Hohmann et al., 2007; Iglesias-Linares und Hartsfield, 2017]. Bei der Oberflächenresorption handelt es sich demnach um eine transiente Form, die progressiv fortschreitet, solange der Reiz nicht beseitigt wird. Oberflächenresorptionen verursachen aber nicht nur oberflächliche Defekte an der Zahnwurzel, sondern können ohne rechtzeitige Intervention zu massiven und ausgedehnten Zerstörungen der betroffenen Zähne führen.
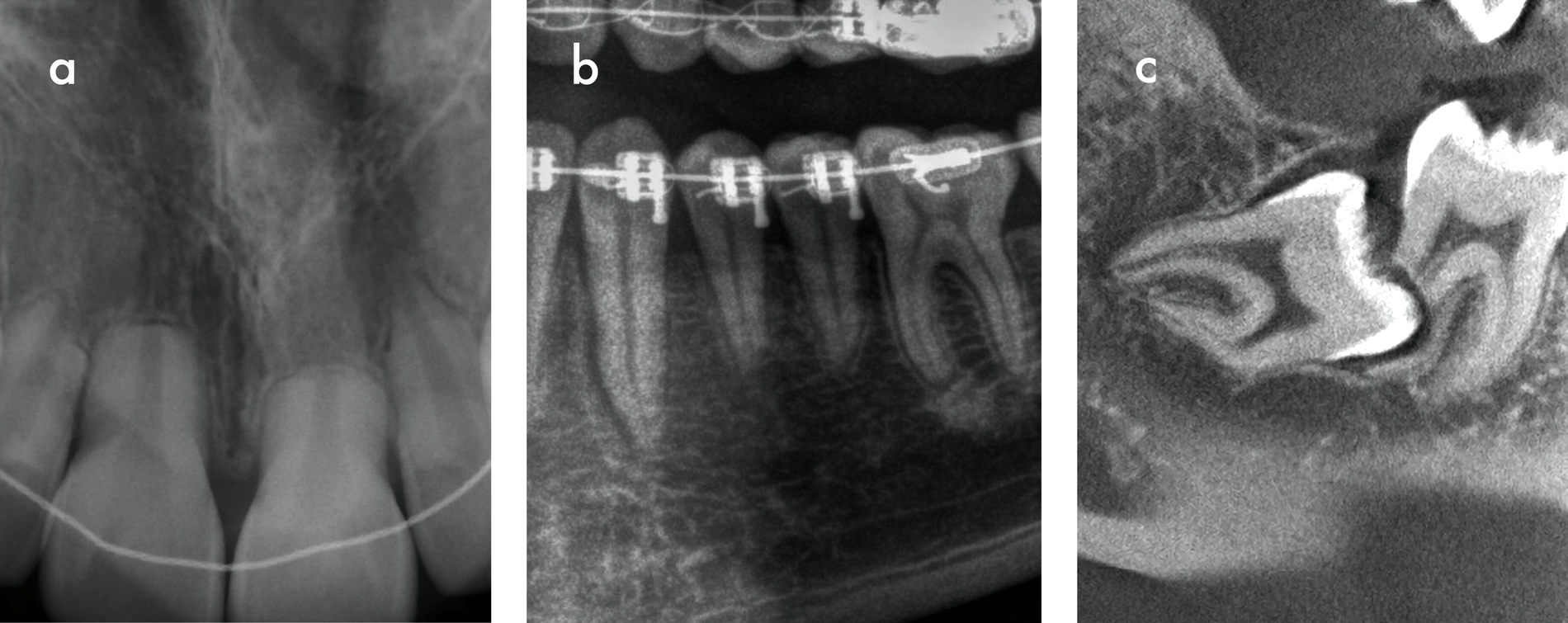
Verschiedene Studien haben bisher die Prävalenz von Oberflächenresorptionen untersucht. Es wird berichtet, dass bis zu fünf Prozent der kieferorthopädisch behandelten Zähne eine starke Oberflächenresorption (> 4 mm oder Verlust von 1/3 der Wurzel) aufweisen [Killiany, 1999; Weltman et al., 2010]. Kieferorthopädisch behandelte Zähne, die in der Vergangenheit ein Zahntrauma erlitten haben, sind dabei für resorptive Ereignisse besonders anfällig [Malmgren et al., 1982]. Die Inzidenz externer Oberflächenresorptionen an zweiten Molaren durch verlagerte dritte Molaren beträgt bis zu 55 Prozent [Matzen et al., 2017; Yamaoka et al., 1999]. Schwere Fälle können erhebliche Schäden verursachen und sogar zum Zahnverlust führen. Die Prävalenz von Oberflächenresorptionen im Zusammenhang mit Zysten liegt einer Studie zufolge in der asiatischen Bevölkerung bei 38 Prozent [Teo et al., 2021].
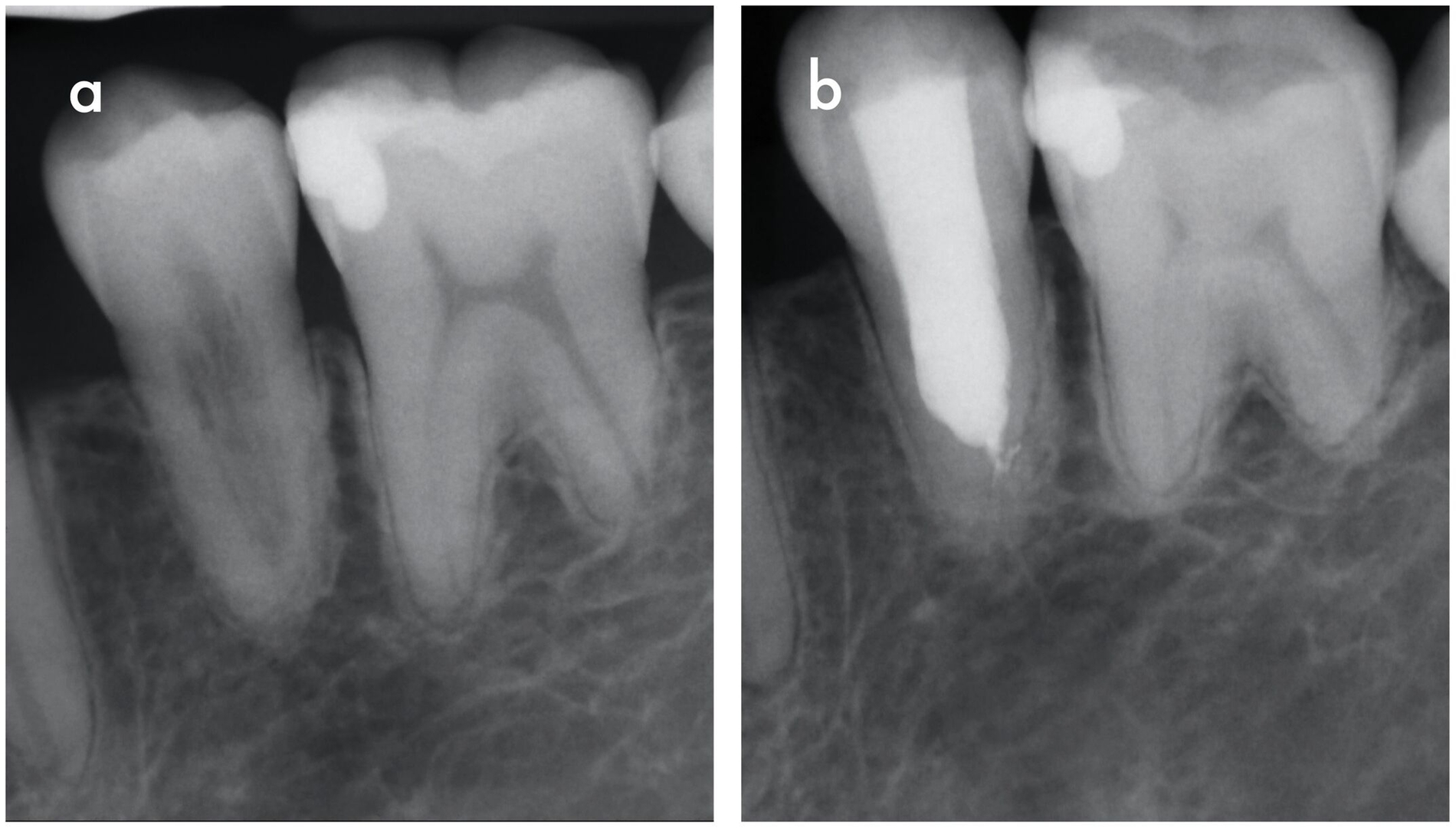
Der klinische Verlauf von externen Oberflächenresorptionen ist in der Regel asymptomatisch und die betroffenen Zähne reagieren meist positiv auf Sensibilitätstests. Die radiologischen Befunde sind in Form und Größe sehr heterogen (Abbildung 5). Im Zusammenhang mit kieferorthopädisch bedingten Resorptionen ist beispielsweise häufig eine scheinbare Abstumpfung der Wurzelspitze zu beobachten, wodurch die Zähne insgesamt kürzer erscheinen als die nicht von resorptiven Prozessen betroffenen Nachbarzähne [Sameshima und Iglesias-Linares, 2021; Sondeijker et al., 2019].
Externe entzündliche (infektionsbedingte) Resorption
Die Schädigung der äußeren Schutzbarriere der Zahnwurzel und die gleichzeitige bakterielle Besiedlung des Wurzelkanals infolge einer Pulpanekrose führen zu externen entzündlichen Resorptionen. Diese treten häufig als Komplikation nach Zahntraumata auf, insbesondere nach Avulsionen und Intrusionen [Krastl et al., 2021; Souza et al., 2020]. Es wird berichtet, dass externe entzündliche Resorptionen vor allem bei schweren Dislokationsverletzungen entstehen [Crona-Larsson et al., 1991]. Entzündliche Resorptionen wurden bei 38 Prozent der Zähne nach Intrusionen und bei 30 Prozent der Zähne nach Replantation bei Avulsionen beschrieben [Andreasen und Pedersen, 1985; Crona-Larsson et al., 1991]. Extrusionen und laterale Dislokationen führen nur in sechs Prozent beziehungsweise drei Prozent zu entzündlichen Resorptionen. Bei leichten Verletzungen wie Konkussionen oder Lockerungen sind diese dagegen sehr selten [Andreasen und Pedersen, 1985].
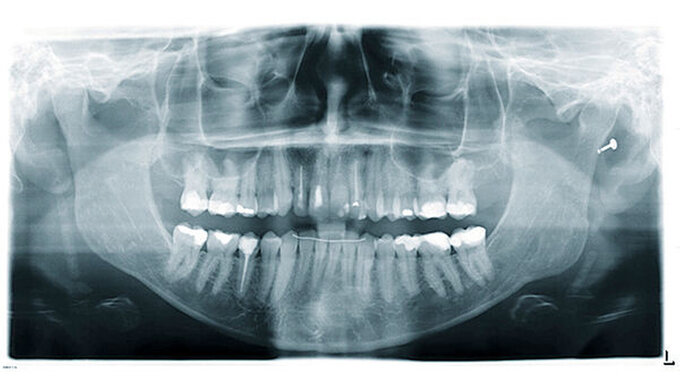
Entzündliche Resorptionen sind bei fehlender klinischer Symptomatik häufig ein radiologischer Zufallsbefund. Sie können aber auch mit einer symptomatischen Entwicklung wie irreversibler Pulpitis oder apikaler Parodontitis einhergehen. Resorptionsdefekte an der Wurzeloberfläche erscheinen im Röntgenbild aufgrund ihres raschen Fortschreitens oft zerklüftet (Abbildung 6). Entlang einer unregelmäßigen Wurzelaußenkontur sind transluzente Zonen im Sinne von „schüsselförmigen“ Resorptionslakunen unterschiedlicher Größe zu erkennen. Häufig findet man verkürzte Wurzeln mit zusätzlichen periapikalen Aufhellungen. In fortgeschrittenen Fällen kann die Resorption bis ins Zahninnere vordringen und den Wurzelkanal perforieren [Andreasen und Hjørting-Hansen, 1966; Finucane und Kinirons, 2003].
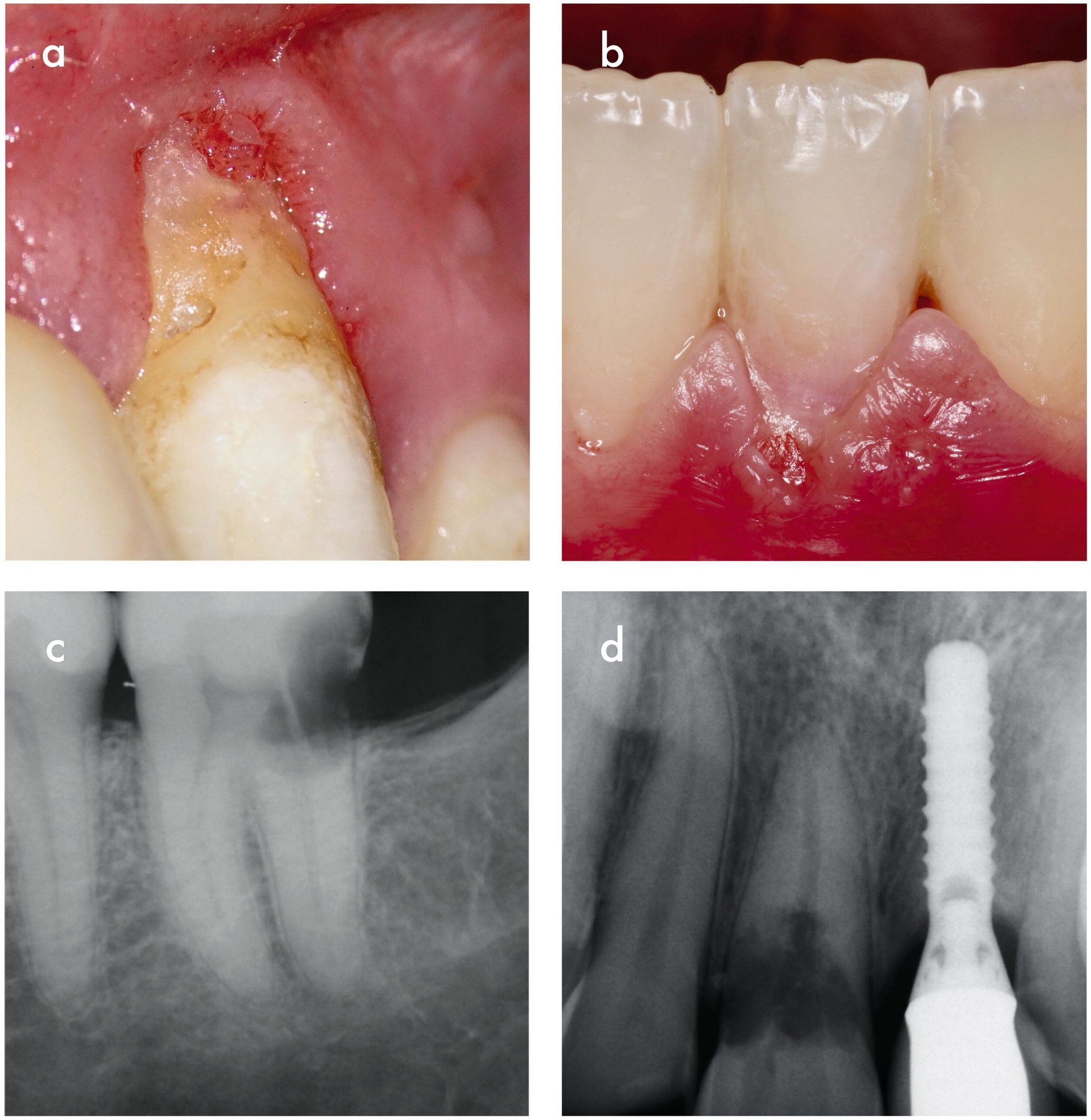
Externe invasive zervikale Resorption
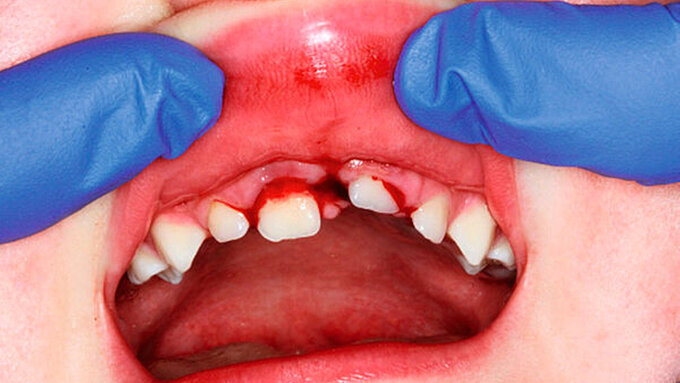
Klinisch handelt es sich häufig um Zufallsbefunde, die im Frühstadium asymptomatisch verlaufen. Bei der Untersuchung finden sich oft tastbare Defekte im Zahnhalsbereich, die mit leicht blutendem Granulationsgewebe gefüllt sind (Abbildung 7a). Mit zunehmender Größe können diese sich als rötliche Verfärbung der Zahnkrone darstellen, die als Pink-Spot-Läsionen bekannt sind (Abbildung 7b). Im Röntgenbild sind wolkige Aufhellungen im Bereich des Zahnhalses zu erkennen (Abbildungen 7c und 7d). Charakteristisch ist auch das intakte perikanaläre Dentin, das eine Schutzbarriere um den Wurzelkanal bildet und zusammen mit der vitalen Pulpa lange unversehrt bleibt [Patel et al., 2018; Patel et al., 2009].
Die genauen Faktoren, die zur Entstehung invasiver zervikaler Resorptionen führen, sind noch nicht bekannt. Studien haben gezeigt, dass es sich um eine multifaktorielle Ursache handeln kann, wobei Zahnunfälle und kieferorthopädische Behandlungen häufig damit in Zusammenhang zu bringen sind. Andere Faktoren, die oft eine Rolle spielen, sind zum Beispiel Parafunktionen, eine schlechte Mundhygiene, eine Parodontalbehandlung, eine Extraktion von Nachbarzähnen oder intrakoronales Bleichen. Parodontale Mikroorganismen scheinen eine stimulierende Rolle im Krankheitsprozess zu spielen [Mavridou et al., 2017].
Über die Prävalenz invasiver zervikaler Resorptionen liegen nur wenige Berichte vor. Einige epidemiologische und retrospektive Studien berichten von einer Prävalenz von bis zu 2,3 Prozent [Heithersay, 1999; Irinakis et al., 2020], was jedoch aufgrund des Mangels an gut konzipierten Studien die tatsächliche Häufigkeit unterschätzen könnte. Invasive zervikale Resorptionen treten hauptsächlich im Oberkiefer auf, wobei die Frontzähne den größten Anteil ausmachen. Im Unterkiefer sind dagegen vor allem die Prämolaren und die Molaren betroffen [Mavridou et al., 2017].
Externe Ersatzresorption
Dislokationsverletzungen, die zu einer ausgeprägten Schädigung des Wurzelzements und der desmodontalen Zellen führen, haben häufig eine externe Ersatzresorption zur Folge. Ersatzresorptionen sind daher in der Regel mit schweren Dislokationsverletzungen assoziiert. Am häufigsten treten diese bei Avulsionen auf (51 bis 87 Prozent), gefolgt von Intrusionen (57 Prozent) [Soares et al., 2015; Souza et al., 2018].
Dabei wird das Dentin zunehmend durch Odontoklasten abgebaut und durch Knochengewebe ersetzt [Andreasen, 1980; Souza et al., 2020]. Die daraus resultierende Verschmelzung von Zahn und Alveolarknochen wird als Ankylose bezeichnet und äußert sich klinisch durch ein helles, metallisches Klopfgeräusch und das Fehlen der physiologischen Zahnbeweglichkeit (Abbildung 8). Im Laufe der Gebissentwicklung kann es als Folge der Ankylose zu Infrapositionen der betroffenen Zähne kommen. Der Parodontalspalt ist röntgenologisch nicht mehr eindeutig erkennbar [Andersson et al., 1984].
Therapie
Im Mittelpunkt der Behandlung pathologischer Wurzelresorptionen steht die Erhaltung des Zahnes mit dem Ziel, einen beschwerdefreien Zustand sowie eine gute Funktionalität und Ästhetik herzustellen. Aufgrund der vielfältigen Erscheinungsformen von Wurzelresorptionen sind unterschiedliche Therapieansätze möglich. Im Folgenden werden die empfohlenen Maßnahmen gemäß den aktuellen Leitlinien der European Society of Endodontology (ESE) zusammengefasst [Patel et al., 2023].
Die prognostische Einschätzung einer pathologischen Wurzelresorption und die Behandlungsplanung erfordern eine präzise Diagnostik und ein Verständnis der Pathogenese. Eine genaue Kenntnis der Lokalisation und der Ausdehnung des Defekts ist entscheidend für die Beurteilung des Zugangsweges und der Restaurationsmöglichkeiten. Im Rahmen der Therapieplanung wird daher die dreidimensionale Röntgendiagnostik mittels digitaler Volumentomografie empfohlen [Patel et al., 2018; Patel et al., 2019].
Interne Wurzelresorption
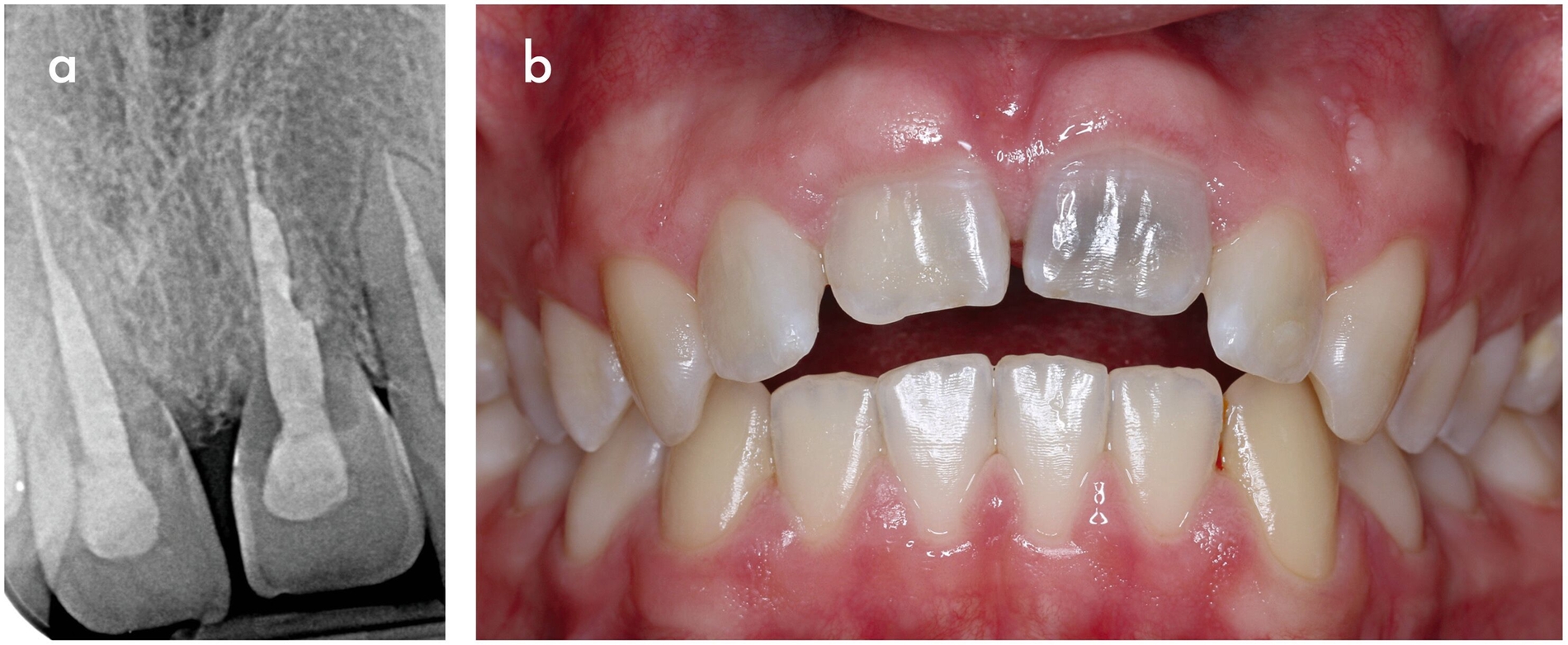
Bei allen Varianten der progressiven internen Resorption ist grundsätzlich eine endodontische Intervention erforderlich. Nach Entfernung des resorbierenden Gewebes aus dem Wurzelkanal kann dieses sorgfältig desinfiziert und gefüllt werden (Abbildung 9). Wenn der Resorptionsdefekt die Wurzelkanalwand durchbrochen hat, sollten bioaktive hydraulische Kalziumsilikatzemente wie Mineral Trioxide Aggregate (MTA) zur Reparatur verwendet werden. Im Fall einer Perforation kann auch eine chirurgische Behandlung von außen erforderlich sein. Die Prognose für den betroffenen Zahn hängt von der Position, der Größe und dem Infektionsgrad des Defekts ab. Ist die Zahnerhaltung aufgrund eines erheblichen Substanz- und Stabilitätsverlusts nicht mehr möglich, ist eine Extraktion unumgänglich [Nilsson et al., 2013].
Neben der konventionellen Behandlung wurden in den vergangenen Jahren zunehmend regenerative endodontische Therapieoptionen zur Behandlung interner Resorptionen beschrieben [Arnold, 2021; Patel et al., 2022; Saoud et al., 2016]. Dabei scheinen regenerative endodontische Verfahren in der Lage zu sein, den Resorptionsprozess zu stoppen und die Bildung von Hartgewebe zu induzieren, was insbesondere bei großen Perforationen zu einer Verkleinerung des Defekts führt. Möglicherweise ist die gesunde Restpulpa im apikalen Kanalabschnitt sogar eine Quelle für die Bildung neuen Gewebes im Kanal [Arnold, 2021]. Weitere klinische Studien sind jedoch erforderlich, um den genauen Heilungsmechanismus und die Langzeitergebnisse zu untersuchen.
Bei transienten internen Resorptionen nach intraalveolären Wurzelfrakturen werden regelmäßige klinische und röntgenologische Kontrollen empfohlen. So kann der Verlauf beurteilt und bei Komplikationen rechtzeitig eingegriffen werden [Andreasen, 2003].
Externe Oberflächenresorption
Die primäre therapeutische Maßnahme zur Behandlung besteht in der Beseitigung der Ursachen der Resorption, insbesondere des übermäßigen Drucks. Das kann zum Beispiel durch die Entfernung von kieferorthopädischen Apparaturen, Zysten oder impaktierten Zähnen, durch die Verwendung einer Aufbissschiene bei Bruxismus oder durch die Reduzierung von Kräften, die zum Beispiel beim Nägelkauen oder beim Spielen von Blasinstrumenten auftreten, erzielt werden [Patel et al., 2023].
Externe entzündliche (infektionsbedingte) Resorption
Vorrangiges Ziel der Behandlung ist die Desinfektion des infizierten Wurzelkanalsystems. Eine erfolgreich durchgeführte Wurzelkanalbehandlung kann je nach Ausmaß der ursprünglichen Entzündung zu einer Heilung des umliegenden Gewebes führen.
Bislang gibt es keine eindeutigen Beweise für eine überlegene Wirksamkeit von antibiotisch/kortikoidhaltigen Wundauflagen wie Ledermix (Riemser Pharma, Greifswald) im Vergleich zu Kalziumhydroxid oder ein- oder mehrzeitigen Behandlungsprotokollen. Die Heilung bestehender periapikaler Läsionen und die Wiederherstellung des parodontalen Ligaments um die zuvor resorbierte Wurzel sind wünschenswert, können jedoch nicht in allen Fällen erreicht werden [Patel et al., 2022]. Im weiteren Verlauf kann es auch zu einer knöchernen Ersatzresorption kommen. Als letzte Möglichkeit muss die Extraktion des Zahnes in Betracht gezogen werden [Abbott, 2016; Finucane und Kinirons, 2003].
Externe invasive zervikale Resorption
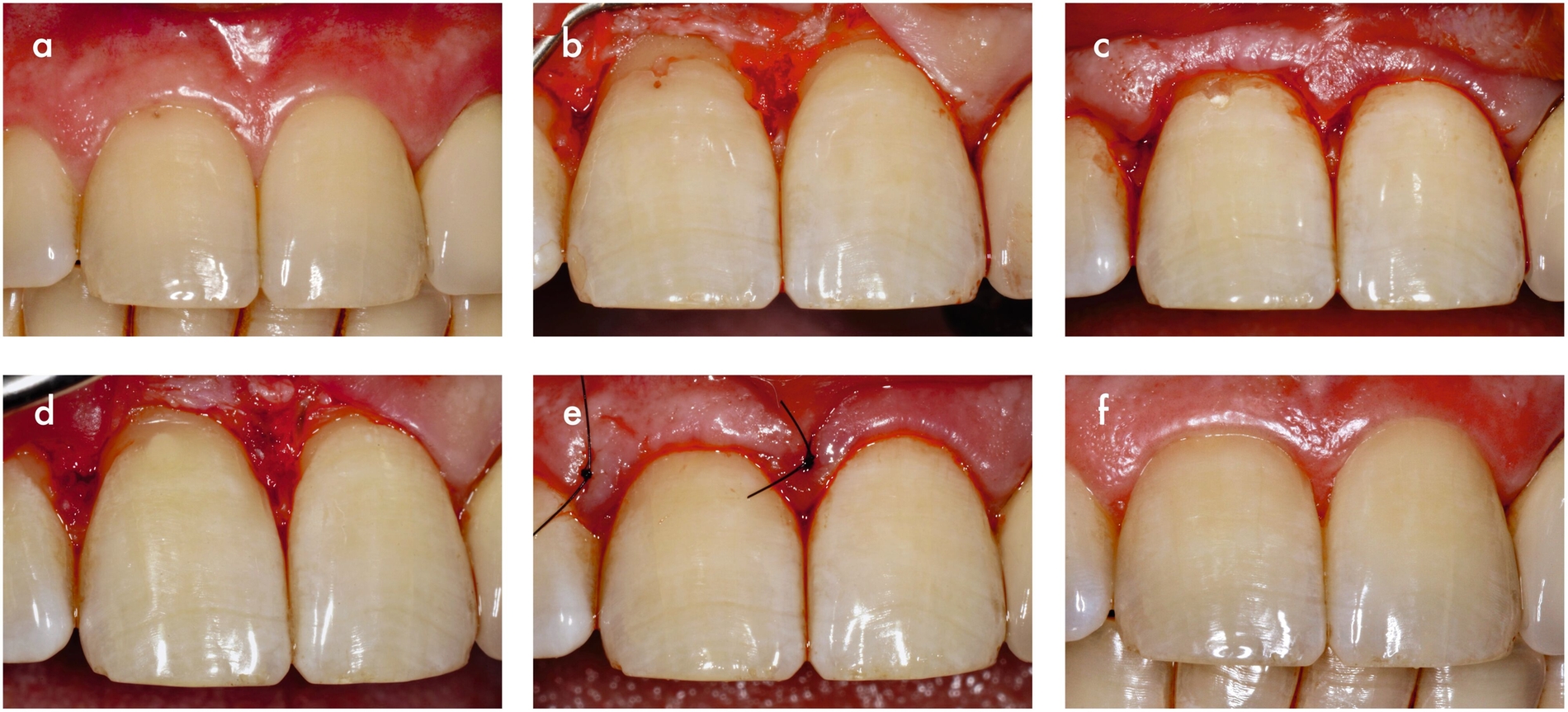
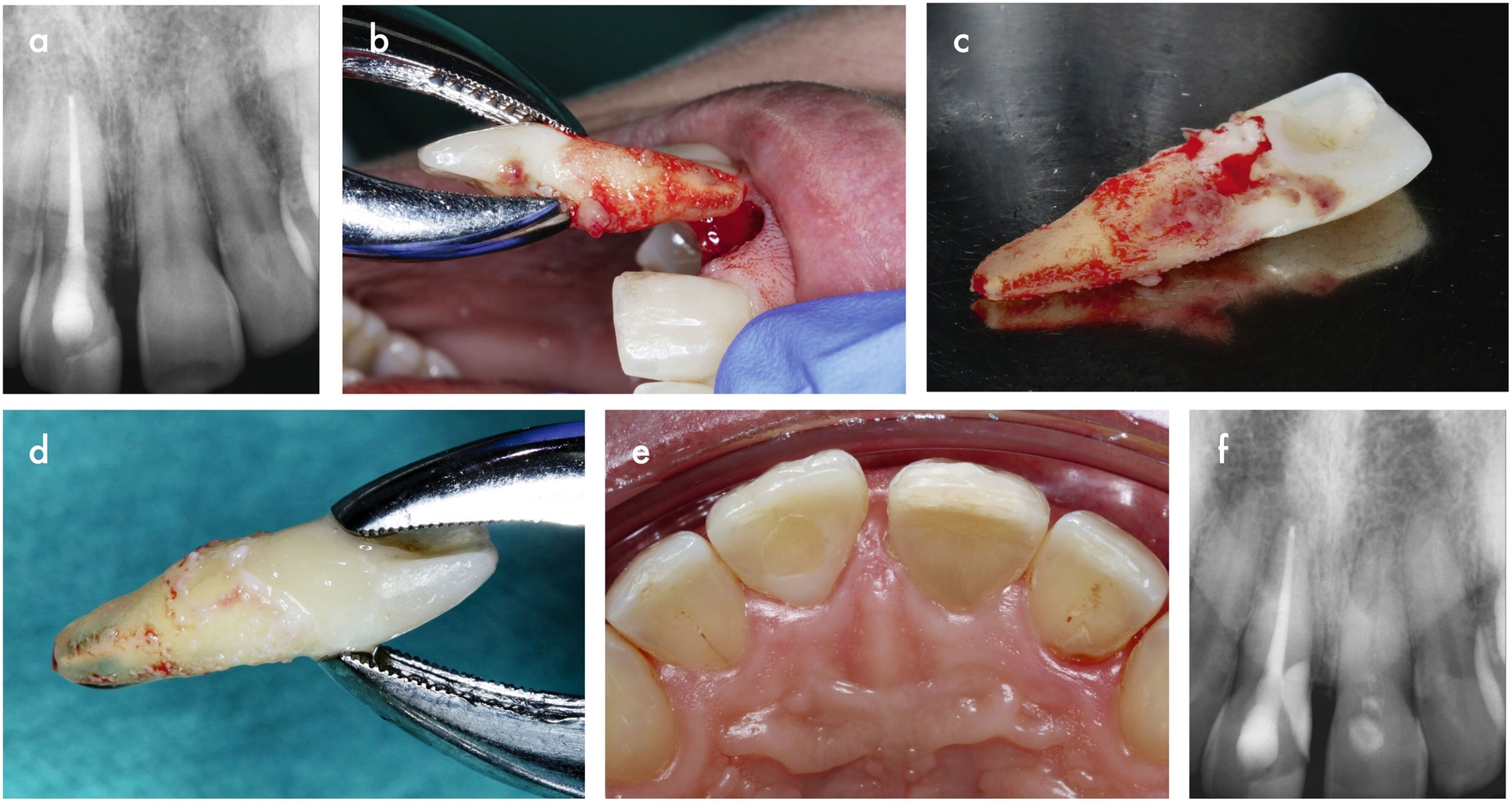
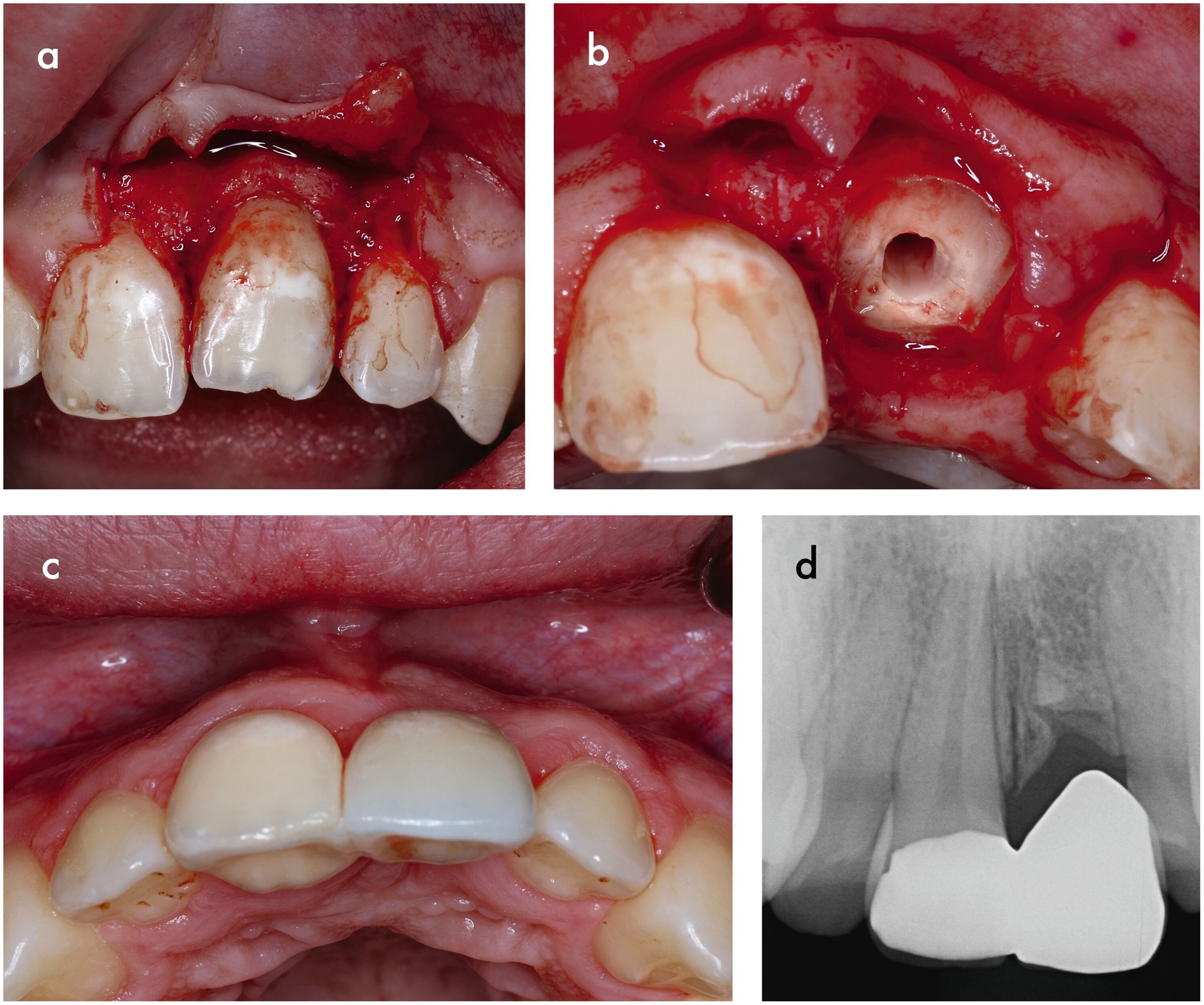
Die erfolgreiche Therapie invasiver zervikaler Resorptionen umfasst grundsätzlich die vollständige Entfernung des Granulationsgewebes. Zu den Behandlungsoptionen gehören die externe Reparatur ohne Wurzelkanalbehandlung, die interne Reparatur mit Wurzelkanalbehandlung, die intentionelle Replantation oder die regelmäßige Kontrolle mit Sensibilitätstests bei asymptomatischen, nicht restaurierbaren Fällen (Abbildungen 10 und 11). Die Extraktion stellt die einzige Behandlungsoption für nicht restaurierbare, symptomatische Läsionen dar [Patel et al., 2018].
Externe Ersatzresorption
Gegenwärtig gibt es keine Behandlung, um die externe Resorption zu stoppen. Sie kann stagnieren oder kontinuierlich voranschreiten und die Zahnwurzel durch Knochengewebe ersetzen. Daher müssen regelmäßige Kontrollen durchgeführt werden, um die Notwendigkeit einer Intervention zu prüfen.
Die Behandlung der externen Ersatzresorption hängt vom Alter des Patienten ab. Bei älteren Patienten kann die Progression langsam sein und der Zahn kann viele Jahre funktionsfähig bleiben, ohne dass eine Behandlung erforderlich ist. Bei jüngeren Patienten können ankylosierte Zähne aufgrund des Kieferwachstums in Infraposition geraten und eine ästhetische und funktionelle Korrektur durch Kompositrestaurationen erforderlich machen. Bei Infrapositionen von mehr als 2 mm, die das Wachstum des Alveolarfortsatzes beeinträchtigen können, oder wenn der Zahn nicht mehr erhaltungswürdig ist, sollte frühzeitig eine Extraktion erwogen werden [Patel et al., 2018].
Dabei stellt auch die Dekoronation des Zahnes eine Möglichkeit dar (Abbildung 12), um dem Abbau des Alveolarknochens entgegenzuwirken [Mohadeb et al., 2016]. Zudem sollte insbesondere bei Kindern und Jugendlichen neben der konventionellen prothetischen Versorgung der Lücke nach Zahnextraktion ein kieferorthopädischer Lückenschluss oder eine Autotransplantation erwogen werden [Kafourou et al., 2017; Rohof et al., 2018].
Fazit
Die korrekte Diagnose und Behandlung von Wurzelresorptionen ist eine Herausforderung im klinischen Alltag. Das Verständnis der Ätiologie und der pathologischen Vorgänge hilft, resorptive Prozesse möglichst zu vermeiden und bereits bestehende Läsionen richtig einzuschätzen. Moderne dreidimensionale bildgebende Verfahren ermöglichen bereits bei der Therapieplanung eine genaue Abschätzung des Ausmaßes von Resorptionen. So kann eine erfolgreiche Therapie der betroffenen Zähne durchgeführt werden, die die Prognose verbessert und langfristig die Zahnerhaltung ermöglicht.
Prof. Dr. Matthias Widbiller
Poliklinik für Zahnerhaltung und Parodontologie / Zahntraumazentrum
Universitätsklinikum Regensburg,
Franz-Josef-Strauß-Allee 11, 93053 Regensburg
matthias.widbiller@ukr.de
2008–2013: Studium der Zahnheilkunde an der Universität Regensburg
seit 2014: Wissenschaftlicher Mitarbeiter an der Poliklinik für Zahnerhaltung und Parodontologie des Universitätsklinikums Regensburg
2015: Promotion zum Dr. med. dent.
seit 2016: Koordination des Zahntraumazentrums am Universitätsklinikum Regensburg
2017–2018: Postdoc am University of Texas Health Science Center in San Antonio (UTHSCSA), USA
2019: Habilitation und Ernennung zum Privatdozenten an der Fakultät für Medizin der Universität Regensburg
seit 2021: Leitung des Forschungslabors der Poliklinik für Zahnerhaltung und Parodontologie
2023: Berufung zum ordentlichen Professor für Endodontologie an der Universität Regensburg
Forschungsschwerpunkte: Immunprozesse in der Zahnpulpa, bioaktive Proteine der Dentinmatrix, Tissue Engineering der Zahnpulpa. Klinische Schwerpunkte: dentale Traumatologie, Vitalerhaltung der Pulpa, endodontische Regeneration.
Prof. Dr. Gabriel Krastl
Poliklinik für Zahnerhaltung und Parodontologie / Zahnunfallzentrum
Universitätsklinikum Würzburg,
Pleicherwall 2, 97070 Würzburg
Krastl_G@ukw.de
1998–2005: Wissenschaftlicher Assistent (ab 2002 Oberarzt), Poliklinik für Zahnerhaltung, Tübingen
2005–2014: Oberarzt, Klinik für Parodontologie, Endodontologie und Kariologie, Basel, Schweiz
seit 2014: Direktor der Poliklinik für Zahnerhaltung und Parodontologie und Leiter des Zahnunfallzentrums, Würzburg
seit 2016: Generalsekretär der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie e.V. (DGET)
seit 2018: Geschäftsführender Direktor des Zentrums für Zahn-, Mund- und Kiefergesundheit am Universitätsklinikum Würzburg
Klinische und wissenschaftliche Schwerpunkte: Dentale Traumatologie, Ästhetische Zahnheilkunde, Endodontologie. Über 250 Publikationen, vornehmlich in den genannten Bereichen. Mitglied des Herausgeberbeirats verschiedener wissenschaftlicher Zeitschriften, unter anderem Dental Traumatology, Journal of Adhesive Dentistry, International Endodontic Journal, Dentistry Journal.
Literaturliste
Abbott, P. V. (2016). Prevention and management of external inflammatory resorption following trauma to teeth. Australian Dental Journal, 61, 82–94.
Andersson, L., Blomlöf, L., Lindskog, S., Feiglin, B., Hammarström, L. (1984). Tooth ankylosis - clinical, radiographic and histological assessments. International Journal of Oral Surgery, 13, 423–431.
Andreasen, F. M. (2003). Transient root resorption after dental trauma: the clinician’s dilemma. Journal of Esthetic and Restorative Dentistry, 15, 80–92.
Andreasen, F. M., Andreasen, J. O. (1988). Resorption and mineralization processes following root fracture of permanent incisors. Dental Traumatology, 4, 202–214.
Andreasen, F. M., Pedersen, B. V. (1985). Prognosis of luxated permanent teeth – the development of pulp necrosis. Dental Traumatology, 1, 207–220.
Andreasen, J. O. (1980). Analysis of pathogenesis and topography of replacement root resorption (ankylosis) after replantation of mature permanent incisors in monkeys. Swedish Dental Journal, 4, 231–240.
Andreasen, J. O., Hjørting-Hansen, E. (1966). Replantation of teeth. I. Radiographic and clinical study of 110 human teeth replanted after accidental loss. Acta Odontologica Scandinavica, 24, 263–286.
Andreasen, J. O., Kristerson, L. (1981). The effect of limited drying or removal of the periodontal ligament. Periodontal healing after replantation of mature permanent incisors in monkeys. Acta Odontologica Scandinavica, 39, 1–13.
Arnold, M. (2021). Reparative endodontic treatment of a perforating internal inflammatory root resorption: a case report. Journal of Endodontics, 47, 146–155.
Crona‐Larsson, G., Bjarnason, S., Norén, J. G. (1991). Effect of luxation injuries on permanent teeth. Dental Traumatology, 7, 199–206.
Finucane, D., Kinirons, M. J. (2003). External inflammatory and replacement resorption of luxated, and avulsed replanted permanent incisors: a review and case presentation. Dental Traumatology, 19, 170–174.
Fuss, Z., Tsesis, I., Lin, S. (2003). Root resorption-diagnosis, classification and treatment choices based on stimulation factors. Dental Traumatology, 19, 175–182.
Galler, K. M., Grätz, E.-M., Widbiller, M., Buchalla, W., Knüttel, H. (2021). Pathophysiological mechanisms of root resorption after dental trauma: a systematic scoping review. BMC Oral Health, 21, 163.
Heboyan, A., Avetisyan, A., Karobari, M. I., Marya, A., Khurshid, Z., Rokaya, D., Zafar, M. S., Fernandes, G. V. (2022). Tooth root resorption: a review. Science Progress, 105, 00368504221109217.
Heithersay, G. S. (1999). Invasive cervical resorption: an analysis of potential predisposing factors. Quintessence International, 30, 83–95.
Hohmann, A., Wolfram, U., Geiger, M., Boryor, A., Sander, C., Faltin, R., Faltin, K., Sander, F. G. (2007). Periodontal ligament hydrostatic pressure with areas of root resorption after application of a continuous torque moment. The Angle Orthodontist, 77, 653–659.
Iglesias-Linares, A., Hartsfield, J. K. (2017). Cellular and molecular pathways leading to external root resorption. Journal of Dental Research, 96, 145–152.
Irinakis, E., Aleksejuniene, J., Shen, Y., Haapasalo, M. (2020). External cervical resorption: a retrospective case-control study. Journal of Endodontics, 46, 1420–1427.
Kafourou, V., Tong, H. J., Day, P., Houghton, N., Spencer, R. J., Duggal, M. (2017). Outcomes and prognostic factors that influence the success of tooth autotransplantation in children and adolescents. Dental Traumatology, 33, 393–399.
Killiany, D. M. (1999). Root resorption caused by orthodontic treatment: an evidence-based review of literature. Seminars in Orthodontics, 5, 128–133.
Kim, J.-M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J.-H. (2020). Osteoblast-osteoclast communication and bone homeostasis. Cells, 9, 2073.
Krastl, G., Weiger, R., Filippi, A., Waes, H. V., Ebeleseder, K., Ree, M., Connert, T., Widbiller, M., Tjäderhane, L., Dummer, P. M. H., Galler, K. (2021). Endodontic management of traumatized permanent teeth: a comprehensive review. International Endodontic Journal, 54, 1221–1245.
Malmgren, O., Goldson, L., Hill, C., Orwin, A., Petrini, L., Lundberg, M. (1982). Root resorption after orthodontic treatment of traumatized teeth. American Journal of Orthodontics, 82, 487–491.
Matzen, L. H., Schropp, L., Spin-Neto, R., Wenzel, A. (2017). Radiographic signs of pathology determining removal of an impacted mandibular third molar assessed in a panoramic image or CBCT. Dentomaxillofacial Radiology, 46, 20160330.
Mavridou, A. M., Bergmans, L., Barendregt, D., Lambrechts, P. (2017). Descriptive analysis of factors associated with external cervical resorption. Journal of Endodontics, 43, 1602–1610.
Mohadeb, J. V. N., Somar, M., He, H. (2016). Effectiveness of decoronation technique in the treatment of ankylosis: a systematic review. Dental Traumatology, 32, 255–263.
Nilsson, E., Bonte, E., Bayet, F., Lasfargues, J.-J. (2013). Management of internal root resorption on permanent teeth. International Journal of Dentistry, 2013, 929486.
Patel, S., Brown, J., Semper, M., Abella, F., Mannocci, F. (2019). European Society of Endodontology position statement: use of cone beam computed tomography in endodontics. International Endodontic Journal, 52, 1675–1678.
Patel, S., Foschi, F., Condon, R., Pimentel, T., Bhuva, B. (2018). External cervical resorption: part 2 - management. International Endodontic Journal, 51, 1224–1238.
Patel, S, Lambrechts, P., Shemesh, H., Mavridou, A. M. (2018). European Society of Endodontology position statement: external cervical resorption. International Endodontic Journal, 51, 1323–1326.
Patel, S., Mavridou, A. M., Lambrechts, P., Saberi, N. (2018). External cervical resorption‐part 1: histopathology, distribution and presentation. International Endodontic Journal, 51, 1205–1223.
Patel, S., Ford, T. P. (2017). Is the resorption external or internal? Dental Update, 34, 218–229.
Patel, S., Kanagasingam, S., Ford, T. P. (2009). External cervical resorption: a review. Journal of Endodontics, 35, 616–625.
Patel, S., Krastl, G., Weiger, R., Lambrechts, P., Tjäderhane, L., Gambarini, G.,Teng, P. (2023). ESE position statement on root resorption. International Endodontic Journal, 56, 792–801.
Patel, S., Ricucci, D., Durak, C., Tay, F. (2010). Internal root resorption: a review. Journal of Endodontics, 36, 1107–1121.
Patel, S., Saberi, N., Pimental, T., Teng, P. (2022). Present status and future directions: root resorption. International Endodontic Journal, 55(Suppl 4), 892–921.
Rohof, E. C. M., Kerdijk, W., Jansma, J., Livas, C., Ren, Y. (2018). Autotransplantation of teeth with incomplete root formation: a systematic review and meta-analysis. Clinical Oral Investigations, 22, 1613–1624.
Sameshima, G. T., Iglesias-Linares, A. (2021). Orthodontic root resorption. Journal of the World Federation of Orthodontists, 10, 135–143.
Saoud, T. M. A., Mistry, S., Kahler, B., Sigurdsson, A., Lin, L. M. (2016). Regenerative endodontic procedures for traumatized teeth after horizontal root fracture, avulsion, and perforating root resorption. Journal of Endodontics, 42, 1476–1482.
Soares, A. J., Souza, G. A., Pereira, A. C., Vargas-Neto, J., Zaia, A. A., Silva, E. J. N. L. (2015). Frequency of root resorption following trauma to permanent teeth. Journal of Oral Science, 57, 73–78.
Sondeijker, C. F. W., Lamberts, A. A., Beckmann, S. H., Kuitert, R. B., Westing, K. van, Persoon, S., Kuijpers-Jagtman, A. M. (2019). Development of a clinical practice guideline for orthodontically induced external apical root resorption. European Journal of Orthodontics, 42, 115–124.
Souza, B. D. M., Dutra, K. L., Kuntze, M. M., Bortoluzzi, E. A., Flores-Mir, C., Reyes-Carmona, J., Felippe, W. T., Porporatti, A. L., Canto, G. D. L. (2018). Incidence of root resorption after the replantation of avulsed teeth: a meta-analysis. Journal of Endodontics, 44, 1216–1227.
Souza, B. D. M. de, Dutra, K. L., Reyes-Carmona, J., Bortoluzzi, E. A., Kuntze, M. M., Teixeira, C. S., Porporatti, A. L., Canto, G. D. L. (2020). Incidence of root resorption after concussion, subluxation, lateral luxation, intrusion, and extrusion: a systematic review. Clinical Oral Investigations, 24, 1101–1111.
Suda, T., Takahashi, N., Udagawa, N., Jimi, E., Gillespie, M. T., Martin, T. J. (1999). Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocrine Reviews, 20, 345–357.
Teo, K. W., Shi, A. H., Teh, L. Y., Lee, A. M. H. (2021). External root resorption in common odontogenic cysts and ameloblastomas of the jaw: a retrospective radiographic study in an asian population. Oral Surgery, 14(4), 335–341.
Trope, M. (1998). Root resorption of dental and traumatic origin: classification based on etiology. Practical Periodontics and Aesthetic Dentistry, 10, 515–522.
Weltman, B., Vig, K. W. L., Fields, H. W., Shanker, S., Kaizar, E. E. (2010). Root resorption associated with orthodontic tooth movement: a systematic review. American Journal of Orthodontics and Dentofacial Orthopedics, 137, 462–476.
Widbiller, M. (2020). Pathologie und Management von Wurzelresorptionen. ZMK, 1-2, 6–18.
Yamaoka, M., Furusawa, K., Ikeda, M., Hasegawa, T. (1999). Root resorption of mandibular second molar teeth associated with the presence of the third molars. Australian Dental Journal, 44, 112–116.
Yu, V. S. H., Messer, H. H., Tan, K. B. (2011). Multiple idiopathic cervical resorption: case report and discussion of management options. International Endodontic Journal, 44, 77–85.